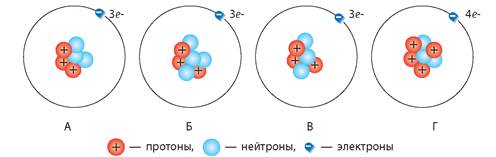
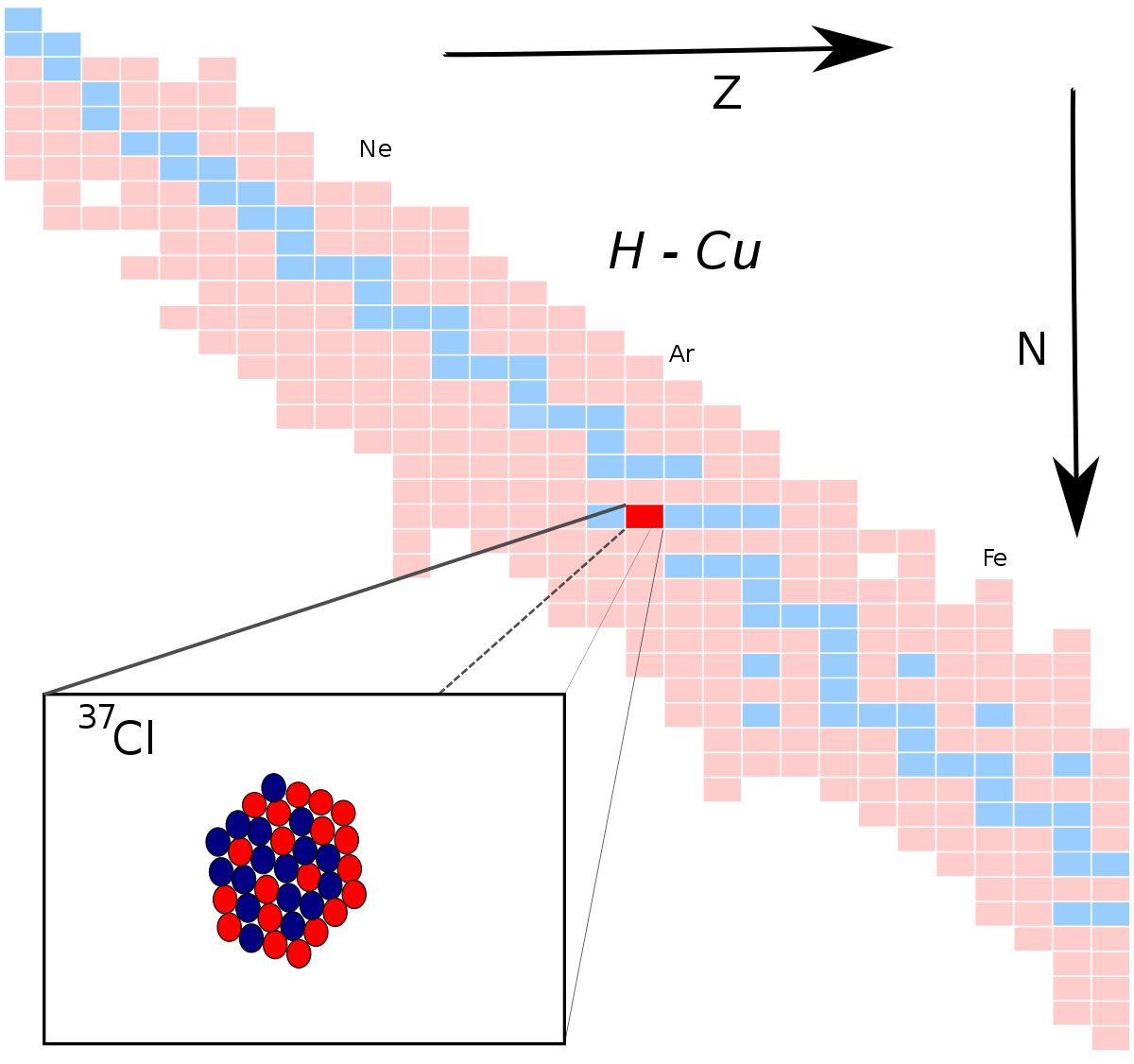
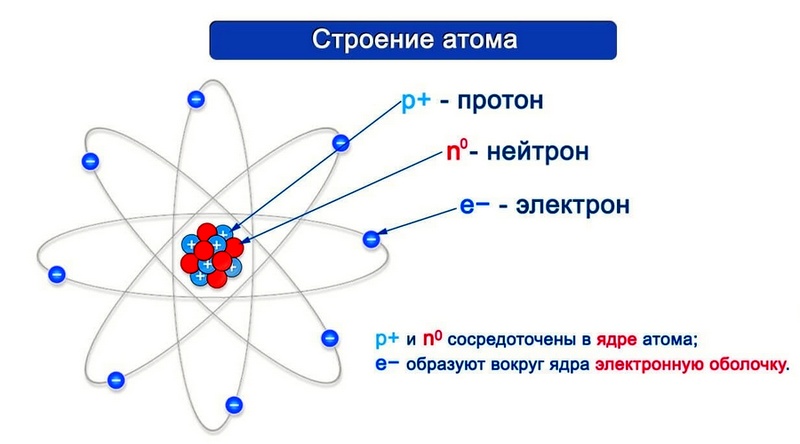
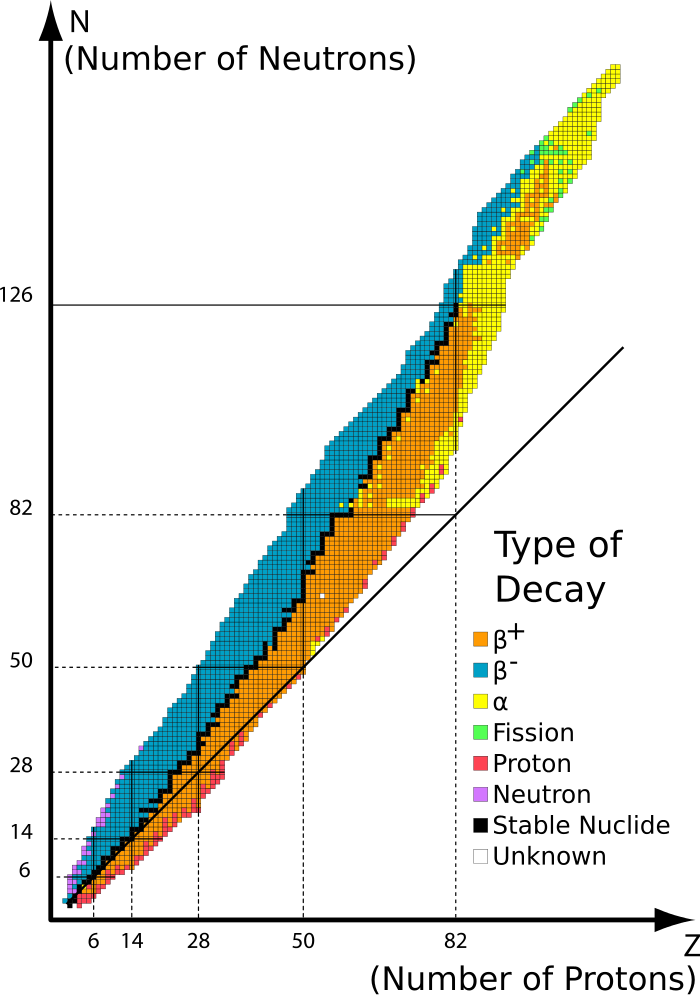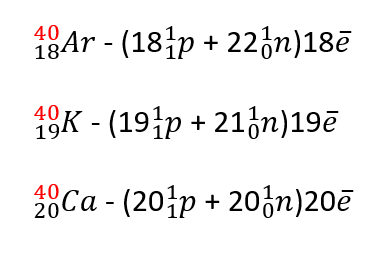Типы нуклидов
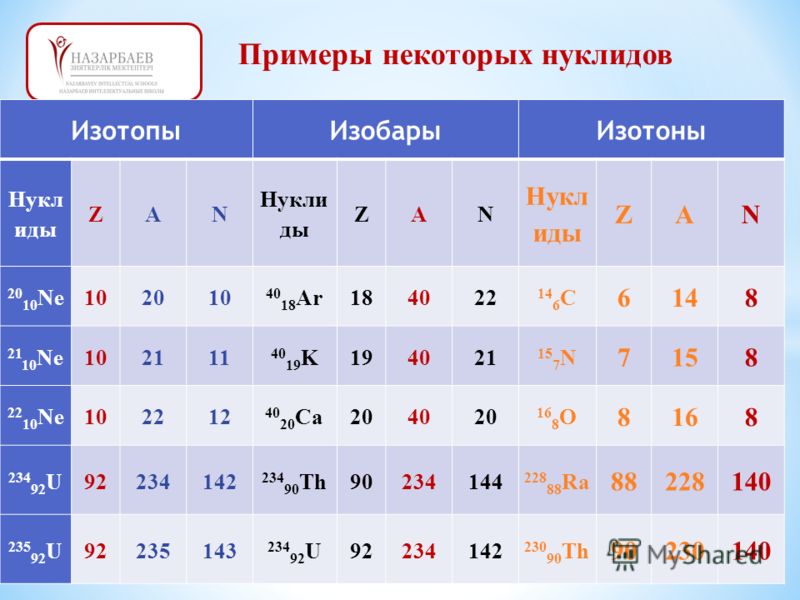
Хотя слова нуклид и изотоп часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
| Обозначение | Характеристики | пример | Замечания |
|---|---|---|---|
| Изотопы | одинаковое число протонов ( Z 1 = Z 2 ) | 12 6C, 13 6C, 14 6C | |
| Изотоны | равное количество нейтронов ( N 1 = N 2 ) | 13 6C, 14 7N, 15 8О | |
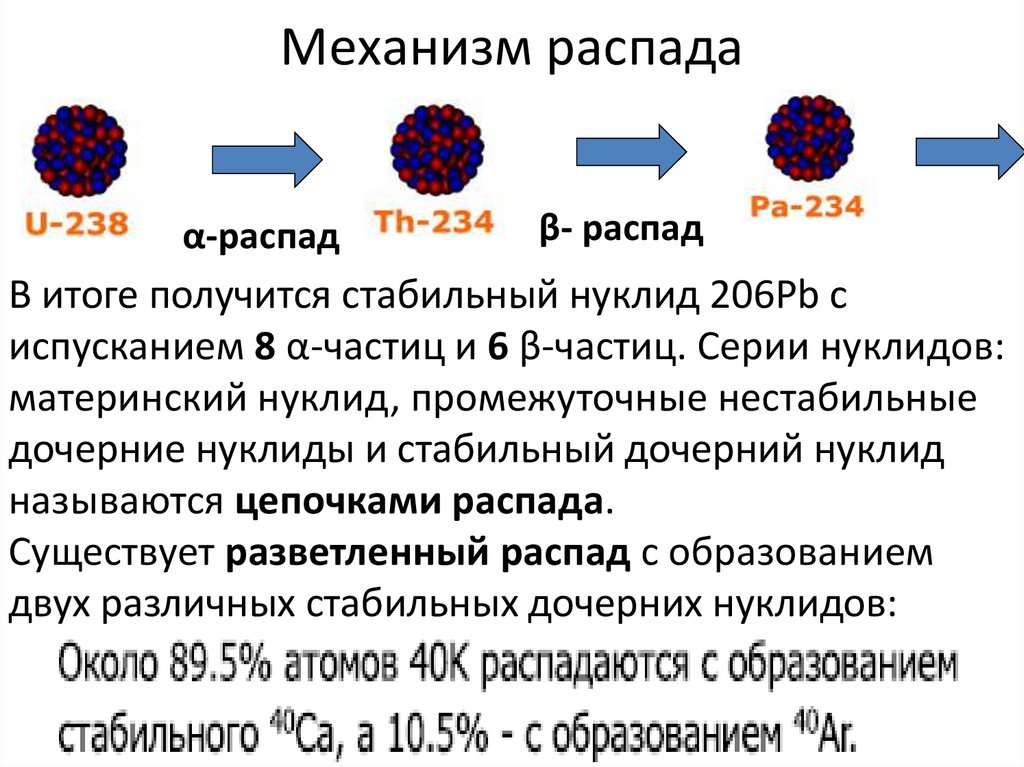
| Изобары | равное массовое число (Z 1 + N 1 = Z 2 + N 2 ) | 17 7N, 17 8О, 17 9F | увидеть бета-распад |
| Исодиаферы | равный нейтронный избыток (N 1 — Z 1 = N 2 — Z 2 ) | 13 6C, 15 7N, 17 8О | Примеры — изодиаферы с нейтронным избытком 1.
Нуклид и продукт его альфа-распада являются изодиаферами. |
| Зеркальные ядра | обмен числа нейтронов и протонов
(Z 1 = N 2 и Z 2 = N 1 ) |
3 1ЧАС, 3 2Он | |
| Ядерные изомеры | одинаковое количество протонов и массовое число,
но с разными энергетическими состояниями |
99 43Tc, 99м 43Tc | m = метастабильное (долгоживущее возбужденное состояние) |
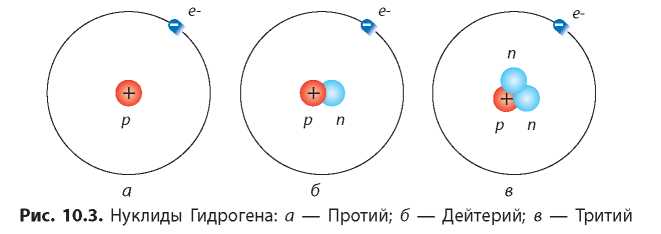
Набор нуклидов с одинаковым числом протонов ( атомным номером ), т. Е. Одного и того же химического элемента, но с разными числами нейтронов , называется изотопами этого элемента. Конкретные нуклиды по-прежнему часто называют «изотопами», но термин «нуклид» в целом является правильным (то есть, когда Z не фиксировано). Аналогичным образом, набор нуклидов с равным массовым числом A , но различным атомным номером , называется изобарами (изобара = равный вес), а изотоны — это нуклиды с одинаковым числом нейтронов, но с различным числом протонов. Точно так же нуклиды с одинаковым нейтронным избытком ( N — Z ) называют изодиаферами. Имя isoto п е был получен из имени isoto р е подчеркнуть , что в первой группе нуклидов это число нейтронов (N) , что является постоянным, тогда как во втором числа протонов (р).
См. Раздел « для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
Ядерные изомеры являются членами набора нуклидов с равным числом протонов и равным массовым числом (что делает их по определению одним и тем же изотопом), но с разными состояниями возбуждения. Примером могут служить два состояния одного изотопа99 43Tcпоказаны среди схем распада . Каждое из этих двух состояний (технеций-99m и технеций-99) квалифицируется как отдельный нуклид, что иллюстрирует один способ, которым нуклиды могут отличаться от изотопов (изотоп может состоять из нескольких разных нуклидов с разными состояниями возбуждения).
Самым долгоживущим ядерным изомером в неосновном состоянии является нуклид тантал-180m (180м 73Та), период полураспада которого превышает 1000 триллионов лет. Этот нуклид существует изначально, и его распад до основного состояния никогда не наблюдался. (Напротив, нуклид тантал-180 в основном состоянии не встречается изначально, так как он распадается с периодом полураспада всего 8 часов до 180 Hf (86%) или 180 Вт (14%)).
В природе существует 252 нуклида, распад которых никогда не наблюдался. Они встречаются среди 80 различных элементов, которые имеют один или несколько стабильных изотопов. См. Стабильный нуклид и первичный нуклид . Нестабильные нуклиды радиоактивны и называются радионуклидами . Продукты их распада («дочерние» продукты) называются радиогенными нуклидами . 252 стабильных и около 87 нестабильных (радиоактивных) нуклидов существуют в природе на Земле, в общей сложности около 339 природных нуклидов на Земле.
Нуклиды против изотопов
Нуклид — это разновидность атома с определенным числом протонов и нейтронов в ядре, например углерод-13 с 6 протонами и 7 нейтронами. Концепция нуклидов (относящаяся к отдельным видам ядер) подчеркивает ядерные свойства над химическими свойствами, в то время как концепция изотопов (группировка всех атомов каждого элемента) подчеркивает химические свойства над ядерными. Число нейтронов имеет большое влияние на ядерные свойства, но его влияние на химические реакции для большинства элементов незначительно. Даже в случае очень легких элементов, где отношение числа нейтронов к атомному числу наиболее сильно различается между изотопами, оно обычно имеет лишь небольшой эффект, но в некоторых случаях имеет значение (для водорода, самого легкого элемента, изотопный эффект достаточно велик, чтобы сильно повлиять на биологические системы). Поскольку изотоп — более старый термин, он более известен, чем нуклид, и до сих пор иногда используется в контекстах, в которых нуклид может быть более подходящим, таких как ядерные технологии и ядерная медицина.
Тенденции в таблице нуклидов
| 5 | часов | Он | Ли | Be | млрд | С | с.ш. | O | F | Ne | Al | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 6 | часов | Он | Ли | Be | млрд | С | с.ш. | O | F | Ne | Na | Mg | 19 Al | ||
| 7 | Он |
ли |
Be | млрд | С | с.ш. | O | F | Ne | Na | мг | 20 Аl | Si | ||
| 8 | Он | Ли | Be | млрд | С | с.ш. | 16 O | 17 F | 18 Ne | 19 Na | 20 мг | 21 Al | 22 Si | ||
| 9 | Ли | Be | млрд | 15 С | 16 с.ш. | O |
F |
19 Ne | 20 Na | 21 мг | 22 Al | 23 Si |
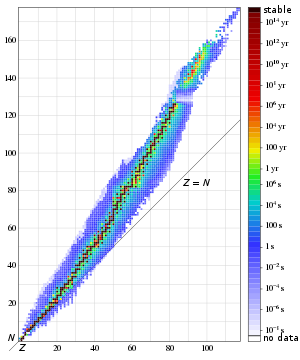
Период полураспада изотопа. Более темная область более стабильного изотопа отходит от линии протонов (Z) = нейтронов (N), поскольку число элементов Z становится больше
- Изотопы — это нуклиды с одинаковым числом протонов, но разным числом нейтронов; то есть они имеют одинаковый атомный номер и, следовательно, являются одним и тем же химическим элементом . Изотопы соседствуют друг с другом по вертикали. Примеры включают углерод-12, углерод-13 и углерод-14 в таблице выше.
- Изотоны — это нуклиды с одинаковым числом нейтронов, но разным числом протонов. Изотоны соседствуют друг с другом по горизонтали. Примеры включают углерод-14, азот-15 и кислород-16 из приведенной выше таблицы.
- Изобары — это нуклиды с одинаковым числом нуклонов (т.е. массовым числом), но разным числом протонов и нейтронов. Изобары соседствуют друг с другом по диагонали от верхнего левого угла до нижнего правого. Примеры включают углерод-14, азот-14 и кислород-14 в таблице выше.
- Изодиаферы — это нуклиды с одинаковой разницей между их числом нейтронов и протонов ( N — Z ). Как и изобары, они следуют диагональным линиям, но под прямым углом к линиям изобар (от верхнего правого до нижнего левого). Примеры включают бор-10, углерод-12 и азот-14 (как N — Z = 0 для каждой пары) или бор-12, углерод-14 и азот-16 (как N — Z = 2 для каждой пары). .
- За нейтронной капельной линией в нижнем левом углу нуклиды распадаются за счет нейтронной эмиссии .
- За линией капель протонов в правом верхнем углу нуклиды распадаются за счет испускания протонов . Капельные линии установлены только для некоторых элементов.
- Островок стабильности является гипотетическим область в верхнем правом кластере нуклидов , который содержит изотопы гораздо более стабильны , чем другие трансурановые элементы .
- Не существует стабильных нуклидов с равным числом протонов и нейтронов в ядрах с атомным номером больше 20 (т. Е. Кальций ), как это легко увидеть из диаграммы. Ядрам с большим атомным номером для стабильности требуется избыток нейтронов.
- Единственными стабильными нуклидами, имеющими нечетное число протонов и нечетное число нейтронов, являются водород-2 , литий-6 , бор-10 , азот-14 и (по наблюдениям) тантал-180 . Это связано с тем, что масса-энергия таких атомов обычно выше, чем у их соседей по той же изобарической цепочке, поэтому большинство из них нестабильны к бета-распаду .
- Не существует стабильных нуклидов с массовыми числами 5 или 8. Существуют стабильные нуклиды со всеми другими массовыми числами до 208, за исключением 147 и 151. ( Висмут-209 оказался радиоактивным в 2003 году, но с периодом полураспада. 1,9 × 10 19 лет.)
- За исключением, возможно, пары теллур-123 и сурьма-123 , нечетные массовые числа никогда не представлены более чем одним стабильным нуклидом. Это связано с тем, что масса-энергия является выпуклой функцией атомного номера, поэтому все нуклиды в нечетной изобарической цепочке, кроме одного, имеют соседа с более низкой энергией, до которого они могут распадаться в результате бета-распада.
- Не существует стабильных нуклидов с атомным номером больше Z = 82 ( свинец ), хотя висмут ( Z = 83) стабилен для всех практических целей человека. Все элементы с атомными номерами от 1 до 82 имеют стабильные изотопы, за исключением технеция ( Z = 43) и прометия ( Z = 61).
Все еще не наблюдаемый распад
Ожидается, что некоторое постоянное улучшение экспериментальной чувствительности позволит обнаружить очень слабую радиоактивность (нестабильность) некоторых изотопов, которые сегодня считаются стабильными. В качестве примера недавнего открытия, только в 2003 году висмут-209 (единственный первичный изотоп висмута) оказался очень умеренно радиоактивным, что подтвердило теоретические предсказания ядерной физики о том, что висмут-209 будет очень медленно распадаться под действием альфа-излучения. .
Изотопы, которые теоретически считаются нестабильными, но распад которых не наблюдался, называются стабильными с точки зрения наблюдений .
Список стабильных нуклидов
- Водород-1
- Водород-2
- Гелий-3
-
Гелий-4
- нет массового числа 5
- Литий-6
-
Литий-7
нет массового числа 8 - Бериллий-9
- Бор-10
- Бор-11
- Углерод-12
- Углерод-13
- Азот-14
- Азот-15
- Кислород-16
- Кислород-17
- Кислород-18
- Фтор-19
- Неон-20
- Неон-21
- Неон-22
- Натрий-23
- Магний-24
- Магний-25
- Магний-26
- Алюминий-27
- Кремний-28
- Кремний-29
- Кремний-30
- Фосфор-31
- Сера-32
- Сера-33
- Сера-34
- Сера-36
- Хлор-35
- Хлор-37
- Аргон-36 (2Э)
- Аргон-38
- Аргон-40
- Калий-39
- Калий-41
- Кальций-40 (2E) *
- Кальций-42
- Кальций-43
- Кальций-44
- Кальций-46 (2B) *
- Скандий-45
- Титан-46
- Титан-47
- Титан-48
- Титан-49
- Титан-50
- Ванадий-51
- Хром-50 (2E) *
- Хром-52
- Хром-53
- Хром-54
- Марганец-55
- Железо-54 (2Е) *
- Утюг-56
- Утюг-57
- Утюг-58
- Кобальт-59
- Никель-58 (2Е) *
- Никель-60
- Никель-61
- Никель-62
- Никель-64
- Медь-63
- Медь-65
- Цинк-64 (2E) *
- Цинк-66
- Цинк-67
- Цинк-68
- Цинк-70 (2В) *
- Галлий-69
- Галлий-71
- Германий-70
- Германий-72
- Германий-73
- Германий-74
- Мышьяк-75
- Селен-74 (2E)
- Селен-76
- Селен-77
- Селен-78
- Селен-80 (2В)
- Бром-79
- Бром-81
- Криптон-80
- Криптон-82
- Криптон-83
- Криптон-84
- Криптон-86 (2Б)
- Рубидий-85
- Стронций-84 (2E)
- Стронций-86
- Стронций-87
- Стронций-88
- Иттрий-89
- Цирконий-90
- Цирконий-91
- Цирконий-92
- Цирконий-94 (2В) *
- Ниобий-93
- Молибден-92 (2Е) *
- Молибден-94
- Молибден-95
- Молибден-96
- Молибден-97
-
Молибден-98 (2В) *
Технеций — нет стабильных изотопов
- Рутений-96 (2E) *
- Рутений-98
- Рутений-99
- Рутений-100
- Рутений-101
- Рутений-102
- Рутений-104 (2В)
- Родий-103
- Палладий-102 (2E)
- Палладий-104
- Палладий-105
- Палладий-106
- Палладий-108
- Палладий-110 (2В) *
- Серебро-107
- Серебро-109
- Кадмий-106 (2E) *
- Кадмий-108 (2E) *
- Кадмий-110
- Кадмий-111
- Кадмий-112
- Кадмий-114 (2B) *
- Индий-113
- Олово-112 (2Э)
- Олово-114
- Олово-115
- Олово-116
- Олово-117
- Олово-118
- Олово-119
- Олово-120
- Олово-122 (2Б)
- Олово-124 (2Б) *
- Сурьма-121
- Сурьма-123
- Теллур-120 (2E) *
- Теллур-122
- Теллур-123 (E) *
- Теллур-124
- Теллур-125
- Теллур-126
- Йод-127
- Ксенон-126 (2Е)
- Ксенон-128
- Ксенон-129
- Ксенон-130
- Ксенон-131
- Ксенон-132
- Ксенон-134 (2В) *
- Цезий-133
- Барий-132 (2E) *
- Барий-134
- Барий-135
- Барий-136
- Барий-137
- Барий-138
- Лантан-139
- Церий-136 (2E) *
- Церий-138 (2E) *
- Церий-140
- Церий-142 (А, 2Б) *
- Празеодим-141
- Неодим-142
- Неодим-143
- Неодим-145 (А) *
-
Неодим-146 (2В)
нет массового числа 147 -
Неодим-148 (А, 2Б) *
Прометий — нет стабильных изотопов
- Самарий-144 (2Э)
- Самарий-149 (А) *
-
Самарий-150
нет массового числа 151 - Самарий-152
- Самарий-154 (2Б) *
- Европий-153
- Гадолиний-154
- Гадолиний-155
- Гадолиний-156
- Гадолиний-157
- Гадолиний-158
- Гадолиний-160 (2В) *
- Тербий-159
- Диспрозий-156 (A, 2E) *
- Диспрозий-158
- Диспрозий-160
- Диспрозий-161
- Диспрозий-162
- Диспрозий-163
- Диспрозий-164
- Гольмий-165
- Эрбий-162 (A, 2E) *
- Эрбий-164
- Эрбий-166
- Эрбий-167
- Эрбий-168
- Эрбий-170 (А, 2Б) *
- Тулий-169
- Иттербий-168 (A, 2E) *
- Иттербий-170
- Иттербий-171
- Иттербий-172
- Иттербий-173
- Иттербий-174
- Иттербий-176 (A, 2B) *
- Лютеций-175
- Гафний-176
- Гафний-177
- Гафний-178
- Гафний-179
- Гафний-180
- Тантал-180m (A, B, E, IT) * ^
- Тантал-181
- Вольфрам-182 (А) *
- Вольфрам-183 (А) *
- Вольфрам-184 (А) *
- Вольфрам-186 (А, 2Б) *
- Рений-185
- Осмий-184 (A, 2E) *
- Осмий-187
- Осмий-188
- Осмий-189
- Осмий-190
- Осмий-192 (А, 2В) *
- Иридий-191
- Иридий-193
- Платина-192 (А) *
- Платина-194
- Платина-195
- Платина-196
- Платина-198 (А, 2Б) *
- Золото-197
- Меркурий-196 (А, 2Е) *
- Меркурий-198
- Меркурий-199
- Меркурий-200
- Меркурий-201
- Меркурий-202
- Меркурий-204 (2Б)
- Таллий-203
- Таллий-205
- Свинец-204 (А) *
- Свинец-206 (А)
- Свинец-207 (А)
-
Свинец-208 (А) *
Висмут ^^ и выше — нет стабильных изотопов
нет массового числа 209 и выше
Сокращения для предсказанного ненаблюдаемого распада:
A для альфа-распада, B для бета-распада, 2B для двойного бета-распада, E для электронного захвата, 2E для двойного электронного захвата, IT для изомерного перехода, SF для спонтанного деления, * для нуклидов, период полураспада которых имеет нижнюю границу.
^ Тантал-180m является «метастабильным изотопом», что означает, что это возбужденный ядерный изомер тантала-180. См. Изотопы тантала . Однако период полураспада этого ядерного изомера настолько велик, что его распад никогда не наблюдался, и поэтому он встречается как «нерадиоактивный» первичный нуклид , как второстепенный изотоп тантала. Это единственный случай ядерного изомера, период полураспада которого настолько велик, что никогда не наблюдалось его распада. Таким образом, он включен в этот список.
^^ Висмут-209 долгое время считался стабильным из-за его необычайно длительного периода полураспада 2,01 × 10 19 лет, что более чем в миллиард (1000 миллионов) раз превышает возраст Вселенной.
Первозданные элементы
Существует 252 стабильных первичных нуклида и 34 радиоактивных первичных нуклида, но только 80 первичных стабильных элементов (с 1 по 82, т.е. водород через свинец, исключая 43 и 61, технеций и прометий соответственно) и три радиоактивных первичных элемента (висмут, торий и уран). Период полураспада висмута настолько велик, что его часто относят к 80 первичным стабильным элементам, поскольку его радиоактивность не вызывает серьезных опасений. Количество элементов меньше, чем количество нуклидов, потому что многие из первичных элементов представлены несколькими изотопами . См. Химический элемент для получения дополнительной информации.
Сводная таблица количества нуклидов каждого класса
Это сводная таблица из Списка нуклидов
Обратите внимание, что числа неточны и могут незначительно измениться в будущем, так как нуклиды обнаруживаются как радиоактивные или новые периоды полураспада определены с некоторой точностью.
| Тип нуклида по классу устойчивости | Количество нуклидов в классе | Общее количество нуклидов во всех классах на данный момент | Ноты |
|---|---|---|---|
| Теоретически устойчив ко всем, кроме распада протона | 90 | 90 | Включает первые 40 элементов. Если протоны распадаются , то стабильных нуклидов нет. |
| Теоретически устойчив к альфа-распаду , бета-распаду , изомерному переходу и двойному бета-распаду, но не к спонтанному делению , что возможно для «стабильных» нуклидов ≥ ниобия-93 | 56 | 146 | (Отметим, что для нуклидов с массовым числом <230 спонтанное деление никогда не наблюдалось). |
| Энергетически нестабилен по отношению к одной или нескольким известным модам распада, но распад еще не наблюдался. Считается стабильным до подтверждения радиоактивности. | 106 | 252 | Всего — наблюдаемые стабильные нуклиды. |
| Радиоактивные первичные нуклиды . | 34 | 286 | Включает Bi, Th, U. |
| Радиоактивное первородное происхождение, но встречается в природе на Земле. | ~ 61 значительный | ~ 347 значительных | Космогенные нуклиды космических лучей; дочери радиоактивных первооснов, таких как франций и т. д. |
Ядерные свойства и стабильность
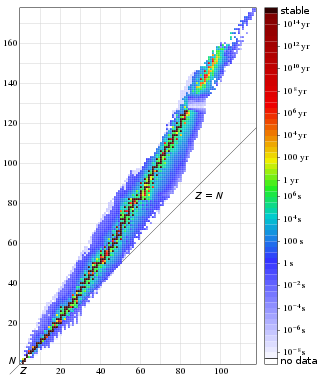
Стабильность нуклидов по ( Z , N ) , пример таблицы нуклидов : Черный — стабильный (все первичные) Красный — первичный радиоактивный Другой — радиоактивный, с уменьшением стабильности от оранжевого до белого
Ядра атомов состоят из протонов и нейтронов, связанных остаточной сильной силой . Поскольку протоны заряжены положительно, они отталкиваются друг от друга. Нейтроны, которые электрически нейтральны, стабилизируют ядро двумя способами. Их совместное присутствие немного раздвигает протоны, уменьшая электростатическое отталкивание между протонами, и они оказывают ядерное притяжение друг на друга и на протоны. По этой причине один или несколько нейтронов необходимы для того, чтобы два или несколько протонов могли быть связаны в ядро. По мере увеличения числа протонов увеличивается и отношение нейтронов к протонам, необходимое для обеспечения стабильного ядра (см. График справа). Например, хотя в соотношении нейтрон-протон из3 2Он составляет 1: 2, нейтронно-протонное отношение 238 92Uбольше 3: 2. Ряд более легких элементов имеет стабильные нуклиды в соотношении 1: 1 ( Z = N ). Нуклид40 20Ca(кальций-40) по наблюдениям является самым тяжелым стабильным нуклидом с таким же количеством нейтронов и протонов; (теоретически самый тяжелый стабильный — сера-32). Все стабильные нуклиды тяжелее кальция-40 содержат больше нейтронов, чем протонов.
Четные и нечетные числа нуклонов
| А | Четный | Странный | Общее количество | ||
|---|---|---|---|---|---|
| Z , N | EE | OO | EO | OE | |
| Стабильный | 146 | 5 | 53 | 48 | 252 |
| 151 | 101 | ||||
| Долгожитель | 21 год | 4 | 4 | 5 | 34 |
| 25 | 9 | ||||
| Все изначальное | 167 | 9 | 57 | 53 | 286 |
| 176 | 110 |
Отношение протон-нейтрон — не единственный фактор, влияющий на ядерную стабильность. Это зависит также от четности или нечетности его атомным номером Z , число нейтронов N и, следовательно, их суммы, массового числа А . Нечеткость как Z, так и N имеет тенденцию к снижению энергии связи ядра , делая нечетные ядра, как правило, менее стабильными. Эта замечательная разница в энергии связи ядер между соседними ядрами, особенно нечетных- A- изобар , имеет важные последствия: нестабильные изотопы с неоптимальным числом нейтронов или протонов распадаются в результате бета-распада (включая распад позитрона), захвата электронов или других экзотических способов, таких как как спонтанное деление, так и распад кластера .
Большинство стабильных нуклидов четно-протонно-нейтронные, где все числа Z , N и A четные. Стабильные нуклиды с нечетным A делятся (примерно поровну) на нуклиды с нечетным протоном и четным нейтроном и нуклиды с четным протоном и нечетным нейтроном. Нуклиды (и ядра) с нечетными протонами и нейтронами встречаются реже всего.