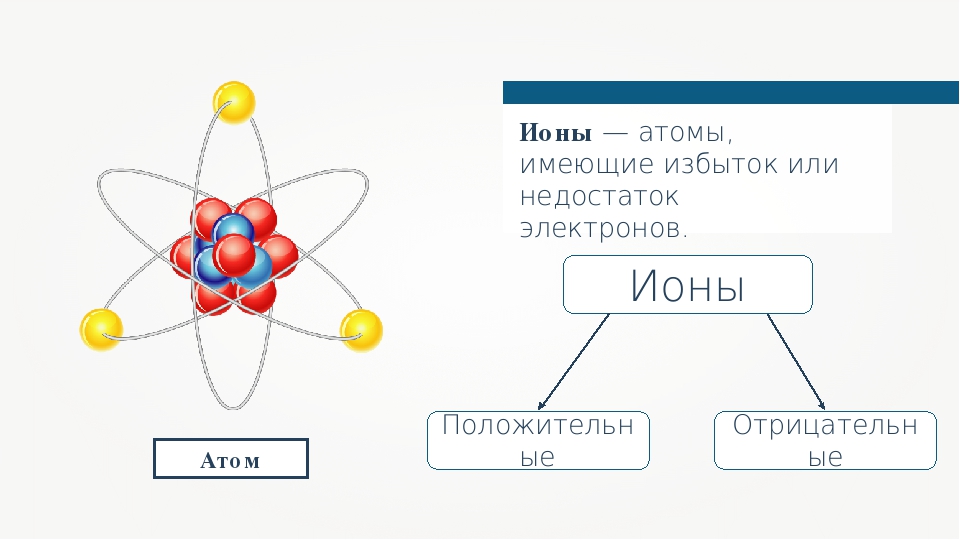
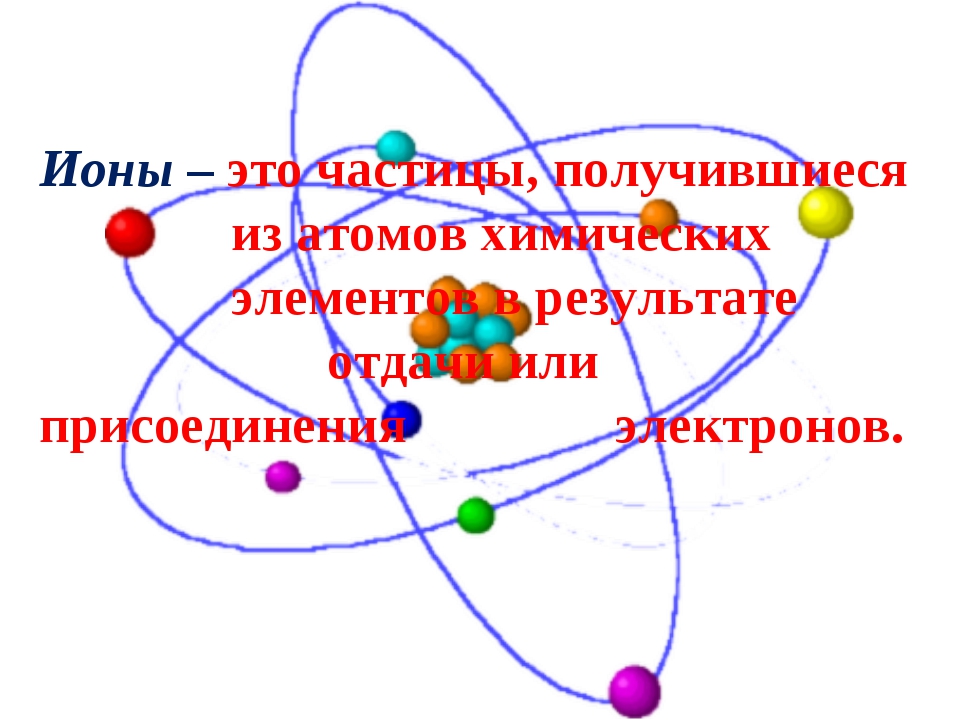
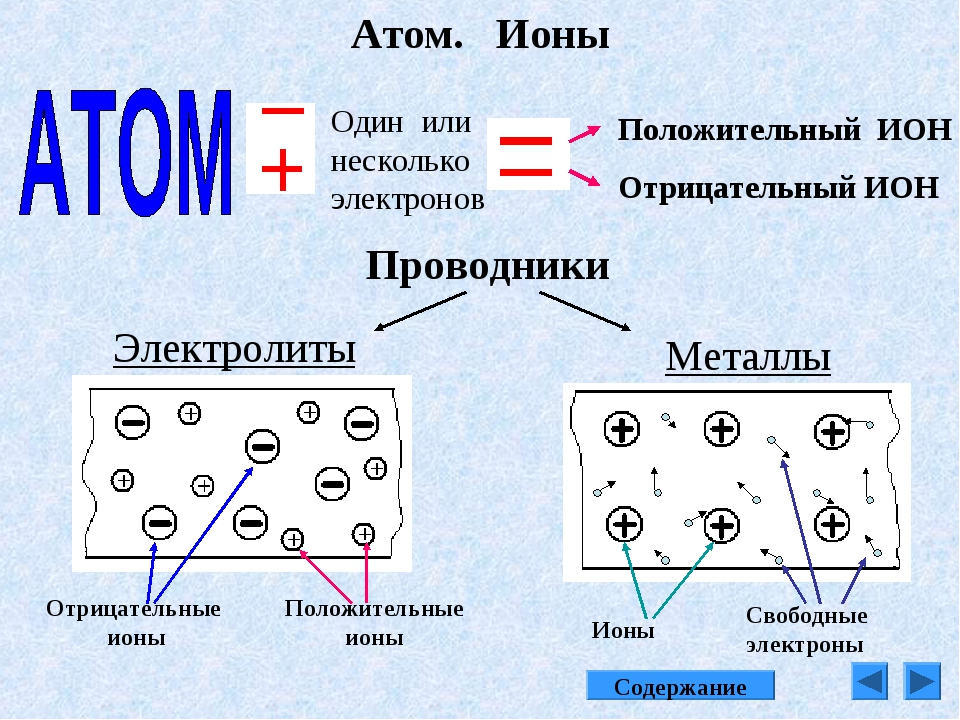
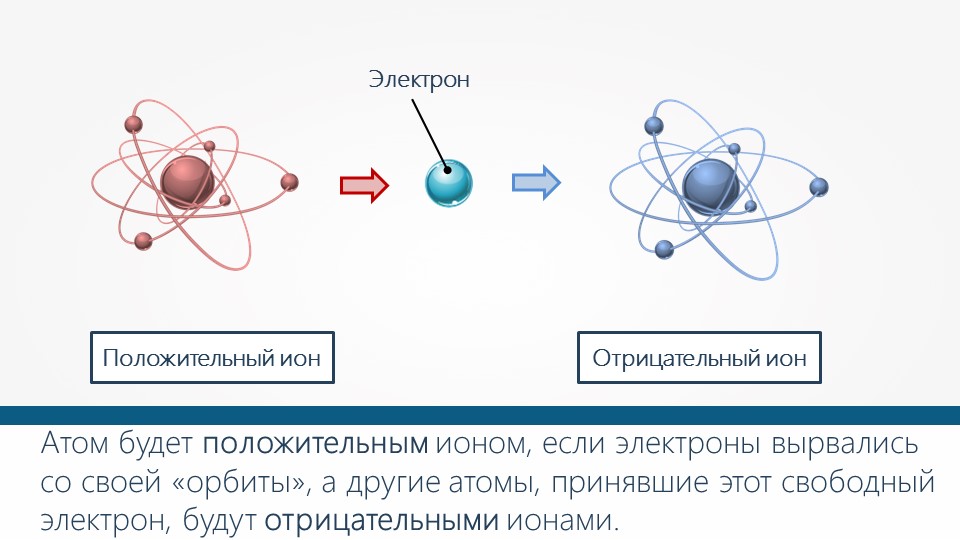
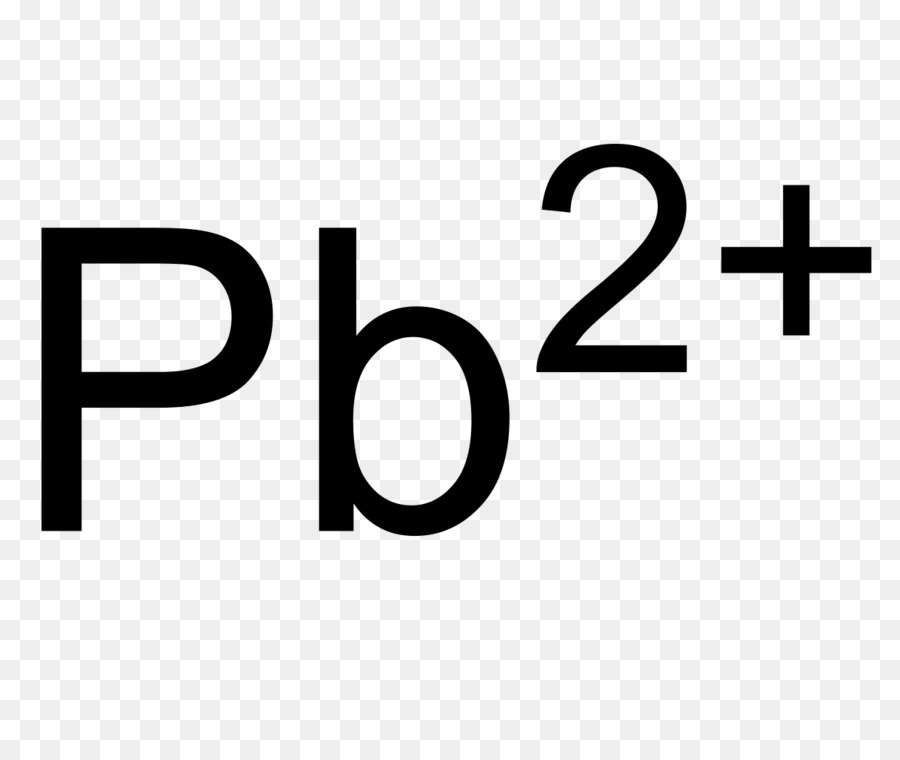Строение простых ионов
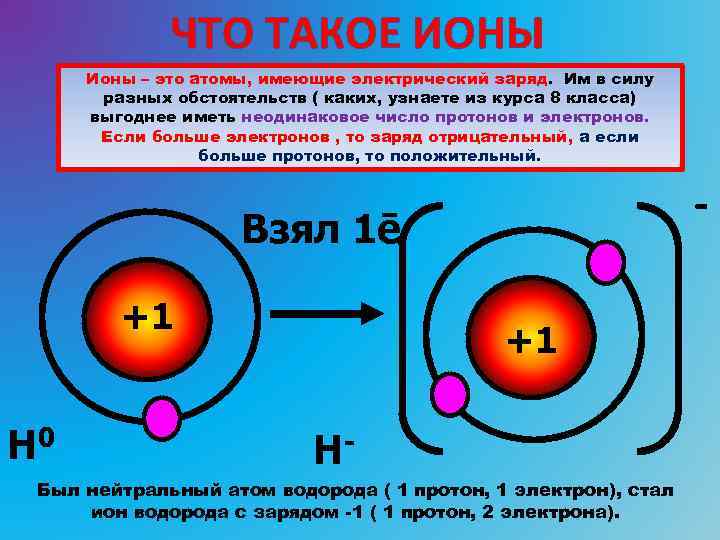
Простые ионы состоят из одного атомного ядра и электронов. Атомное ядро состоит из протонов и нейтронов, неся практически всю (более 99,9%) массу иона и создаёт положительно заряженное электрическое поле. Заряд атомного ядра определяется числом протонов, которое совпадает с порядковым номером элемента в периодической таблице Д.И. Менделеева.
Электроны заполняют электронные слои вокруг атомного ядра. Электроны с одинаковым значением главного квантового числа n образуют квантовый слой близких по размерам электронных облаков. Слои с n = 1,2,3,4… обозначаются соответственно буквами K, L, M, N… По мере удаления от атомного ядра ёмкость слоёв увеличивается и в соответствии со значением n составляет 2 (слой K), 8 (слой L), 18 (слой M), 32 (слой N)… электронов.
Исключением из общего правила является положительный ион водорода, который не содержит электронов и считается элементарной частицей — протоном. В то время как отрицательный ион водорода содержит два электрона. Фактически гидрид-ион является системой из одного протона и двух электронов и изоэлектронен положительному иону лития, имеющему в электронной оболочке также два электрона.
Вследствие волнового характера движения электрона ион не имеет строго определённых границ. Поэтому измерить абсолютные размеры ионов невозможно. Кажущийся радиус иона зависит от того, какое физическое свойство рассматривается, и будет различным для разных свойств. Обычно используют такие ионные радиусы, чтобы сумма двух радиусов равнялась равновесному расстоянию между соответствующими соприкасающимися ионами в кристалле. Такая полуэмпирическая таблица ионных радиусов была составлена Л. Полингом.
Позднее была составлена новая система ионных радиусов на основе кристаллохимических исследований Г.Б. Бокия структур простейших бинарных соединений.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Описание
Понятие и термин «ион» ввёл в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов.
Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обуславливают свойства электролитов.
Согласно химической номенклатуре, название катиона, состоящего из одного атома совпадает с названием элемента, например, Na+ называется натрий-ионом, иногда добавляют в скобках заряд, например, название катиона Fe2+ — железо (II)-ион. Название состоящего из одного атома аниона образуется из корня латинского названия элемента и суффикса «-ид», например, F- называется фторид-ионом.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора — 3.61 эВ, энергия ионизации — 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства — 0,78 эВ, потенциал ионизации — 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl-.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация — 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния — это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Ионизация
Атомы и молекулы могут превращаться в положительно заряженные ионы в результате потери одного или нескольких электронов. Отрыв электрона от атома или молекулы требует затраты энергии, называемой энергией ионизации.
Положительно заряженные ионы также образуются при присоединении протона (положительно заряженного ядра атома водорода). Примером является молекулярный ион водорода, ион аммония, ониевые соединения.
Отрицательно заряженные ионы образуются в результате присоединения электрона к атому или молекуле. Присоединение электрона сопровождается выделением энергии.
Положительный ион водорода (H+) получается при ионизации атома водорода, в физике он имеет название протон и обозначается символом p (или p+); протоны вместе с нейтронами образуют все атомные ядра. Энергия ионизации в данном процессе имеет значение 13,595 эВ.
Для атома гелия энергия ионизации составляет 24,581 эВ и 54,403 эВ и соответствует отрыву первого и второго электронов. Получаемый ион гелия (He2+) в физике имеет название альфа-частица. Выброс альфа-частиц наблюдается при радиоактивном распаде некоторых атомных ядер, например 88Ra226.
Энергия отрыва первого электрона атома имеет явно выраженный периодический характер в зависимости от порядкового номера элемента.
Зависимость энергии ионизации атомов от порядкового номера элемента
В связи с низкими значениями энергии ионизации щелочных металлов, их атомы легко теряют свои внешние электроны под действием света. Работа отрыва электрона производится в данном случае за счёт энергии поглощаемых металлом квантов света.
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.

Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).

Значение слова ИОН. Что такое ИОН?
ИО́Н, -а, м. Физ. Электрически заряженная частица (атом или группа атомов).
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Ио́н (др.-греч. ἰόν — идущее) — частица, в которой общее число протонов не эквивалентно общему числу электронов. Ион, в котором общее число протонов больше общего числа электронов, имеет положительный заряд и называется катионом. Ион, в котором общее число протонов меньше общего числа электронов имеет отрицательный заряд и называется анионом.
В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях вещества: в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвёздном пространстве).
ИО’Н, а, м. (физ.). Атом или молекула, содержащие в себе электрический заряд.
«Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Я стал чуточку лучше понимать мир эмоций.
Вопрос: последить — это что-то нейтральное, положительное или отрицательное?
- химия
- физика
- частица
- атом
- молекула
- (ещё…)
джон вакуум радиация плазма спектр … (все синонимы к слову ИОН)
Предложения со словом «ион»:
- Помимо кровоизлияний, высокая концентрация ионов железа может быть следствием процесса деградации крови в кавернах мальформации (96, 192, 227, 291).
- Оно имеет высокий водородный показатель на уровне 11 — 12 (мера активности ионов водорода в растворе), обозначаемый аббревиатурой PH.
- Почему же отрицательные ионы так благоприятствуют здоровью? Выяснено, что они оказывают на настроение людей положительное воздействие.
- (все предложения)
заряженный отрицательный положительный … (все определения)
Цитаты со словом «ион»:
- Мы не можем доверять никому, даже собственной семье. (1972 год, генералу Иону Пачепе)
- — Исследования ионных ракетных двигателей ведёт лаборатория электроники в г. Стэнфорд (Electronics Laboratory Stanford University). Основное препятствие в работе — нестабильность ионной струи на выходе из двигателя.
Чтобы двигатель, теряя положительный заряд, не заряжался отрицательно, поток ионов на выходе нужно нейтрализовать электронами. Величина вибраций струи пока не поддаётся расчётам, а от вибрации нарушается рабочий процесс в двигателе.
Всё упирается в математику, как считает д-р Дерфлер (Derfler, Heinrich): «Более исчерпывающий анализ нелинейных уравнений существенно повлияет на определение возможности применения ионных ракет в космическом пространстве». Вот ещё часть статьи, возможно не совсем точно переведённая: «Необходимо добиться сохранения высокого к.п.д.
двигателя при увеличении и уменьшении напряжения на электродах, уменьшить потери тепла на излучение у раскалённого эмиттера, избирательно искривить траекторию пучка ионов внутри ионного двигателя. Ионная пушка должна быть спроектирована и изготовлена с учётом этих требований. Однако, несмотря на облегчение эксперимента, спроектировать ионную пушку сложнее, чем электронную.
Согласно требованиям уже отработаны отдельные вопросы проблемы и найдены оптимальные характеристики системы. В конечном счёте, ионный эмиттер из цезия должен быть отработан. Важная особенность течения рабочего процесса в ионном двигателе – едва ли не абсолютная ионная оптика и как можно меньшие потери тепла за счёт радиации в стенки камеры.
Ещё две трудности проектирования ионной оптики – в низкой конвергенции потока ионов и в регулировании параметров на выходе при нейтрализации потока. …Регулирование необходимых параметров соответственно этим требованиям может в свою очередь определить новую программу и эффект ионной оптики.
При чередующейся работе над двумя программами может быть выяснена реальность и эффективность ионной пушки». Лев Владимирович Баньковский (1938–2011) — российский философ
- Действие радия на кожу изучено доктором Доло в больнице Сен-Луи. С этой точки зрения радий даёт ободряющие результаты: эпидерма, частично разрушенная действием радия, преобразуется в здоровую. Мария Склодовская-Кюри (1867–1934)
- (все цитаты)
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
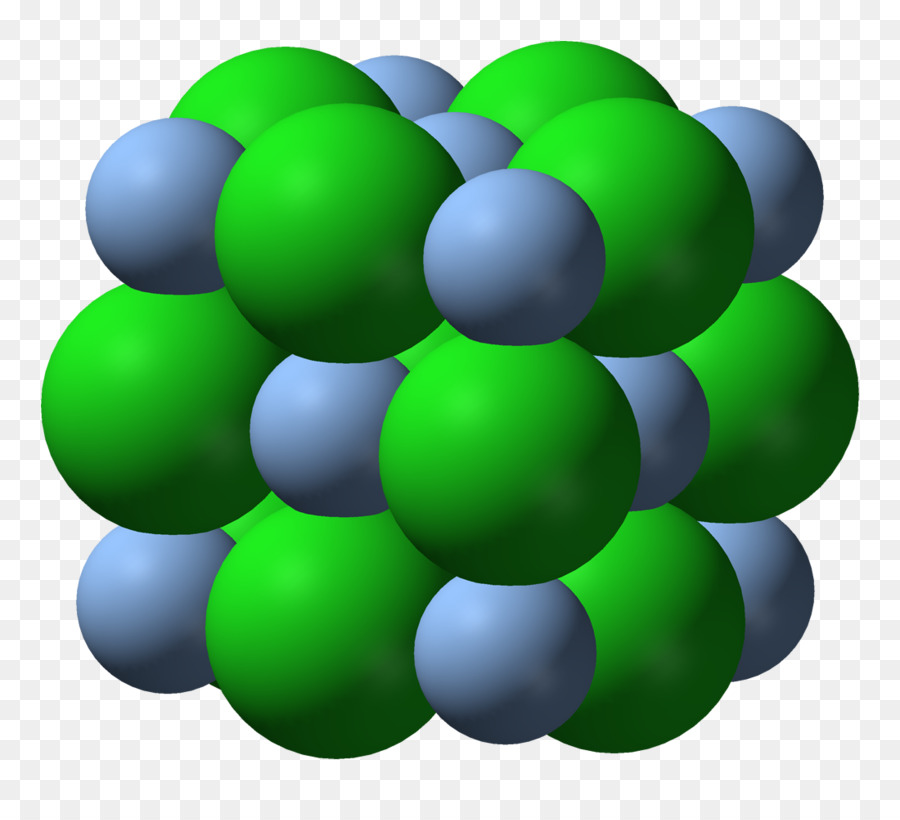
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Ионизация
Атомы и молекулы могут превращаться в положительно заряженные ионы в результате потери одного или нескольких электронов. Отрыв электрона от атома или молекулы требует затраты энергии, называемой энергией ионизации.
Положительно заряженные ионы также образуются при присоединении протона (положительно заряженного ядра атома водорода). Примером является молекулярный ион водорода, ион аммония, ониевые соединения.
Отрицательно заряженные ионы образуются в результате присоединения электрона к атому или молекуле. Присоединение электрона сопровождается выделением энергии.
Положительный ион водорода (H+) получается при ионизации атома водорода, в физике он имеет название протон и обозначается символом p (или p+); протоны вместе с нейтронами образуют все атомные ядра. Энергия ионизации в данном процессе имеет значение 13,595 эВ.
Для атома гелия энергия ионизации составляет 24,581 эВ и 54,403 эВ и соответствует отрыву первого и второго электронов. Получаемый ион гелия (He2+) в физике имеет название альфа-частица. Выброс альфа-частиц наблюдается при радиоактивном распаде некоторых атомных ядер, например 88Ra226.
Энергия отрыва первого электрона атома имеет явно выраженный периодический характер в зависимости от порядкового номера элемента.
Зависимость энергии ионизации атомов от порядкового номера элемента
В связи с низкими значениями энергии ионизации щелочных металлов, их атомы легко теряют свои внешние электроны под действием света. Работа отрыва электрона производится в данном случае за счёт энергии поглощаемых металлом квантов света.
Описание
Понятие и термин «ион» ввёл в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов.
Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обуславливают свойства электролитов.
Согласно химической номенклатуре, название катиона, состоящего из одного атома совпадает с названием элемента, например, Na+ называется натрий-ионом, иногда добавляют в скобках заряд, например, название катиона Fe2+ — железо (II)-ион. Название состоящего из одного атома аниона образуется из корня латинского названия элемента и суффикса «-ид», например, F- называется фторид-ионом.