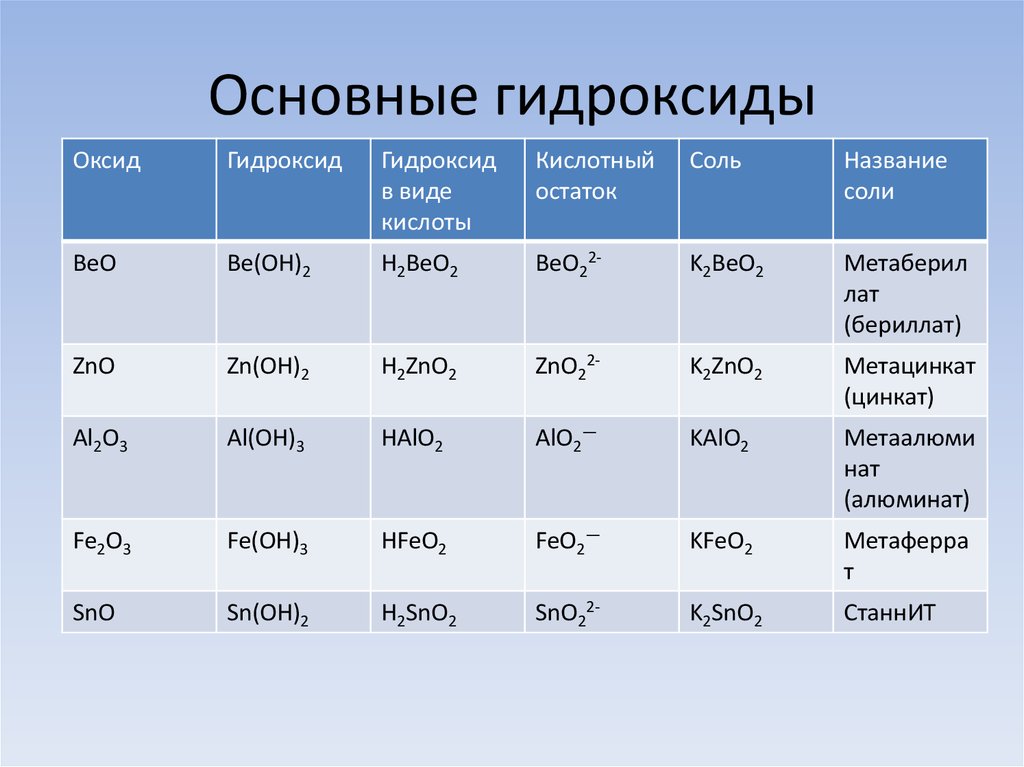
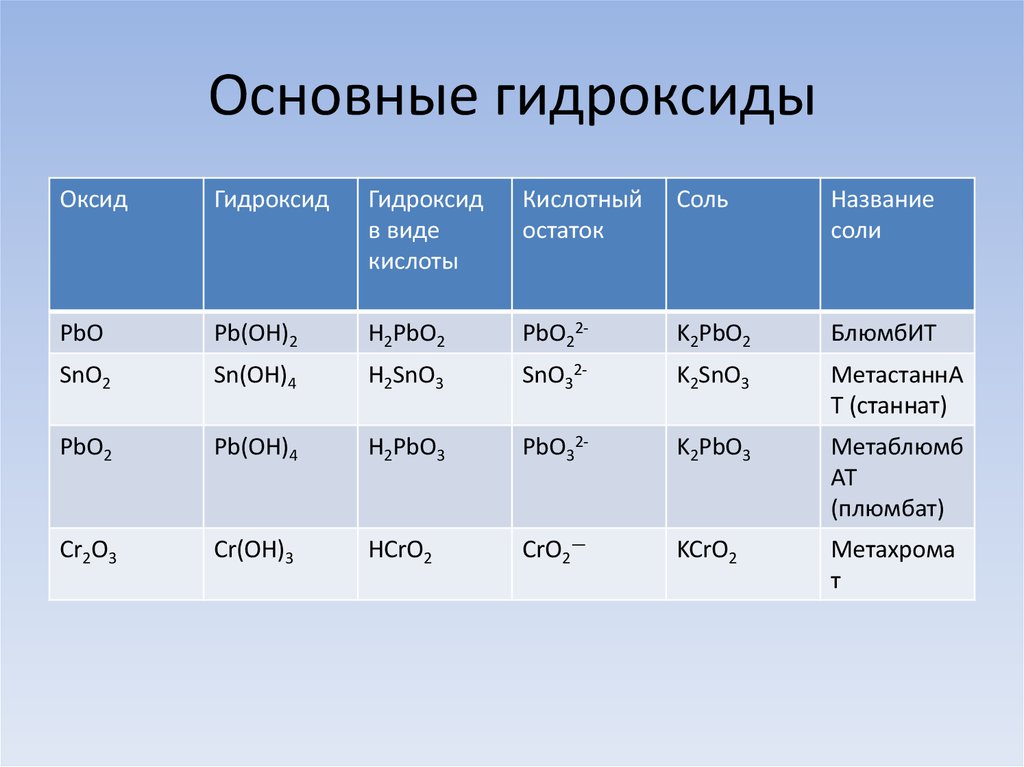
Основания, проявляющие двойственные свойства
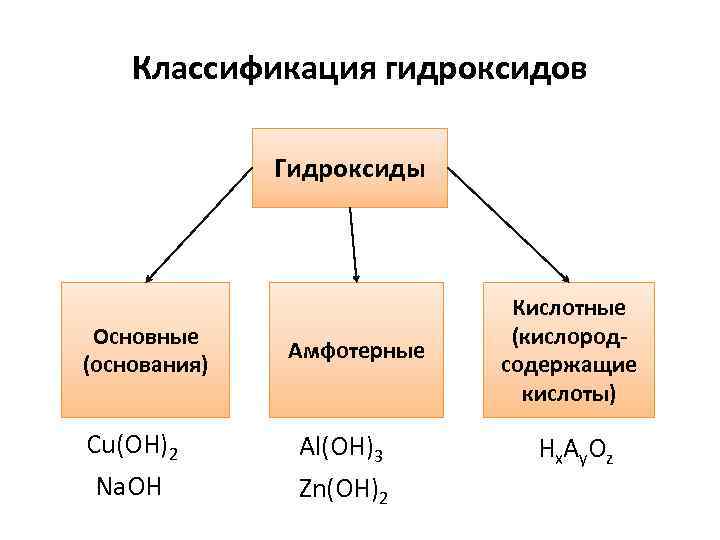
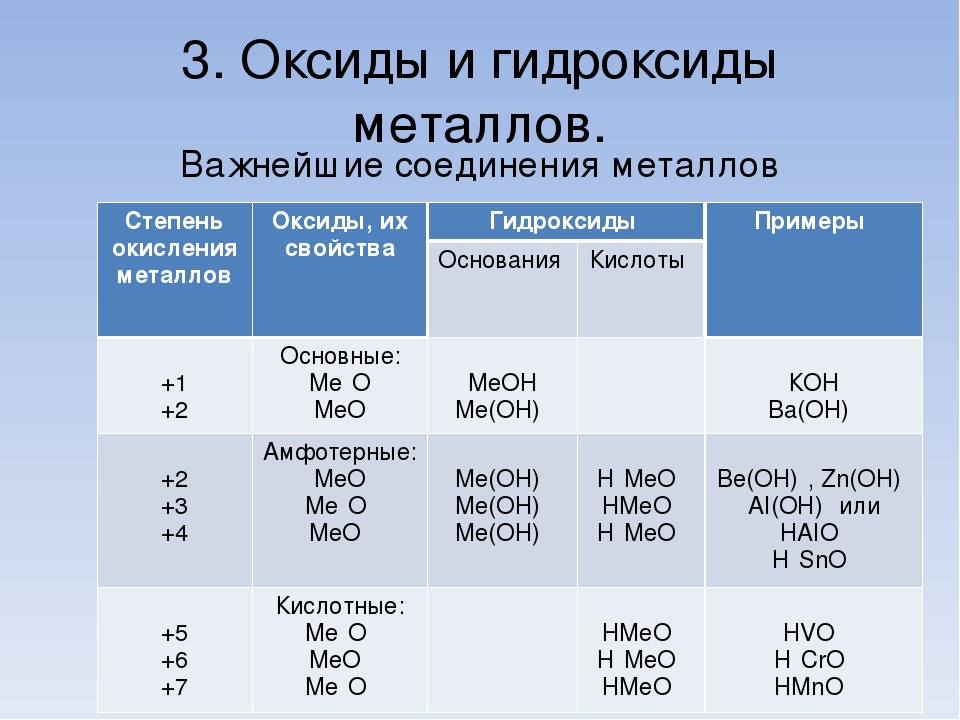
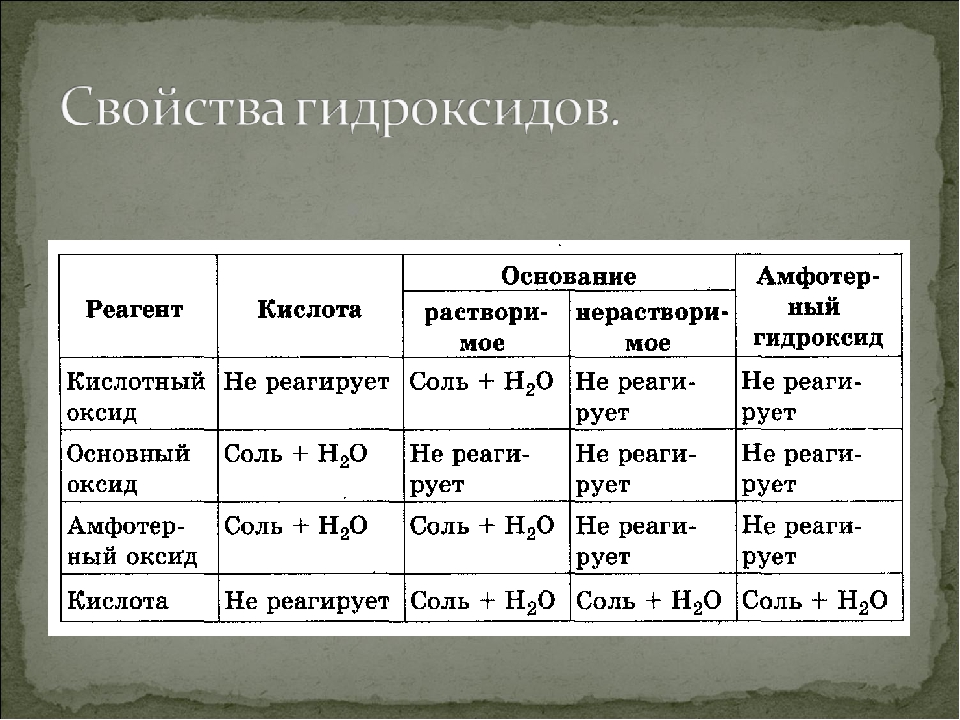
Если элемент или сложное вещество может реагировать и с кислотами, и с щелочами – его называют амфотерным. К таковым относятся, например, цинк, алюминий и их основания. Свойства амфотерных гидроксидов позволяют записывать их молекулярные формулы как в виде оснований, выделяя при этом гидроксогруппу, так и в виде кислот. Представим несколько уравнений реакций основания алюминия с хлоридной кислотой и гидроксидом натрия. Они иллюстрируют особые свойства гидроксидов, относящихся к амфотерным соединениям. Вторая реакция проходит с распадом щелочи:
2Al(OH)3 + 6HCl = 2AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Продуктами процессов будут вода и соли: хлорид алюминия и алюминат натрия. Все амфотерные основания не растворяются в воде. Добывают их в результате взаимодействия соответствующих солей и щелочей.
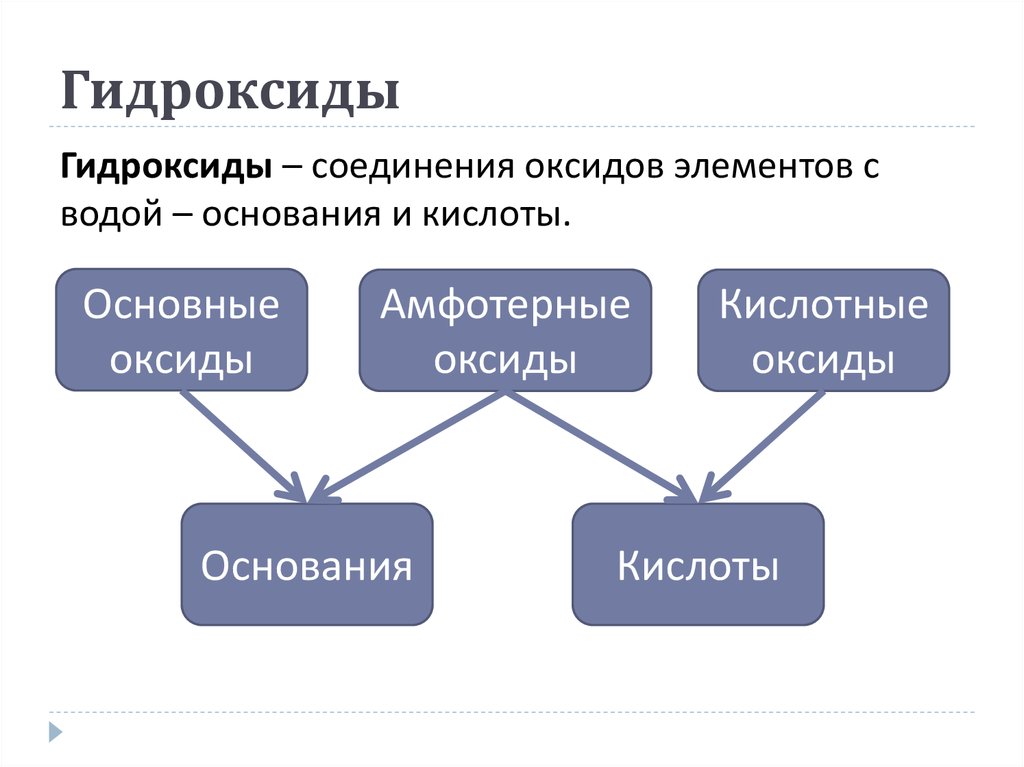
Основания (гидроксиды). Свойства, получение, применение
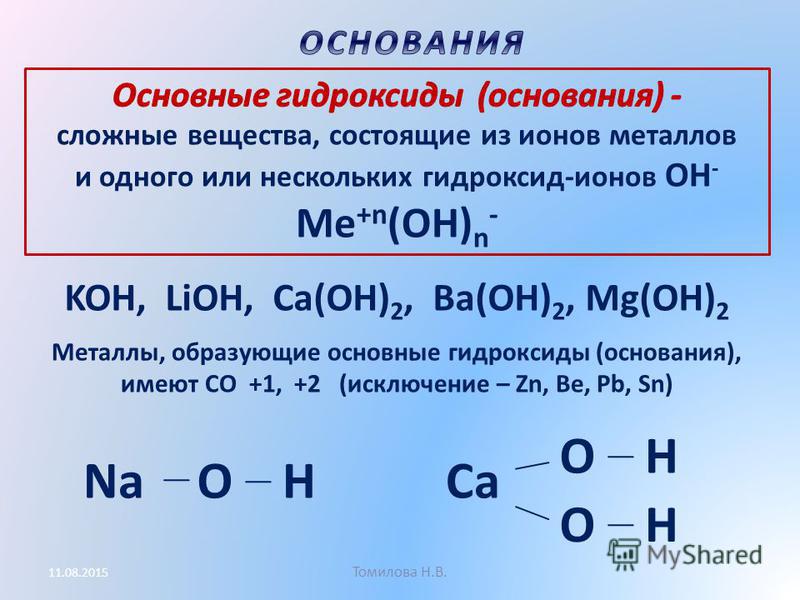
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса).
Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты.
Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калияCa(OH)2 — гидроксид кальцияFe(OH)2 — гидроксид железа (II)Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
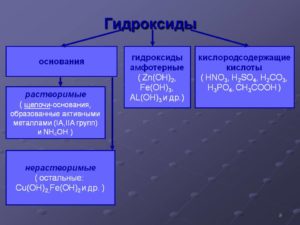
Классификация оснований
Основания можно классифицировать по следующим признакам:
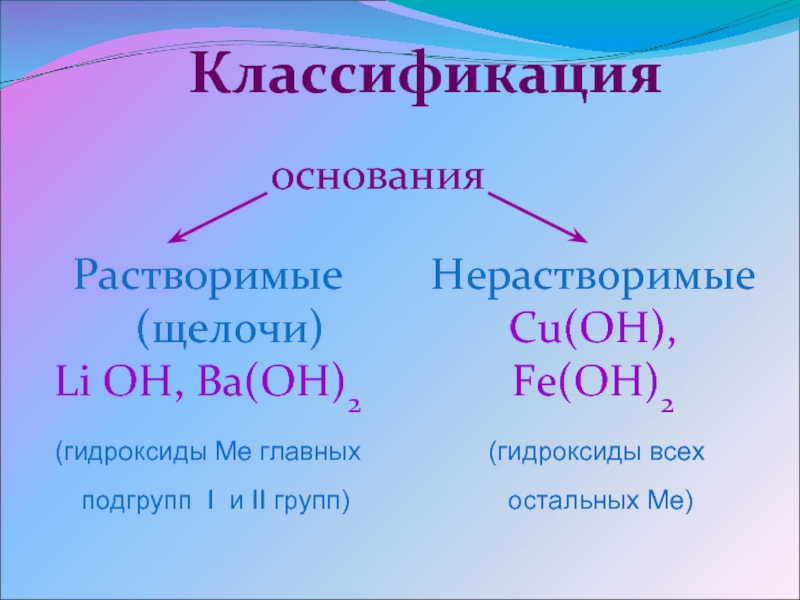
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.б) слабые (α
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты.
Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода.
Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2NaCI + 4H2O 2NaOH + 2H2 + CI2
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту
При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Литература
- Общая химическая технология. Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
- Основы общей химии, т. 3, Б. В. Некрасов. — М.: Химия, 1970.
- Общая химическая технология. Фурмер И. Э., Зайцев В. Н. — М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. № 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. № 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21 июля 1997 г. № 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изм. на 18 декабря 2006 г.).
- Приказ МПР РФ от 2 декабря 2002 г. № 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25 октября 1974 г. № 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых даёт право на дополнительный отпуск и сокращённый рабочий день» (с изм. на 29 мая 1991 г.).
- Постановление Минтруда России от 22 июля 1999 г. № 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30 мая 2003 г. № 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест».(с изм. на 3 ноября 2005 г.).
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Редько А. В. Основы фотографических процессов. — 2-е изд.. — СПб.: «Лань», 1999. — 512 с. — (Учебники для ВУЗов. Специальная литература). — 3000 экз. — ISBN 5-8114-0146-9.
Химические свойства
-
- NaOH ⇄ Na++OH−{\displaystyle {\mathsf {NaOH\ \rightleftarrows \ Na^{+}+OH^{-}}}}
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- лакмус становится синим,
- метилоранж — жёлтым,
- фенолфталеин приобретает цвет фуксии.
При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
-
- NaOH+HCl → NaCl+H2O{\displaystyle {\mathsf {NaOH+HCl\ {\xrightarrow {}}\ NaCl+H_{2}O}}}
- Примечание: реакция не идёт, если и кислота и основание слабые.
При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
-
- NaOH+H3PO4 → NaH2PO4+H2O{\displaystyle {\mathsf {NaOH+H_{3}PO_{4}\ {\xrightarrow {}}\ NaH_{2}PO_{4}+H_{2}O}}}
- 2Cu(OH)2+H2CO3 → (CuOH)2CO3+2H2O{\displaystyle {\mathsf {2Cu(OH)_{2}+H_{2}CO_{3}\ {\xrightarrow {}}\ (CuOH)_{2}CO_{3}+2H_{2}O}}}
Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
-
- Zn(OH)2+2KOH → K2Zn(OH)4{\displaystyle {\mathsf {Zn(OH)_{2}+2KOH\ {\xrightarrow {}}\ K_{2}}}}
Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
-
- 2NaOH+SiO2 → Na2SiO3+H2O{\displaystyle {\mathsf {2NaOH+SiO_{2}\ {\xrightarrow {}}\ Na_{2}SiO_{3}+H_{2}O}}}
- 2NaOH+Al2O3 → 2NaAlO2+H2O{\displaystyle {\mathsf {2NaOH+Al_{2}O_{3}\ {\xrightarrow {}}\ 2NaAlO_{2}+H_{2}O}}}
Основания вступают в обменные реакции (реагируют с растворами солей):
-
- Ba(OH)2+Na2SO4 → 2NaOH+BaSO4↓{\displaystyle {\mathsf {Ba(OH)_{2}+Na_{2}SO_{4}\ {\xrightarrow {}}\ 2NaOH+BaSO_{4}\downarrow }}}
Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
-
- Cu(OH)2 →T CuO+H2O{\displaystyle {\mathsf {Cu(OH)_{2}\ {\xrightarrow {T}}\ CuO+H_{2}O}}}
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
Физические свойства
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
ΔH растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при 12,3—61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔHобр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация) . Растворимость в метаноле 23,6 г/л (t = 28 °C), в этаноле 14,7 г/л (t = 28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Получение
Гранулы гидроксида натрия
Гидроксид кальция
Гидроксид алюминия
Метагидроксид железа
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
- CaO+H2O → Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\ {\xrightarrow {}}\ Ca(OH)_{2}}}}
- Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- CuSO4+2NaOH → Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+2NaOH\ {\xrightarrow {}}\ Cu(OH)_{2}\downarrow +Na_{2}SO_{4}}}}
- Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
- Ca+2H2O → Ca(OH)2+H2↑{\displaystyle {\mathsf {Ca+2H_{2}O\ {\xrightarrow {}}\ Ca(OH)_{2}+H_{2}\uparrow }}}
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
- 2NaCl+2H2O →e− 2NaOH+H2↑+Cl2↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\ {\xrightarrow {e^{-}}}\ 2NaOH+H_{2}\uparrow +Cl_{2}\uparrow }}}
- Некоторые основания можно получить реакциями обмена:
- Li2SO4+Ba(OH)2 → 2LiOH+BaSO4↓{\displaystyle {\mathsf {Li_{2}SO_{4}+Ba(OH)_{2}\ {\xrightarrow {}}\ 2LiOH+BaSO_{4}\downarrow }}}
- Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Номенклатура и строение молекулы
Чтобы правильно назвать основание, требуется к названию металлического элемента прибавить слово гидроксид. Приведем конкретные примеры. Основание алюминия относится к амфотерным гидроксидам, свойства которых мы рассмотрим в статье. Обязательное присутствие в молекулах оснований гидроксильной группы, связанной с катионом металла ионным типом связи, можно определить с помощью индикаторов, например, фенолфталеина. В водной среде избыток ионов OH-определяется по изменению цвета раствора индикатора: бесцветный фенолфталеин становится малиновым. Если металл проявляет несколько валентностей, он может образовывать несколько оснований. Например, железо имеет два основания, в которых валентность металла равна 2 или 3. Первое соединение характеризуется признаками основных гидроксидов, второе — амфотерных. Поэтому свойства высших гидроксидов отличаются от соединений, в которых металл имеет низшую степень валентности.

Химические свойства гидроксидов
Взаимодействие между собой двух важнейших групп соединений – кислот и оснований – именуют в химии реакцией нейтрализации. Такое название можно объяснить тем, что химически агрессивные гидроксиды и кислоты образуют нейтральные продукты – соли и воду. Являясь, по сути, обменным процессом между двумя сложными веществами, нейтрализация характерна как для щелочей, так и для нерастворимых в воде оснований. Приведем уравнение реакции нейтрализации между едким калием и хлоридной кислотой:
KOH + HCl = KCl + H2O
Важное свойство оснований щелочных металлов является их способность реагировать с кислотными оксидами, в результате можно получить соль и воду. Например, пропуская через гидроксид натрия углекислый газ, можно получить его карбонат и воду:. 2NaOH + CO2 = Na2CO3 + H2O
2NaOH + CO2 = Na2CO3 + H2O
К реакциям ионного обмена относится взаимодействие между щелочами и солями, идущее с образованием нерастворимых гидроксидов или солей. Так, приливая по каплям раствор едкого натра в раствор сернокислой меди, можно получить голубой желеобразный осадок. Это основание меди, нерастворимое в воде:
CuSO4 + 2NaOH = Cu(OH)2 + Na2 SO4
Химические свойства гидроксидов, нерастворимых в воде, отличаются от щелочей тем, что они при небольшом нагревании теряют воду – дегидратируются, переходя в форму соответствующего основного окисла.
Применение
Биодизельное топливо

Получение биодизеля
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
Для омыления жиров при производстве мыла, шампуня и других моющих средств
В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г
н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад. В настоящее время продукты на основе гидроксида натрия (с добавлением гидроксида калия), нагретые до 50-60 °C, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
В химических отраслях промышленности — для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число — условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
В текстильной промышленности — для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск.
Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524. Некоторые блюда готовятся с применением каустика:
Лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
Брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
В косметологии для удаления ороговевших участков кожи, бородавок, папиллом.
В фотографии — как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
Меры предосторожности при обращении с гидроксидом натрия
Химический ожог в результате действия раствора гидроксида натрия. Фотография сделана через 44 часа после воздействия
Гидроксид натрия — едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности
Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги
Попадание в глаза вызывает необратимые изменения зрительного нерва (атрофию) и, как следствие, потерю зрения. При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струёй воды, а при попадании на кожу — слабым раствором уксусной или борной кислоты. При попадании едкого натра в глаза следует немедленно промыть их сначала слабым раствором борной кислоты, а затем водой.
При работе с едким натром рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела — химически стойкая одежда, пропитанная винилом или прорезиненные костюмы.
Предельно допустимая концентрация гидроксида натрия в воздухе 0,5 мг/м³.
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
2KOH + SO3 → K2SO4 + H2O
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.