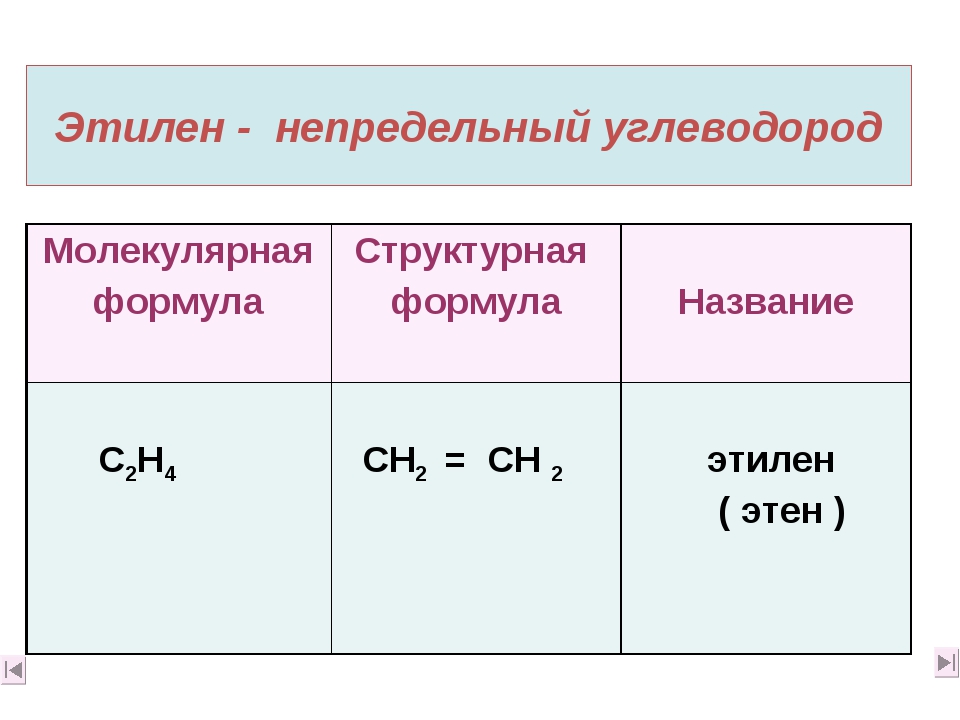
Гидрогенизация и горение этилена
Несмотря на все вышесказанное, реакция соединения водорода не имеет большого практического значения. Однако она показывает генетическую связь между различными классами органических соединений, в данном случае алканов и олефинов. Присоединяя водород, этен превращается в этан. Противоположный процесс — отщепление от предельных углеводородов атомов водорода приводит к образованию представителя алкенов — этена. Жесткое окисление олефинов, называемое горением, сопровождается выделением большого количества тепла, реакция является экзотермической. Продукты сгорания одинаковы для веществ всех классов углеводородов: алканов, непредельных соединений ряда этилена и ацетилена, ароматических веществ. К ним относятся углекислый газ и вода. Воздух в реакции с этиленом образует взрывчатую смесь.

Примечания[ | код]
- Devanney Michael T. (англ.) (недоступная ссылка). SRI Consulting (September 2009).
- (англ.) (недоступная ссылка). WP Report. SRI Consulting (January 2010).
- (недоступная ссылка). Дата обращения 21 января 2007.
- Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. — 2-е изд. — М.: Высшая школа, 1993. — С. 345. — 447 с. — ISBN 5-06-002965-4.
- В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
- ↑
- ↑ Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. — 2-е изд.. — Санкт-Петербург: Н-Л, 2010. — С. 432.
- Нелюбов Д. Н. О горизонтальной нутации у Pisum sativum и некоторых других растений (рус.) // Труды Санкт-Петербургского Общества Естествознания : журнал. — 1901. — Т. 31, № 1., также Beihefte zum «Bot. Centralblatt», т. Х, 1901
- Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
Взаимосвязь между строением молекулы и свойствами вещества
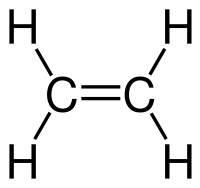
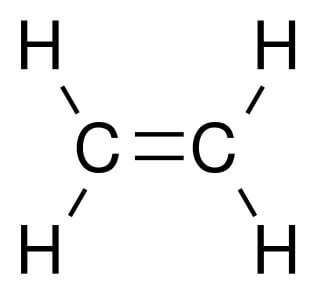
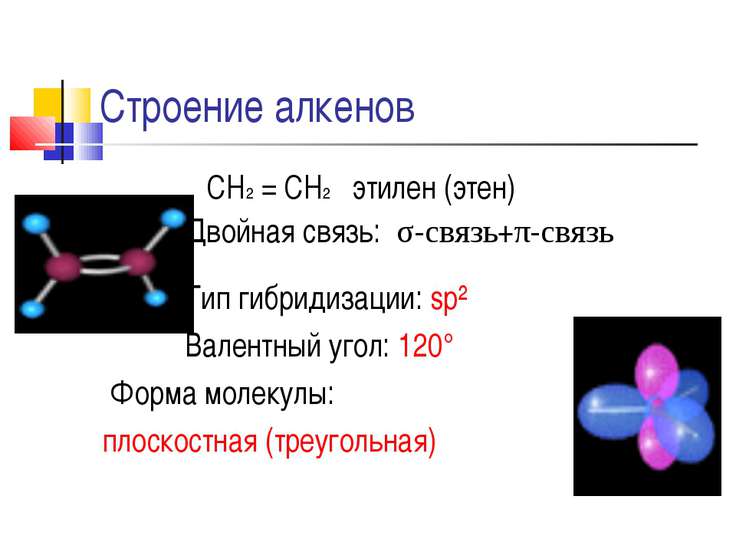
Согласно теории строения органических веществ, предложенной М. Бутлеровым, характеристика соединения полностью зависит структурной формулы и вида связей его молекулы. Химические свойства этилена также определяются пространственной конфигурацией атомов, гибридизацией электронных облаков и наличием в его молекуле пи-связи. Два негибридизованных p-электрона атомов углерода перекрываются в плоскости, перпендикулярной плоскости самой молекулы. Формируется двойная связь, разрыв которой обусловливает способность алкенов к реакциям присоединения и полимеризации.
Этилен и горение
Этилен – это газ без цвета, который плохо растворяется в воде. Горение этилена в воздухе сопровождается образованием углекислого газа и воды. В чистом виде газ горит световым диффузионным пламенем. Смешанный с небольшим количеством воздуха, он дает пламя, состоящее из трех отдельных слоев – внутреннего сердечника — несгоревшего газа, сине-зеленого слоя и внешнего конуса, где частично окисленный продукт из предварительно перемешанного слоя сгорают в диффузионном пламени. Результирующее пламя показывает сложную серию реакций, а если к газовой смеси добавляется больше воздуха, постепенно диффузионный слой исчезает.
4 Требования безопасности
4.1 По степени воздействия на организм этилен относится к малоопасным веществам (4-й класс опасности по ГОСТ 12.1.007).
4.2 Предельно допустимая концентрация (ПДК) этилена в воздухе рабочей зоны — 100 мг/м по ГОСТ 12.1.005 . Максимальная разовая ПДК по алкенам (в пересчете на углерод) — 300 мг/м, среднесменная — 100 мг/м.________________При превышении ПДК этилен оказывает наркотическое действие, вызывает головную боль, головокружение, ослабление дыхания, удушье, нарушение кровообращения, потерю сознания.Сжиженный этилен при попадании на кожу вызывает ее поражение, аналогичное ожогу.Этилен кумулятивными свойствами не обладает.Этилен при нормальных условиях не вступает в химическое взаимодействие с водой, в воздушной среде токсичные соединения не образует.
4.3 Меры первой помощи при отравлении: свежий воздух (можно дать кислород), тепло, покой, в случае необходимости — искусственное дыхание.Пораженные участки кожи следует смазать противоожоговой мазью и наложить стерильную повязку.После оказания первой помощи следует обратиться к врачу.
4.4 Средства индивидуальной защиты органов дыхания при превышении ПДК: изолирующий самоспасатель, дыхательный аппарат со сжатым воздухом, кислородно-изолирующий противогаз; при работе в замкнутых пространствах — шланговый противогаз ПШ-1 или ПШ-2 или другие изолирующие средства индивидуальной защиты органов дыхания.
4.5 Этилен — бесцветный горючий газ, способный к взрывному разложению при повышенном давлении, высокой температуре или воздействии открытого огня в присутствии кислорода. Концентрационные пределы распространения пламени в воздухе, % об.:- нижний — 2,8;- верхний — 36,35.Температура самовоспламенения — 427°С.Минимальное взрывоопасное содержание кислорода при разбавлении этилено-воздушных смесей азотом — 10%, диоксидом углерода — 12,1%.Показатели пожаровзрывоопасности определены по ГОСТ 12.1.044 .
4.6 При возникновении очага загорания в качестве средств пожаротушения применяют порошковые, хладоновые и углекислотные огнетушители, воздушно-механическую пену, водяной пар, инертные газы, аэрозольные составы.
4.7 Концентрацию этилена в воздухе рабочей зоны определяют по методикам, утвержденным в установленном порядке.Контроль за содержанием этилена в воздухе рабочей зоны и периодичность контроля — по ГОСТ 12.1.005 , раздел 4*.________________* Перечень нормативных документов, действующих в Российской Федерации, представлен в приложении А.Довзрывоопасную концентрацию в помещениях определяют с помощью автоматических сигнализаторов типов СТМ, СТХ, СГГ, ЭХТ, индикатора типа ИВП и других аналогичных приборов.
4.8 В производственных условиях должны быть предусмотрены следующие меры предосторожности: герметизация производственного оборудования, приточно-вытяжная вентиляция в соответствии с требованиями ГОСТ 12.4.021 , запрещение применения открытого огня и источников искрообразования.Электрооборудование и освещение должны быть во взрывобезопасном исполнении, оборудование и трубопроводы — заземлены. При работе с продуктом следует соблюдать требования электростатической искробезопасности по ГОСТ 12.1.018
4.9 Все работы с этиленом следует проводить с соблюдением санитарных правил, правил по технике безопасности, принятых для работы со сжиженными, горючими газами, и правил устройства и безопасной эксплуатации сосудов, работающих под давлением.
3 Технические требования
3.1 Этилен изготовляют в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
3.2 Характеристики
3.2.1 По физико-химическим показателям этилен должен соответствовать нормам, указанным в таблице 1.Таблица 1
|
Наименование показателя |
Метод анализа |
|
|
1 Объемная доля этилена, %, не менее |
||
|
2 Объемная доля пропилена, %, не более |
||
|
3 Объемная доля метана и этана, %, не более |
||
|
4 Объемная доля ацетилена, %, не более |
||
|
5 Объемная доля диеновых углеводородов (пропадиена и бутадиена), %, не более |
||
|
6 Объемная доля диоксида углерода, %, не более |
||
|
7 Объемная доля оксида углерода, %, не более |
||
|
8 Объемная доля метанола, %, не более |
||
|
9 Объемная доля кислорода в продукте, поставляемом по трубопроводу, %, не более |
||
|
10 Массовая концентрация серы, мг/м, не более |
||
|
11 Массовая доля воды, %, не более |
||
|
а) в продукте, поставляемом по трубопроводу |
||
|
б) в продукте, поставляемом в цистернах и баллонах |
||
|
12 Объемная доля аммиака, %, не более |
||
|
Примечание — Этилен, предназначенный для холодильных установок, должен соответствовать нормам по показателям 1-4. Остальные показатели не определяют. |
3.3 Маркировка
3.3.1 При маркировке должны быть соблюдены нормы законодательства, действующего в каждом из государств — участников Соглашения и устанавливающего порядок маркирования продукции информацией на государственном языке.
3.3.2 Маркировка — по ГОСТ 1510 (на условиях аналога углеводородных сжиженных топливных газов).Допускается по согласованию с потребителем не наносить номер партии и дату изготовления при условии указания их в документе о качестве.
3.3.3 Транспортная маркировка — по ГОСТ 14192 с нанесением манипуляционного знака «Беречь от солнечных лучей», а также в соответствии с правилами перевозки опасных грузов, действующими на соответствующем виде транспорта.
3.3.4 При транспортировании железнодорожным транспортом маркировку осуществляют в соответствии с правилами . На каждое грузовое место отправитель обязан нанести транспортную маркировку, характеризующую вид и транспортную опасность груза, содержащую:- знак опасности — N 2.1;- наименование груза — ЭТИЛЕН;- классификационный шифр этилена — 2111;- номер ООН — 1962;- классификационный код — 2F;- номер аварийной карточки — 204;для этилена охлажденного жидкого маркировка должна содержать:- знак опасности — N 2.1;- наименование груза — ЭТИЛЕН ОХЛАЖДЕННЫЙ ЖИДКИЙ;- классификационный шифр этилена охлажденного жидкого — 2113;- номер ООН — 1038:- классификационный код — 3F;- номер аварийной карточки — 204.
3.3.5 Предупредительная маркировка — в соответствии с ГОСТ 31340 .
3.4 Упаковка
3.4.1 Упаковка этилена — по ГОСТ 1510
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоныГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасностиГОСТ 12.1.018-93 Система стандартов безопасности труда. Пожаровзрывобезопасность статического электричества. Общие требованияГОСТ 12.1.044-89 (ИСО 4589-84) Система стандартов безопасности труда. Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определенияГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требованияГОСТ 17.2.3.02-78 Охрана природы. Атмосфера. Правила установления допустимых выбросов вредных веществ промышленными предприятиямиГОСТ 1510-84 Нефть и нефтепродукты. Маркировка, упаковка, транспортирование и хранениеГОСТ 14192-96 Маркировка грузовГОСТ 24975.0-89 (ИСО 7382-86, ИСО 8563-87) Этилен и пропилен. Методы отбора пробГОСТ 24975.1-89 (ИСО 6379-81, ИСО 6380-81, ИСО 6381-81, ИСО 8174-86) Этилен и пропилен. Хроматографические методы анализаГОСТ 24975.2-89 Этилен и пропилен. Методы определения серыГОСТ 24975.3-81 Этилен и пропилен. Методы определения кислородаГОСТ 24975.4-89 Этилен. Метод определения аммиакаГОСТ 24975.5-91 Этилен и пропилен. Методы определения водыГОСТ 31340-2007 Предупредительная маркировка химической продукции. Общие требованияПримечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
7 Методы анализа
7.1 Отбор проб для анализа — по ГОСТ 24975.0 .
7.2 Общие указания
7.2.1 Результаты определения округляют до того количества значащих цифр, которому соответствует норма по данному показателю.По согласованию с потребителем допускается округлять результаты определения до количества значащих цифр, установленных требованиями договора (контракта).
7.2.2 Допускается применять другие методы анализа, обеспечивающие требуемую точность и достоверность результатов определения. Применяемые методики должны быть аттестованы в установленном порядке. При разногласиях в оценке качества продукта анализ проводят методами, указанными в настоящем стандарте.
Использование
Основные промышленные реакции этилена включают в порядке масштаба: 1) полимеризация, 2) окисление, 3) halogenation и hydrohalogenation, 4) алкилирование, 5) гидратация, 6) oligomerization, и 7) hydroformylation. В Соединенных Штатах и Европе, приблизительно 90% этилена используются, чтобы произвести этиленовую окись, этиленовое двухлористое соединение, ethylbenzene и полиэтилен.
Полимеризация
Полиэтилен потребляет больше чем половину мировой этиленовой поставки. Полиэтилен, также названный полиэтиленом, является наиболее широко используемой пластмассой в мире, прежде всего используясь делать фильмы используемыми в упаковке, сумках и лайнерах мусора. Линейные альфа-олефины, произведенные oligomerization (формирование коротких полимеров), используются в качестве предшественников, моющих средств, пластификаторов, синтетических смазок, добавок, и также как co-мономеры в производстве полиэтиленов.
Окисление
Этилен окислен, чтобы произвести этиленовую окись, ключевое сырье в производстве сурфактантов и моющих средств ethoxylation. Этиленовая окись также гидролизируется, чтобы произвести этиленовый гликоль, широко используемый в качестве автомобильного антифриза, а также более высоких гликолей молекулярной массы, эфиров гликоля и терефталата полиэтилена.
Этилен подвергается окислению палладием, чтобы дать ацетальдегид. Это преобразование остается основным производственным процессом (10M kg/y). Процесс продолжается через начальное комплексообразование этилена к Фунту (II) центр.
Halogenation и hydrohalogenation
Главные промежуточные звенья от halogenation и hydrohalogenation этилена включают этиленовое двухлористое соединение, хлорид этила и этиленовый дибромид. Добавление хлора влечет за собой «oxychlorination», т.е. сам хлор не используется. Некоторыми продуктами, полученными из этой группы, является поливинилхлорид, трихлорэтилен, перхлорэтилен, хлороформ метила, polyvinylidene хлорид и сополимеры и бромид этила.
Алкилирование
Главные химические промежуточные звенья от алкилирования с этиленом — ethylbenzene, предшественник стирола. Стирол используется преимущественно в полистироле для упаковки и изоляции, а также в бутадиеновом каучуке стирола для шин и обуви. В меньшем масштабе, ethyltoluene, ethylanilines, 1,4-hexadiene, и алюминий alkyls. Продукты этих промежуточных звеньев включают полистирол, ненасыщенные полиэстеры и этиленовый пропилен terpolymers.
Реакция Oxo
hydroformylation (oxo реакция) этилена приводит к propionaldehyde, предшественнику пропионовой кислоты и алкоголя n-пропила.
Гидратация
Этилен долго представлял крупного неферментативного предшественника этанола. Оригинальный метод повлек за собой свое преобразование в диэтиловый сульфат, сопровождаемый гидролизом. Главный метод, опытный с середины 1990-х, является прямой гидратацией этилена, катализируемого твердыми кислотными катализаторами:
:CH + HO → CHCHOH
Димеризация к n-Butenes
Этилен может быть dimerized к n-butenes использующие процессы, лицензируемые Lummus или IFP. Процесс Lummus производит смешанный n-butenes (прежде всего 2-butenes), в то время как процесс IFP производит 1-butene.
Использование ниши
Пример использования ниши как анестезирующий агент (в 85%-м этиленовом/15 кислородном отношении %). Это может также использоваться, чтобы ускорить фруктовое созревание, а также сварочный газ.
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
В высоких концентрациях этилен оказывает на человека и животных наркотическое действие.
Этилен: особенности структуры и свойства
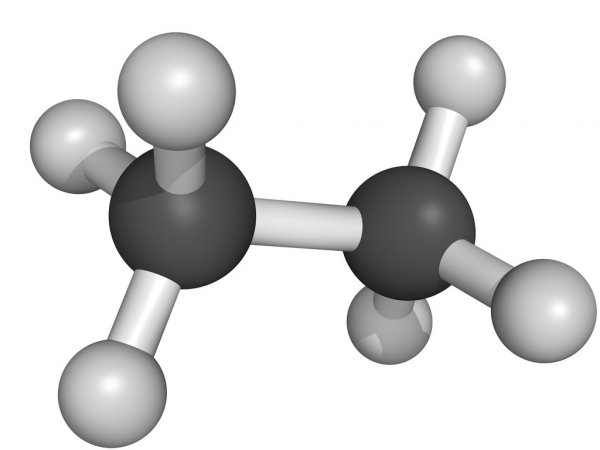
Углеводороды представляют собой молекулы, содержащие водород и углерод. Они сильно различаются с точки зрения количества одинарных и двойных связей и структурной ориентации каждого компонента. Одним из простейших, но биологически и экономически выгодных углеводородов является этилен. Он поставляется в газообразном виде, является бесцветным и легковоспламеняющимся. Он состоит из двух двойных скрепленных атомов углерода с атомами водорода. Химическая формула имеет вид C 2 H 4 . Структурная форма молекулы является линейной из-за наличия двойной связи в центре.Этилен имеет сладковатый мускусный запах, который позволяет легко идентифицировать вещество в воздухе. Это касается газа в чистом виде: запах может исчезать при смешивании с другими химическими веществами.
Производство
Глобальное производство этилена составило 107 миллионов тонн в 2005, 109 миллионов тонн в 2006, 138 миллионов тонн в 2010 и 141 миллион тонн в 2011. К 2013 этилен был произведен по крайней мере 117 компаниями в 32 странах. Чтобы удовлетворить когда-либо растущий спрос для этилена, резкие увеличения в производственных объектах добавлены глобально, особенно на Ближнем Востоке и на Китае.
Производственный процесс
Этилен произведен в нефтехимической промышленности паровым взламыванием. В этом процессе газообразные или легкие жидкие углеводороды нагреты до 750–950 °C, вызывание многочисленных реакций свободного радикала, сопровождаемых непосредственным, подавляет, чтобы остановить эти реакции. Этот процесс преобразовывает большие углеводороды в меньшие и вводит ненасыщенность. Этилен отделен от получающейся сложной смеси повторным сжатием и дистилляцией. В связанном процессе, используемом на нефтеперерабатывающих заводах, высокие углеводороды молекулярной массы сломаны по катализаторам цеолита. Более тяжелое сырье для промышленности, такое как керосин и газовые масла требует, чтобы по крайней мере два «подавили башни» вниз по течению раскалывающихся печей, чтобы повторно распространить полученный из пиролиза бензин и техническую воду. Взломав смесь этана и пропана, только одна вода подавляет башню, требуется.
Области этиленового завода:
паровые печи взламывания:
основное и вторичное тепловое восстановление с подавляет;
пар растворения перерабатывает систему между печами и подавить систему;
основное сжатие резкого газа (3 стадии сжатия);
сероводород и удаление углекислого газа (кислотное газовое удаление);
вторичное сжатие (1 или 2 стадии);
высыхание резкого газа;
криогенное лечение;
весь холод раскололся, газовый поток идет в demethanizer башню. Верхний поток из demethanizer башни состоит из всего водорода и метана, который был в резком газовом потоке. Криогенно рассматривающий этот верхний поток отделяет водород от метана
Восстановление метана важно по отношению к экономичной деятельности этиленового завода.
нижний поток из demethanizer башни идет в deethanizer башню. Верхний поток из deethanizer башни состоит из весь, которые были в резком газовом потоке
Поток содержит ацетилен, который является взрывчатым выше 200 кПа (29 фунтов на квадратный дюйм). Если парциальное давление ацетилена, как ожидают, превысит эти ценности, поток частично гидрогенизируется. Тогда продолжаются к разделителю. Этилен продукта взят из верхней из башни, и этан, прибывающий из основания разделителя, переработан к печам, которые будут сломаны снова;
нижний поток из de-ethanizer башни идет в depropanizer башню. Верхний поток из depropanizer башни состоит из весь, которые были в резком газовом потоке. Прежде, чем питаться к разделителю, поток гидрогенизируется, чтобы преобразовать methylacetylene и propadiene (allene) соединение. Этот поток тогда посылают в разделитель. Верхний поток от разделителя — пропилен продукта, и нижний поток — пропан, который передают обратно в печи для взламывания или используют в качестве топлива.
Нижний поток из depropanizer башни питается debutanizer башню. Верхний поток от debutanizer — весь из, которые были в резком газовом потоке. Нижний поток от debutanizer (легкий бензин пиролиза) состоит из всего в резком газовом потоке, который является или более тяжел.
Так как производство этилена — интенсивная энергия, много усилия было посвящено восстановлению высокой температуры от газа, оставив печи. Большая часть энергии, восстановленной от резкого газа, используется, чтобы сделать высокое давление (1 200 фунтов на квадратный дюйм) пар. Этот пар в свою очередь используется, чтобы вести турбины для сжатия резкого газа, компрессора охлаждения пропилена и этиленового компрессора охлаждения. Этиленовый завод, однажды управление, не должен импортировать пар, чтобы вести его паровые турбины. Типичный этиленовый завод мирового масштаба (приблизительно 1,5 миллиарда фунтов этилена в год) использует резкий компрессор, компрессор пропилена и этиленовый компрессор.
Лабораторный синтез
Хотя из большой стоимости промышленно, этилен редко используется в лаборатории и обычно покупается.
Это может быть произведено через обезвоживание этанола с серной кислотой или в газовой фазе с алюминиевой окисью.
Получение и свойства этилена
Немецкий химик Иоган Бехер случайно использовал этиловый спирт в опытах с концентрированной серной кислотой. Так впервые был получен этен в лабораторных условиях (1680 год). В середине XIX века А.М. Бутлеров дал соединению название этилен. Физические свойства и химические реакции также были описаны известным русским химиком. Бутлеров предложил структурную формулу, отражающую строение вещества. Способы его получения в лаборатории:
- Каталитическое гидрирование ацетилена.
- Дегидрогалогенирование хлорэтана в реакции с концентрированным спиртовым раствором сильного основания (щелочи) при нагревании.
- Отщепление воды от молекул этилового спирта (дегидратация). Проходит реакция в присутствии серной кислоты. Ее уравнение: Н2С–СН2–OH → Н2С=СН2 + Н2О
Промышленное получение:
- переработка нефти — крекинг и пиролиз углеводородного сырья;
- дегидрирование этана в присутствии катализатора. H3C–CH3 → H2C=CH2 + H2
Строение этилена объясняет его типичные химические реакции — присоединение частиц атомами C, которые находятся при кратной связи:
- Галогенирование и гидрогалогенирование. Продуктами этих реакций являются галогенопроизводные.
- Гидрирование (насыщение водородом), получение этана.
- Окисление до двухатомного спирта этиленгликоля. Его формула: OH–H2C–CH2–OH.
- Полимеризация по схеме: n(H2C=CH2) → n(-H2C–CH2-).
8 Транспортирование и хранение
8.1 Газообразный этилен транспортируют по трубопроводу, сжиженный — в специальных железнодорожных и автомобильных цистернах грузоотправителя (грузополучателя), рассчитанных на давление.Баллоны с этиленом транспортируют железнодорожным и автомобильным транспортом в крытых транспортных средствах в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта. Жидкий этилен транспортируют в вагонах-цистернах в соответствии с правилами .Транспортирование автомобильным транспортом производится в соответствии с требованиями Европейского соглашения о международной перевозке опасных грузов (ДОПОГ)*, приложения А и В________________* Перечень нормативных документов, действующих в Российской Федерации, представлен в приложении А.
8.2 Хранение этилена проводят в соответствии с требованиями ГОСТ 1510 (на условиях аналога углеводородных сжиженных топливных газов) и правил устройства и безопасной эксплуатации сосудов, работающих под давлением, действующих на территории страны — участника Соглашения.
Полимеризация олефинов
Повышение температуры, увеличение давления и применение катализаторов — это необходимые условия для проведения процесса полимеризации. Его механизм отличается от реакций присоединения или окисления. Он представляет собой последовательное связывание многих молекул этилена в местах разрыва двойных связей. Продуктом реакции является полиэтилен, физические характеристики которого зависят от величины n — степени полимеризации. Если она невелика, то вещество находится в жидком агрегатном состоянии. Если показатель приближается к 1000 звеньев, то из такого полимера изготовляют полиэтиленовую пленку, гибкие шланги. Если степень полимеризации превышает 1500 звеньев в цепи, то материал представляет собой твердое вещество белого цвета, жирное на ощупь.
Промышленное производство этанола
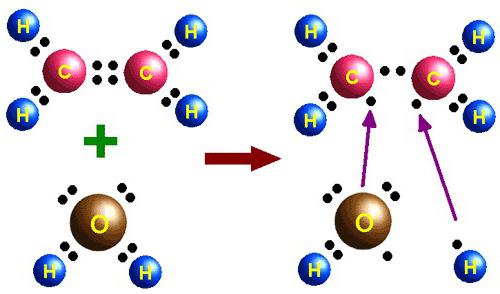
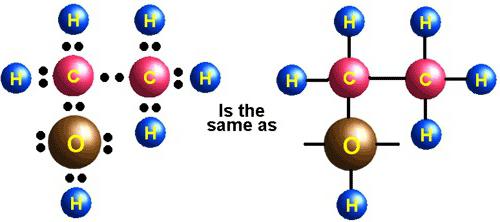
Химические свойства этилена часто используют для получения важных веществ, широко применяемых в промышленности и быту. Например, нагревая этен с водой в присутствии ортофосфорной или серной кислот, под действием катализатора происходит процесс гидратации. Он идет с образованием этилового спирта — многотоннажного продукта, получаемого на химических предприятиях органического синтеза. Механизм реакции гидратации протекает по аналогии с другими реакциями присоединения. Кроме того, взаимодействие этилена с водой также происходит в результате разрыва пи-связи. К свободным валентностям атомов углерода этена присоединяются атомы водорода и гидроксогруппа, входящие в состав молекулы воды.
Основные химические свойства
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
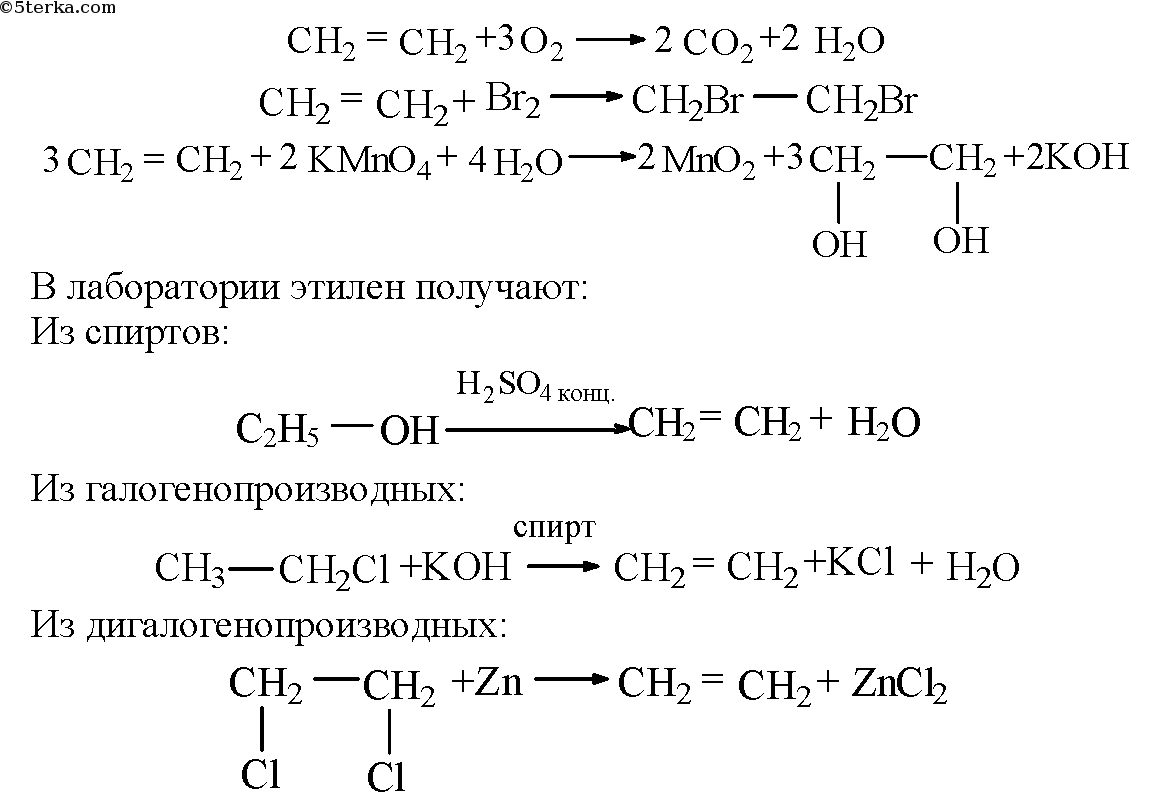
Галогенирование:
-
- CH2=CH2+Br2→CH2Br-CH2Br+D{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+Br_{2}\rightarrow CH_{2}Br{\text{-}}CH_{2}Br+D}}}
- Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения.
Гидрирование:
-
- CH2=CH2+H2→NiCH3-CH3{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+H_{2}{\xrightarrow{Ni}}CH_{3}{\text{-}}CH_{3}}}}
Гидрогалогенирование:
-
- CH2=CH2+HBr→CH3CH2Br+D{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+HBr\rightarrow CH_{3}CH_{2}Br+D}}}
Гидратация:
-
- CH2=CH2+H2O→H+CH3CH2OH{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+H_{2}O{\xrightarrow{H^{+}}}CH_{3}CH_{2}OH}}}
- Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта.
Окисление:
- Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. В результате образуется этиленгликоль. Уравнение реакции:
- 3CH2=CH2+2KMnO4+4H2O→CH2OH-CH2OH+MnO2+2KOH{\displaystyle {\mathsf {3CH_{2}{\text{=}}CH_{2}+2KMnO_{4}+4H_{2}O\rightarrow CH_{2}OH{\text{-}}CH_{2}OH+MnO_{2}+2KOH}}}
Горение:
-
- CH2=CH2+3O2→2CO2+2H2O{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+3O_{2}\rightarrow 2CO_{2}+2H_{2}O}}}
Полимеризация (получение полиэтилена):
-
- nCH2=CH2→(-CH2-CH2-)n{\displaystyle {\mathsf {nCH_{2}{\text{=}}CH_{2}\rightarrow ({\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}})_{n}}}}
Димеризация
-
- 2CH2=CH2→CH2=CH-CH2-CH3{\displaystyle {\mathsf {2CH_{2}{\text{=}}CH_{2}\rightarrow CH_{2}{\text{=}}CH{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
Коммерческое использование
Свойства этилена дают хорошую коммерческую основу для большого количества органических (содержащих углерод и водород) материалов. Одиночные молекулы этилена могут быть соединены вместе для получения полиэтилена (что означает много молекул этилена). Полиэтилен используется для изготовления пластмасс. Кроме того, он может быть использован для изготовления моющих средств и синтетических смазочных материалов, которые представляют собой химические вещества, используемые для уменьшения трения. Применение этилена для получения стиролов актуально в процессе создания резины и защитной упаковки. Кроме того, он используется в обувной промышленности, особенно это касается спортивной обуви, а также при производстве автомобильных покрышек. Применение этилена является коммерчески важным, а сам газ является одним из наиболее часто производимых углеводородов в глобальном масштабе.
История
Много геологов и ученых полагают, что известная греческая Oracle в Дельфи (Pythia) вошла в ее подобное трансу государство как в эффект этилена, повышающегося с замыканий на землю.
Этилен, кажется, был обнаружен Йоханом Йоахимом Бехером, который получил его, нагрев этанол с серной кислотой; он упомянул газ в своем Physica Subterranea (1669). Джозеф Пристли также упоминает газ в своих Экспериментах и наблюдениях, касающихся различных отраслей естественной философии: с продолжением наблюдений относительно воздуха (1779), где он сообщает, что Ян Индженхусз видел этилен, синтезируемый таким же образом г-ном Эне в Амстердаме в 1777 и что Индженхусз впоследствии произвел газ сам. Свойства этилена были изучены в 1795 четырьмя голландскими химиками, Йоханом Рудольфом Дайманом, Адриеном Пацем ван Труствиком, Антони Лауверенбургом и Николасом Бондтом, который нашел, что отличался от водородного газа и что он содержал и углерод и водород. Эта группа также обнаружила, что этилен мог быть объединен с хлором, чтобы произвести нефть голландских химиков, с 1,2 дихлорэтанами; это открытие дало этилену имя, используемое для него в то время, olefiant газ (делающий нефть газ.)
В середине 19-го века суффикс-ene (древнегреческий корень, добавленный до конца женских имен, означающих «дочь»), широко использовался, чтобы относиться к молекуле или части этого, которая содержала тот меньше водородных атомов, чем изменяемая молекула. Таким образом этилен был «дочерью этила» . Этилен имени использовался в этом смысле уже в 1852.
В 1866 немецкий химик Аугуст Вильгельм фон Хофман предложил систему номенклатуры углеводорода, в которой суффиксы-ane,-ene,-ine, — один, и-une использовались, чтобы обозначить углеводороды с 0, 2, 4, 6, и 8 меньше hydrogens, чем их родительский алкан. В этой системе этилен стал этеном. Система Хофмана в конечном счете стала основанием для Женевской номенклатуры, одобренной Международным Конгрессом Химиков в 1892, который остается в ядре номенклатуры IUPAC. Однако к тому времени этилен имени был глубоко укреплен, и это остается в широком использовании сегодня, особенно в химической промышленности.
Следующее экспериментирование Luckhardt, Крокером и Картером в Чикагском университете, этилен использовался в качестве анестезирующего средства, которым Это осталось в использовании посредством использования 1940-х даже, в то время как хлороформ постепенно сокращался. Сегодня его острый аромат и его взрывчатый характер ограничивают ее использование.
Номенклатура
Правила номенклатуры IUPAC 1979 года сделали исключение для сохранения несистематического этилена имени, однако, это решение было полностью изменено в правилах 1993 года, таким образом, имя IUPAC — теперь этен.
Безопасность
Как все углеводороды, этилен — удушающее вещество и горючий. Это перечислено как канцерогенное вещество класса 3 IARC.
Схема применения этилена
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации — это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука. Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
Опасность для здоровья
Этилен представляет опасность для здоровья прежде всего потому, что он является легковоспламеняющимся и взрывоопасным. Он также может действовать как наркотик при низких концентрациях, вызывая тошноту, головокружение, головные боли и потерю координации движения. При более высоких концентрациях он действует как анестетик, вызывая потерю сознания, нечувствительность к боли и другим раздражителям. Все эти негативные моменты могут быть причиной для беспокойства в первую очередь для людей, непосредственно работающих с газом. Количество этилена, с которым большинство людей сталкивается в повседневной жизни, как правило, сравнительно небольшое.