См. также
Экономика метанола
Комплексы железа встречаются в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Мессершмитт Ме.163 Комета — немецкий ракетный истребитель-перехватчик времён Второй мировой войны. Me-163 имел жидкостный ракетный двигатель, в который подавалась 80-процентная перекись водорода и жидкий катализатор (раствор перманганата калия либо смесь метанола, гидразин-гидрата и воды)
В камере сгорания перекись водорода разлагалась с образованием большого объёма перегретой парогазовой смеси, создавая мощную реактивную тягу.
Отравление метиловым спиртом
Метиловый спирт содержится в: жидкости для очистки стекол автомобиля и растворителях. В организме метиловый спирт окисляется до формальдегида и муравьиной кислоты, которые и осуществляют главное токсическое действие. Симптомы отравления возникают через 12-24 после употребления. Симптомы: головная боль, тошнота, упорная рвота, боли в животе, головокружение, недомогание, нарушение зрения (мушки, туман перед глазами, двоение в глазах, слепота). При отравлении метиловым спиртом очень часто поражается сетчатка глаза и зрительный нерв, что во многих случаях приводит к слепоте. Стойкое расширение зрачка при отравлении считается неблагоприятным прогностическим признаком. В тяжелых случаях смерть возникает от паралича дыхания и нарушения сердечнососудистой деятельности.
В США максимальное суточное употребление метанола (Reference Dose), не связанное с какими-либо эффектами на здоровье, составляет 2 мг на кг веса тела (с 1988 года).
Наиболее легкая форма отравления метанолом характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой. Поэтому опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ желтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола).
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора (то есть настоящая обычная водка) перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.
Получение
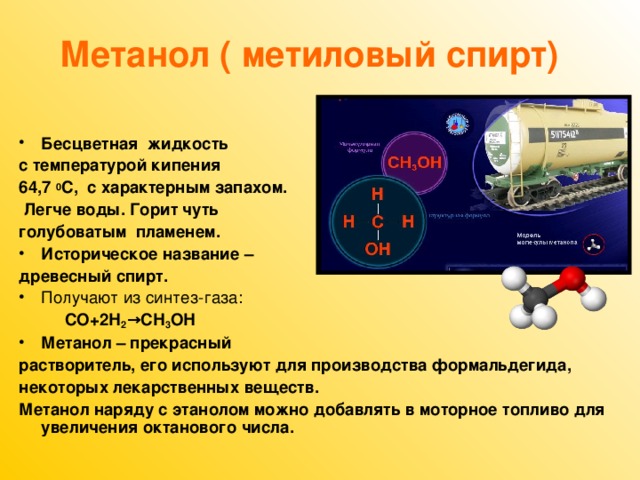
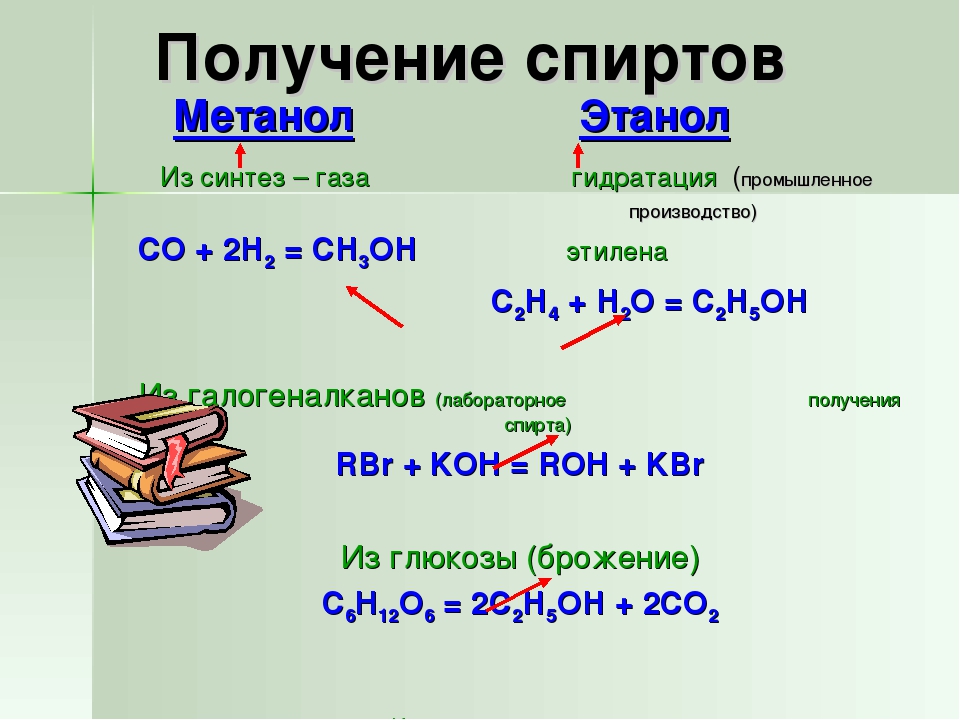
Известно несколько способов получения метанола: сухая перегонка древесины и лигнина, термическое разложение солей муравьиной кислоты, синтез из метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа. Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 25—35 МПа на цинк-хромовом катализаторе (ZnO/Cr2O3) при температуре 320—450 °C. Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах, промотированных цинком, хромом и др., при 200—300 °C и давлении 3,5—5,5 МПа, разработанный в Англии.
Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях:
- температура — 250 °C,
- давление — 7 МПа (= 69,08 атм = 70 Бар = 71,38 кгс/см²)
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:
-
- CO+2H2→CH3OH{\displaystyle {\mathsf {CO+2H_{2}\rightarrow CH_{3}OH}}}
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В настоящее время этот способ неактуален.
Молекулярная формула — CH4O или CH3—OH, структурная:
Производство метанола (в тыс. тонн):
| год | США | Германия | Мир | Цена продажи($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Опасность метанола
Опасность продукта, кроме сказанного ранее, заключается в том, что отличить его от этанола практически невозможно. Характеристика одного вещества почти полностью идентична другому. Но какой-либо физический или химический параметр может отличаться. Запах и вкус у веществ одинаковые, цвет отсутствует. Однако цена на метанол намного ниже и составляет за тонну от 15,5 тысяч рублей. Безусловно, ни одна аптека этот продукт не реализует. А вот изготовители алкоголя по причине дешевизны нередко разбавляют им алкоголь.
Другая опасность продукта — вероятность отравления через вдох вещества. Атомы спирта содержатся в испарениях антифризов, средствах для мытья стекол и лакокрасочных веществах. Они проникают в организм, аккумулируются там и ведут к необратимым изменениям. Поэтому не обязательно нужно выпить алкоголь, чтобы отравиться метанолсодержащей продукцией. Вещество может причинить человеку вред даже при вдыхании.
Пить метанол категорически запрещается, хотя он принадлежит к спиртам. Это не ЛВС (поливиниловый спирт), допустимый к применению, и в минимальных дозировках входящий во многие лекарственные препараты. Смертельный исход возможен, даже если применение метанола было в малых объемах. Использовать внутрь организма продукт очень опасно.
https://youtube.com/watch?v=kTa1ipIuSF0
Могут ли сдетонировать или вступить в реакцию метанол или еще что-то при утечке с какими-либо из продуктов производства других предприятий в Находке? Например, с угольной пылью?
Во-первых, у НЗМУ и у других предприятий Находки нет таких отходов, которые могли бы вступить в реакцию друг с другом и вызвать негативные последствия для окружающей среды.
Во-вторых, утечка метанола на производстве практически невозможна, так как метанол будет храниться в строгом соответствии с правилами безопасности, хранения и обращения.
В-третьих, на НЗМУ запроектирован специальный бетонный бассейн — обваловка. При разгерметизации резервуара весь метанол останется на месте — как в стакане, аварийными насосами он перекачается в соседние резервуары.
В-четвертых, ни угольный терминал, ни любое другое находкинское производство не будет потревожено утечкой: НЗМУ будет укомплектовано высокочувствительными датчиками загазованности, которые еще на 20 процентах от величины опасной концентрации вещества в воздухе объявят «тревогу», все операторы узнают о потенциальной угрозе задолго до ее начала. В 95% случаев такие системы гарантируют предотвращение аварий.
Производство метанола
Сейчас, на первом этапе, на НЗМУ строится исключительно метанольное производство. В промышленных масштабах метанол будут получать из природного газа путем риформинга — переработки газа с водяным паром. Полученную таким способом газовую смесь затем перегоняют, чтобы создать чистый метанол.
В результате получают жидкий органический химикат, растворимый в воде и легко поддающийся биологическому разложению. В процессе производства задействованы только природный газ (метан), вода и углекислый газ. Никаких промежуточных продуктов на этом этапе не создается.
Хранение и перевозка метанола
Метанол — конечный продукт, он не вызывает коррозии большинства металлов при температуре окружающей среды, поэтому будет храниться в жидком виде в герметичных резервуарах. На НЗМУ запроектирован специальный бетонный бассейн — обваловка; его вместимость будет равна вместимости всего резервуарного парка метанола.
Из резервуаров метанол по трубопроводам будет отгружаться на специальные танкеры для отправки покупателям.
Грубо говоря, это большой «самогонный аппарат». По трубе приходит газ, из него получается метанол, который по трубе уходит в танкеры.
Что такое метанол
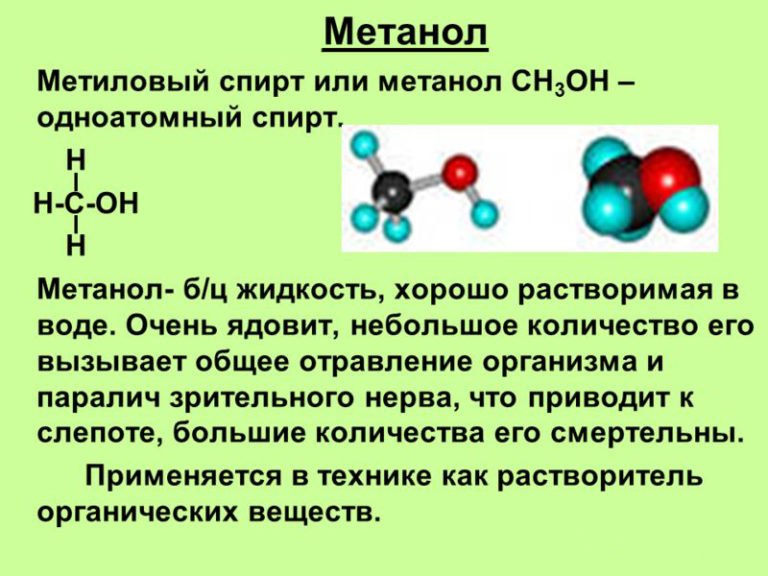
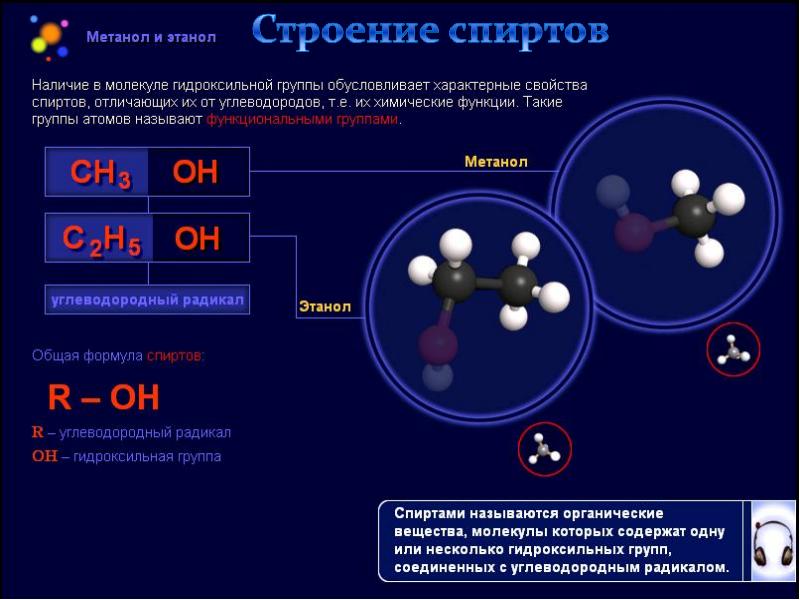
Это простейший представитель одноатомных спиртов, являющийся кислотным производным метана. Соединение содержит короткую углеводородную цепочку, объединённую с гидроксильной группой. Производные метанола в виде эфиров находятся в жасминовом и мандариновом масле, алкалоидах снотворного мака и натуральных красителях. Другие названия вещества — метиловый или древесный спирт, гидроксид метила.
Существует несколько способов получения метанола. Раньше его добывали при сухой перегонке дерева. Поэтому вещество изначально называли древесным спиртом. В настоящее время метанол производится каталитическим синтезом угарного газа и водорода. Реакция происходит при давлении 70 атмосфер и температуре 250 °C, и является эндотермической, то есть с поглощением теплоты.
Метанол был открыт английским учёным Робертом Бойлем в 1661 году, при исследовании продуктов сухой перегонки древесины. А его выделение в чистом виде произвели французские химики Жан-Батист Дюма и Эжен Пелиго в 1834 году. Практически одновременно, была установлена химическая формула метанола — CH3OH. Впервые синтез древесного спирта осуществил французский физикохимик Марселен Бертло в 1857 году.
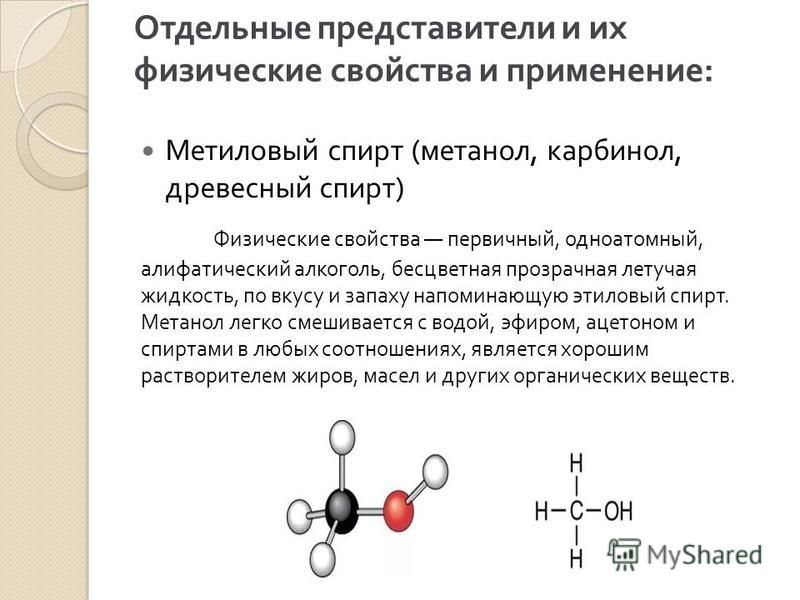
Метанол — это бесцветная жидкость с характерным резковатым, сходным с этиловым спиртом, запахом. Его физические свойства включают хорошую растворимость в воде и органических растворителях, высокую степень воспламеняемости и взрывоопасности. Удельная плотность — 0,79 г/см3. Температура испарения — 64,7 °C. Пламя горящего метанола имеет светло-голубой цвет. Хорошо растворяет смолы и лаки.

Является представителем класса алканов. Химические свойства метанола обусловлены принадлежностью к этой группе. Для неё типичны следующие реакции:
- окисление с выделением углекислого газа и воды;
- элиминирование (дегидрирование) с образованием альдегида или кетона;
- этерификация с получением эфиров.
При поступлении в организм человека метанол проявляет свойства яда. Особенно когда его принимают внутрь. Опасность представляет не только неразбавленное вещество, но и жидкости с незначительным его содержанием. При попадании на кожу и при вдыхании паров, также может вызывать отравления.
См. также
Гидрат метана
Экономика метанола
Комплексы железа встречаются в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Мессершмитт Ме.163 Комета — немецкий ракетный истребитель-перехватчик времён Второй мировой войны. Me-163 имел жидкостный ракетный двигатель, в который подавалась 80-процентная перекись водорода и жидкий катализатор (раствор перманганата калия либо смесь метанола, гидразин-гидрата и воды)
В камере сгорания перекись водорода разлагалась с образованием большого объёма перегретой парогазовой смеси, создавая мощную реактивную тягу.
Метанол вокруг нас
Метанол занимает ключевое место в химической промышленности. Из него производят сотни продуктов для нашей ежедневной жизни. Основные потребители — производители формальдегида, смол и других продуктов на его основе. Значительные количества метанола используют в лакокрасочной промышленности для изготовления растворителей для лаков. Еще метанол перерабатывают в формальдегид, из которого, в свою очередь, производят адгезивы, пены, растворители и стеклоомыватели.
На НЗМУ не предполагается получение формальдегида. Конечным продуктом производства НЗМУ будет метанол.
топливо;
пластмассу;
антисептики, консерванты и косметические средства;
краски, лаки и эмали, растворители;
реагенты для дорог;
сухое горючее. Из него делают таблетки для розжига, взрывчатые вещества, а также используют в фармацевтике;
мебель — фанеру и ДСП
Важное сырье в деревообработке — карбамидоформальдегидный концентрат — тоже делается с применением метанола;
Метанол используют для очищения воды от нитратов: в США, например, число установок для очистки сточных вод, на которых метанол используют в процессе денитрификации, превышает 100. Установка по обработке сточных вод в столице США Вашингтоне является одной из крупнейших очистных установок, применяющих метанол.
Основные потребители метанола
В мире наибольший спрос на метанол предъявляют потребители из Китая, китайские компании используют почти 50% производимого в мире метанола. Другие страны Азиатского региона и компании из США и Канады потребляют еще порядка 40% метанола, предприятия из Латинской Америки — 10%.
20 крупнейших покупателей на мировом рынке потребляют 30% производимого метанола. Эти покупатели — крупнейшие глобальные и китайские компании, такие как BP, Celanese, Momentive, Sabic, BASF, Skyford и другие.
Спрос на метанол
В мировом масштабе спрос на метанол растет по нескольким причинам.
В настоящее время наблюдается значительный рост промышленности Methanol-to-Olefins в Китае и, соответственно, высокий спрос на метанол как основное сырье.
Метанол — хорошая альтернатива нефтепродуктам и может использоваться в качестве топлива. Китай предъявляет все больший спрос на метанол в качестве топлива. Ожидается, что в ближайшие четыре года спрос вырастет не менее чем на 5%.
В морских перевозках также растет спрос на метанол в качестве топлива для судов, особенно в США и Западной Европе, а также в Ближневосточном регионе и Австралии.
Химическая характеристика
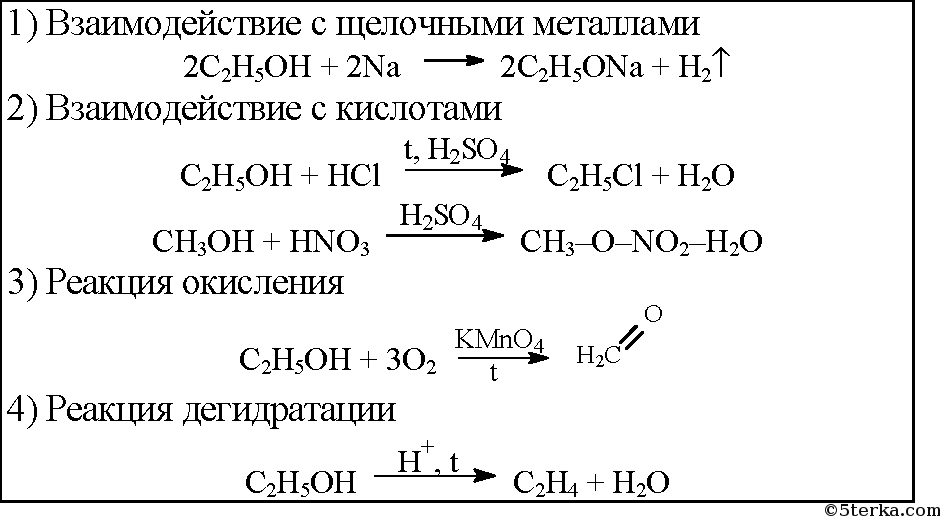
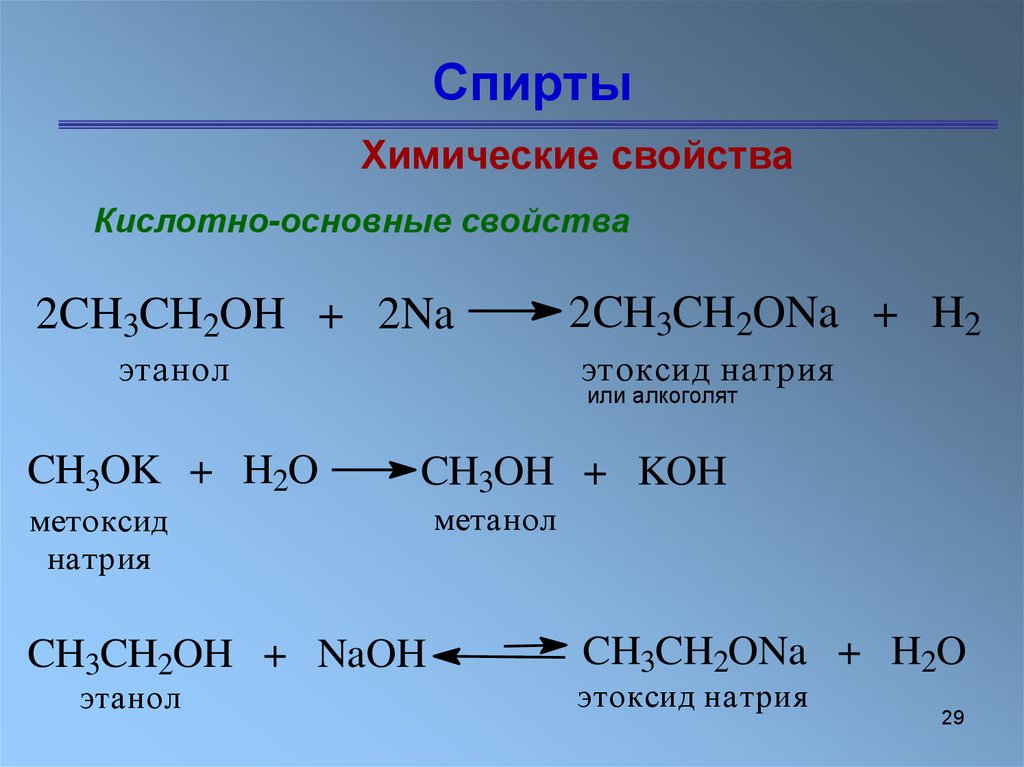
У карбинола нет ярко выраженных свойств кислот или оснований, к тому же водный раствор вещества не действует на индикаторы. Типичные реакции метанола – это взаимодействие с активными металлами и карбоновыми кислотами. В первом случае образуются алкоголяты металлов, во втором – сложные эфиры. Например, натрий вытесняет атомы водорода в функциональной гидроксильной группе спирта:
2CH3OH + 2Na = 2CH3ONa +H2.
Взаимодействие между метиловым спиртом и уксусной кислотой приводит к образованию метилацетата, или метилового эфира уксусной кислоты:
CH3COOH+CH3OH<—(H2SO4)—>CH3COOCH3+H2O.
Приведенная выше реакция именуется этерификацией и имеет важное практическое значение

Свойства метилового спирта
Важнейшие свойства метилового спирта обусловлены наличием гидроксильных групп в его молекулах.
Физические свойства
| Свойство | Описание |
| Молярная масса | 32 г/моль |
| Плотность | 0,7918 г/см3 |
| Температура плавления | -97oС |
| Температура кипения | 64,7oС |
Метанол – это прозрачная, бесцветная, легковоспламеняющаяся жидкость с очень низкой температурой кипения. При очищении метиловый спирт теряет запах. Метанол хорошо растворяется в полярных растворителя, смешивается с водой в любых пропорциях. При растворении в воде между молекулами спирта и воды образовываются водородные связи. Наличие водородных связей между молекулами спиртов обуславливают относительно высокую в сравнении с углеводородами температуру кипения.
Химические свойства
Реакции с металлами. Метиловый спирт взаимодействует с щелочными металлами с выделением водорода и образованием солеобразных соединений:
В этой реакции спирт напоминает кислоту. Однако его молекула не диссоциирует с образованием катионов Водорода, а водный раствор метилового спирта не действует на индикаторы.
Дегидратация. Так называют реакцию отщепления воды от какого-либо соединения. При пропускании паров метилового спирта через раскалённую трубку получается C2H2 и другие продукты.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия,
превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Отдельно следует отметить увеличение индикаторного КПД при работе классического ДВС на метаноле по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотностьэнергии | Смесь воздухас топливом |
Удельнаяэнергиясмеси воздуха
с топливом |
Удельная теплотаиспарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Недостатки
- Метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырцу, содержащему значительные количества примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащий воду, начинает реагировать с алюминием при температуре выше 50 °C, а с обычной углеродистой сталью не реагирует вовсе.
- Гидрофильность. Метанол втягивает воду, что является причиной расслоения топливных смесей бензин-метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, могут иметь проблемы с запуском при температуре ниже +10 °C и отличаться повышенным расходом топлива до достижения рабочей температуры. Данная проблема однако, легко решается добавлением в метанол 10—25 % бензина.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.
Получение метанола
Гидролиз соответствующих галогеноалкилов в присутствии гидроксидов активных металлов, например, щелочных или щелочноземельных, и при нагревании – это распространенный метод получения карбинола. В качестве исходных веществ берут хлор- или бромметан, результатом реакции будет замещение атома галогена функциональной группой –OH и получение метанола.
Еще один метод, ведущий к образованию первичных предельных спиртов – это восстановление альдегидов или карбоновых кислот. Для данной окислительно-восстановительной реакции применяют такие сильные восстановители, как натрийборгидрид или литийалюминийгидрид. Исходными соединениями являются муравьиная кислота или формальдегид. Один из современных методов получения карбинола – это его синтез из углерода, воды, водорода и монооксида углерода. Процесс проходит при температуре +250 °C, повышенном давлении и в присутствии окислов цинка и меди в качестве катализаторов. Новым, но экономически оправданным можно назвать метод получения спирта из микроскопических водорослей океанов и морей, биомасса которых действительно огромна. Растительный субстрат подвергают брожению, выделяющийся метан собирают и далее окисляют до метанола. Большими преимуществами производства биометанола считают отсутствие потребности в использовании запасов пресной воды, электроэнергии и чистоту технологии.

ОПИСАНИЕ
Метанол — бесцветная легкоподвижная горючая жидкость, практически без запаха. Метанол смешивается во всех соотношениях с водой, этанолом, ацетоном, бензолом.
Молекулярный вес — 32,04.
Плотность — 0,8100 г/смВязкость — 0,817мПа-с
Температура кипения — 64,7 гр. С
Температура плавления — -97,68 гр.С
Теплота парообразования — 8,94 ккал/моль
Теплота сгорания: жидкого — 173,65 ккал/моль, газообразного — 177,40 ккал/моль.
Химические свойства
По химическим свойствам метиловый спирт — типичный одноатомный алифатический спирт: сочетает свойства очень слабого основания и еще более слабой кислоты.
С щелочными металлами реагирует с выделением водорода, образуя метилаты (например, CH3ONa); в реакции с кислотами образуются сложные эфиры (в присутствии сильных минеральных кислот реакция ускоряется), например с HNO2 дает метил-нитрит CH3ONO (количественно), с H2SO4 при температуре ниже 100 гр. С — метилсульфат CH3OSO2OH, с карбоновыми кислотами — RCOOCH3.
При взаимодействии с аммиаком в присутствии дегидратирующих катализаторов метанол дает метиламины.
Он разлагается водяным паром на катализаторе:
СН3ОН + Н2О = ЗН2 + СО2.
С воздухом образует взрывоопасные смеси (температура вспышки 15,6 гр.C).
Класс опасности — III. По степени воздействия на организм человека – умеренно опасное вещество
Смертельная доза метанола при приеме внутрь равна 30 г, но тяжелое отравление, сопровождающееся слепотой, может быть вызвано 5-10 г. Действие паров его выражается в раздражении слизистых оболочек глаз и более высокой подверженности заболеваниям верхних дыхательных путей, головных болях, звоне в ушах, дрожании, невритах, расстройствах зрения. Метанол может проникать в организм через неповрежденную кожу.
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5мг/м.
Упаковка, транспортировка и хранение
Метанол транспортируют в специальных железнодорожных цистернах, автоцистернах, стальных бочках вместимостью 200 м3, пластмассовых емкостях или металлических бочках с наружным коробом из деревянных досок и стеклянных 20-ти литровых бутылях в соответствии с правилами перевозки грузов, действующими на данном виде транспорта.
При транспортировке необходимо соблюдать условия герметичности груза, защиты от падений и разрушений. Строго запрещается транспортировка метанола вместе с кислотами, кислотными ангидридами, сильными окислителями, щелочными металлами, легко воспламеняющимися и горючими веществами, химическими веществами для пищевой продукции.
Запрещаются остановки транспортного средства с грузом вблизи жилых районов и скоплений людей.
Продукт хранят в герметичных емкостях, в затененных проветриваемых складских помещениях вдали от источников тепла, искр, попадания прямых солнечных лучей, отдельно от окислителей. Температура хранения не должна превышать 30ºС.
Гарантийный срок хранения метанола – 6 месяцев.
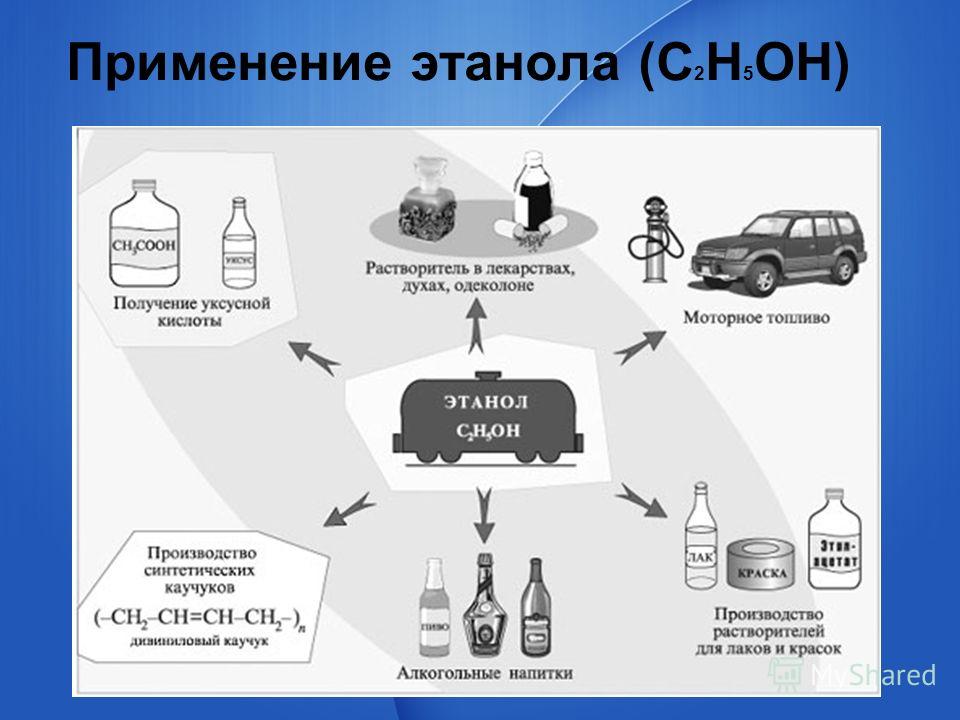
Применение
Метанол — один из ключевых продуктов химической промышленности, который
является сырьем для получения многих продуктов органического синтеза.
Главные сферы применения метанола:
производство формальдегида (участвующего в синтезе
различных пластмасс) и МТБЭ (высокооктановой присадки к моторному топливу).
в производстве синтетических каучуков, уксусной кислоты, метилметакрилата, пластмасс, растворителей, метиламинов, диметилтерефталата, метилформиата, хлористого метила.
для получения лекарственных средств;
как добавка к автомобильным бензинам;
как денатурирующая добавка к этиловому спирту, предназначенного для промышленного использования;
в последнее время метанол находит применение в топливных элементах;
как промышленный растворитель;
метанол входит в состав ряда антифризов.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия,
превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Отдельно следует отметить увеличение индикаторного КПД при работе классического ДВС на метаноле по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотностьэнергии | Смесь воздухас топливом |
Удельнаяэнергиясмеси воздуха
с топливом |
Удельная теплотаиспарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Недостатки
- Метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырцу, содержащему значительные количества примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащий воду, начинает реагировать с алюминием при температуре выше 50 °C, а с обычной углеродистой сталью не реагирует вовсе.
- Гидрофильность. Метанол втягивает воду, что является причиной расслоения топливных смесей бензин-метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, могут иметь проблемы с запуском при температуре ниже +10 °C и отличаться повышенным расходом топлива до достижения рабочей температуры. Данная проблема однако, легко решается добавлением в метанол 10—25 % бензина.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.
Первая помощь при отравлении
При обнаружении первых признаков отравления следует немедленно вызвать скорую помощь. Если такой возможности нет, то следует увеличить количество потребляемой жидкости. Желательно пить напитки с содержанием щелочи: минеральную воду, раствор лимонной кислоты, а также употреблять помидоры, бананы, изюм, виноград, спаржу, мед и другие продукты.
В клинических условиях отравление метанолом лечится введением в организм этилового спирта. Если вы не уверены, что главным отравляющим веществом является метанол, от использования водки в качестве противоядия стоит отказаться. Спасти жизнь человеку может обильное промывание желудка, искусственно вызванная рвота.