Сурьма как вещество: физические свойства
Внешне вещество похоже на металл, однако характеризуется меньшей электро- и теплопроводностью. Оно отличается хрупкостью (легко растирается в порошок) и способностью расширяться при застывании.
Элемент существует в четырех модификациях:
- Кристаллическая, или серая (основная модификация).
- Черная (аморфная).
- Взрывчатая (аморфная).
- Желтая (аморфная).
Кристаллическая сурьма
В основной модификации полуметалл образует игольчатые кристаллы в форме звезд. Чем меньше примесей, тем толще кристаллы. Вещество начинает плавиться при температуре +630,5 ⁰C, закипает — при +1634 ⁰C. Обладает диамагнитностью, т.е. намагничивается против направления внутреннего поля.
Основные свойства вещества:
- Плотность при стандартных условиях — 6,691 г/см3.
- Удельная теплоемкость — 0,210 кДж/(кг*К) при температурах от 20 ⁰С до 200 ⁰С.
- Молярная теплоемкость — 25,2 Дж/(K*моль).
- Теплопроводность — 17,6 вт/(м*К) при температуре 20 ⁰C.
- Молярный объем — 18,4 см3/моль.
- Удельная теплота плавления — 20,08 кДж/моль.
- Удельная теплота испарения — 195,2 кДж/моль.
В основной модификации металл устойчив при стандартных условиях. Он имеет слоистую структуру.
Черная сурьма
Это аморфная металлическая модификация, которая образуется из кристаллической сурьмы при резком охлаждении паров вещества. Она имеет плотность 5,3 г/см3. Данная неустойчивая модификация в безвоздушном пространстве при нагреве до 400 ⁰С переходит в кристаллическую сурьму.
Желтая сурьма
Чтобы получилась желтая сурьма, требуется воздействие кислорода на сниженный стибин SbH3. Эта модификация содержит небольшой процент химически связанного водорода. Является неустойчивой: переходит в черную сурьму при освещении или нагревании.
Взрывчатая сурьма
Электролиз раствора SbCl3 в соляно-кислой среде приводит к образованию взрывчатой сурьмы. Она имеет плотность от 5,64 до 5,97 г/см3, внешне напоминает графит. При любом прикосновении взрывается и превращается в кристаллическую сурьму.
Сурьма как ресурс: применение
Металлургия
Поскольку сурьма — хрупкий металл, в металлургической промышленности она практически не применяется отдельно. Зато в сплавах она повышает прочность других металлов и препятствует окислению.
Сплав сурьмы, олова и свинца называется «гарт» (в переводе с украинского — «зеркала»). Он на протяжении многих веков используется в типографии для изготовления шрифтов. В основу положено свойство сурьмы расширяться при затвердевании: благодаря этому сплав более плотно заполняет литейную матрицу. Помимо этого, сурьма повышает износостойкость шрифта. Гарт также используется для отливки пуль, изготовления кабелей, труб для протока агрессивных жидкостей и др.
Сплав свинца и сурьмы отличается твердостью и устойчивостью к коррозии. Он применяется в химическом машиностроении.
Баббиты (подшипниковые сплавы) широко используются в железнодорожном, автомобильном транспорте и станкостроении. Они содержат сурьму, олово, медь и свинец. Имеют высокую твердость, стойкость к истиранию и коррозии.
Всего существует порядка 200 сплавов различных металлов с сурьмой. В том числе она добавляется к металлам для хрупкой отливки.

Полупроводниковая промышленность
Полуметалл входит в свинцовые сплавы, используется при производстве диодов, ИК детекторов, датчиков Холла и других элементов в полупроводниковой промышленности.
Медицина
Стибнит, природный сульфит сурьмы, в древности применялся в качестве лекарства от паразитов. В некоторых странах его до сих пор добавляют в препараты. Соединения металла применяются для лечения лейшманиозов и глазных заболеваний.
Другие области применения
Оксид сурьмы используют в текстильной промышленности как закрепитель. Он также входит в состав многих эмалей и красок. Пятиокись металла применяется при изготовлении стекла, люминесцентных ламп, резины. Трехсернистая сурьма входит в состав спичек. Металла находит применение в электронике (для некоторых припоев) и в термоэлектрический сплавах.

Характеристика и полезные свойства сурьмы для глаз
Исторически сложилось так, что изначально сурьмой имели возможность пользоваться только египетские царицы. Средство представляло собой не просто косметический, но лечебный продукт. Краску для окрашивания бровей и ресниц изготавливали с помощью пропитывания текстиля маслом и последующим его сжиганием. В основной компонент — сажу — добавляли специальные целебные травяные настойки.
Так, сурьмяный продукт в Египте служил, в первую очередь, лекарством. Им избавлялись от болезней глаз. На Востоке широко распространено поверье о том, что каждому новорожденному младенцу нужно красить глаза. Данное действие позволит защитить ребенка от воздействия злых существ потустороннего мира и сохранить малышу жизнь.
В разных странах согласно сложившимся традициям для изготовления краски применяли отличные друг от друга компоненты:
- В Северной Африке принято готовить красящий карандаш для глаз на основе растёртого галенита. Данный компонент, являющийся сульфидом свинца, отнюдь небезопасен для здоровья. Его применение нежелательно. Свинец отличается высоким содержанием токсических составляющих, способных спровоцировать развитие раковых заболеваний и аллергии.
- В Южной Африке используют листочки кактуса, которые обладают маслянистой поверхностью. В процессе горения они преобразуются в вязкую и жирную сажу. Данный тип каджала (порошка из сурьмы) эффективно использовать для лечения глаз; ухода за бровями, ресницами.
- В Египте — родине сурьмы — продукт изготавливают на основе пасты из сандалового дерева. Сырье высушивают и прожигают одновременно с касторовым маслом до достижения равномерной кашицы.
Физические и химические свойства[править | править код]
Сурьма — серебристо-серый с синеватым оттенком хрупкий металл. Серая сурьма, Sb I, с ромбоэдрической решеткой, устойчива при обычных условиях. Температура плавления 630,5 °C, кипения 1634 °C. Плотность 6,69 г/см3. При 5,5 ГПа Sb I переходит в кубическую модификацию Sb II, при давлении 8,5 ГПа — в гексагональную Sb III, выше 28 ГПа — Sb IV. Серая сурьма имеет слоистую структуру, где каждый атом Sb пирамидально связан с тремя соседями по слою (межатомное расстояние 0,288 нм) и имеет трех ближайших соседей в другом слое (межатомное расстояние 0,338 нм).
С некоторыми металлами сурьма образует антимониды: антимонид олова SnSb, никеля Ni2Sb3, NiSb, Ni5Sb2 и Ni4Sb. Сурьма не взаимодействует с соляной, плавиковой и серной кислотами.
С концентрированной азотной кислотой образуется плохо растворимая b-сурьмяная кислота HSbO3:
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O.
Общая формула сурьмяных кислот Sb2O5·nH2O. С концентрированной H2SO4 сурьма реагирует с образованием сульфата сурьмы (III) Sb2(SO4)3:
2Sb + 6H2SO4 = Sb2(SO4)3 + 3SO2 + 6H2O.
Сурьма устойчива на воздухе до 600 °C. При дальнейшем нагревании окисляется до Sb2O3:
4Sb + 3O2 = 2Sb2O3.
При нагревании Sb2O3 выше 700 °C в кислороде образуется оксид состава Sb2O4:
2Sb2O3 + O2 = 2Sb2O4.
Этот оксид одновременно содержит Sb (III) и Sb (V). В его структуре соединены друг с другом октаэдрические группировки [SbIIIO6] и [SbVO6].
При осторожном обезвоживании сурьмяных кислот образуется пентаоксид сурьмы Sb2O5:
2HSbO3 = Sb2O5 + H2O,
проявляющий кислотные свойства:
Sb2O5 + 6NaOH = 2Na3SbO4 + 3H2O,
и являющийся окислителем:
Sb2O5 + 10HCl = 2SbCl3 + 2Cl2 + 5H2O.
Соли сурьмы легко гидролизуются. Выпадение гидроксосолей начинается при pH 0,5–0,8 для Sb (III) и pH 0,1 для Sb (V). Состав продукта гидролиза зависит от соотношения соль/вода и последовательности внесения реагентов:
SbCl3 + H2O = SbOCl + 2HCl,
4SbCl3 + 5H2O = Sb4O5Cl2 + 10HCl.
С фтором сурьма образует пентафторид SbF5. При его взаимодействии с плавиковой кислотой HF возникает сильная кислота H[SbF6].
Сурьма горит при внесении её порошка в Cl2 с образованием смеси пентахлорида SbCl5 и трихлорида SbCl3:
2Sb + 5Cl2 = 2SbCl5, 2Sb + 3Cl2 = 2SbCl3.
При действии сероводорода H2S на водные растворы Sb (III) и Sb (V), образуются оранжево-красный трисульфид Sb2S3 или оранжевый пентасульфид Sb2S5, которые взаимодействуют с сульфидом аммония (NH4)2S:
Sb2S3 + 3 (NH4)2S = 2 (NH4)3SbS3,
Sb2S5 + 3 (NH4)2S = 2 (NH4)3SbS4.
Получены органические соединения сурьмы, производные стибина, например, oриметилстибин Sb (CH3)3:
2SbCl3 + 3Zn (CH3)2 = 3ZnCl2 + 2Sb (CH3)3.
Элементы: ядовитый полуметалл – сурьма
Дата: 28.08.2019
Первые производства сурьмы появились на древнем Востоке 5 тысяч лет назад. Сурьмяная бронза (сплав меди и олова с добавлением сурьмы) использовалась в период Вавилонского царства во втором тысячелетии до н.э. Исторически сложилось так, что в русской химической терминологии у этого элемента три названия. Химический элемент называется «сурьма», в формулах произносится «стибиум», а соединения сурьмы с металлами называются антимонидами». В 1789 г. Лавуазье включил сурьму в список простых веществ, дав ей название antimoine от лат. «antimonium». Оно и сейчас остается французским названием элемента № 51. Другое латинское название элемента, «stibium», встречается в сочинениях Плиния Старшего в первом веке н. э. и стало международным. Русское слово «сурьма» родом из турецкого языка. Так и сейчас на Востоке называется порошок для чернения бровей. По другим данным, «сурьма» — от персидского «сурме» — металл. Итак, сурьма (символ — Sb) имеет атомный номер 51 в Таблице Менделеева с атомной массой 121, 760 а.е.м. и относится к группе полуметаллов.

Сурьма в Таблице Менделеева.
Существуют четыре аллотропные разновидности сурьмы: кристаллическая, взрывчатая, чёрная и жёлтая. Наиболее устойчивая, и поэтому самая распространённая – кристаллическая сурьма. Взрывчатая — взрывается при любом соприкосновении. Чёрная и жёлтая — неустойчивы и при пониженных температурах переходят в кристаллическую.
Кристаллическая сурьма по внешнему виду напоминает металл серебристо-белого цвета с синеватым оттенком, довольно хрупкий (легко истирается в порошок).

Кристаллическая сурьма.
Cурьма токсична и относится к ядовитым веществам. Пыль и пары этого элемента вызывают носовое кровотечение, сурьмяную лихорадку. Французский термин сурьмы «antimoine
переводится буквально: «против монахов». Такое название, возможно, возникло из легенды 15 века, в которой настоятель одного мужского монастыря заметил, что свиньи быстро жиреют, потребляя сурьму. Решив, что этот рецепт набора веса сгодится и для людей, он добавил в кашу истощённой братии монастыря сурьму. На следующий день все кто ел — были мертвы. Эту легенду подробно описал Ярослав Гашек в рассказе «Камень жизни» в 1910 году. Отсюда происходит и русское название главного рудного минерала – антимонит с формулой Sb2S3, где содержание сурьмы составляет 72 %. Антимонитовые руды являются основным источником для получения сурьмы и её соединений.

Антимонит Sb2S3, кристаллы до 5 см. Месторождение Кадамджай, Киргизия.
Мировая добыча сурьмы по итогам 2015 года составила около 145 тысяч тонн. Основные объемы добычи приходятся на Китай (47%), Россию (17%), Боливию (15%) и Таджикистан (12%).
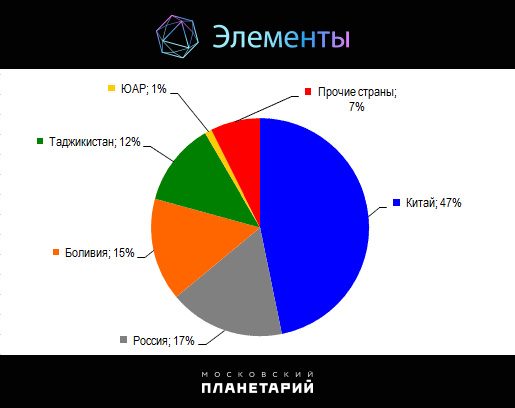
Мировая добыча сурьмы, 2015 г.
В Китае основная добыча ведется в провинции Хунань, где расположено крупнейшее в мире сурьмяное месторождение Сикуаньшань. В России главный регион по добыче антимонитовых руд — Республика Саха (Якутия), где расположены крупные месторождения Сарылах и Сентачан.
Сурьма применяется при производстве диодов и инфракрасных детекторов. Является компонентом свинцовых сплавов, увеличивающим их твёрдость и механическую прочность.
Примечания
- (англ.). WebElements. Дата обращения 15 июля 2010.
- ↑ Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 475. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8.
- Walde A., Hofmann J. B. Lateinisches etymologisches Wörterbuch. — Heidelberg: Carl Winter’s Universitätsbuchhandlung, 1938. — S. 591.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- ↑ (недоступная ссылка). Дата обращения 9 апреля 2012.
- (недоступная ссылка). Дата обращения 9 апреля 2012.
- (недоступная ссылка). Дата обращения 9 апреля 2012.
- Глинка Н. Л. «Общая химия», — Л. Химия, 1983г
- Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
- Неорганическая химия: В 3т. /под ред. Ю. Д. Третьякова. Т. 2 : Химия непереходных элементов : учебник для студ. учреждений высш проф. образования/ А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов — 2-е изд.,перераб. — М. : Издательский центр «Академия», 2011. — 368 с.
- ГН 2.1.5.1315-03 ПДК химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования
- Алексеев А. И. и др. «Критерии качества водных систем», — СПб. ХИМИЗДАТ, 2002г
История
Сурьма известна с глубокой древности. В странах Востока она использовалась примерно за 3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в XIX в. до н. э. порошок сурьмяного блеска (природный Sb2S3) под названием mesten или stem применялся для чернения бровей. В Древней Греции он был известен как στίμμι и στίβι, отсюда лат. stibium. Около XII—XIV вв. н. э. появилось название antimonium. Подробное описание свойств и способов получения сурьмы и её соединений впервые дано алхимиком Василием Валентином (Германия) в 1604 году. В 1789 году А. Лавуазье включил сурьму в список химических элементов под названием antimoine (современный английский antimony, испанский и итальянский antimonio, немецкий Antimon). Русское слово «сурьма» произошло от турецкого и крымско-татарского sürmä; им обозначался порошок свинцового блеска PbS, также служивший для чернения бровей (по другим данным, «сурьма» — от персидского «сурме» — металл).
Химические свойства
Со многими металлами образует интерметаллические соединения — антимониды. Основные валентные состояния в соединениях: III и V.
Окисляющие концентрированные кислоты активно взаимодействуют с сурьмой.
серная кислота превращает сурьму в сульфат сурьмы(III) с выделением сернистого газа:
- 2Sb + 6H2SO4 ⟶ Sb2(SO4)3 + 3SO2↑+ 6H2O{\displaystyle {\mathsf {2Sb\ +\ 6H_{2}SO_{4}\ \longrightarrow \ Sb_{2}(SO_{4})_{3}\ +\ 3SO_{2}\uparrow +\ 6H_{2}O}}}
азотная кислота переводит сурьму в сурьмяную кислоту (условная формула H3SbO4{\displaystyle {\mathsf {H_{3}SbO_{4}}}}):
- Sb + 5HNO3 ⟶ H3SbO4 + 5NO2↑+ H2O{\displaystyle {\mathsf {Sb\ +\ 5HNO_{3}\ \longrightarrow \ H_{3}SbO_{4}\ +\ 5NO_{2}\uparrow +\ H_{2}O}}}
Сурьма растворима в «Царской водке»:
- 3Sb + 18HCl + 5HNO3 ⟶ 3HSbCl6 + 5NO↑+ 10H2O{\displaystyle {\mathsf {3Sb\ +\ 18HCl\ +\ 5HNO_{3}\ \longrightarrow \ 3H\ +\ 5NO\uparrow +\ 10H_{2}O}}}
Сурьма легко реагирует с галогенами:
с иодом в инертной атмосфере при незначительном нагревании:
- 2Sb + 3I2 ⟶ 2SbI3 {\displaystyle {\mathsf {2Sb\ +\ 3I_{2}\ \longrightarrow \ 2SbI_{3}\ }}}
с хлором реагирует по-разному, в зависимости от температуры:
- 2Sb + 3Cl2 →20oC 2SbCl3 {\displaystyle {\mathsf {2Sb\ +\ 3Cl_{2}\ {\xrightarrow {20^{o}C}}\ 2SbCl_{3}\ }}}
- 2Sb + 5Cl2 →80oC 2SbCl5 {\displaystyle {\mathsf {2Sb\ +\ 5Cl_{2}\ {\xrightarrow {80^{o}C}}\ 2SbCl_{5}\ }}}
Средство для красоты
Знаменитые восточные стрелки для глаз рисуются именно сурьмой! Однако, преследуя косметические цели, следует тщательно подходить к выбору средства. Например, Al-Sherifain — порошковая индийская сурьма. Отзывы тех, кто ее опробовал, пестрят заявлениями, что она хороша только для лечебных целей, так как выполненные с ее помощью стрелки быстро осыпаются. Иное средство индийского производства — Hind ka Noor — позиционируется как прекрасная основа для макияжа: стрелки получаются не тонкие, внутреннее веко декорируется замечательно. При помощи сурьмы очень легко сделать знаменитые smoky eyes. Макияж получается благодаря порошковой структуре средства. При этом четкие стрелки рисуются масляной или карандашной сурьмой.

Виды сурьмы и как правильно ими пользоваться
Сурьма производится и продается четырех видов в зависимости от ее состава:
- порошок сурьмы. Такой вид средства подходит для ночного нанесения для снятия напряжения, очищения глаз от отложений и профилактики офтальмологических недугов;
- с добавлением масла миндаля. Подходит для яркого макияжа с эффектом увлажнения, а так же обладает многочисленными полезными свойствами;
- карандаш на основе сурьмы и оливкового масла. Подходит как для повседневного макияжа, так и для ночных лечебных процедур. Легко смывается, а главное его можно использовать каждый день, поскольку состав гипоаллергенный;
- с добавлением растительных масел и камфоры. Идеальное средство для разгрузки и снятия усталости с глаз.
Видео: как красить глаза порошковой сурьмой
Автор данного видеоролика делится своим собственным опытом в чернении глаз сурьмой, подробно описывая процесс нанесения средства. Так же на видео представлена сравнительная характеристика плюсов и минусов элемента для создания мейк-апа глаз, что позволяет принять правильное решении при выборе и использовании средства.
Видео: как подвести глаза подводкой, чтобы она не размазалась
Ознакомившись с представленным материалом можно получить ответы на все интересующие вопросы относительно подводки глаз сурьмой. Видео включает в себя пошаговый процесс нанесения состава, что может выступать в качестве наглядной, понятной для каждого инструкции.
Знакомьтесь: сурьма!
Обращали ли вы внимание на индусов, арабов, бедуинов пустыни с подведенными глазами? Сурьма это! Что такое в ней усмотрели восточные мужи, применяя средство на себе не только для украшения, но и с терапевтической целью? В жарких пустынях Африки, равно как и в Индии, сурьма использовалась в качестве защиты глаз от песка, пыли, палящего солнца. Антисептические свойства средства помогали предотвращать развитие различных инфекций зрительного органа
В Иране, например, измельченный черный камень (основа приготовления сурьмы) применялся с целью лечения ожогов. Благодаря этому люди избавлялись от волдырей. Он также закладывался по краям раны для ее обеззараживания и скорейшего заживления.
Итак, универсальное средство, совмещающее в себе как косметический, так и лечебный эффект, — это сурьма. Как пользоваться средством для глаз, зависит от его формы выпуска. Она бывает в виде порошка, карандаша, пасты в тюбике. Сурьма может отличаться по цвету: палитра начинается от иссиня-черного и заканчивается практически бесцветным, светлым оттенком. Часто она содержит дополнительные вещества, усиливающие ее свойства. Например, камфору, косметические масла и травяные эссенции.

Где используют сурьму?
Используют данный материал чаще всего в полупроводниковой промышленности. Он необходим во время производства инфракрасных детекторов и диодов. Устройства с эффектом Холла не изготавливают без сурьмы.
Сурьма активно применяется в производстве стрелкового оружия и оболочки для кабелей, спичек и типографских сплавов, батарей, в линотипных печатных машинах. Еще она применяется при изготовлении лекарств.
Если соединить сурьму с медью и оловом, то получится сплав баббит, который широко применяется в производстве подшипников скольжения.
Хим. Иногда содержит Ag, Fe или As
Характер, выдел. Сплошные зернистые выделения, реже натечные агрегаты (почковидные, гроздевидные), иногда лучистого строения; кристаллы редки.Структ. и морф, крист. Триг. с. D53d-R3m; arh = 4,507 А; a= 57°06″; Z = 2; ah = 4,310; ch = 11,318 A; ah : ch = 1 : 2,627; Z = 6. Структура типа мышьяка. Расстояния Sb-Sb 2,87 и 3,37 А. Дитригон.-скаленоэдр. кл.; а : с = 1 : 1,3236 Кристаллы ромбоэдрические, толстотаблитчатые по (0001) или пластинчатые. Дв. по (1012); образуют сложные группы — четверники (фиг. 75), шестерники, часто полисинтетические.
Физ. Сп. по (0001) совершенная, по (2021) иногда ясная, по (1120) и по (1012) несовершенная. Диамагнитна.
Микр. В полир, шл. в отраж. св. белая. Отраж. спос. (в %): для зеленых лучей 67,5, для оранжевых — 58, для красных — 55; по Фолинсби, измеренная с помощью фотоэлемента,- 74,6. Двуотражение слабое. Анизотропна.Цвет оловянно-белый с желтой побежалостью. Блеск металлический. Прозрачность непрозрачна. Черта Твердость 3-3,5. Плотность 6,61-6,72 Излом неровный. Очень хрупка. Сингония Триг. Форма кристаллов . Кристаллы ромбоэдрические, толстотаблитчатые по (0001) или пластинчатые. Дв. по (1012); образуют сложные группы — четверники (фиг. 75), шестерники, часто полисинтетические. Спайность по (0001) совершенная, по (2021) иногда ясная, по (1120) и по (1012) несовершенная. Агрегаты Сплошные зернистые выделения, реже натечные агрегаты (почковидные, гроздевидные), иногда лучистого строения; кристаллы редки П. тр. на угле в восст. пл. легко плавится (плавк. 1), в окисл. пл, сгорает, давая белый налет и дым Sb2О3. В откр. тр. полностью улетучивается, образуя кристаллический возгон Sb2О3. На гипсовой пластинке со смесью KJ -+- S дает оранжево-красный налет SbJ3. Поведение в кислотах В конц. HNO3 окисляется в НSbО3, растворяется в царской водке; в НСl не растворима. В полир, шл. от HNO3 чернеет, иризирует, от паров НСl тускнеет, от KCN слабо буреет, от FeCl3 буреет и чернеет, от HgCl слабо буреет и иризирует. Реактивы для структурного травления: FeCl3 (20%-ный раствор) в течение нескольких секунд; K2S (конц. раствор); H2Sb2O7 (конц. раствор). Том 1, 85.
Свойства минерала
- Удельный вес: 6,61 — 6,72 (вычисл. 6,73)
- Форма выделения: Кристаллы ромбоэдрические, толстотаблитчатые по (0001) или пластинчатые. Дв. по (1012); образуют сложные группы — четверники (фиг. 75), шестерники, часто полисинтетические
- Классы по систематике СССР: Оксиды
- Химическая формула: Sb
- Сингония: тригональная
- Цвет: оловянно-белый с желтой побежалостью
- Цвет черты: буровато-серая
- Блеск: металлический
- Прозрачность: непрозрачный
- Излом: неровный
-
Твердость: 3
3,5 - Хрупкость: Да
-
Дополнительно: на угле в восст. пл. легко плавится (плавк. 1), в окисл. пл, сгорает,
давая белый налет и дым Sb2Оз. В откр. тр. полностью улетучивается, образуя кристаллический возгон
Sb2О3. На
гипсовой пластинке со смесью KJ -+-
S дает оранжево-красный
налет SbJ3.В конц. HNCb окисляется в НЭЬОз, растворяется
в царской водке; в НС1 не растворима. В полир, шл. от HNO3 чернеет,
иризирует, от паров НС1 тускнеет, от KCN слабо буреет, от FeCl буреет и чернеет,
от HgCl слабо буреет и иризирует. Реактивы для структурного травления: FeCl
(20%-ный раствор) в течение нескольких секунд; K2S (конц. раствор);
H2Sb207 (конц. раствор).
Фото минерала
Сурьму человек знает издавна
Сурьму (англ. Antimony, франц. Antimoine, нем. Antimon) человек знает издавна и в виде металла, и в виде некоторых соединений.
Нахождение в природе
Кларк сурьмы — 500 мг/т. Её содержание в изверженных породах в общем ниже, чем в осадочных. Из осадочных пород наиболее высокие концентрации сурьмы отмечаются в глинистых сланцах (1,2 г/т), бокситах и фосфоритах (2 г/т) и самые низкие в известняках и песчаниках (0,3 г/т). Повышенные количества сурьмы установлены в золе углей. Сурьма, с одной стороны, в природных соединениях имеет свойства металла и является типичным халькофильным элементом, образуя антимонит. С другой стороны она обладает свойствами металлоида, проявляющимися в образовании различных сульфосолей — бурнонита, буланжерита, тетраэдрита, джемсонита, пираргирита и др. С такими металлами, как медь, мышьяк и палладий, сурьма может давать интерметаллические соединения. Ионный радиус сурьмы Sb3+ наиболее близок к ионным радиусам мышьяка и висмута, благодаря чему наблюдается изоморфное замещение сурьмы и мышьяка в блёклых рудах и геокроните Pb5(Sb, As)2S8 и сурьмы и висмута в кобеллите Pb6FeBi4Sb2S16 и др. Сурьма в небольших количествах (граммы, десятки, редко сотни г/т) отмечается в галенитах, сфалеритах, висмутинах, реальгарах и других сульфидах. Летучесть сурьмы в ряде её соединений сравнительно невысокая. Наиболее высокой летучестью обладают галогениды сурьмы SbCl3. В гипергенных условиях (в приповерхностных слоях и на поверхности) антимонит подвергается окислению примерно по следующей схеме: Sb2S3 + 6O2 = Sb2(SO4)3. Возникающий при этом сульфат окиси сурьмы очень неустойчив и быстро гидролизирует, переходя в сурьмяные охры — сервантит Sb2O4, стибиоконит Sb2O4 • nH2O, валентинит Sb2O3 и др. Растворимость в воде довольно низкая (1,3 мг/л), но она значительно возрастает в растворах щелочей и сернистых металлов с образованием тиокислоты типа Na3SbS3. Содержание в морской воде — 0,5 мкг/л. Главное промышленное значение имеет антимонит Sb2S3 (71,7 % Sb). Сульфосоли тетраэдрит Cu12Sb4S13, бурнонит PbCuSbS3, буланжерит Pb5Sb4S11 и джемсонит Pb4FeSb6S14 имеют небольшое значение.
Генетические группы и промышленные типы месторождений
В низко- и среднетемпературных гидротермальных жилах с рудами серебра, кобальта и никеля, также в сульфидных рудах сложного состава.
Месторождения
Месторождения сурьмы известны в ЮАР, Алжире, Азербайджане, Таджикистане, Болгарии, России, Финляндии, Казахстане, Сербии, Китае, Киргизии.






















































