Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
- Кетольной (0,132 нм) — C-N-связь стабилизирована и полностью одинарна.
- Переходной или мезомерной – промежуточная форма, имеет частично неопределенный характер.
- Енольной (0,127 нм) — пептидная связь становится полностью двойной, а соединение С-О — полностью одинарным. При этом кислород приобретает частично отрицательный заряд, а атом водорода — частично положительный.

Такая особенность называется эффектом резонанса и объясняется делокализованностью ковалентной связи между атомом углерода и азота. При этом гибридные sp2-орбитали формируют электронное облако, распространяющееся на атом кислорода.
Синтез
Образование пептидной связи посредством реакции дегидратации .
Когда две аминокислоты образуют дипептид через пептидную связь, это тип реакции конденсации . При таком типе конденсации две аминокислоты приближаются друг к другу, при этом фрагмент карбоновой кислоты без боковой цепи (C1) одной приближается к фрагменту аминогруппы без боковой цепи (N2) другого. Один теряет водород и кислород из своей карбоксильной группы (COOH), а другой теряет водород из своей аминогруппы (NH 2 ). В результате этой реакции образуется молекула воды (H 2 O) и две аминокислоты, соединенные пептидной связью (-CO-NH-). Две соединенные аминокислоты называются дипептидом.
Амидная связь синтезируется, когда карбоксильная группа одной молекулы аминокислоты взаимодействует с аминогруппой другой молекулы аминокислоты, вызывая высвобождение молекулы воды (H 2 O), следовательно, этот процесс представляет собой реакцию синтеза дегидратации .
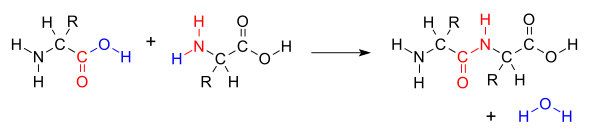
Конденсация дегидратации двух аминокислот с образованием пептидной связи (красный) с вытеснением воды (синий).
На образование пептидной связи расходуется энергия, которая в организмах происходит от АТФ . Пептиды и белки представляют собой цепочки аминокислот, удерживаемые вместе пептидными связями (а иногда и несколькими изопептидными связями). Организмы используют ферменты для производства нерибосомных пептидов и рибосомы для производства белков посредством реакций, которые в деталях отличаются от синтеза дегидратации.
Некоторые пептиды, такие как альфа-аманитин , называются рибосомальными пептидами, поскольку они производятся рибосомами, но многие из них не являются рибосомными пептидами, поскольку они синтезируются специализированными ферментами, а не рибосомами. Например, трипептид глутатион синтезируется в две стадии из свободных аминокислот двумя ферментами: глутамат-цистеинлигаза (образует изопептидную связь, которая не является пептидной связью) и глутатионсинтетазой (образует пептидную связь).
Резонансные формы пептидных связей
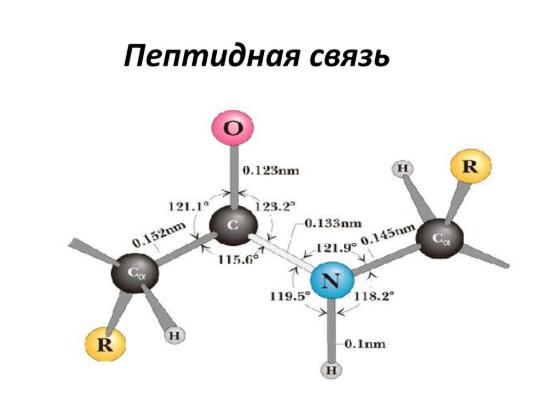
В 1930-1940-х годах Лайнус Карл Полинг (Linus Carl Pauling) и Роберт Кори (Robert Brainard Corey) проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось выяснить, что пептидная группа имеет жесткую планарную структуру, в которой шесть атомов лежат в одной плоскости: ^5,-атом углерода и C=O группа первой аминокислоты, и N-H группа и ^5,-атом углерода второй аминокислоты. Полинг объяснил данный факт существованием двух резонансных форм пептидной группы, на что указывала меньшая длина C-N связи в пептидной группе (133 пм), в сравнении с той же связью у простых аминов (149 пм). Вследствие частичного разделения электронной пары между карбонильным кислородом и амидным азотом, пептидная связь на 40% имеет двойные свойства.
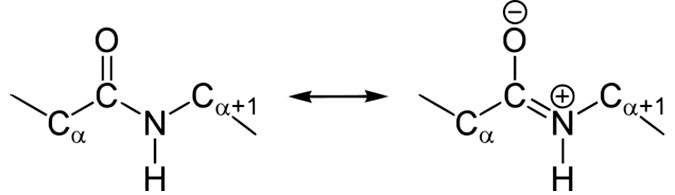 Резонансные формы типичной пептидной группы. Незаряженная единичная форма (около 60%) показана слева, заряженная двойная форма (около 40%) справа.
Резонансные формы типичной пептидной группы. Незаряженная единичная форма (около 60%) показана слева, заряженная двойная форма (около 40%) справа.
В пептидных группах вращения вокруг C-N связи не происходит вследствие ее частичной двойственности. Вращение возможно только вокруг связей С—С^5, и N—С^5,. В результате остов пептида может быть представлен в виде серии полей, разделенных совместными точками вращения (С^5, атомы). Данная структура ограничивает количество возможных пептидных цепей.
Кроме того, эффект резонанса стабилизирует группу, добавляя энергию примерно 84 ккал / моль, что делает ее менее химически активной, в сравнении с подобными группам (например, эфирами). Данная группа не имеет заряда с точки зрения физиологических значений pH, однако вследствие существования двух резонансных форм, карбонильный кислород несет частично отрицательный заряд, а амидный азот – частично положительный. Таким образом, возникает диполь с дипольным моментом, около 3,5 Дебай (0,7 электрон-ангстрем). Указанные дипольные моменты могут ориентироваться параллельно в определенных типах вторичной структуры (например ^5,-спирали).
Свойства цепочки
Различные аминокислоты, являющиеся своего рода «строительным материалом» для белка, имеют радикал R.
Как и с любыми амидами, пептидная связь белка цепи C-N с помощью взаимодействия канонических структур между карбонильным углеродом и азотным атомом, как правило имеет свойство двойной. Обычно это находит проявление в снижении ее длины до 1,33 ангстрема.
Все это ведет к следующим выводам:
- C, H, O и N — 4 связных атома, плюс 2 a-углерода располагаются на одной плоскости. Группы R аминокислот и a-углеродные водороды располагаются уже за пределами этой зоны.
- Н и О в пептидной связи аминокислот и a-углероды пары аминокислот являются транс-ориентированными, хотя транс-изомер более стабилен. У L-аминокислот R-группы тоже являются транс-ориентированными, что присутствует во всех пептидах и белках в природе.
- Вращение вокруг цепочки C-N сложно, более вероятно вращение у связи C-C.

Для того чтобы понять, что такое пептидная связь, а также для обнаружения самих пептидов с белками и определения их количества в определенном растворе, пользуются биуретовой реакцией.
Стереоизомерия
Возможные конфигурации
Для планарного пептидной связи возможны две конфигурации: в транс -конфигурации α-атомы углерода и боковые цепи расположены по разные стороны пептидной связи, в то время как в цис -конфигурации — с одной и той же. Транс-форма пептидных н ‘связей значительно более распространенной чем цис (встречается в 99,6% случаев), из-за того, что в последнем случае велика вероятность пространственного столкновения между боковыми группами аминокислот:
Исключением является аминокислота пролин, если она соединена через аминогруппу с какой-либо другой аминокислотой. Пролин — единственная из протеиногенным аминокислот, содержит около C α не первоначальная, а вторичную аминогруппу. В ней атом азота связан с двумя атомами углерода, а не с одним, как у остальных аминокислот. В пролина, что включенный в пептид, заместители при атоме азота отличаются не так сильно, как в других аминокислот. Поэтому разница между транс — и цис -конфигурации очень незначительна и ни одна из них не имеет энергетической преимущества.
Возможны конформации
Конформация пептида определяется тремя торсионными углами, отражающие вращения вокруг трех последовательных связей в пептидной остове: ψ (пси) — вокруг C α1-С, ω (омега) — вокруг С-N, и φ (фи) — вокруг N- С α2.
Как уже упоминалось вращения вокруг собственно пептидной связи не происходит, так ω угол всегда имеет значение ок. 180 ° в транс -конфигурации и 0 ° в значительно более редкой цис -конфигурации.
Поскольку связи N-С α2 и C α1-С по обе стороны от пептидной являются обычными одинарными связями, вращения вокруг них неограничен, в результате чего пептидные цепи могут принимать различные пространственные конформации. Однако возможны не все комбинации торсионных углов, при некоторых из них происходит пространственное столкновения атомов. Допустимые значения визуализируют на двухмерном графике, называется диаграммой Рамахандрана.
Замена аминокислоты
Внутри аномального гемоглобина S мутировали 2 β-цепи, глутамат в которых, а также отрицательно заряженная высокополярная аминокислота в шестом положении, были подменены содержащим радикал гидрофобным валином.
Внутри мутировавшего гемоглобина находится участок, который является комплиментарным другому участку с такими же молекулами, что содержит измененную аминокислоту. В конечном итоге молекулы гемоглобина «слиплись вместе» и образовали длинные фибриллярные агрегаты, которые изменяют эритроцит и ведут к появлению мутирующего эритроцита серповидной формы.

Внутри оксигемоглобина S в результате смены белковой конформации маскируется комплиментарный участок. Отсутствие доступа к нему не дает возможности для соединения молекул друг с другом у этого оксигемоглобина. Существуют условия, способствующие образованию HbS агрегатов. Они увеличивают скопления дезоксигемоглобина внутри клеток. К ним могут относиться:
- гипоксия;
- высокогорные условия;
- физический труд;
- полет на самолете.
Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
- Кетольной (0,132 нм) — C-N-связь стабилизирована и полностью одинарна.
- Переходной или мезомерной – промежуточная форма, имеет частично неопределенный характер.
- Енольной (0,127 нм) — пептидная связь становится полностью двойной, а соединение С-О — полностью одинарным. При этом кислород приобретает частично отрицательный заряд, а атом водорода — частично положительный.

Такая особенность называется эффектом резонанса и объясняется делокализованностью ковалентной связи между атомом углерода и азота. При этом гибридные sp2-орбитали формируют электронное облако, распространяющееся на атом кислорода.
Примечания
Примечания и пояснения к статье «Пептидная связь».
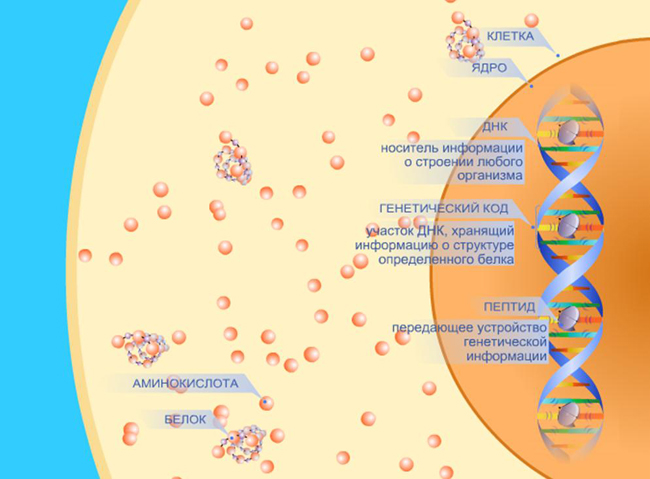
- Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот. Пептиды перманентно синтезируются во всех живых организмах для регулирования физиологических процессов, принимают участие, в том числе, в процессах регенерации клеток.
- Белок, протеин – высокомолекулярное органическое вещество, состоящее из альфа-аминокислот, объединенных пептидной связью. Существуют две класса белков: простой белок, при гидролизе распадающийся исключительно на аминокислоты, и сложный белок (холопротеин, протеид), в котором содержится простетическая группа (кофакторы), при гидролизе сложного белка, кроме аминокислот, освобождается небелковая часть или продукты ее распада. Белки-ферменты катализируют (ускоряют) протекание биохимических реакций, оказывая значимое влияние на процессы метаболизма. Отдельные белки выполняют механическую или структурную функцию, образуя цитоскелет, сохраняющий форму клеток. Кроме того, белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле. Белки являются основой для создания мышечной ткани, клеток, тканей и органов у человека.
- Аминокислоты – органические соединения, являющиеся строительным материалом для белковых структур, мышечных волокон. Организм использует аминокислоты для собственного роста, укрепления и восстановления, для выработки различных гормонов, ферментов и антител.
- Нуклеофил (от латинского nucleus – «ядро» и древнегреческого `6,_3,_5,^1,`9, – «любить») – электроноизбыточный химический реагент, образующий связь с электрофилом (партнером по реакции), предоставляя электронную пару, образующую новую связь.
- Свободная энергия Гиббса – это величина, демонстрирующая изменение энергии в момент протекания химической реакции, дающая ответ на вопрос о принципиальной возможности протекания химической реакции.
- Конформация – пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей.
- Пролин (пирролидин-^5,-карбоновая кислота) – гетероциклическая аминокислота, в которую атом азота входит в составе вторичного, а не первичного амина. Пролин представляет собой бесцветные, хорошо растворимые в воде и этаноле, хуже – в бензоле и ацетоне и совершенно не растворимые эфире кристаллы. В организме человека пролин синтезируется из глутаминовой кислоты. В составе коллагена, пролин (при участии аскорбиновой кислоты) окисляется в гидроксипролин.
- Метод Лоури – один из колориметрических методов количественного определения белка в моче (протеинурии, альбуминурии), чувствительность которого составляет 10 – 100 мкг/мл.
При написании статьи о пептидных связях, в качестве источников, использовались материалы информационных и медицинских интернет-порталов, сайтов новостей Nature.com, ScienceDaily.com, Википедия, а также следующие печатные издания:
- Валькович Э. И. «Общая и медицинская эмбриология: учебное пособие для медицинских вузов». Издательство «Фолиант», 2003 год, Санкт-Петербург,
- Лебедев А. Т., Артеменко К. А., Самгина Т. Ю. «Основы масс-спектрометрии белков и пептидов». Издательство «Техносфера», 2012 год, Москва.

Что такое амидная связь
Амидная связь представляет собой тип ковалентной связи, участвующей в образовании амида. Амид характеризуется наличием функциональной группы, известной как R n E (O) x NR’2 (R и R ‘относятся к H или органическим группам). Есть три типа амидов в природе. Это карбоксамиды ( n = 1, E = C, x = 1), фосфорамиды ( n = 2, E = P, x = 1 и многие родственные формулы) и сульфонамиды (E = S, x = 2). Более того, простейшими амидами являются производные аммиака (RC (O) NH2).
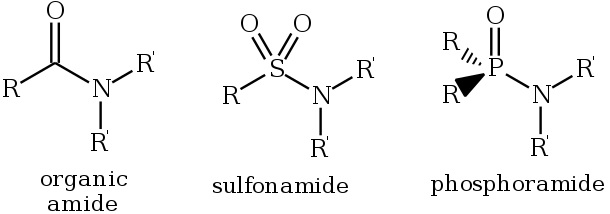
Рисунок 1: Амиды
Принимая во внимание основность, амиды являются очень слабыми основаниями по сравнению с аминами. Следовательно, они не проявляют кислотно-основных свойств в воде
Кроме того, амиды имеют ряд технологических применений в качестве конструкционного материала. Нейлоны — это такие полиамиды, которые используются в ткани, как волокна и формы.
Антивозрастные пептиды
Антивозрастные пептиды — это что такое? Это название имеют крошечные белки, которые могут обратить вспять признаки старения. Поскольку процесс старения вызывает естественное снижение количества пептидов в коже, его синтетические версии, содержащиеся в сыворотках и кремах, помогают повысить уровень коллагена и эластина.
Кожа человека состоит в основном из коллагена, который утолщает и сглаживает кожу и тем самым улучшает ее структуру. У женщин в возрасте до 30 лет достаточно коллагена, что является следствием гладкой, подтянутой кожи. С возрастом кожа постепенно становится тоньше, что приводит к потере ее эластичности. Когда коллаген разрушается в коже от возраста и факторов окружающей среды, таких как солнце и стресс, на ней образуются морщины. Действие пептидов направлено на выработку коллагена и может обеспечить значительные омолаживающие преимущества.
Пептиды посылают «сообщение» коже о том, что она потеряла коллаген и нуждается в большем его количестве. При использовании пептидов, которые запускают выработку коллагена, кожа «думает», что организму необходимо вырабатывать новый коллаген. Таким образом, можно успешно минимизировать морщины и придать коже более молодой вид
Поэтому важно использовать хороший крем, содержащий антивозрастные пептиды
Исследования показывают, что правильный крем со специфическими пептидами может играть важную роль в восстановлении и улучшении состояния кожи. Он должен включать компоненты:
- стимулирующие коллаген;
- уменьшающие воспаление;
- расслабляющие мышцы лица, тем самым, уменьшающие появление морщин, подобно ботоксу.
Как применять пептиды для кожи? Лучше всего их использовать в сыворотках или кремах, которые, по большей части, требуют времени для работы, за исключением непосредственного воздействия некоторых нейропептидов. При регулярном нанесении средства на кожу можно увидеть результаты через 4-12 недель. Со временем кожа станет выглядеть более яркой, подтянутой и гладкой, что является прямым результатом работы пептидов.
При использовании пептидов для ухода за кожей не было отмечено побочных эффектов.

Пептидная связь
Появление пептидного соединения происходит в момент, когда азот из аминогруппы связывается с углеродом карбоксильной. Эта связь является ковалентной и некоторыми учеными называется также амидной. Образование связи осуществляется благодаря гидролизу, а не синтезу, поэтому не требует дополнительного источника энергии. Биосинтез пептидов происходит буквально за несколько секунд, но воссоздание такой же реакции в лаборатории может быть делом длительным. Однако образованные связи являются стабильными, и в отсутствии катализаторов в водном растворе пептиды могут существовать тысячи лет.
Если две аминокислоты связываются друг с другом, то появляется дипептид, если три – то трипептид. Количество аминокислот, что могут создавать сложные полимерные структуры, почти не ограничено. Конец аминокислоты, у которой связана карбоксильная группа, называется N-концом. С другой же стороны находится С-конец, то есть свободная карбоксильная группа второй участвующей в образовании соединения аминокислоты. Пептидная связь крайне распространена в организме, часто она становится основой для формирования белков. К пептидным соединениям относят и гормоны, в частности, окситоцин. Синтез пептидов в организме человека осуществляется во всех клетках, включая нейроны мозга.

Разница между амидной и пептидной связью
Цис / транс-изомеры пептидной группы
Значительная делокализация неподеленной пары электронов на атоме азота придает группе характер . Частичная двойная связь делает амидную группу плоской , присутствуя либо в цис-, либо в транс-изомерах . В развернутом состоянии белков пептидные группы могут изомеризоваться и принимать оба изомера; однако в свернутом состоянии только один изомер принимается в каждом положении (за редкими исключениями). Транс-форма предпочтительна по большинству пептидных связей (соотношение примерно 1000: 1 в транс: цис-популяциях). Однако пептидные группы X-Pro обычно имеют соотношение примерно 30: 1, предположительно потому, что симметрия между атомами и пролина делает цис- и транс-изомеры почти равными по энергии (см. Рисунок ниже).Cα{\ displaystyle \ mathrm {C ^ {\ alpha}}}Cδ{\ displaystyle \ mathrm {C ^ {\ delta}}}
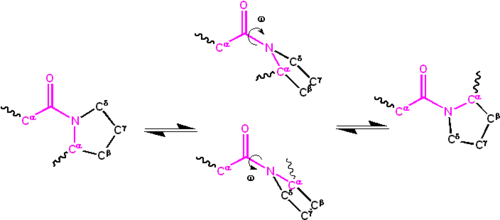
Изомеризация пептидной связи X-Pro. Цис- и транс-изомеры находятся слева и справа, соответственно, разделенные переходными состояниями.
Двугранный угол , связанный с пептидной группы (определяемой четырьмя атомами ) обозначается ; для цис-изомера ( синперипланарная конформация) и для транс-изомера ( антиперипланарная конформация). Амидные группы могут изомеризоваться по связи C’-N между цис- и транс-формами, хотя и медленно ( 20 секунд при комнатной температуре). В переходные состояния требует, чтобы парциальное двойную связь быть нарушена, так что энергия активации составляет примерно 80 кДж / моль (20 ккал / моль). Однако энергию активации можно снизить (и катализировать изомеризацию ) изменениями, которые благоприятствуют односвязной форме, такими как размещение пептидной группы в гидрофобной среде или передача водородной связи атому азота пептидной группы X-Pro. . Оба этих механизма снижения энергии активации наблюдались в пептидилпролилизомеразах (PPIases), которые являются естественными ферментами, которые катализируют цис-транс-изомеризацию пептидных связей X-Pro.
Cα-C′-N-Cα{\ Displaystyle C ^ {\ alpha} -C ^ {\ prime} -NC ^ {\ alpha}}ω{\ displaystyle \ omega}ωзнак равно∘{\ displaystyle \ omega = 0 ^ {\ circ}}ωзнак равно180∘{\ displaystyle \ omega = 180 ^ {\ circ}}τ∼{\ Displaystyle \ тау \ сим} ωзнак равно±90∘{\ displaystyle \ omega = \ pm 90 ^ {\ circ}}
Конформационное сворачивание белка обычно происходит намного быстрее (обычно 10–100 мс), чем цис-транс-изомеризация (10–100 с). Ненативный изомер некоторых пептидных групп может значительно нарушить конформационную укладку, либо замедляя ее, либо предотвращая ее даже до тех пор, пока не будет достигнут нативный изомер. Однако не все пептидные группы одинаково влияют на фолдинг; неродные изомеры других пептидных групп могут вообще не влиять на фолдинг.
Обзор качественной косметики
Изучив отзывы женщин различных возрастных групп, мы подготовили для вас рейтинг эффективных средств ухода с пептидами в составе.
Биоконцентрат от New Line
Средство предназначено для уменьшения глубины морщин и подтягивания овала лица. Активные элементы в составе стимулируют выработку коллагена и эластана, оказывая эффект лифтинга. Производитель заявляет, что при регулярном, курсовом применении состояние зрелой кожи значительно улучшается, разглаживаются морщинки и выравнивается контур лица. Повышаются защитные свойства дермы, выравнивается микрорельеф . Наилучший эффект достигается после 10-15 применений в сочетании с массажем. Биокончентрат смешивают с основным средством ухода и наносят на ночь.
Peptide Ampoule Cream от Mizon
Корейский бренд специализируется на производстве косметики с антивозрастным эффектом. Peptide Ampoule Cream был разработан для кожи, на которой проявляются первые признаки старения. При регулярном использовании средство восстанавливает гидро-липидный баланс дермы, повышает ее тургор, питает и подтягивает. На первом месте в составе значится трипептид-3. Это доказывает, что крем действительно выполняет свою задачу при регулярном применении.
Пептиды от морщин от DNC
Гель предназначен для дневного ухода. Подходит для всех типов кожи. Решает такие задачи, как возвращение упругости, активация производства собственного коллагена, увлажнение. Покупатели отмечают, что спустя месяц применения дерма откликается на уход здоровым сиянием.
Лора от Эвалар
Производитель рекомендует начинать использовать крем с 30-летнего возраста. В составе значатся пальмитоил трипептид-5, антикосиданты и масла. Достаточно жирный, не подойдет для дневного ухода, поскольку дает сальный блеск. Отлично работает ночью, выравнивая цвет лица и подтягивая овал.
Echoice от WelcosCo
Еще один корейский крем, отлично зарекомендовавший себя на рынке. Средство выравнивает цвет лица, укрепляет стенки сосудов, способствует разглаживанию мимических морщин, активирует выработку собственного коллагена, улучшает микроциркуляцию крови. Состав обогащен маслами макадамии и ши, поэтому он достаточно тяжело распределяется по лицу. Девушки отмечают, что крем лучше использовать на ночь. При регулярном применении действительно повышается тургор кожи, а мимические морщинки не остаются на лице после улыбки.
Крем универсальный от Sengara
Средство способствует разглаживанию морщин, тормозит процессы естественного увядания дермы. Пептиды запускают процессы деления стволовых клеток, улучшают кровообращение и качество обеспечения клеточных мембран кислородом. Комплекс растительных масел помогает активным соединениям питать кожу, снимает раздражения и уменьшает воспаления. Девушки отмечают, что крем делает лицо более ухоженным, молодым, овал подтянутым, но наилучший эффект достигается в сочетании с пилингами и грамотным очищением.
Сыворотка Matrixyl 10% от The Ordinary
В состав средства входят матричные пептиды нового поколения матриксил. Их задача – стимуляция синтеза коллагена, восстановление тканей эпидермиса и уменьшение глубины морщин. Примечательно, что производитель обогатил сыворотку гиалуроновой кислотой, обеспечивающей дополнительное увлажнение. Гилауронка помогает аминокислотам проникать глубже в клетки дермы, питая и стимулируя их к делению и обновлению.
Deep Reveal Nourishing от Amly
Густой, маслянистый крем с плотной текстурой обогащен витаминами, восстанавливающими текстуру кожи и выравнивающими ее тон. Основная задача средства – подарить лицу свежий, отдохнувший, сияющий вид за счет увеличения уровня увлажненности. Подходит для любого типа дермы, приятно и ненавязчиво пахнет. Применяется как маска, 2 раза в неделю. Сеанс длится 20 минут, после чего крем нужно смыть и нанести основной уход.
Copper Amino Isolate Serum 2:1 от NIOD
Сыворотка содержит сразу несколько групп пептидов, действующих комплексно. Одни из них подавляют действие ферментов, разрушающих клеточные мембраны, другие обеспечивают транспортировку питательных веществ к тканям. Средство выравнивает тон и текстуру эпидермиса, придает кожному покрову здоровое сияние и свечение, уменьшает поры и мимические морщины.
Наша статья позволяет сделать однозначный вывод о том, что пептиды являются необходимым строительным материалом для клеток дермы, способствуют ее обновлению и увлажнению. Результативность косметики с аминокислотными цепочками в антивозрастной косметологии очевидна. Продлите молодость своей кожи, попробовав одно из средств, представленных в нашем обзоре.
Пептидные связи
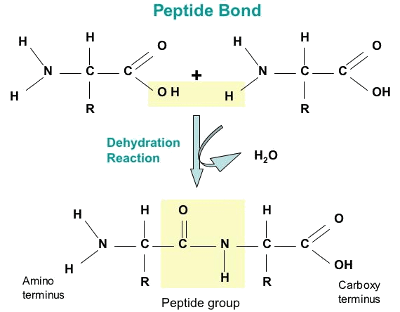
Аминокислоты объединяются c образованием крупных органических полимеров, известных как пептиды.
Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации.
Карбоксильная группа одной аминокислоты и аминогруппа другой аминокислоты объединяются, высвобождая молекулу воды.
Полученная связь представляет собой пептидную связь и продукты, образованные такими связями, называются пептидами.
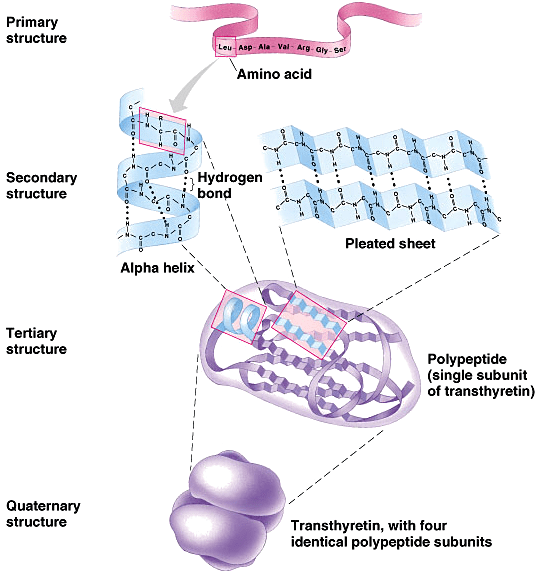
В глобулярных белках существуют четыре уровня структуры:
1) Первичная
Первичная структура — уникальная последовательность аминокислот в полипептидной цепи.
2) Вторичная
Локальное складывание полипептида в некоторых регионах приводит к вторичной структуре белка.
Наиболее распространенными являются α-спираль и β-листовые структуры. Обе структуры представляют собой α-спиральную структуру.
Спираль сохраняет свою форму за счет водородных связей.
3) Третичная
Третичная структура связана с химическими взаимодействиями внутри полипептидной цепи.
Сложную трехмерную третичную структуру белка в первую очередь создают взаимодействия между R группами.
4) Четвертичная
Первичная, вторичная и третичная структуры относятся к отдельным полипептидным цепям белка, а четвертичная — к взаимодействиям, которые происходят между полипептидными цепями в белках, состоящих из двух или более полипептидов.
Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру.