Реакции
Примечательной особенностью углеводородов является их инертность, особенно для насыщенных членов. В противном случае можно выделить три основных типа реакций:
- Реакция замещения
- Реакция сложения
- Горение
Свободнорадикальные реакции
Реакции замещения происходят только в насыщенных углеводородах (одинарные углерод-углеродные связи). Для таких реакций требуются высокореакционные реагенты, такие как хлор и фтор . В случае хлорирования один из атомов хлора замещает атом водорода. Реакции протекают по свободнорадикальным путям .
- CH 4 + Cl 2 → CH 3 Cl + HCl
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl
полностью до CCl 4 ( четыреххлористый углерод )
- C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl
- C 2 H 4 Cl 2 + Cl 2 → C 2 H 3 Cl 3 + HCl
полностью до C 2 Cl 6 ( гексахлорэтан )
Замена
Из классов углеводородов ароматические соединения однозначно (или почти так) подвергаются реакциям замещения. Примером может служить химический процесс, применяемый в самых крупных масштабах: реакция бензола и этилена с образованием этилбензола .
Реакции сложения
Реакции присоединения относятся к алкенам и алкинам. В этой реакции различные реагенты добавляют «поперек» пи-связи (ей). Хлор, хлористый водород, вода и водород являются иллюстративными реагентами. Алкены и алкины некоторые также подвергаются полимеризациям , алкен метатезиса и алкинового метатезис .
Окисление
Углеводороды в настоящее время являются основным источником энергии и тепла в мире (например, для отопления домов) из-за энергии, вырабатываемой при их сжигании. Часто эта энергия используется непосредственно в качестве тепла, например, в домашних обогревателях, в которых используется нефть или природный газ . Углеводород сжигается, а тепло используется для нагрева воды, которая затем циркулирует. Аналогичный принцип используется для выработки электроэнергии на электростанциях .
Общие свойства углеводородов заключаются в том, что они выделяют пар, двуокись углерода и тепло во время горения и что для горения требуется кислород . Простейший углеводород — метан — горит следующим образом:
- CH 4 + 2 O 2 → 2 H 2 O + CO 2 + энергия
При недостаточной подаче воздуха образуются газообразный оксид углерода и водяной пар :
- 2 СН 4 + 3 О 2 → 2 СО + 4 Н 2 О
Другой пример — сжигание пропана :
- C 3 H 8 + 5 O 2 → 4 H 2 O + 3 CO 2 + энергия
И, наконец, для любого из n атомов углерода
- C n H 2 n +2 +3 п + 12 O 2 → ( n + 1) H 2 O + n CO 2 + энергия.
Частичное окисление характеризует реакции алкенов и кислорода. Этот процесс является основой прогоркания и высыхания краски .
Алифатические насыщенные углеводород
Алифатические насыщенные углеводороды действуют на нервную систему, как наркотики. С увеличением в молекуле числа атомов углерода до 9 включительно это действие усиливается, а с дальнейшим ростом молекулы — ослабевает.
Высшие алифатические насыщенные углеводороды стали применять для синтезов сравнительно недавно, несмотря на то, что их можно получать из нефтяного или буроугольного парафина и синтезировать дешевым способом по Фишеру-Тропшу. Они очень мало реакционноспособны и неоднородны по составу.
Высшие алифатические насыщенные углеводороды стали применять для синтезов сравнительно недавно, несмотря на то, что их можно получать из нефтяного или буроугольного парафина ш синтезировать дешевым способом по Фишеру-Тропшу. Они очень мало реакционноспособны и неоднородны по составу.
В качестве дисперсионной среды могут использоваться ароматические и алифатические насыщенные углеводороды, а также смеси углеводородов с С6 — Сю и др. Инициирование полимеризации обеспечивается применением различных водорастворимых инициаторов, УФ — и у — облучения. Процесс полимеризации протекает в микрореакторах, которыми являются капли водного раствора мономера, и имеет в кинетическом отношении некоторое сходство с полимеризацией в массе, однако при этом проявляется влияние защитных коллоидов на процесс.
Нефть — это сложная смесь органических соединений, в которой доминирующими компонентами являются алифатические насыщенные углеводороды. Состав нефтей лежит в пределах от d до Сао или С4о и широко варьирует в зависимости от месторождения нефти. Фракция нефти, кипящая при температуре ниже 200, содержит несколько сотен различных соединений, в том числе алканы, алкены, циклоалканы и ароматические углеводороды.
Нефть — это сложная смесь органических соединений, в которой доминирующими компонентами являются алифатические насыщенные углеводороды. Состав нефтей лежит в пределах от GI до С30 или С4о и широко варьирует в зависимости от месторождения нефти. Фракция нефти, кипящая при температуре ниже 200, содержит несколько сотен различных соединений, п том числе алканы, алкены, циклоалканы и ароматические углеводороды.
|
Зависимость изменения энергии Гиббса для реакции образования галогеиидов от температуры ( в расчете на 1 г-атом галогена. |
В этом процессе остаются труднолетучие компоненты, которые подвергают пиролизу и превращают в аморфный углерод, а термической обработкой последнего получают графит. Теплота образования всех алифатических насыщенных углеводородов отрицательна, термодинамически они более устойчивы, чем ароматические или ненасыщенные углеводороды. Кроме того, по мере уменьшения числа атомов углерода возрастает абсолютная величина этой отрицательной энергии, приходящейся на один углеродный атом. Отсюда следует, что поскольку энергия связей С — Н и С С больше, чем энергия связи С-С ( гл.
Пористая структура сополимеров обеспечивается введением в смесь реагентов при полимеризации инертного растворителя, хорошо растворяющего исходные мономеры, но практически не растворяющего конечные полимерные продукты. В качестве такого растворителя наиболее пригодны алифатические насыщенные углеводороды.
Пористая структура сополимеров достигается введением в смесь реагентов при полимеризации инертного растворителя, хорошо растворяющего исходные мономеры, но; практически не растворяющего конечные полимерные продукты. В качестве такого растворителя наиболее пригодны алифатические насыщенные углеводороды. В сополимере после удаления растворителя образуется сложная система пор.
Пористая структура сополимеров достигается введением в смесь реагентов при полимеризации инертного растворителя, хорошо растворяющего исходные мономеры, но практически не растворяющего конечные полимерные продукты. В качестве такого растворителя наиболее пригодны алифатические насыщенные углеводороды. В сополимере после удаления растворителя образуется сложная система пор.
Полиэтилен относится к неполярным полимерам, его дипольный момент равен нулю. Вследствие весьма высокой степени электрической симметрии он обладает высокими диэлектрическими свойствами и превосходит в этом отношении полярные диэлектрики. Диэлектрическая постоянная полиэтилена обусловливается только электронной и атомной поляризацией; она имеет ту же величину, что и диэлектрическая постоянная алифатических насыщенных углеводородов.
Реликтовые и преобразованные углеводороды
Все углеводороды нефти делят на две группы:
- Преобразованные – утратившие особенности строения, характерные для исходных биоорганических молекул.
- Реликтовые, или хемофоссилии – те углеводороды, которые сохранили характерные особенности строения исходных молекул независимо от того, были ли эти углеводороды в исходной биомассе или сформировались позднее из других веществ.
Реликтовые углеводороды, входящие в состав нефти, подразделяются на две группы:
- изопреноидного типа – алициклического и алифатического строения, с числом циклов в одной молекуле до пяти;
- неизопреноидного – в основном алифатические соединения, имеющие н-алкильные или слаборазветвленные цепи.
Реликтов изопреноидного строения значительно больше, чем неизопреноидного.
Выделено свыше 500 реликтовых углеводородов нефти, и их число увеличивается с каждым годом.
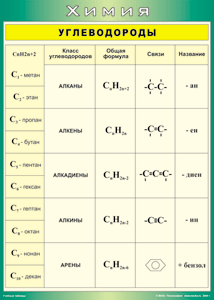
Непредельные (ненасыщенные) ациклические углеводороды:
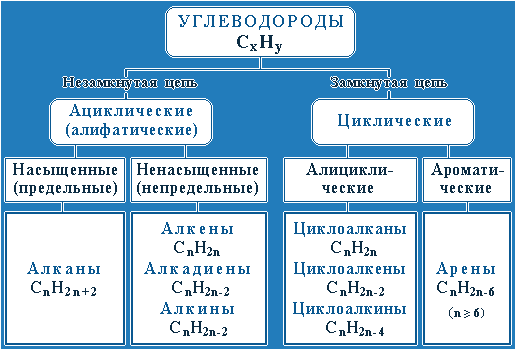
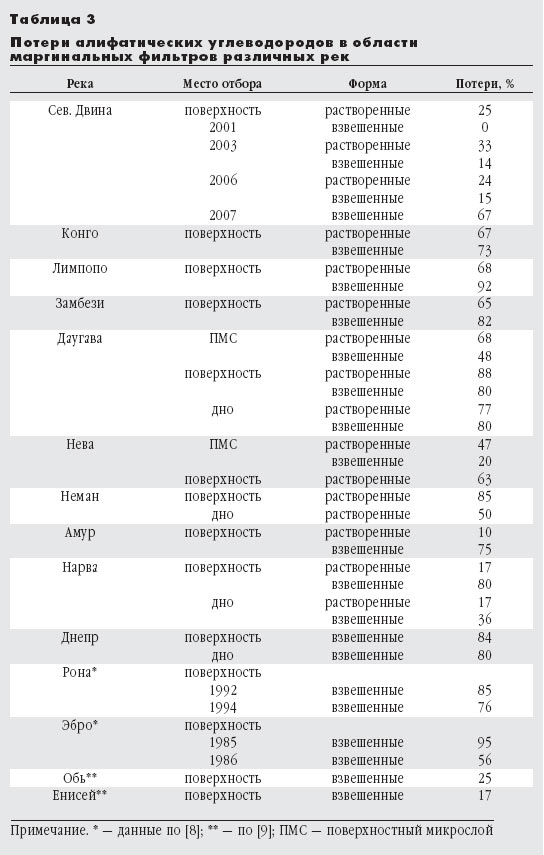
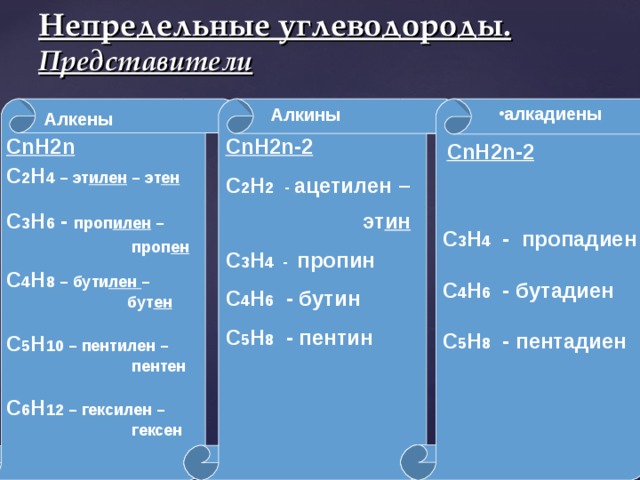
Алкены (также именуемые олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Связи C=C представляют собой π-связи. Длина связи C=C составляет 0,134 нм.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены образуют гомологический ряд, также называемый рядом этилена. К алкенам относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10, гексен C6H12, гептен C7H14, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены, число атомов углерода в которых больше двух (т.е. кроме этилена), имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
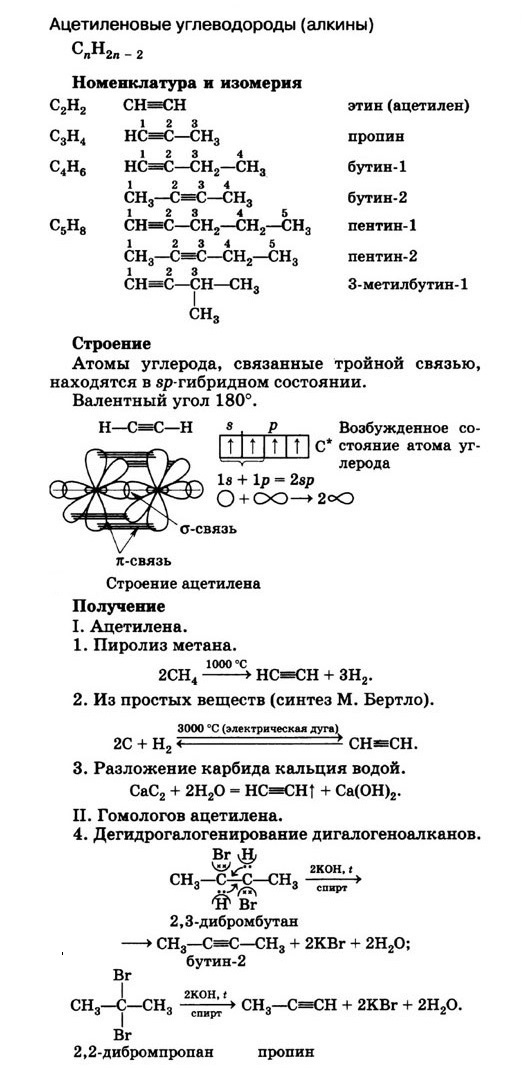
Алкины (также именуемые ацетиленовые углеводороды) – ациклические непредельные углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный плоский угол 180°. Таким образом у алкинов связь С≡С линейна (угол 180°) и находится в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Алкины образуют гомологический ряд, также называемый рядом ацетилена. К алкинам относятся: этин (ацетилен) C2H2, пропин C3H4, бутин C4H6, пентин C5H8, гексин C6H10, гептин C7H12, октин C8H14, нонин C9H16, децин C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины, число атомов углерода в которых больше трех (т.е. кроме ацетилена и пропина), имеют изомеры. Для алкинов характерны изомерия углеродного скелета, положения тройной связи и межклассовая. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Диены (именуемые также алкадиены) – ациклические непредельные углеводороды, содержащие две двойных связи между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы:
– сопряжённые диены, в которых двойные связи разделены одинарной (1,3-диены)
– аллены с кумулированными двойными связями (1,2-диены)
– диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
По номенклатуре IUPAC названия диенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-диен»; положение двух двойных связей указывается двумя арабскими цифрами.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации. Связи C=C представляют собой π-связи. В сопряженных диенах длина связи C=C составляет 0,137 нм, а C-C – 0,146 нм.
Диены образуют гомологический ряд. К диенам относятся: пропадиен (С3Н4), бутадиен (С4Н6), пентадиен (С5Н8), гексадиен (С6Н10), гептадиен (С7Н12), октадиен (С8Н14), нонадиен (С9Н16), декадиен (С10Н18) и т.д., которые имеют формулу CnH2n-2.
Диены, число атомов углерода в которых больше четырех (т.е. кроме пропадиена и бутадиена), имеют изомеры. Для диенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная, цис-транс-изомерия). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
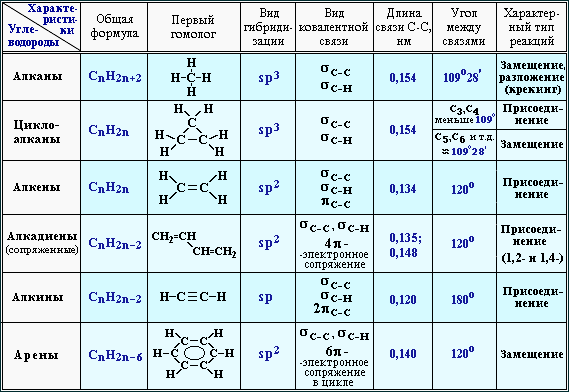
Сравнительная таблица углеводородов[править | править код]
|
Характеристика |
Алканы |
Алкены |
Алкины |
Алкадиены |
Циклоалканы |
Арены |
|---|---|---|---|---|---|---|
|
Общая формула |
CnH2n+2 |
CnH2n |
CnH2n-2 |
CnH2n-2 |
CnH2n |
CnH2n-6 |
|
Строение |
sp³-гибридизация — 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. Тип углеродной связи — σ-связи |
sp²-гибридизация, валентный угол 120°.Тип углеродной связи — π-связи. lc-c — 0,134 нм. |
sp-гибридизация, молекула плоская (180°), тройная связь, lc-c — 0,120 нм. |
lc-c — 0,132 нм – 0,148 нм, 2 или более π-связей. У каждого атома три гибридные sp²-орбитали. |
sp³-гибридизация, валентный угол около 100° lc-c — 0,154 нм. |
Строение молекулы бензола (6 р-электронов, n = 1), Валентный угол 120° lc-c — 0,140 нм, молекула плоская (6 π | σ) |
|
Изомерия |
Изомерия углеродного скелета, возможна оптическая изомерия |
Изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная |
Изомерия углеродного скелета, положения тройной связи, межклассовая |
Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия |
Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия |
Изомерия боковых цепей, а также их взаимного положения в бензольном ядре |
|
Химические свойства |
реакции замещения (галогенирование, нитрирование), окисления, радикальное галогенирование CH4 + Cl2 → CH3Cl + HCl (хлорметан), горения, отщепления (дегидрирование) |
Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения |
Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения |
Реакции присоединения |
Для колец из 3-4 атомов углерода — раскрытие кольца |
Реакции электрофильного замещения |
|
Физические свойства |
С CH4 до C4H10 — газы; с C5H12 до C16H34 — жидкости; после C17H36 — твёрдые тела. |
С C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. |
Алкины по своим физическим свойствам напоминают соответствующие алкены |
С C3H6 до C4H8 — газы; с C5H10 до C16H32 — жидкости; после C17H34 — твёрдые тела. |
Все ароматические соединения — твердые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра |
|
|
Получение |
Каталитический и высокотемпературный крекинг углеводородов нефти и природного газа, реакции дегидратации соответствующих спиртов, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных |
Постадийное дегидрирование алканов, дегидрирование спиртов. |
Изопреноидные алканы
К изопреноидным алканам относят разветвленные углеводороды с правильным чередованием метильных групп. Например, 2,6,10,14-тетраметилпентадекан или 2,6,10-триметилгексадекан. Изопреноидные алканы и алканы с неразветвленной цепью составляют преобладающую массу биологического исходного материала нефти. Конечно, вариантов изопреноидных углеводородов гораздо больше.

Для изопреноидов характерна гомологичность и неравновесность, то есть для разных нефтей характерен свой набор этих соединений. Гомологичность является следствием разрушения более высокомолекулярных источников. В изопреноидных алканах можно выявить «провалы» в концентрациях каких-либо гомологов. Это следствие невозможности разрыва их цепи (образования этого гомолога) в том месте, где находятся метильные заместители. Эту особенность используют для определения источников образования изопреноидов.
Техническое значение углеводородного состава нефти
Состав веществ существенно влияет на показатели качества нефти.
1. Парафины:
- Нормальные парафины (неразветвленные) обладают низким октановым числом и высокими температурами застывания. Поэтому в процессе переработки их превращают в углеводороды других групп.
- Изопарафины (разветвленные) обладают высоким октановым числом, то есть высокими антидетонационными свойствами (изооктан – эталонное соединение с октановым числом 100), а также низкими, по сравнению с нормальными парафинами, температурами застывания.
2. Нафтены (циклопарафины) наряду с изопарафинами положительно влияют на качество дизельного топлива и смазочных масел. Их высокое содержание в тяжелой бензиновой фракции приводит к высокому выходу и высокому октановому числу продуктов.
3. Ароматические углеводороды ухудшают экологические свойства топлива, но обладают высоким октановым числом. Поэтому при переработке нефти другие группы углеводородов превращают в ароматические, но количество их, в первую очередь бензола, в топливе строго регламентируется.
Насыщенные алифатические углеводород
Насыщенные алифатические углеводороды нерастворимы в воде, а также в концентрированной серной кислоте при нагревании Ненасыщенные ( алкены) углеводороды растворяются в концентрированной серной кислоте и присоединяют бром.
|
Прозрачность хлороформа.| Прозрачность четыреххлористого углерода. |
Насыщенные алифатические углеводороды обладают максимумами поглощения ( маловажными) у 0 9; 1 02; 1 117; 1 38 и 2 17 мкм. Первая сильная полоса поглощения имеется после 3 мкм.
Насыщенные алифатические углеводороды на активных сорбентах не адсорбируются вовсе или адсорбируются очень слабо; поэтому их не удается идентифицировать методом тонкослойной хроматографии.
Насыщенные алифатические углеводороды имеют ряд преимуществ перед другими видами пропеллентов. Они стабильны в водных средах и легче воды, поэтому главным образом употребляются в водных раствор ах. В связи с горючестью их не используют в составах, где присутствуют органические растворители или другие огнеопасные вещества.
Насыщенные алифатические углеводороды, как правило, не обладают достаточной активностью в процессах анодного окисления и лишь в узком диапазоне специально подобранных условий могут с достаточной селективностью реагировать с образованием функциональных соединений.
Насыщенные алифатические углеводороды нерастворимы в воде, а также в концентрированной серной кислоте при нагревании.
Насыщенные алифатические углеводороды имеют малую вязкость, но удовлетворительные вязкостно-температурные характеристики. Вязкость увеличивается по мере увеличения длины цепи. Такая же зависимость существует для температуры застывания и индекса вязкости. Длина и положение боковых цепей влияют на все три характеристики. Более низкие температуры застывания имеют масла, у которых разветвление происходит в середине цепи. Длинные боковые цепи улучшают вязкостно-температурные характеристики.
Насыщенные алифатические углеводороды часто используют в химии переходных металлов в качестве растворителей, поскольку их легко очистить и вследствие удобных для работы температур кипения. Обычно полагают, что насыщенные алифатические углеводороды инертны, но они могут вести себя и как источники водорода.
Насыщенные алифатические углеводороды нерастворимы в воде, а также в концентрированной серной кислоте при нагревании. Ненасыщенные ( алкены) углеводороды растворяются в концентрированной серной кислоте и присоединяют бром.
Насыщенные алифатические углеводороды нерастворимы в воде, а также в концентрированной серной кислоте при нагревании. Ненасыщенные углеводороды ( алкены) растворяются в концентрированной серной кислоте и присоединяют бром.
Насыщенные алифатические углеводороды нерастворимы в воде, а также в концентрированной серной кислоте при нагревании. Ненасыщенные ( алкены) углеводороды растворяются в концентрированной серной кислоте и присоединяют бром.
Насыщенные алифатические углеводороды входят в состав целевых фракций алкилбензолов и их промежуточных фракций. Перечисленные выше и другие побочные реакции в значительной степени подавляются большим избытком бензола. Избыток бензола также подавляет реакции образования ди — и полиалкилбензолов и сдвигает реакцию в сторону образования преимущественно моноалкилбензолов, но некоторое количество их все же неизбежно образуется.
|
Число изомерных алканов. |
Насыщенные алифатические углеводороды общей брутто-формулы СлН2 / ч — 2 образуют гомологический ряд алканов. Раньше эти соединения назывались также предельными углеводородами, поскольку в них достигнута предельная степень насыщения атомами водорода. В технической литературе алканы чаще всего называют парафиновыми углеводородами или парафинами ( от лат.
Методы исследования углеводородного состава нефти
Для технических целей достаточно установление состава нефти по содержанию в ней отдельных классов углеводородов. Фракционный состав нефти важен для выбора направления переработки нефти.
С целью определения группового состава нефти применяют различные методы:
- Химические подразумевают проведение реакции (нитрования или сульфирования) взаимодействия реагента с определенным классом углеводородов (алкенами или аренами). По изменению объема или количеству получившихся продуктов реакции судят о содержании определяемого класса углеводородов.
- Физико-химические включают экстракцию и адсорбцию. Так проводят экстрагирование аренов диоксидом серы, анилином или диметилсульфатом, с последующей адсорбцией этих углеводородов на силикагеле.
- Физические включают определение оптических свойств.
- Комбинированные — наиболее точные и самые распространенные. Сочетают в себе два каких-либо метода. Например, удаление аренов химическим или физико-химическим методом и измерение физических свойств нефти до и после их удаления.
Для научных целей важно определить точно, какие углеводороды в нефти содержатся или преобладают. Для выявления отдельных молекул углеводородов используют газожидкостную хроматографию с использованием капиллярных колонок и установления температуры, хромато-масспектрометрию с компьютерной обработкой и построением хроматограмм по отдельным характеристическим фрагментным ионам (масс-фрагментография или масс-хроматография)
Используются также спектры ЯМР на ядрах 13С
Для выявления отдельных молекул углеводородов используют газожидкостную хроматографию с использованием капиллярных колонок и установления температуры, хромато-масспектрометрию с компьютерной обработкой и построением хроматограмм по отдельным характеристическим фрагментным ионам (масс-фрагментография или масс-хроматография). Используются также спектры ЯМР на ядрах 13С.
Современные схемы анализа состава углеводородов нефти включают предварительное разделение на две или три фракции с разными температурами кипения. После этого каждую из фракций разделяют на насыщенные (парафиново-нафтеновые) и ароматические углеводороды с помощью жидкостной хроматографии на силикагеле. Далее ароматические углеводороды следует разделить на моно-, би- и полиароматические с помощью жидкостной хроматографии с использованием оксида алюминия.

использование

Нефтеперерабатывающие заводы — это один из способов переработки углеводородов для использования. Сырая нефть обрабатывается в несколько этапов с образованием желаемых углеводородов, используемых в качестве топлива и других продуктов.
Вагон-цистерна 33 80 7920 362-0 с углеводородным газом на Bahnhof Enns (2018).
Преимущественно углеводороды используются в качестве источника горючего топлива . Метан — преобладающий компонент природного газа. Алканы с C 6 по C 10 , алкены и изомерные циклоалканы являются основными компонентами бензина , нафты , авиационного топлива и смесей специальных промышленных растворителей. С постепенным добавлением углеродных единиц простые углеводороды без кольцевой структуры имеют более высокую вязкость , индекс смазки, точки кипения, температуры затвердевания и более глубокий цвет. На противоположной стороне от метана находятся тяжелые смолы, которые остаются самой низкой фракцией в реторте для переработки сырой нефти . Их собирают и широко используют в качестве кровельных смесей, дорожных покрытий ( битум ), консервантов для древесины ( серия креозотов ) и в качестве жидкостей с чрезвычайно высокой вязкостью, устойчивых к сдвигу.
Некоторые крупномасштабные нетопливные применения углеводородов начинаются с этана и пропана, которые получают из нефти и природного газа. Эти два газа превращаются либо в синтез-газ, либо в этилен и пропилен . Эти два алкена являются предшественниками полимеров, включая полиэтилен , полистирол, акрилаты, полипропилен и т. Д. Другой класс специальных углеводородов — это БТК , смесь бензола , толуола и трех изомеров ксилола . Мировое потребление бензола оценивается более чем в 40 000 000 тонн (2009 г.).
Углеводороды также широко распространены в природе. Некоторые эусоциальные членистоногие, такие как бразильская пчела без жала, Schwarziana quadripunctata , используют уникальные углеводородные «запахи», чтобы отличить родство от другого. Химический углеводородный состав варьируется в зависимости от возраста, пола, местоположения гнезда и иерархического положения.
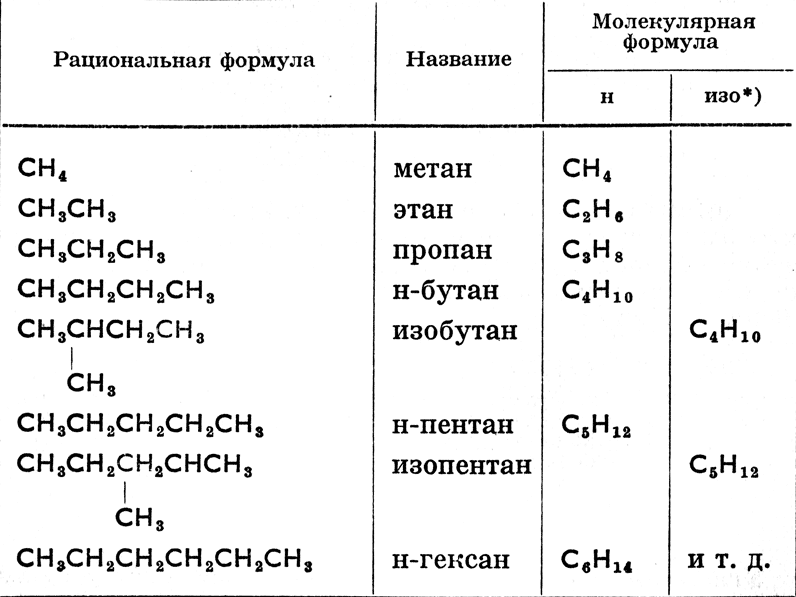
Алканы
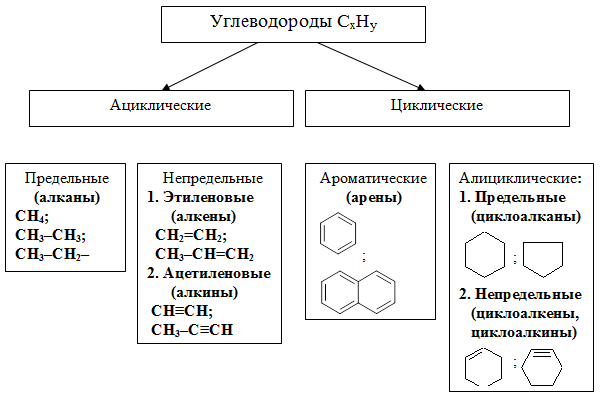
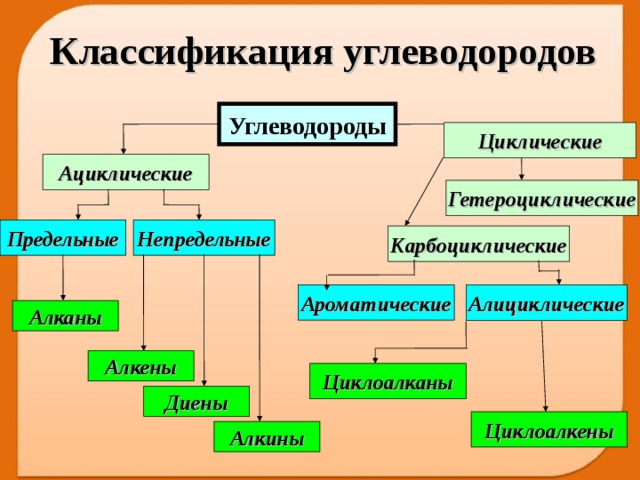
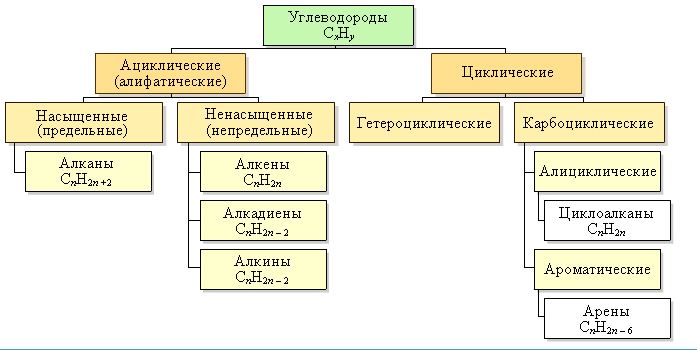
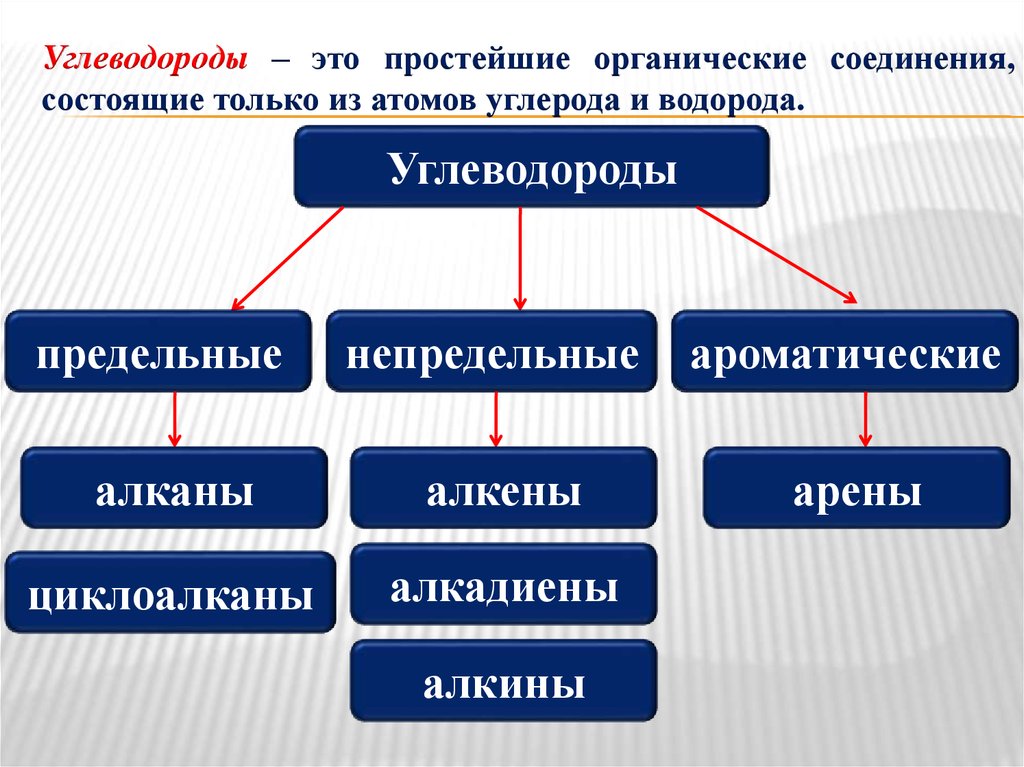
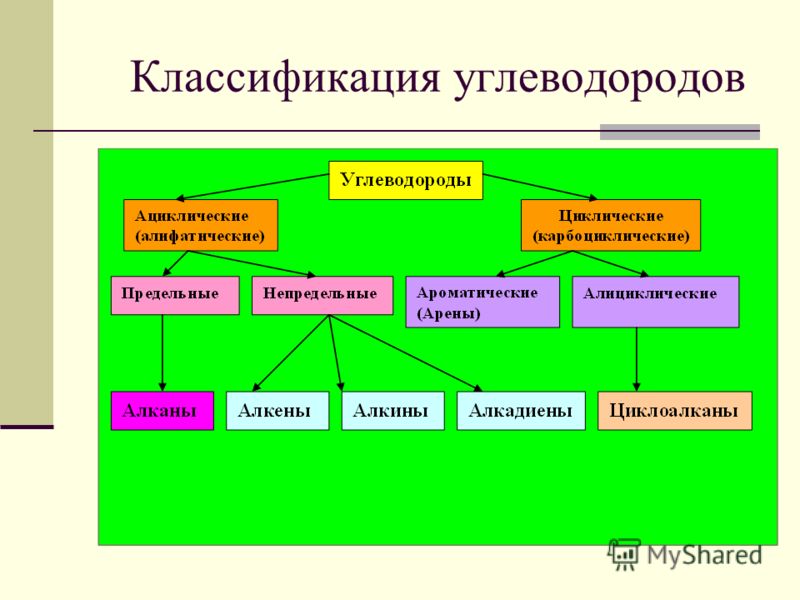
Предельные углеводороды — это соединения, имеющие общую формулу СпН2п+2. Среди их особенностей можно упомянуть отсутствие замкнутой структуры, а также одинарные (простые) связи. Их в органической химии называют ациклическими соединениями.
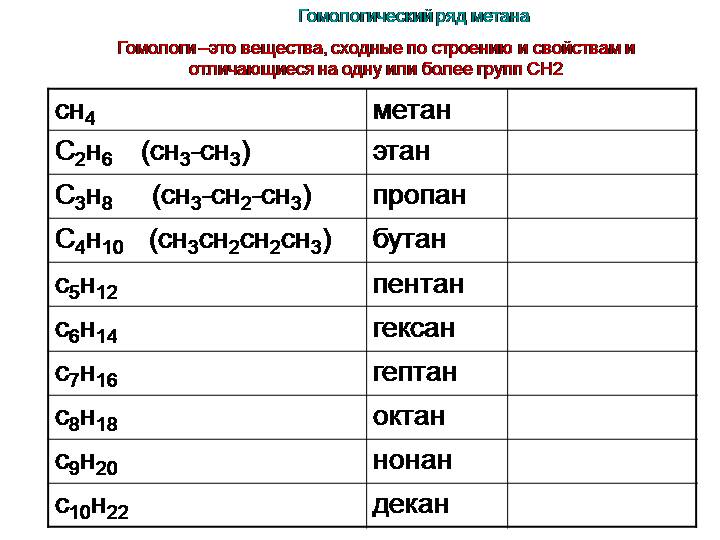
Типичным представителем данного класса является метан – СН4. Именно он начинает гомологический ряд алканов, обладает всеми свойствами, присущими остальным представителям парафинов.
Первые представители данного класса углеводородов являются газообразными веществами, обладающими малой растворимостью в воде, специфическим запахом.
Среди основных химических свойств, которыми обладают представители гомологического ряда алканов, выделим радикальное замещение.
Галогенирование протекает при повышенной температуре либо наличии ультрафиолетового облучения. Реакция протекает в несколько стадий, характеризуется постепенным замещением атомов водорода галогеном. Свойства углеводородов ряда метана объясняются насыщенностью связи между углеродными атомами. Они не способны вступать в реакции присоединения, при этом отлично горят в кислороде воздуха с образованием углекислого газа, водяного пара, выделением достаточного количества тепловой энергии.
Среди основных отраслей применения представителей данного класса углеводородов выделим использование в качестве топлива, а также вариант исходного сырья для производства множества иных органических соединений.

Алкены
Ненасыщенные углеводороды — это соединения, которые имеют одну либо несколько кратных (ненасыщенных) связей между углеродными атомами. Алкены имеют общую формулу СпН2п. Типичным представителем данного класса является этилен.
Эти природные углеводороды входят в состав нефти. Учитывая, что в молекуле содержится двойная связь, для алкенов характерны реакции присоединения. Например, они могут вступать в галогенирование, гидратацию.
Если двойная связь располагается в первом положении, например в бутене-1, присоединение галогеноводорода и гидратация (реакция с водой) протекают по правилу Марковникова. Суть его состоит в том, что при гидрогалогенировании и гидратации водород присоединяется к тому атому углерода, который им максимально насыщен.
Гидроксильная группа или атом галогена присоединяется к атому С, который не насыщен водородом. Качественной реакцией на непредельную (двойную) связь является обесцвечивание бромной воды или перманганата калия.

Ненасыщенные углеводороды
Непредельные алифатические углеводороды – это представители ряда этилена и ацетилена. Проанализируем их основные свойства и применение. Для алкенов характерно наличие двойной связи, поэтому общая формула ряда имеет вид СпН2п.
Учитывая непредельный характер этих веществ, можно отметить, что они вступают в реакции соединения: гидрирования, галогенирования, гидратации, гидрогалогенирования. Кроме того, представители ряда этилена способны к полимеризации. Именно эта их особенность делает представителей данного класса востребованными в современном химическом производстве. Полиэтилен и полипропилен – вещества, составляющие основу полимерной промышленности.
Ацетилен – первый представитель ряда, имеющего общую формулу СпН2п-2. Среди отличительных особенностей этих соединений можно выделить наличие тройной связи. Ее присутствие поясняет протекание реакций соединения с галогенами, водой, галогеноводородом, водородом. Если тройная связь в таких соединениях располагается в первом положении, то для алкинов характерна качественная реакция замещения с комплексной солью серебра. Именно эта способность является качественной реакцией на алкин, используется для обнаружения его в смеси с алкеном и алканом.
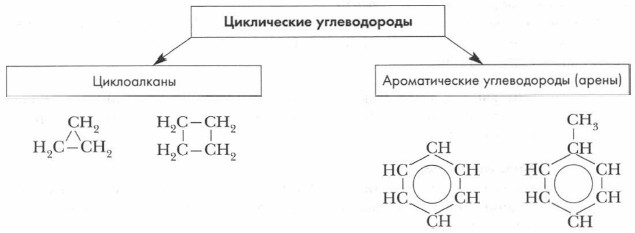
Ароматические углеводороды являются циклическими непредельными соединениями, поэтому не считаются алифатическими соединениями.
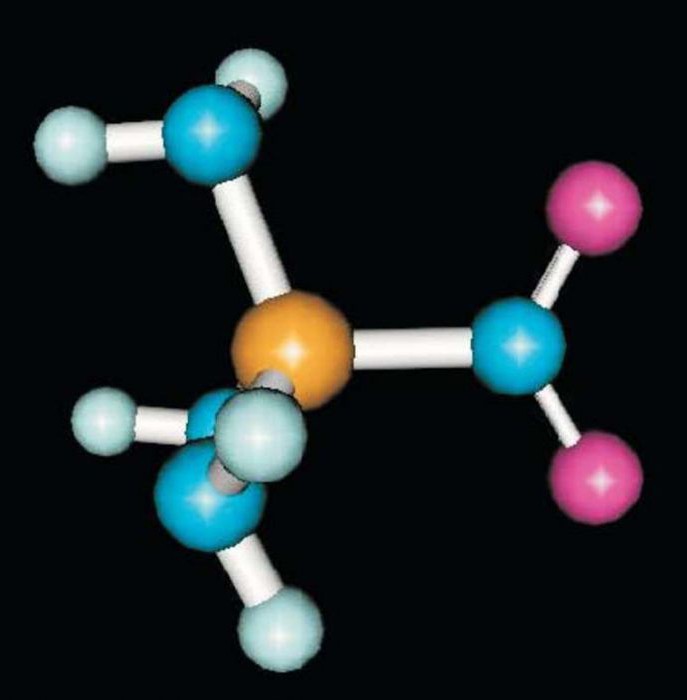
Углеводороды в Энциклопедическом словаре:
Углеводороды — органические соединения, молекулы которых построены толькоиз атомов углерода и водорода. Различают алифатические, или ациклические,углеводороды, в молекулах которых атомы углерода образуют линейные илиразветвленные открытые цепи (напр., этан, изобутилен), и карбоциклическиеуглеводороды, молекулы которых представляют собой циклы (кольца) из трехили более атомов углерода. Эти углеводороды подразделяют на алициклические(напр., циклогексан) и ароматические (напр., бензол). Углеводороды -важнейшие компоненты нефти, природного газа, продуктов их переработки,широко используемые как сырье для получения многих химических продуктов,топлива и др.
Источники углеводородов
Природные источники углеводородов нефти и газа – биоорганические молекулы разных соединений, в основном их липидные компоненты. Ими могут быть:
- липиды высших растений,
- водоросли,
- фитопланктон,
- зоопланктон,
- бактерии, особенно липиды клеточных мембран.
Липидные компоненты растений по химическому составу очень схожи, однако, определенные вариации молекул позволяют определить преимущественное участие тех или иных веществ в образовании данной нефти.
Все липиды растений разделяют на два класса:
- соединения, состоящие из молекул с неразветвленной (или слаборазветвленной) цепью;
- соединения, в основе которых изопреноидные звенья алициклического и алифатического ряда.
Существуют соединения, состоящие из элементов, принадлежащих к обоим классам, например, воск. Молекулы воска являются сложными эфирами высших насыщенных или непредельных жирных кислот и циклических изопреноидных спиртов – стеролов.
Типичными представителями липидных природных источников углеводородов нефти являются следующие соединения:
- Насыщенные и непредельные жирные кислоты состава С12-С26 и оксикислоты. Жирные кислоты состоят из четного числа атомов углерода, так как они синтезируются из С2-ацетатных компонентов. Входят в состав триглицеридов.
- Природный воск — в отличие от жиров, содержит не глицерин, а высшие жирные спирты или стеролы.
- Слаборазветвленные кислоты, имеющие метилзаместители на противоположном от карбоксильной группы конце цепи, например изо- и антеизокислоты.
- Интересными веществами являются суберин и кутин, входящие в разные части растений. Они образованы полимеризованными связанными жирными кислотами и спиртами. Эти соединения устойчивы к ферментативному и микробиальному воздействию, что предохраняет от биологического окисления алифатические цепи.
Прогнозы, разведка
Углеводородное сырье — это природный газ, нефть, включая попутный (нефтяной) газ. Доходы, получаемые от реализации сырья, идут на развитие социальных отраслей. По оценкам экспертов, объемы природных углеводородов постепенно исчерпываются. Для нефти сроки полного расходования составляют 50-100 лет, а для газа — 120 лет.
Некоторые ученые считают, что есть еще неизвестные месторождения газа и нефти, а также нетрадиционные месторождения углеводородов, объемы которых настолько велики, что их будет достаточно для удовлетворения потребностей следующих поколений. Бережное использование разведанных запасов, разумное восполнение добычи новых месторождений, освоение эффективных новых технологий разведки, извлечения углеводородов из пластов, эффективное применение энергетических ресурсов — все это способствует сохранению ценных энергетических ресурсов планеты.
Газы
Востребованным углеводородным сырьем являются попутный и природный газы. Они могут находиться в трех типах залежей: газонефтяных, газовых, газоконденсатных. Для газовых залежей характерно естественное подземное скопление алканов, которое не имеет прямой связи с нефтяными месторождениями. Газонефтяные залежи характеризуются одновременным присутствием нефти и газа.
Газоконденсатные виды характеризуются высоким давлением и повышенными температурами в пласте. В таких условиях углеводороды переходят в газ, при понижении давления идет обратная конденсация.
Природные газы в большей части состоят из метана. Также в их составе есть пропан, этан, бутан, несущественное количество пентана и иных компонентов: азота, углекислого газа, инертных газов, сероводорода. На долю природного газа приходится 99,3 % метана, а гомологи составляют не больше 5 %.
Попутный газ — это газ, который растворен в нефти либо выделяется из нее в процессе добычи. По выходу из скважины нефть и попутный газ проходят через газогенераторы, здесь и начинается их разделение. Именно попутный газ является ценнейшим сырьем для нефтехимического промышленного синтеза.
Ароматические соединения
Бензол является первым представителем данного класса. Он имеет общую формулу СпН2п-6. В отличие от всех остальных углеводородов, данное соединение имеет ароматическое кольцо. В его образовании принимают участие свободные электроны каждого углеродного атома. Три электрона С образуют гибридные облака, а четвертый электрон не повергается гибридизации. Именно он формирует ароматическое кольцо, которое равномерно распределяется по всей молекуле. Равномерное распределение кольца по структуре объясняет его химическую стабильность. Сам бензол вступает в замещение и присоединение только при жестких условиях.
Толуол, являющийся его гомологом, характеризуется некоторым смещением электронной плотности, поэтому у него выше способность к замещению. Углеводородный радикал является ориентантом 1 рода, входящие заместители (галоген, нитрогруппа) занимают орто-, параположения.
Воздействие на окружающую среду
Сжигание углеводородов в качестве топлива с образованием диоксида углерода и воды является основным фактором антропогенного глобального потепления . Углеводороды попадают в окружающую среду в результате их широкого использования в качестве топлива и химикатов, а также в результате утечек или случайных разливов во время разведки, добычи, переработки или транспортировки. Антропогенное загрязнение почвы углеводородами является серьезной глобальной проблемой из-за стойкости загрязнителей и их негативного воздействия на здоровье человека.
Когда почва загрязнена углеводородами, это может оказать значительное влияние на ее микробиологические, химические и физические свойства. Это может служить для предотвращения, замедления или даже ускорения роста растительности в зависимости от конкретных происходящих изменений. Сырая нефть и природный газ — два основных источника загрязнения почвы углеводородами.