Парциальное давление в ныряющем, вдыхая газы
В развлекательном подводном плавании и профессионале, ныряющем, богатство отдельных составляющих газов дыхания газов выражено парциальным давлением.
Используя ныряющие термины, парциальное давление вычислено как:
Давление:partial = (полное абсолютное давление) × (часть объема газового компонента)
Для составляющего газа «i»:
:ppi = P × Fi
Например, в, полное абсолютное давление (т.е., 1 бар атмосферного давления + 5 баров гидравлического давления) и парциальные давления главных компонентов
воздух, кислород 21% объемом и азотом 79% объемом:
:ppN2 = 6 баров × 0.79 = 4,7 бара абсолютный
:ppO2 = 6 баров × 0.21 = 1,3 бара абсолютный
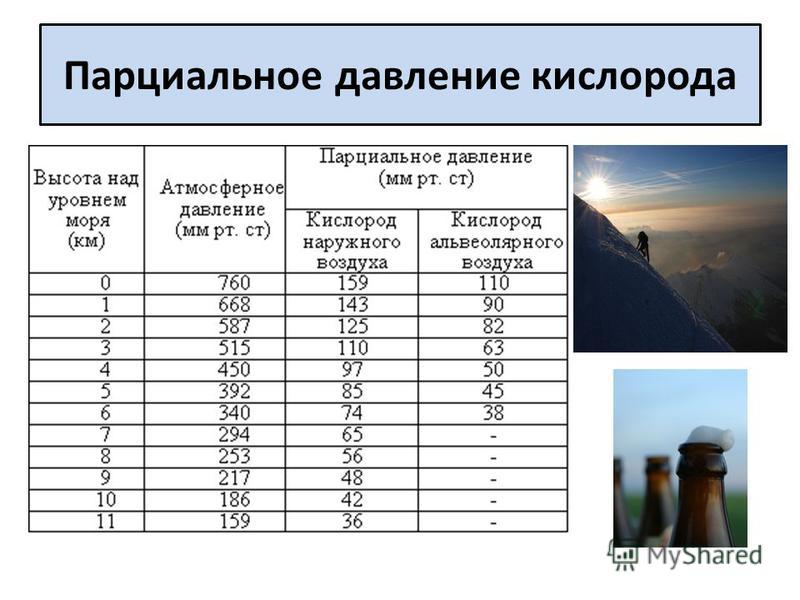
Минимальный безопасный нижний предел для парциальных давлений кислорода в газовой смеси абсолютный. Гипоксия и внезапное бессознательное состояние становятся проблемой с кислородным парциальным давлением меньше чем 0,16 абсолютных баров. Кислородная токсичность, включая конвульсии, становится проблемой, когда кислородное парциальное давление слишком высоко. NOAA Ныряющее Руководство рекомендует максимальное единственное воздействие 45 минут в 1,6 абсолютных барах, 120 минут в 1,5 абсолютных барах, 150 минут в 1,4 абсолютных барах, 180 минут в 1,3 абсолютных барах и 210 минут в 1,2 абсолютных барах. Кислородная токсичность становится риском, когда эти кислородные парциальные давления и воздействия превышены. Парциальное давление кислорода определяет максимальную операционную глубину газовой смеси.
Наркоз азота — проблема, вдыхая газы в высоком давлении. Как правило, максимальное полное парциальное давление наркотических газов использовало, когда планирование технического подводного плавания — 4,5 бара, абсолютные, основанные на эквивалентной наркотической глубине.
Закон Генри и растворимость газов
Газы распадутся в жидкостях до степени, которая определена равновесием между нерастворенным газом и газом, который распался в жидкости (названный растворителем). Равновесие, постоянное для того равновесия:
: (1)
Форма равновесия постоянные шоу, что концентрация газа раствора в решении непосредственно пропорциональна парциальному давлению того газа выше решения. Это заявление известно как Закон Генри, и постоянное равновесие довольно часто упоминается как Законная константа Генри.
Закон Генри иногда издается как:
: (2)
где также упоминается как Законная константа Генри. Как видно, сравнивая уравнения (1) и (2) выше, аналог. Так как оба могут упоминаться как Законная константа Генри, читатели технической литературы должны вполне стараться отметить, какая версия Законного уравнения Генри используется.
Закон Генри — приближение, которое только просит разведенные, идеальные решения и для решений, где жидкий растворитель не реагирует химически с растворяемым газом.
Константы равновесия реакций с участием газовых смесей
Можно вычислить константу равновесия для химической реакции с участием смеси газов, учитывая парциальное давление каждого газа и общую формулу реакции. Для обратимой реакции с участием газовых реагентов и газовых продуктов, таких как:
- аА+бBcC+dD{\ displaystyle a \, A + b \, B \ leftrightarrow c \, C + d \, D}
константа равновесия реакции будет:
- Kпзнак равнопCcпDdпАапBб{\ displaystyle K_ {p} = {\ frac {p_ {C} ^ {c} \, p_ {D} ^ {d}} {p_ {A} ^ {a} \, p_ {B} ^ {b} }}}
| где: | |
| Kп{\ displaystyle K_ {p}} | = константа равновесия реакции |
|---|---|
| а{\ displaystyle a} | = коэффициент реагента А{\ displaystyle A} |
| б{\ displaystyle b} | = коэффициент реагента B{\ displaystyle B} |
| c{\ displaystyle c} | = коэффициент продукта C{\ displaystyle C} |
| d{\ displaystyle d} | = коэффициент продукта D{\ displaystyle D} |
| пCc{\ displaystyle p_ {C} ^ {c}} | = парциальное давление, возведенное в степеньC{\ displaystyle C}c{\ displaystyle c} |
| пDd{\ displaystyle p_ {D} ^ {d}} | = парциальное давление, возведенное в степеньD{\ displaystyle D}d{\ displaystyle d} |
| пАа{\ displaystyle p_ {A} ^ {a}} | = парциальное давление, возведенное в степеньА{\ displaystyle A}а{\ displaystyle a} |
| пBб{\ displaystyle p_ {B} ^ {b}} | = парциальное давление, возведенное в степеньB{\ displaystyle B}б{\ displaystyle b} |
Для обратимых реакций изменения общего давления, температуры или концентрации реагентов будут сдвигать равновесие в пользу правой или левой стороны реакции в соответствии с принципом Ле Шателье . Однако кинетика реакции может либо противодействовать, либо усиливать сдвиг равновесия. В некоторых случаях кинетика реакции может быть решающим фактором, который следует учитывать.
Что такое парциальное давление
Характеристикой состояния компоненты смеси идеальных газов является парциальное давление.
Определение
Парциальное давление $(p_{i\ })$ $i-го$ газа в смеси называется давление, которое создавал бы этот газ, если кроме него все остальные газы отсутствовали, но объем и температура остались неизменными.
\
где $V-\ $объем смеси, $T$- температура смеси. Здесь необходимо отметить, что вследствие равенства средних кинетических энергий молекул смесей можно говорить о равенстве температур всех компонент смесей в состоянии термодинамического равновесия.
Давление смеси идеальных газов p определяется по закону Дальтона:
\
Следовательно, парциальное давление, можно выразить как:
\
Что такое парциальный объем
Другим важным параметром состояния смеси газов является парциальный объем.
Определение
Парциальным объемом $V_i$ $i-го$ газа в смеси называют тот объем, который имел бы газ, если бы из смеси убрали все остальные газы, при неизменной температуре и объеме:
\
Для смеси идеальных газов выполняется закон Амага:
\
Действительно, если из (6) выразить ${\nu }_i$ и подставить в (4), получим:
\
Парциальный объем можно рассчитать по формуле:
\
Параметры состояния смеси идеальных газов подчиняются уравнению Менделеева — Клайперона в следующем виде:
\
где все параметры в уравнении (9) относятся к смеси в целом.
Или уравнение (9) иногда удобнее записывать в таком виде:
\
где $R_{sm}=\frac{R}{{\mu }_{sm}}=R\sum\limits^N_{i=1}{\frac{g_i}{{\mu }_i}}$ — удельная газовая постоянная смеси.
Пример 1
Задание: При 290 K в сосуде объемом 1$м^3$ содержится 0,5${\cdot 10}^{-3}$ кг водорода и 0,10${\cdot 10}^{-3}$ кг гелия. Найдите парциальное давление гелия и давление смеси.
Решение:
Найдем количество молей для каждой компоненты смеси, используя формулу:
\
тогда количество молей водорода в смеси, если с помощью таблицы Менделеева находим, что молярная масс водорода ${\mu }_{H_2}=2\cdot {10}^{-3}\frac{кг}{моль}$:
\
Проведем расчет:
\
Аналогично рассчитаем ${\nu }_{He}\ ({\mu }_{He}=4\cdot {10}^{-3}\frac{кг}{моль}):$
\
Используем уравнение Менделеева — Клайперона найдем парциальные давления каждой компоненты смеси:
\
Тогда давление водорода:
\
Рассчитаем парциальное давление водорода:
\
Аналогично найдем парциальное давление гелия:
\
Давление смеси найдем как сумму давлений составляющих ее компонент:
\
Следовательно, давление смеси равно:
$p=602,5+60,25=662,75$ (Па)
Ответ: Парциальное давление гелия равно $60,25$ Па, давление смеси $662,75$ Па.
Пример 2
Задание: В состав смеси газов входят 0,5 кг $O_2$ и 1 кг $CO_2$. Определить объем, который займет смесь газов при давлении в одну атмосферу, если газы считать идеальными. Температуру смеси принять равной 300 К.
Решение:
Найдем массу смеси газов:
\
Следовательно,
\
Найдем массовые компоненты смеси $g_i$:
\
\
Рассчитаем газовую постоянную смеси:
\
\
Выражение для объема смеси, полученное из уравнение Менделеева — Клайперона:
\
Проведем вычисления объема, учитывая, что p=1атм.=$\ {10}^5Па$:
\
Ответ: Смесь занимает объем 0,9 $м^3.$
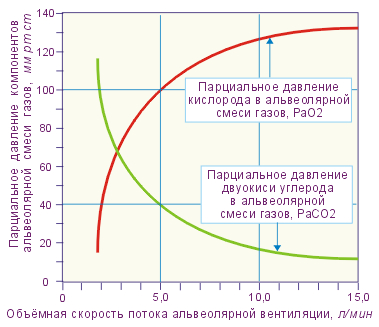
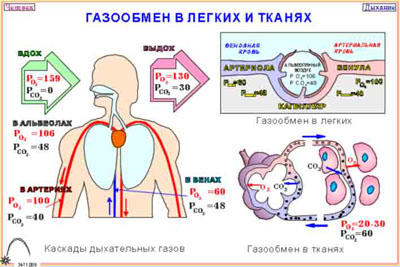
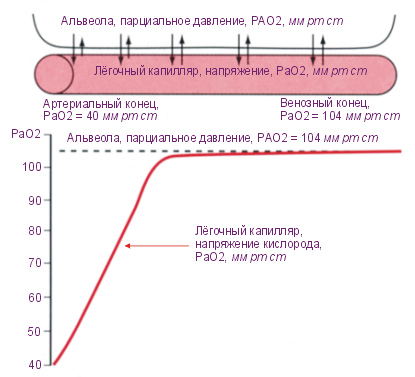
Насыщение тканей газами
При погружении (увеличении давления) парциальное давление газов в дыхательном тракте — выше чем в тканях. Таким образом газы насыщают кровь, а через кровоток насыщаются все ткани организма. Скорость насыщения различна для разных тканей и характеризуется «периодом полунасыщения», т.е. временем, в течение которого при постоянном давлении газа разница парциальных давлений газа и тканей уменьшается вдвое. Обратный процесс называют «рассыщением», он происходит при всплытии (уменьшении давления). В этом случае парциальное давление газов в тканях выше, чем давление в газа в легких, идет обратный процесс — газ из крови выделяется в легких, кровь с уже меньшим парциальным давлением циркулирует по организму, из тканей газы переходят в кровь и снова по кругу. Газ всегда движется от большего парциального давления к меньшему.
Принципиально важно, что разные газы имеют разную скорость насыщения/рассыщения, обусловленную их физическими свойствами. Растворимость газов в жидкостях тем больше, чем выше давление
В случае, если количество растворенного газа больше предела растворимости при данном давлении — происходит выделение газа, в том числе концентрация в виде пузырьков. Мы это наблюдаем каждый раз, как вскрываем бутылку газированной воды. Так как скорость выведения газа (рассыщения тканей) ограничена физическими законами и газовым обменом через кровь, слишком быстрое падение давления (быстрое всплытие) может привести к образованию пузырьков газа непосредственно в тканях, сосудах и полостях организма, нарушая его работу вплоть до летального исхода. Если давление падает медленно, то организм успевает вывести «лишний» газ за счет разницы парциальных давлений
Растворимость газов в жидкостях тем больше, чем выше давление. В случае, если количество растворенного газа больше предела растворимости при данном давлении — происходит выделение газа, в том числе концентрация в виде пузырьков. Мы это наблюдаем каждый раз, как вскрываем бутылку газированной воды. Так как скорость выведения газа (рассыщения тканей) ограничена физическими законами и газовым обменом через кровь, слишком быстрое падение давления (быстрое всплытие) может привести к образованию пузырьков газа непосредственно в тканях, сосудах и полостях организма, нарушая его работу вплоть до летального исхода. Если давление падает медленно, то организм успевает вывести «лишний» газ за счет разницы парциальных давлений.
Для расчетов этих процессов используются математические модели тканей организма, наиболее популярной является модель Альберта Бюльмана, которая учитывает 16 видов тканей (компартментов) со временем полунасыщения/полурассыщения от 4 до 635 минут.
Наибольшую опасность представляет инертный газ, имеющий максимально большое абсолютное давление, чаще всего это — азот, который составляет основу воздуха и не участвует в метаболизме. По этой причине основные расчеты в массовом дайвинге проводятся по азоту, т.к. воздействие кислорода в плане насыщения на порядки меньше, при этом оперируют понятием «азотная нагрузка», т.е. остаточное количество растворенного в тканях азота.
Таким образом, насыщение тканей зависит от состава газовой смеси, давления и продолжительности его воздействия. Для начальных уровней дайвинга практикуются ограничения по глубине, продолжительности погружения и минимальному времени между погружениями, заведомо не допускающие ни при каких условиях насыщения тканей до опасных уровней, т.е. бездекомпрессионные погружения, и даже в этом случае принято выполнять «остановки безопасности» .
«Продвинутые» дайверы используют дайв-компьютеры, которые динамически рассчитывают насыщение по моделям в зависимости от газа и давления, в том числе рассчитывают «компрессионный потолок» — глубину, всплытие выше которой потенциально опасно исходя из текущего насыщения. При сложных погружениях компьютеры дублируются, не говоря уже о том, что одиночные погружения как правило не практикуются.
Ацидоз и алкалоз
Если говорить понятным языком, анализ газов крови определяет, в достаточном ли количестве организм получает кислород. Также следует разобраться и с тем, что собой являют ацидоз и алкалоз. Эти патологии входят в число состояний, которые сигнализируют организму о полном истощении его защитных функций, как правило, это связано со сбоями в кислотно-щелочном балансе.
При этом ацидоз бывает нескольких видов:
- Дыхательный ацидоз – это патология, которая характеризуется снижением кислотно-щелочного баланса и повышением давления углекислоты. Развитие патологического состояния происходит из-за уменьшения объема дыхания. Подобное состояние может развиваться на фоне пневмонии, обострения бронхиальной астмы или болезней бронхов обструктивного типа. С помощью анализа газов крови ставиться диагноз о наличии или отсутствии дыхательной недостаточности.
- Метаболический ацидоз – развивается из-за снижения количества бикарбонатов и увеличения количества выделяемой кислоты. Такое состояние может развиваться на фоне почечной недостаточности или сахарного диабета.
Алкалоз – это состояние, которое характеризуется увеличением кислотности крови в результате накопления щелочных элементов.
Выделяют несколько видов такого состояния:
- Компенсированный тип. Наблюдается нарушение кислотно-щелочного баланса, при котором кислотность находится в норме, и присутствуют только незначительные сдвиги в буферных системах.
- Некомпенсированный тип. Показатели кислотности выходят за пределы нормы, это чаще всего вызвано чрезмерным содержанием оснований и малым количеством физиологических и физико-химических механизмов регуляции кислотно-щелочного баланса.
При сдаче анализа крови на газы требуется соблюдать такие же правила подготовки, как и при сдаче общего анализа крови. За несколько дней до обследования из рациона следует исключить жирную, жареную, соленую и острую пищу.
Как правило, расшифровку результатов исследования пациент получает по прошествии нескольких дней, максимум недели. С результатами больной отправляется к доктору и уже под его руководством приступает к лечению.
источник
Подробное описание
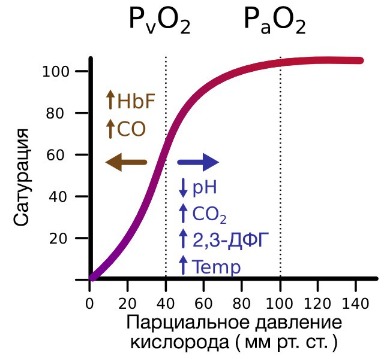
РаО2 наряду с двумя другими величинами (раСО2 и рН) составляют такое понятие как “газы крови” (Arterial blood gases – ABG(s)). Значение рaО2 зависит от многих параметров, главными из которых являются возраст и высота нахождения пациента (парциальное давление О2 в атмосферном воздухе). Таким образом, показатель рО2 должн быть интепретирован индивидуально для каждого пациента. Точные результаты для ABGs зависит от сбора, обработки и собственно анализа образца. Клинически важные ошибки могут возникать на любом из этих этапов, но измерение газов крови являются особенно уязвимыми к ошибкам возникающим до проведения анализа. Наиболее распространенные проблемы включают в себя – забор не артериальной (смешанной или венозной) крови; – наличие воздушных пузырьков в пробе; – недостаточное или чрезмерное количество антикоагулянта в образце; – задержка проведения анализа и хранение образца всё это время неохлажденным.
Надлежащий образец крови для анализа ABG содержит, как правило,1-3 мл артериальной крови, взятой пункционно анаэробно из периферической артерии в специальный контейнер из пластика, с помощью иглы малого диаметра. Пузырьки воздуха, которые могут попасть во время отбора пробы, должны быть незамедлительно удалены. Воздух в помещении имеет раО2 около 150 мм рт.ст. (на уровне моря) и раСО2 практически равное нулю. Таким образом, воздушные пузырьки, которые смешиваются с артериальной кровью сдвигают (увеличивают) раО2 к 150 мм рт.ст. и уменьшают (снижают) раСО2.
Если в качестве антикоагулянта используется гепарин и забор производится шприцем а не специальным контейнером, следует учитывать рН гепарина, который равен приблизительно 7,0. Таким образом, избыток гепарина может изменить все три значения ABG (раО2, раСО2, рН). Очень малое количество гепарина необходимо, чтобы предотвратить свертывание; 0,05 – 0,10 мл разбавленного раствора гепарина (1000 ЕД / мл), будет противодействовать свертыванию приблизительно 1 мл крови, не влияя при этом на рН, раО2, раСО2. После промывки шприца гепарином, достаточное количество его обычно остается в мертвом пространстве шприца и иглы, чего хватает для антикоагуляции без искажения значений ABG.
После сбора, образец должен быть проанализирован в кратчайшие сроки. Если происходит задержка более 10 минут, образец должен быть погружен в контейнер со льдом. Лейкоциты и тромбоциты продолжают потреблять кислород в образце и после забора, и могут вызвать значительное падение раО2, при хранении в течение долгого времени при комнатной температуре, особенно в условиях лейкоцитоза или тромбоцитоза. Охлаждение позволит предотвратить любые клинически важные изменения, по крайней мере в течение 1 часа, за счёт снижения метаболической активности этих клеток.
Давление газа
Диаграмма давления паров по логлину для различных жидкостей
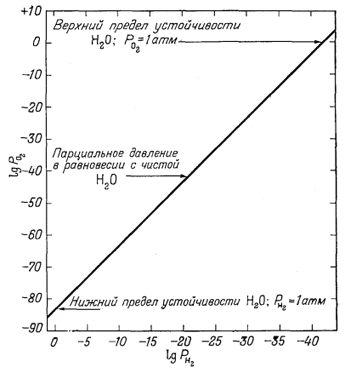
Давление пара является давление в пара в равновесии с его фазами не-пара (то есть, жидких или твердых). Чаще всего этот термин используется для описания жидкости тенденции «s , чтобы испариться . Это мера тенденции молекул и атомов к выходу из жидкости или твердого тела . Точка кипения жидкости при атмосферном давлении соответствует температуре, при которой давление ее пара равно окружающему атмосферному давлению, и ее часто называют нормальной точкой кипения .
Чем выше давление пара жидкости при данной температуре, тем ниже нормальная точка кипения жидкости.
На представленной диаграмме давления пара есть графики зависимости давления пара от температуры для различных жидкостей. Как видно из диаграммы, жидкости с самым высоким давлением пара имеют самую низкую нормальную температуру кипения.
Например, при любой заданной температуре хлористый метил имеет самое высокое давление пара среди всех жидкостей в таблице. Он также имеет самую низкую нормальную точку кипения (-24,2 ° C), где кривая давления паров хлористого метила (синяя линия) пересекает горизонтальную линию давления в одну атмосферу ( атм ) абсолютного давления пара
Обратите внимание, что на больших высотах атмосферное давление ниже, чем на уровне моря, поэтому точки кипения жидкостей снижаются. На вершине Эвереста атмосферное давление составляет примерно 0,333 атм, поэтому, используя график, температура кипения диэтилового эфира будет примерно 7,5 ° C по сравнению с 34,6 ° C на уровне моря (1 атм).
Анализ и определение индекса
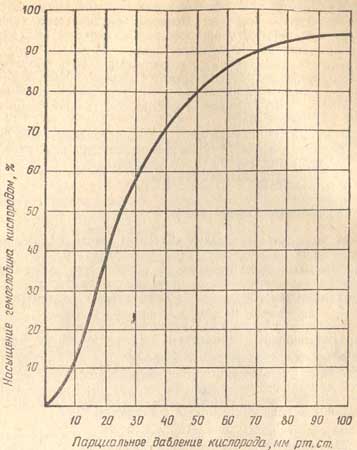
Для выяснения, каков же уровень насыщения кислородом, применяются два основных способа:
- Инвазивный (маркируется в документах SO2) — связанный с некоторыми болезненными ощущениями из-за необходимости забора крови пациента. Он является и весьма времязатратным, так как исследуемый материал отправляется в лабораторию, где анализируется, по нему даётся развёрнутая характеристика и только после этого результат попадает к лечащему врачу.
- Пульсоксиметрический (spo2) — процент сатурации определяется практически моментально и без необходимости сдавать анализ.
Принцип чудо-прибора
В основе работы пульсоксиметра лежит следующее наблюдение: в зависимости от насыщения гемоглобина кислородом он неодинаково реагирует на световые волны разной длины. На этом и базируется работа этого медицинского аппарата.
Посылаемый световой импульс в красном и инфракрасном спектрах поглощается кровью в зависимости от числа молекул О2, захваченных эритроцитом. Связанный гемоглобин принимает инфракрасный луч, а пустой, не связавший кислородных молекул, — красный. Непоглощённый свет регистрируется, прибор считает процент и выдаёт результат на экран. Вся операция занимает 15—20 сек.
На сегодняшний день имеется 2 способа измерить сатурацию: трансмиссионный и отражённый. В первом случае свет проходит сквозь ткани. Передающий элемент и принимающий детектор должны располагаться с разных сторон измеряемого объекта. Для подключения такого прибора и проведения исследования используются пальцы, ноздри, ушная раковина.
https://youtube.com/watch?v=e_zMPK06uhY
Во втором случае предполагается измерение не поглощённых, а отражённых от тканей световых волн. Применяется в случаях необходимости измерения на неудобных участках тела или там, где технически расположить датчики друг против друга не представляется возможным: туловище, плечо, голова, ноги. Оба способа выдают соотносительные результаты.
Недостатки пульсоксиметрии
В ряде случаев неинвазивная методика грешит неточностью при анализе. Это может быть связано с изменением работы в условиях чрезмерной освещённости, при движении объекта, при неправильном позиционировании датчиков. Особую сложность представляют случаи шока и гиповолемии у пациента, когда прибор не в состоянии уловить пульсовую волну.
Отравление угарным газом — случай, как правило, очевидный, может показать стопроцентную сатурацию, хотя гемоглобин насыщен не О2, а СО. Всё это необходимо учитывать при работе с прибором.
Показания к контролю кислорода в крови
Увы, но в РФ, как и на остальном постсоветском пространстве, пристальное внимание к этому индексу здоровья граждан уделяется только в отделениях реанимации, когда больной находится на грани между жизнью и смертью. Связано это как с дороговизной контрольно-измерительной аппаратуры, так и с недостаточной информированностью медперсонала всех уровней
На самом же деле показаний к применению контроля за оксигенацией организма немало:
- Дыхательная недостаточность вне зависимости от причин её вызывающих.
- Проведение наркоза как анестезиологического пособия.
- Послеоперационный период (ортопедия, сосудистая хирургия).
- Глубокая гипоксия при патологии внутренних органов, систем крови, аномалиях эритроцитов.
- Вероятность ночных остановок дыхания (апноэ), хроническая гипоксемия.
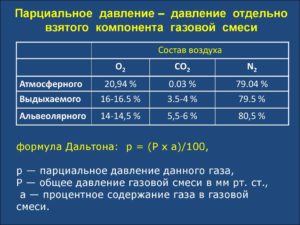
3.2. Парциальные давления в газовой смеси. Закон Дальтона
Газоваясмесь находится в состоянии равновесия,если концентрации компонентов и еёпараметры состояния во всём объёмеимеют одинаковые значения. При этомтемпература всех газов, входящих всмесь, одинакова и равна температуресмеси Тсм.
Вравновесном состоянии молекулы каждогогаза рассеяны равномерно по всему объёмусмеси, то есть имеют свою определённуюконцентрацию и, следовательно, своёдавление рi,Па, которое называется парциальным.Оно определяется следующим образом.
Парциальноедавление равно давлению данногокомпонента при условии, что он одинзанимает весь объём, предназначенныйдля смеси при температуре смеси Тсм.
Позакону английского химика и физикаДальтона, сформулированному в 1801 году,давление смеси идеальных газов рсмравно сумме парциальных давлений еёкомпонентов рi
, (2)
гдеn– число компонентов.
Выражение(2) также называется закономпарциальных давлений.
3.3. Приведённый объём компонента газовой смеси. Закон Амага
Поопределению приведённым объёмом i-гокомпонента газовой смеси Vi,м3,называется объём, который один этоткомпонент мог бы занимать при условии,что его давление и температура будутравны давлению и температуре всейгазовой смеси.
Законфранцузского физика Амага, сформулированныйпримерно в 1870 году, гласит: суммаприведённых объёмов всех компонентовсмеси равна объёму смеси Vсм
,м3. (3)
3.4. Химический состав газовой смеси
Химическийсостав газовой смеси может задаватьсятремяразличнымиспособами.
Рассмотримгазовую смесь, состоящую из nкомпонентов. Смесь занимает объём Vсм,м3,имеет массу Мсм,кг, давление рсм,Па и температуру Тсм,К. Также число молей смеси равно Nсм,моль. При этом масса одного i-гокомпонента mi,кг, а число молей этого компонента νi,моль.
Очевидно, что:
, (4)
. (5)
Используя длярассматриваемой смеси закон Дальтона(2) и Амага (3) можно записать:
, (6)
, (7)
гдерi– парциальное давление i-гокомпонента, Па; Vi– приведённый объём i-гокомпонента, м3.
Однозначнохимический состав газовой смеси можетбыть задан либо массовыми, либо мольными,либо объёмными долями её компонентов:
, (8)
, (9)
, (10)
гдеgi,kiи ri– массовая, мольная и объёмная долиi-гокомпонента смеси соответственно(безразмерные величины).
Очевидно, что:
,,. (11)
Частона практике химический состав смесизадаётся не долями i-гокомпонента, а его процентами.
Например,в теплотехнике приближённо принимается,что сухой воздух состоит из 79 объёмныхпроцентов азота и 21 объёмного процентакислорода.
Процентi-гокомпонента в смеси вычисляется путёмумножения его доли на 100.
Для примера с сухимвоздухом будем иметь:
, . (12)
где и –объёмные доли азота и кислорода в сухомвоздухе; N2и О2– обозначение объёмных процентов азотаи кислорода соответственно, % (об.).
Примечание:
Пользуясьопределением объёмной доли (10)и законом Амага (3) можем записать:
, (13)
гдеVi– приведённый объём i-гокомпонента, м3;νi– число молей i-гокомпонента, моль; –объём одного моля i-гокомпонента при давлении смеси рсми температуресмеси Тсм,м3/моль.
Иззакона Авогадро (см. п. 2.3 данногоприложения) следует, что при одинаковыхтемпературе и давлении один моль любогогаза (компонента смеси) занимает одини тот же объём. В частности, при Тсми рсмэто будетнекоторый объём V1,м3.
Сказанноепозволяет записать равенство:
. (14)
Подставляя(14)в (13)получаем требуемое:
. (15)
2)Объёмные доли компонентов газовой смесиможно рассчитать, зная их парциальныедавления. Покажем это.
Рассмотримi-ыйкомпонент идеальной газовой смеси вдвух различных состояниях: когда оннаходится при своём парциальном давлениирi;когда он занимает свой приведённыйобъём Vi.
Уравнениесостояния идеального газа справедливодля любых его состояний, в частности, идля двух, названных выше.
В соответствиис этим, и учитывая определение удельногообъёма, можем записать:
, (16)
и
,(17)
гдеRi– газовая постоянная i-гокомпонента смеси, Дж/(кг·К).
Последеления обоих частей (16)и (17)друг на друга получаем требуемое:
. (18)
Из(18)видно, что парциальные давлениякомпонентов смеси можно рассчитать поеё химическому составу, при известномобщем давлении смеси рсм
Практическое заключение
Понимание этих тезисов позволяет придать осмысленность многим даваемым на курсах ограничениям и правилам, что совершенно необходимо как для дальнейшего развития, так и для правильного их нарушения.
Нитрокс рекомендован к использованию при обычных погружениях, ибо он снижает азотную нагрузку на организм даже если Вы остаетесь полностью в пределах ограничений рекреационного дайвинга, это лучшее самочувствие, больше удовольствия, легче последствия. Однако, если Вы собираетесь нырять глубоко и часто — надо помнить не только о его преимуществах, но и о возможной кислородной интоксикации. Всегда лично проверяйте уровни кислорода и определяйте свои лимиты.
Азотное отравление — наиболее вероятная из проблем, с которыми можно столкнуться, всегда будьте внимательны к себе и партнеру.
Отдельно хотелось бы обратить внимание, что прочтение данного текста не означает, что читатель освоил полный набор информации для понимания работы с газами при сложных погружениях. Для практического применения этого совершенно недостаточно
Это только стартовая точка и базовое понимание, не более того.
Всегда оставайтесь в пределах своих знаний и физических возможностей! Удачи!