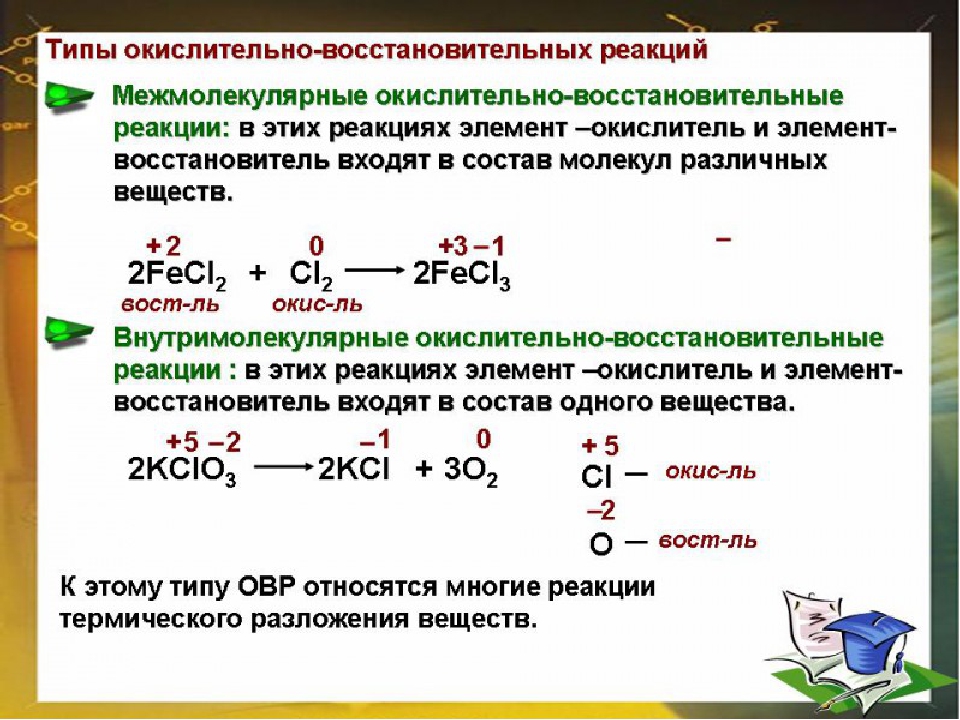
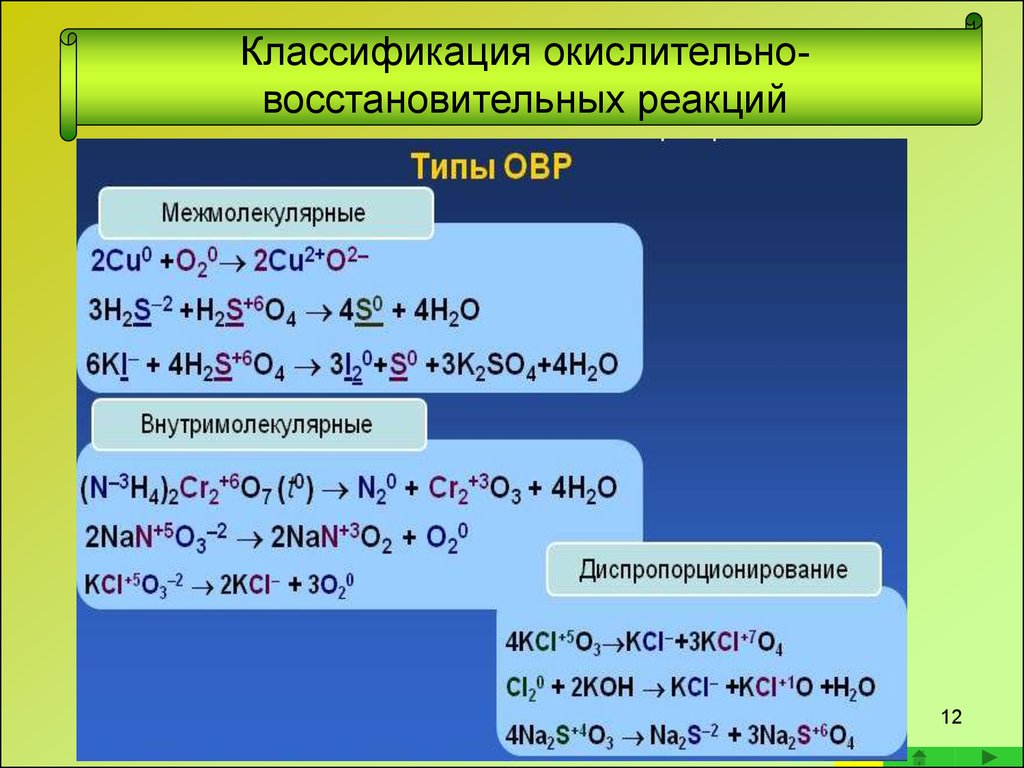
Восстановление
Первоначально термин «восстановление» был синонимом раскисления, то есть лишения вещества кислорода. Однако со временем слово приобретало новое значение, под ним подразумевалось извлечение металлов из содержащих их соединений, а также любые химические превращения, при которых электроотрицательная часть какого-либо вещества заменяется положительно заряженным элементом, например, водородом.
Сложность осуществления процесса во многом зависит от химического сродства элементов в соединении. Чем оно слабее, тем легче осуществляется реакция. Обычно сродство слабее в эндотермических соединениях (при их образовании поглощается тепло). Их восстановление происходит достаточно просто. Яркий тому пример — взрывчатые вещества.
Для того чтобы пошла реакция с участием экзотермических соединений (образующихся с выделением тепла), нужно приложить сильный источник энергии, например, электрический ток.
Примеры
Окислительно-восстановительная реакция между водородом и фтором
-
- H2+F2→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
-
- F2+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal2{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
-
- O2+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
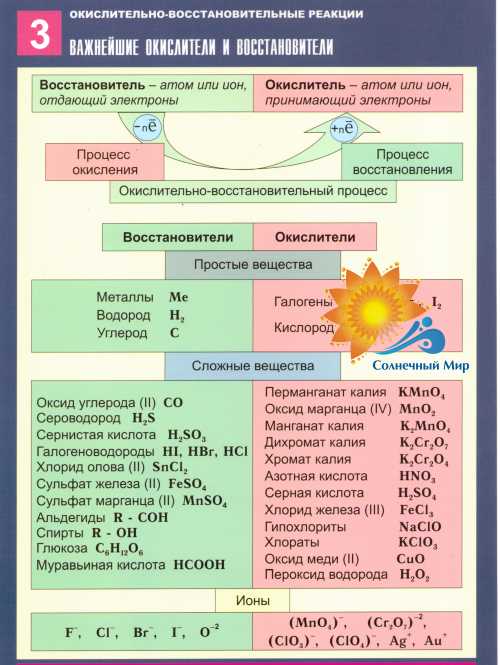
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
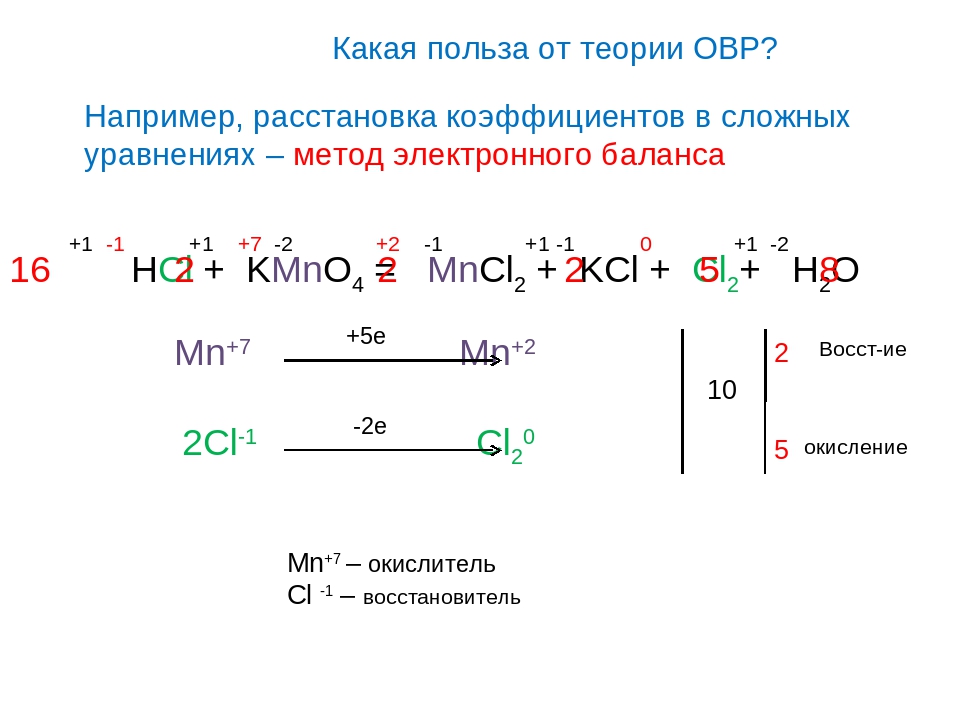
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ
Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений.
Первый пример
Как выполнить задание, связанное с ОВР? Примеры, предлагаемые на выпускных экзаменах в 9 классе, не подразумевают добавления формул веществ. Ребятам, как правило, необходимо определить коэффициенты и вещества, поменявшие значения валентности.
Рассмотрим те ОВР (реакции), примеры которых предлагаются выпускникам 11-х классов. Школьники должны самостоятельно дополнить уравнение веществами и только после этого путем электронного баланса расставить коэффициенты:
H2O2 + H2SO4 +KMnO4 = Mn SO4 + O2 + …+…
Для начала расставим в каждом соединении степени окисления. Так, в пероксиде водорода у первого элемента она соответствует +1, у кислорода -1. В серной кислоте следующие показатели: +1, +6, -2 (в сумме получаем нуль). Кислород является простым веществом, поэтому у него нулевой показатель степени окисления.
В перманганате калия, а также в сульфате марганца (2) получаем следующие значения:
K+Mn+7O4-2, Mn+2S+6O4-2
Расставив значения у элементов, предложенных в задании, необходимо закончить ОВР. Примеры таких взаимодействий аналогичны, поэтому при решении нужно выявить атомы (ионы), которые проявляют окислительные и восстановительные свойства.
Так, в качестве одного из недостающих продуктов реакции будет выступать соль калия, а именно сульфат. Вторым веществом является вода, так как процесс протекает с участием серной кислоты, обладающей гигроскопичными свойствами.
Следующим же этапом будет составление электронного баланса данного процесса:
- 2O – отдает 2 электрона =O25 (восстановитель);
- Mn+7принимает 5 электронов = Mn+2 2 (окислитель).
В процессе расстановки коэффициентов, обязательно суммируем атомы серы, получаем готовое уравнение процесса:
5H2O2 + 3H2SO4 +2KMnO4 = 2Mn SO4 + 5O2 + 8H2O + K2SO4

Стандартные восстановители
Самый древний и распространенный восстановитель – уголь. Он смешивается с рудными окислами, при накаливании из смеси выделяется кислород, соединяющийся с углеродом. В итоге образуется порошок, гранулы или сплав металла.

Другой обыкновенный восстановитель – водород. С его помощью также можно добывать металлы. Для этого окислы забиваются в трубку, через которую пропускают струю водорода. В основном такой метод применяют к меди, свинцу, олову, никелю или кобальту. Можно применить его и для железа, но восстановление будет неполным и образуется вода. Та же проблема наблюдается при попытках воздействия водородом на окислы цинка, к тому же она усугубляется летучестью металла. Калий и некоторые другие элементы вообще не восстанавливаются с помощью водорода.
Электролиз , как окислительно-восстановительный процесс
Окислительно-восстановительные реакции могут происходить и при участии электрического тока. Например, если расплавить поваренную соль, то происходит расщепление кристаллической решетки на ионы: 2NaCl ⇄ Na+ + Cl- При этом образуются катион натрия и анион хлора. Если затем опустить в расплав электроды постоянного электрического тока, происходит следующее. Направляясь к катоду, катион натрия получает с него один электрон, т. е. происходит восстановление: Na+ + e—→Na
Следовательно, катод, на котором имеется постоянный избыток электронов, является восстановителем. К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, атом хлора отдает электрон, т. е. окисляется: Сl— — е— → Сl Таким образом, а н о д, на котором постоянный недостаток электронов, является окислителем. Итак, всякий электролиз есть окислительно-восстановительный процесс, протекающий под действием электрического тока. (Запишите) В связи с тем что при электролизе в реакции принимает участие электрический ток, окислительно-восстановительный процесс приобретает ряд особенностей. Например, при электролизе водных растворов солей в процессе принимает участие вода. Так, электролиз раствора поваренной соли протекает по несколько иной схеме, нежели электролиз расплава. В растворе, помимо диссоциации, соли, протекает весьма слабо диссоциация воды: Н2O ⇄ Н+ + OH— Таким образом, в растворе образуется два вида катионов (Na+ и Н+) и два вида анионов (Сl— и ОН—). В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, он активнее, а значит, и легче отдает электроны. Если же речь идет (как в данном случае) о принятии электронов на катоде, то ион натрия, наоборот, будет труднее принимать электроны, чем ион водорода, и, следовательно, на катоде будет восстанавливаться не металлический натрий, а водород: Н+ + е— → Н (0) Ионы же натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода. К аноду направятся анионы Сl— и ОН—. Эти анионы также неодинаковы. Анион Сl— легче отдает свой электрон, чем анион ОН-, поэтому на аноде будет окисляться хлор, превращаясь в нейтральные атомы хлора: Сl— — е— → Сl В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как Сl—, Вr—, I—, S2- и т. п., окисляются на аноде быстрее, чем гидроксильная группа.
Таким образом, при электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na+ и ОН—. Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.
■ 142. Почему при электролизе расплава NaCl можно получить металлический натрий, а при электролизе раствора NaCl era получить нельзя? 143. Чем объяснить, что в растворе при электролизе NaCl образуется щелочь NaOH? 144. Как осуществляется электролиз раствора KI? 145. В чем отличие процесса электролиза раствора СuСl2 от электролиза раствор а NaCl? (См. Ответ)
Способ наращивания металла на поверхности изделия электролитическим путем позволяет снимать точнейшие слепки и копии. Этот способ называется гальванопластикой.
Статья на тему Окислительно восстановительные реакции
Определение продуктов реакции в ОВР
1. Определить продукты реакции взаимодействия нитрита калия и дихромата калия в кислой среде?
KN+3O2+K2Cr2+6O7+H2S+6O4 → ?
- Поскольку в молекуле дихромата калия хром находится в максимальной степени окисления, дихромат калия играет роль окислителя.
- В нитрите калия азот находится в промежуточной степени окисления, поэтому, нитрит калия может играть как роль окислителя, так и роль восстановителя. Но, поскольку дихромат калия является сильным окислителем, то нитрит калия будет играть роль восстановителя.
- Согласно указанных выше типовых реакций, в кислой среде дихромат калия образует сульфат хрома, калий, взаимодействуя с серной кислотой, образует соль K2SO4, оставшиеся атомы водорода и кислорода образуют воду.
- Что касается нитрита калия, то, играя роль восстановителя, он, окисляясь, образует KNO3 (см. выше).
KN+3O2+K2Cr2+6O7+H2S+6O4 → KNO3+Cr2(SO4)3+K2SO4+H2O
2. Определить продукты реакции йодида калия с хлоратом калия в кислой среде?
KI-1+KCl+5O3+H2SO4 → ?
- йод в йодиде калия находится в низшей степени окисления, поэтому, он может только играть роль восстановителя;
- согласно выше указанным реакциям, анион йода окисляется в I2;
- в хлорате калия калий имеет степень окисления +5, и согласно выше указанных реакций, восстанавливается до KCl-1
- атомы калия и серной кислоты образуют сульфат калия K2SO4, а атомы водорода и кислорода — воду.
KI-+KCl+5O3+H2SO4 → 3I2+KCl-+3K2SO4+3H2O
3. Определить продукты реакции сероводорода с сульфатом натрия в кислой среде?
H2S-2+Na2S+4O3+H2SO4 → ?
- атом серы в молекуле сероводорода имеет низшую степень окисления, следовательно, — это вещество-восстановитель;
- атом серы в молекуле сульфита натрия имеет степень окисления +4 — это вещество-окислитель;
- согласно выше указанных реакций, сероводород будет окисляться до серы, а сульфит натрия в кислой среде будет восстанавливаться, также до серы;
- атомы натрия и серной кислоты образуют сульфата натрия Na2SO4;
- атомы кислорода и водорода образуют воду.
H2S-2+Na2S+4O3+H2SO4 → S+Na2SO4+H2O
Правила ОВР
Эквивалентный обмен электронов и атомный баланс.
Кислая среда
В кислой среде высвобождающиеся оксид-ионы связываются с протонами в молекулы воды; недостающие оксид-ионы поставляются молекулами воды, тогда из них высвобождаются протоны.
Там, где не хватает атомов кислорода, пишем столько молекул воды, сколько не хватает оксид-ионов.
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в сульфите калия имеет степень окисления +4, марганец в перманганате калия имеет степень окисления +7, серная кислота – среда протекания реакции.
Мараганец в высшей степени окисления – окислитель, следовательно, сульфит калия восстановитель.
Примечание: +4 – промежуточная степень окисления для серы, поэтому она может выступать как восстановителем, так и окислителем. С сильными окислителями (перманганат, дихромат) сульфит является восстановителем (окисляется до сульфата), с сильными восстановителями (галогенидами, халькогенидами) сульфит окислитель (восстанавливается до серы или сульфида).
Сера из степени окисления +4 переходит в +6 – сульфит окисляется до сульфата. Марганец из степени окисления +7 переходит в +2 (кислая среда) – перманганат ион восстанавливается до Mn2+.
2. Составляем полуреакции. Уравниваем марганец: Из перманганата высвобождаются 4 оксид-иона, которые связываются ионами водорода (кислая среда) в молекулы воды. Таким образом, 4 оксид-иона связываются с 8 протонами в 4 молекулы воды.
Другими словами, в правой части уравнения не хватает 4 кислорода, поэтому пишем 4 молекулы воды, в левой части уравнения – 8 протонов.
Семь минус два – плюс пять электронов. Можно уравнивать по общему заряду: в левой части уравнения восемь протонов минус один перманганат = 7+, в правой части марганец с зарядом 2+, вода электронейтральна. Семь минус два – плюс пять электронов. Все уравнено.
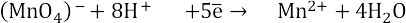
Уравниваем серу: недостающий оксид-ион в левой части уравнения поставляется молекулой воды, из которой впоследствии высвобожается два протона в правую часть.
Слева заряд 2-, справа 0 (-2+2). Минус два электрона.
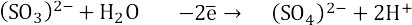
3. Суммарное уравнение электронного баланса. Умножаем верхнюю полуреакцию на 2, нижнюю на 5.
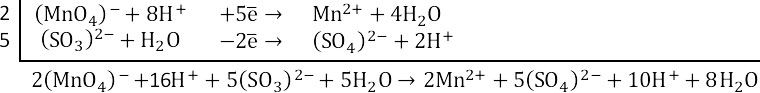
Сокращаем протоноы и воду.
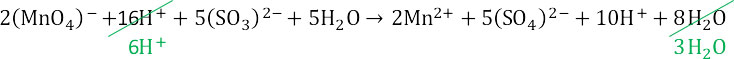
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия и марганца.
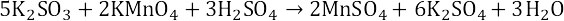
Щелочная среда
В щелочной среде высвобождающиеся оксид-ионы связываются молекулами воды, образуя гидроксид-ионы (OH– группы). Недостающие оксид-ионы поставляются гидроксо-группами, которых надо брать в два раза больше.
Там, где не хватает оксид-ионов пишем гидроксо-групп в 2 раза больше, чем не хватает, с другой стороны – воду.
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
Определяем степень окисления:
Висмут (III) с сильными окислителями (например, Cl2) в щелочной среде проявляет восстановительные свойства (окисляется до висмута V):
Так как в левой части уравнения не хватает 3 кислородов для баланса, то пишем 6 гидроксо-групп, а справа – 3 воды.
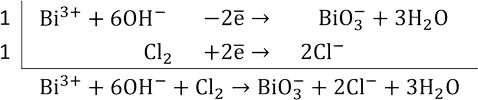
Итоговое уравнение реакции:

Нейтральная среда
В нейтральной среде высвобождающиеся оксид-ионы связываются молекулами воды с образованием гидроксид-ионов (OH– групп). Недостающие оксид-ионы поставляются молекулами воды. Из них высвобождаются ионы H+.
Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в персульфате калия имеет степень окисления +7 (является окислителем, т.к. высшая степень окисления), бром в бромиде калия имеет степень окисления -1 (является восстановителем, т.к. низшая степень окисления), вода – среда протекания реакции.
Сера из степени окисления +7 переходит в +6 – персульфат восстанавливается до сульфата. Бром из степени окисления -1 переходит в 0 – бромид ион окисляется до брома.
2. Составляем полуреакции. Уравниваем серу (коэффициент 2 перед сульфатом). Кислород уравнен.
В левой части заряд 2-, в правой части заряд 4-, присоединено 2 электрона, значит пишем +2
Уравниваем бром (коэффициент 2 перед бромид-ионом). В левой части заряд 2-, в правой части заряд 0, отдано 2 электрона, значит пишем –2
3. Суммарное уравнение электронного баланса.
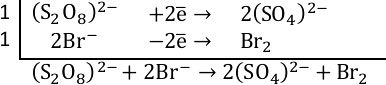
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия в сульфат калия, коэффициент 2 перед KBr и перед K2SO4. Вода оказалась не нужна – заключаем в квадратные скобки.

Первый пример
Разве ОВР — химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Баланс данного задания имеет следующий вид:
Fe(+3)+3e=Fe(0) 2
C(+2)-2e=C(+4) 3
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Основная статья: Окисление
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
- восстановитель — e− сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление
Основная статья: Восстановление
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
- окислитель + e− сопряжённый восстановитель.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Окислители и продукты их реакции
- Галогены:
Cl2 → HCl-1 Br2 → HBr-1 I2 → HI-1 HCl+1O → HCl-1 KCl+1O3 → KCl-1
- Сера:
H2S+6O4 → H2S-2 (с сильным восстановителем) H2S+6O4 → S (с слабым восстановителем) Na2S+4O3 → S (pH<7)
- Азот:
HN+5O3(конц) → N+4O2 (с слабым восстановителем) HN+5O3(конц) → N+2O (с сильным восстановителем) HN+5O3(разб) → N+2O (с слабым восстановителем) HN+5O3(разб) → N2+1O (с сильным восстановителем) HN+5O3(разб) → N-3H3 (с сильным восстановителем) KNO2 → N+2O (pH<7)
- Марганец:
KMn+7O4 → Mn+2SO4 (pH<7 - H2SO4разб) KMn+7O4 → Mn+4SO4 (pH=7 - H2O) KMn+4O4 → K2Mn+6O4 (pH>7 - KOH) Mn+4O2 → Mn+2SO4 (pH<7 - H2SO4разб)
- Хром:
K2Cr2O7 → Cr2+3(SO4)3 (pH<7 - H2SO4разб)
- Свинец:
Pb+4O2 → Pb+2(NO3)2 (pH<7)
- Олово:
Sn+4Cl4 → Sn+2Cl2
- Железо:
Fe+3Cl3 → Fe+2Cl2
Алгоритм разбора
Как правильно разбирать реакции ОВР? Химия школьного курса основывается на составлении электронного баланса между окислителем и восстановителем. Остановимся подробнее на последовательности действий школьников. Сначала необходимо поставить степени окисления у всех элементов, имеющихся в реакции
Для того чтобы успешно справиться с поставленной задачей, важно знать правила. Далее необходимо выявить те вещества, в которых после взаимодействия значения степеней окисления изменились
При составлении электронного баланса, с помощью знака «плюс» показывают число принятых частиц, а «минусом» показывают количество отданных электронов. Между ними определяется наименьшее общее кратное, затем вычисляются индексы. Завершающим этапом будет расстановка коэффициентов в ОВР. Химия неорганических и органических веществ тесно связана с данным типом взаимодействий, к тому же задания предлагаются школьникам на выпускных испытаниях в 9 и 11 классах.
Примеры
Окислительно-восстановительная реакция между водородом и фтором
-
- H2+F2→2H+1F−1{\displaystyle {\mathsf {{\stackrel {0}{\mbox{H}}}_{2}+{\stackrel {0}{\mbox{F}}}_{2}\rightarrow 2{\stackrel {+1}{\mbox{H}}}{\stackrel {-1}{\mbox{F}}}}}}
Разделяется на две полу-реакции:
1) Окисление:
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
2) Восстановление:
-
- F2+2e−→2F−{\displaystyle {\mathsf {{\mbox{F}}_{2}^{0}+2{\mbox{e}}^{-}\rightarrow 2{\mbox{F}}^{-}}}}
-
- H2−2e−→2H+{\displaystyle {\mathsf {{\mbox{H}}_{2}^{0}-2{\mbox{e}}^{-}\rightarrow 2{\mbox{H}}^{+}}}}
- S2−−2e−→S↓{\displaystyle {\mathsf {{\mbox{S}}^{2-}-2{\mbox{e}}^{-}\rightarrow {\mbox{S}}^{0}\downarrow }}}
- Al−3e−→Al3+{\displaystyle {\mathsf {{\mbox{Al}}^{0}-3{\mbox{e}}^{-}\rightarrow {\mbox{Al}}^{3+}}}}
- Fe2+−e−→Fe3+{\displaystyle {\mathsf {{\mbox{Fe}}^{2+}-{\mbox{e}}^{-}\rightarrow {\mbox{Fe}}^{3+}}}}
- 2Hal−−2e−→Hal2{\displaystyle {\mathsf {2{\mbox{Hal}}^{-}-2{\mbox{e}}^{-}\rightarrow {\mbox{Hal}}_{2}^{0}}}}
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
-
- O2+4e−→2O2−{\displaystyle {\mathsf {{\mbox{O}}_{2}^{0}+4{\mbox{e}}^{-}\rightarrow 2{\mbox{O}}^{2-}}}}
- Mn7++5e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{7+}+5{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Mn4++2e−→Mn2+{\displaystyle {\mathsf {{\mbox{Mn}}^{4+}+2{\mbox{e}}^{-}\rightarrow {\mbox{Mn}}^{2+}}}}
- Cr6++6e−→Cr{\displaystyle {\mathsf {{\mbox{Cr}}^{6+}+6{\mbox{e}}^{-}\rightarrow {\mbox{Cr}}^{0}}}}
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два метода уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ
Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений.
Метод электронного баланса
Баланс при окислительно-восстановительных реакциях всегда сохраняется. Это означает, что окислитель принимает ровно столько электронов, сколько было отдано восстановителем. Чтобы правильно составить уравнение окислительно-восстановительной реакции, нужно следовать такому алгоритму:
- Определить степени окисления элементов до реакции и после нее. Например, в реакции между азотной кислотой и фосфором в присутствии воды получается ортофосфорная кислота и оксид азота: HNO3 + P + H2O = H3PO4 + NO. У водорода во всех соединениях степень окисления +1, а у кислорода -2. У азота до начала реакции окислительное число равно +5, а после ее протекания +2, у фосфора – 0 и +5 соответственно.
- Отметить элементы, в которых окислительное число изменилось (азот и фосфор).
- Составить электронные уравнения: N+5 + 3e = N+2; Р- 5е = Р+5.
- Уравнять количество принятых электронов, подобрав наименьшее общее кратное число и вычислив множитель (цифры 3 и 5 являются делителями для числа 15, соответственно множитель для азота равен 5, а для фосфора 3): 5N+5+ (3 х 5)e = 5N+2; 3Р- 15е = 3Р+5.
- Сложить полученные полуреакции в соответствии с левой и правой частями: 5N+5 + 3Р = 5N+2 — 15е = 3Р+5. Если на этом этапе все сделано правильно, электроны сократятся.
- Переписать уравнение полностью, проставив коэффициенты согласно электронному балансу окислительно-восстановительной реакции:5HNO3 + 3P + H2O = 3H3PO4 + 5NO.
- Проверить, везде ли количество элементов до и после реакции остается одинаковым, и в случае необходимости добавить коэффициенты перед другими веществами (в данном примере не уравнялось количество водорода и кислорода, чтобы уравнение реакции выглядело правильно, нужно добавить коэффициент перед водой): 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO.
Такой несложный метод позволяет правильно расставить коэффициенты и не допустить путаницы.