Что несем в пункт приема
Цветные металлы — это распространенное сырье для производства.
Преобладающие цветные металлы
Медь. Самый востребованный и дорогостоящий из цветных металлов. Его можно найти в трансформаторных шинах, электрических проводниках, тросах.
Олово. Дороже меди почти в 4 раза. Ценится чистое олово, но чаще встречается оловосодержащий металлолом: отработанные подшипники, трубопроводы, предметы быта, посуда.
Алюминий. Из всего разнообразия цветного лома его сдают чаще всего. Алюминий подразделяется на вторсырье пищевого, электротехнического и профильного вида.
Свинец. Тяжелый металл, относящийся к средней ценовой категории. Он есть в аккумуляторах автомобилей, кабеле, деталях типографского оборудования.
Никель. Ценный дорогостоящий металл. В чистом виде сдается редко. Встречается в аккумуляторах, отработанных электродах, мельхиоровой посуде, нагревательных элементах бытовых приборов.
Цинк. Высоко ценится, особенно с малой дозой прочих металлических примесей. Содержится в запчастях автомобилей (бензобаки, крышки багажников, двери, глушители и др.).
Титан. Металл, применяемый в металлургической промышленности. Среди его источников: пришедшая в негодность запорная арматура, обрезь трубопроводов, колесные диски.
Среди редких цветных металлов и их сплавов самыми дорогостоящими считаются вольфрам, молибден и баббит.
История развития представлений о металлах
См. также: История производства и использования железа
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образования всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Лишь Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
Список металлов, известных науке
- литий;
- бериллий;
- натрий;
- магний;
- алюминий;
- калий;
- кальций;
- скандий;
- титан;
- ванадий;
- хром;
- марганец;
- железо;
- кобальт;
- никель;
- медь;
- цинк;
- галлий;
- рубидий;
- стронций;
- иттрий;
- цирконий;
- ниобий;
- молибден;
- технеций;
- рутений;
- родий;
- палладий;
- серебро;
- кадмий;
- индий;
- коперниций;
- цезий;
- барий;
- олово;
- железо;
- висмут;
- свинец;
- ртуть;
- вольфрам;
- золото;
- платина;
- осмий;
- гафний;
- германий;
- иридий;
- ниобий;
- рений;
- сурьма;
- таллий;
- тантал;
- франций;
- ливерморий.

Всего известно около 105 химических элементов, большая часть из которых — металлы. Последние являются очень распространенным элементом в природе, который встречается как в чистом виде, так и в составе всевозможных соединений.

Производство металлов
Подготовка руды
Основные статьи: Руда, Добыча полезных ископаемых, Обогащение руд, Металлургия и Металловедение
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространённые металлы, такие как железо, медь, олово, плавят с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Электронное строение
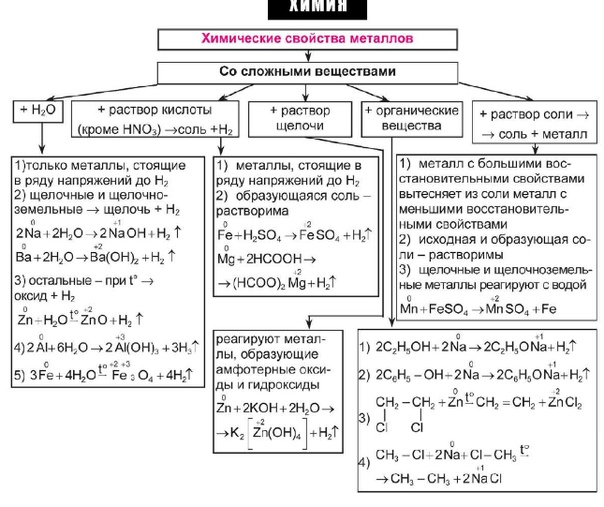
Все металлы имеют слабую связь валентных электронов (электронов внешнего энергетического уровня) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Примечания
- Строго говоря из-за амфотерности химических свойств полуметаллы (металлоиды) представляют собой обособленную группу, не относясь ни к металлам, ни к неметаллам; К группе металлов их можно отнести лишь условно.
- Ломоносов М. В. Основы металлургии и горного дела. — Санкт-Петербург: Императорская Академия Наук, 1763. — 416 с.
- Этимологический словарь русского языка. Вып. 10: М / Под общей редакцией А. Ф. Журавлёва и Н. М. Шанского. — М.: Изд-во МГУ, 2007. — 400 с. ISBN 978-5-211-05375-5
- (англ.) . Дата обращения 8 июня 2007.
- (англ.) . Дата обращения 8 июня 2007.
- Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- , с. 92.
- , с. 93—94.
- , с. 97.
- , с. 103.
Все о металлах – виды металлов и сплавов

Металлы и их сплавы – один из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Почти все металлы, имеющие промышленное значение, используются в виде сплавов. Все выплавляемое железо почти целиком идет на изготовление обычных и легированных сталей, а также чугунов. Дело в том, что сплавлением с некоторыми компонентами можно существенно улучшить механические, электрические, магнитные, термические свойства многих металлов.
Люди узнали о существовании металлов еще на заре цивилизации.
Они обнаружили, что некоторые камни, которые потом назвали рудой, при нагреве превращаются в блестящее вещество – металл, который при высокой температуре является жидкостью, а при комнатной – твердым телом.
Для практического применения металлов и изготовления металлических изделий (оружия, сельскохозяйственных орудий) люди научились обрабатывать металл. Возникли первые технологии обработки металлов.
Металлургия – область науки и техники и отрасль промышленности, охватывающие процессы получения металлов из руд или других материалов, изменения химического состава, структуры и свойств металлических сплавов, придания металлу определенной формы.
Металлургия является одной из наиболее динамично развивающейся отраслью мировой экономики. Развитие производственных мощностей металлургии заметно опережает динамику роста мировой индустрии. Конкуренция в отрасли велика, поставки импортной продукции нарастают. Так, по данным IISI, мировое производство стали за 2006 г.
составило 1,219 млрд т, что на 7,93% выше уровня предыдущего года.
В настоящее время существует базовая классификация видов металлов, определяющая три основные группы: черные, цветные и благородные металлы.Последние иногда включают в группу цветных металлов. Черные и цветные металлы применяются почти во всех сферах промышленного производства,благородные металлы служат еще и средством сохранения и накопления стоимости.
Черные металлы
Черные металлы – это железо и сплавы на его основе. Сюда входят все виды чугунов и сталей. К черным металлам также относят марганец и ванадий.
Процесс производства черных металлов называется черной металлургией. Литье чугуна и стали традиционно считалось одной из составляющихчастей индустриальной мощи любой крупной страны.
Производство тугоплавких металлов и ферросплавов также относится к области черной металлургии.
Цветные металлы
Другой вид металлов, цветные металлы, включает в себя большую часть металлических элементов таблицы Менделеева, за исключением черных металлов итяжелых трансурановых элементов. В эту группу относят всем знакомые медь и олово, алюминий и титан, тантал и цирконий, а также редкоземельные элементы.Цветные металлы делятся на две большие группы: тяжелые и легкие цветные металлы.
Тяжелые – это прежде всего медь, никель, свинец, цинк, а легкие -это алюминий, магний, титан. Для выплавки тегких цветных металлов требуется огромное колличество энергии, поэтому алюминий иногда называютметаллическим эквивалентом электрической энергии. Российская Федерация располагает практически всем набором цветных металлов и являетсяведущей мировой державой в области цветной металлургии.
Благородные металлы
Среди всех видов металлов благородные металлы обладают тем свойством, что практически не подвержены окислению.В группу благородных металлов входят золото, серебро, платина, палладий и другие металлы платиновой группы. Для всех благородных металлов характернаповышенная химическая устойчивость и блеск.
Основные области применения этого вида металлов – это ювелирная промышленность, электроника,медицина, изготовление защитных поверхностей и катализаторов.
Из-за своей высокой стоимости и устойчивости к воздействию внешней среды,металлы этой группы (в основном золото) используются как средство сбережения, государства накапливают золото как консервативную часть своихзолотовалютных резервов.
Металлы в периодической таблице
 Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Положение металлов
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева — металлы, справа — неметаллы. Это было бы очень просто и здорово, но есть исключения — Германий и Сурьма.
Важно! Это работает только в длинной системе, на коротком варианте таблицы Менделеева многие металлы оказываются справа. Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания
Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
 Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.
Признаки металлов
Различают следующие основные механические свойства:
- Твердость – определяет возможность одного материала противодействовать проникновению другого, более твердого.
- Усталость – количество, а также время циклических воздействий, которое может выдержать материал без изменения целостности.
- Прочность. Заключается в следующем: если приложить динамическую, статическую или знакопеременную нагрузку, то это не приведет к изменению формы, строения и размеров, нарушению внутренней и наружной целостности металла.
- Пластичность – это способность удерживать целостность и полученную форму при деформации.
- Упругость – это деформация без нарушения целостности под воздействием определенных сил, а также после избавления от нагрузки возможность к возращению первоначальной формы.
- Стойкость к трещинам – под влиянием внешних сил в материале они не образуются, а также сохраняется наружная целостность.
- Износостойкость – способность сохранять наружную и внутреннюю целостность при продолжительном трении.
- Вязкость – сохранение целостности при увеличивающихся физических воздействиях.
- Жаростойкость – противостояние изменению размера, формы и разрушению при воздействии высоких температур.
Нахождение в природе
В природе металлы встречаются в основном в рудах или соединениях, например, оксидах, солях, карбонатах. Перед использованием они проходят длительные этапы очистки. Многие металлы сопровождают месторождения минералов. Так, кадмий входит в состав цинковых руд, скандий и тантал соседствуют с оловом.
Сразу в чистом виде встречаются только инертные, то есть неактивные металлы. Из-за слабой подверженности к окислениям и коррозиям они завоевали звание благородных. К ним относят золото, платину, серебро, рутений, осмий, палладий и т. д. Благородные металлы очень пластичны и обладают характерным ярким блеском в готовых изделиях.

Металлы окружают нас повсюду. В больших количествах они находятся в земной коре. Самыми распространенными являются алюминий, железо, натрий, магний, кальций, титан и калий. Они содержатся в морской воде (натрий, магний), являются частью живых организмов. В теле человека металлы присутствуют в костях (кальций), в крови (железо), нервной системе (магний), мышцах (магний) и других органах.
Электронное строение
Все металлы имеют слабую связь валентных электронов (электронов внешнего энергетического уровня) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
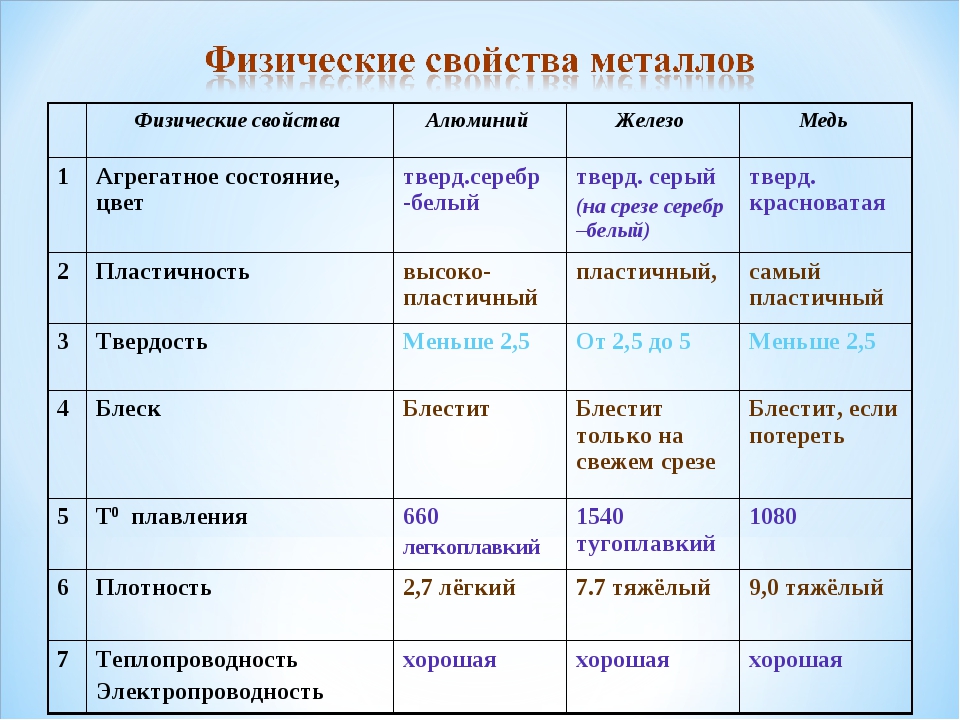
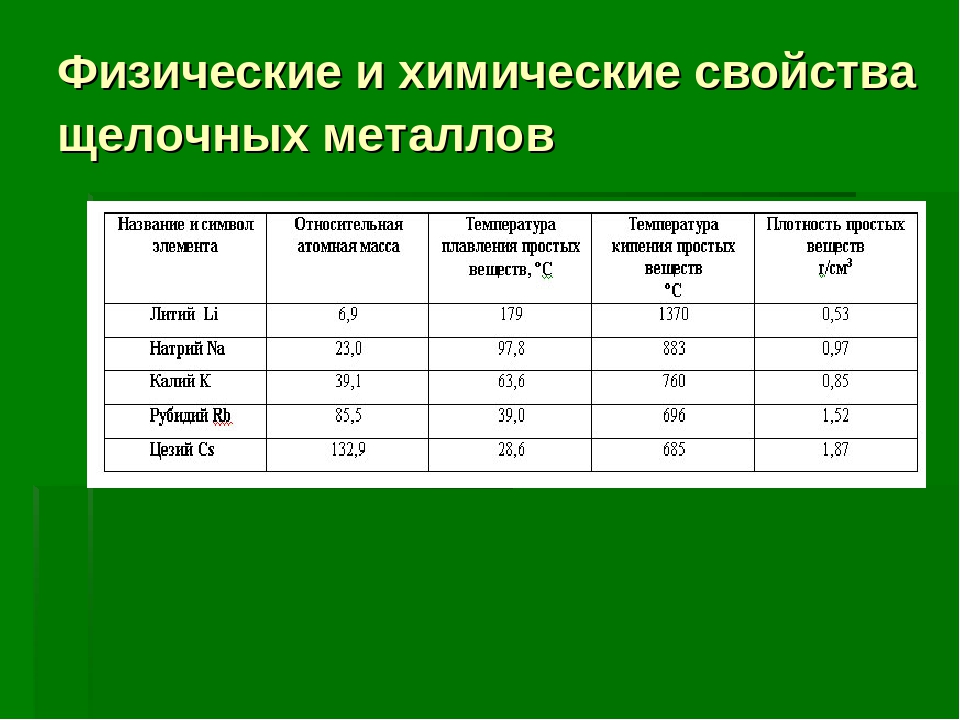
Физические свойства металлов
Твёрдость
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
| Твёрдость | Металл |
|---|---|
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть(тв.) |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
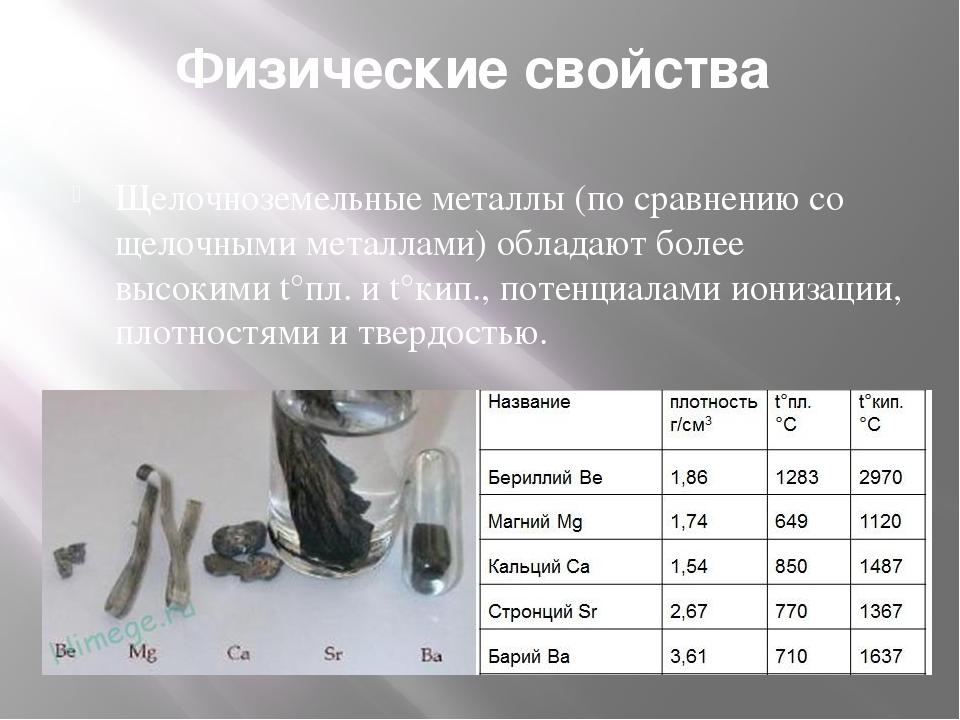
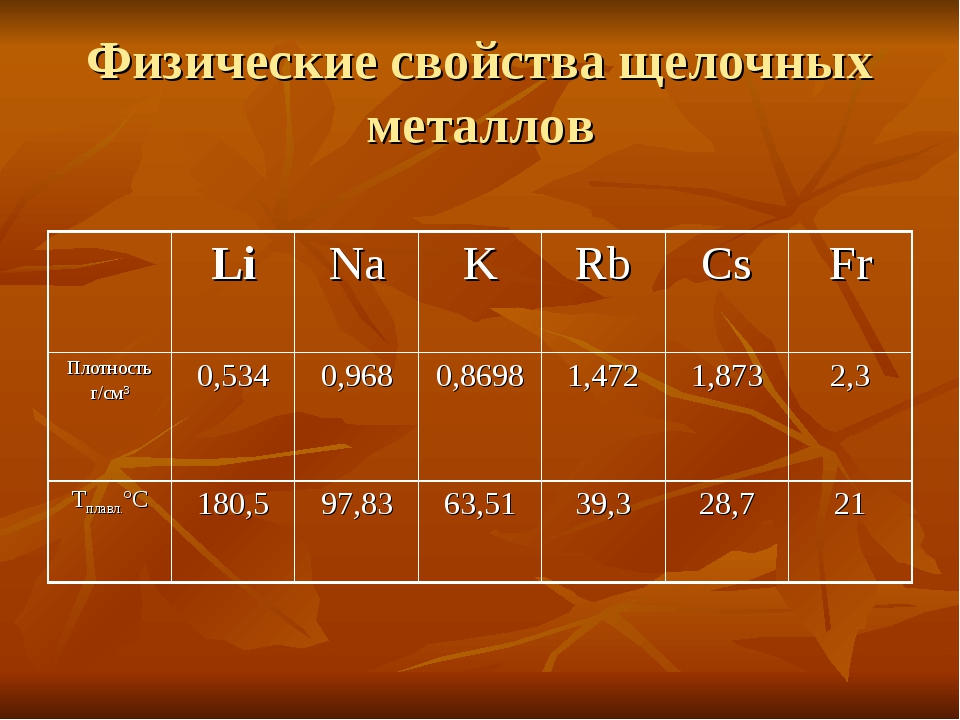
Температура плавления
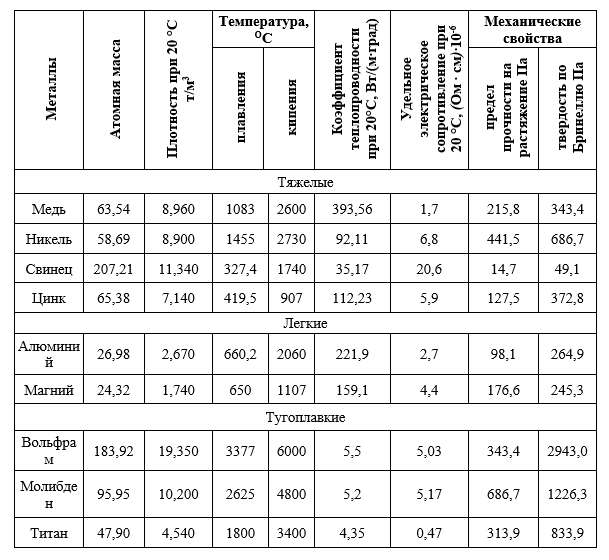
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
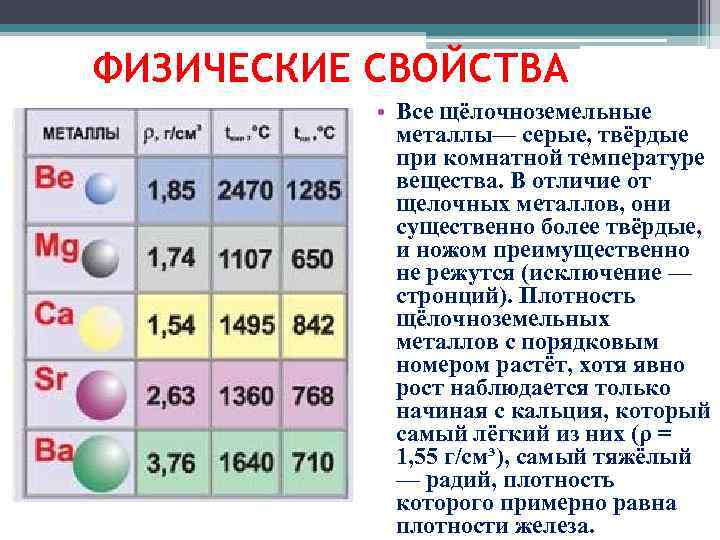
Плотность
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Физические свойства металлов
Твёрдость
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
| Твёрдость | Металл |
|---|---|
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть(тв.) |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температура плавления
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
Плотность
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Слова, образованные от глагола
От глаголов образуются слова со значением признака – прилагательные или причастия. Количество Н в этих частях речи определяют по разным правилам, поэтому сначала надо разобраться, как их различать:
Причастия
Вопрос о количестве Н в причастиях касается только страдательных залога, потому что в словообразовательной цепочке участвуют суффиксы с этой согласной. К глагольной основе на АТЬ/ЯТЬ присоединяется Н(Н), а к остальным основам (на ЕТЬ, ИТЬ, ЧЬ, ТИ и др) – ЕН(Н).
Чтобы быстро выяснить, сколько Н писать в СтПр, сначала определяют форму: в краткой всегда Н: прочитаННая – прочитаНа. Если форма СТПр полная, то анализируют другие критерии выбора:
- Вид. Совершенный – НН, несов – Н.
- Наличие приставки – есть – НН, нет – Н. Отрицательная приставка не учитывается, так как не влияет на вид и другие критерии. Приставку НЕ можно просто убрать.
- В причастном обороте всегда НН.
- В структуре слова есть ОВА/ЕВА или ИРОВА – НН. Кроме слов, в которых ОВ/ЕВ входят в корень (кованый, жеваный), если исключения употреблены без приставки и зависимых слов (подковаННый, немного жеваННый)
Увидев хотя бы один из перечисленных признаков, ставят НН.
Прилагательные
Образованные от глагола ИП пишут с одной Н. Такие слова обычно:
- от глаголов несовершенного вида;
- в предложении не имеют зависимых слов;
- в составе слова нет приставки.
Сравните:
- Крашеный забор вокруг усадьбы (полная форма, без приставки, несов. вид, без зависимых слов).
- Уже крашенный забор (появилось завис слово-уже).
- Покрашенный забор (приставка, сов. Вид).
Правило для причастий и прилагательных с Н и НН содержит список слов-исключений:
| -Н- | -НН- |
|
|
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
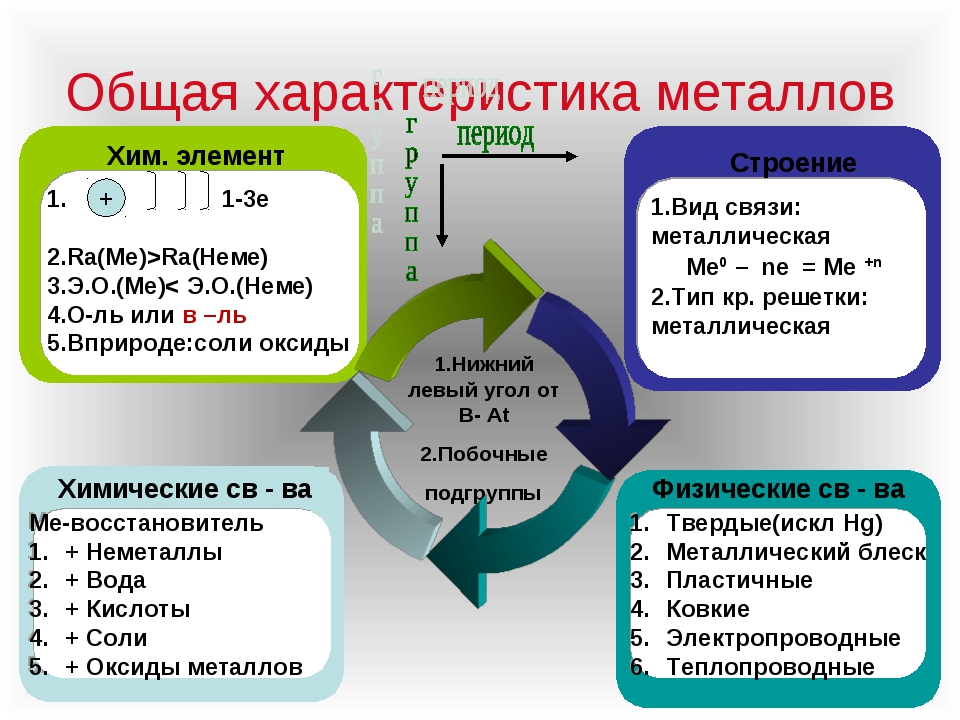
Общая характеристика металлов
Все химические элементы делятся на металлы и неметаллы. В основе такого деления лежит различие в строении атомов элементов.
Неметаллы в таблице Периодической системы Менделеева занимают правый верхний угол (желтые ячейки на рисунке внизу):
Все остальные, не желтые ячейки плюс водород и гелий — занимают металлы. Таким образом, неметаллы и металлы в Периодической таблице разделены условной диагональю бор-астат.
Химические элементы, расположенные в непосредственной близости от этой диагонали (алюминий, титан, галлий, германий, сурьма, теллур, астат), имеют двойственные свойства, реагируя в некоторых случаях, как металлы, а в других — как неметаллы.
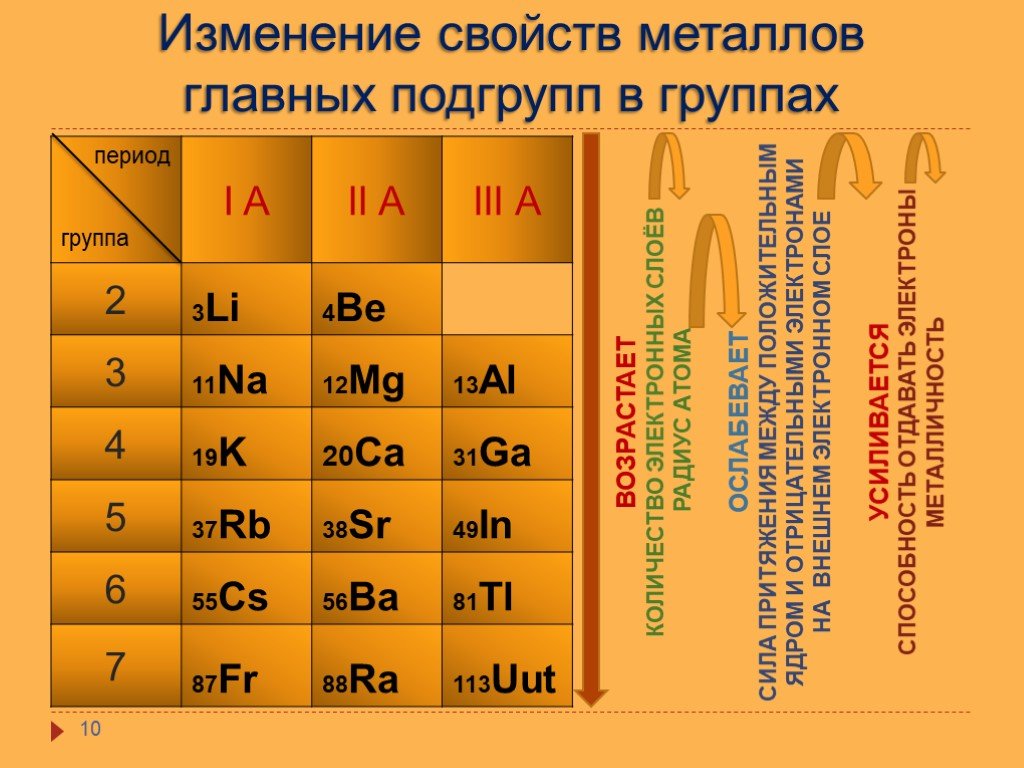
Закономерности расположения элементов в периодах (слева-направо):
- Радиус атома — уменьшается;
- Заряд ядра — увеличивается;
- Электроотрицательность — увеличивается;
- Кол-во электронов на внешнем слое — увеличивается;
- Прочность связи внешних электронов с ядром атома — увеличивается;
- Способность отдавать электроны — уменьшается.
Исходя из вышеуказанных закономерностей, нетрудно догадаться, что металлы находятся в начале каждого периода (слева), а неметаллы — в конце (справа).
Атомы металлов:
- как правило, на внешнем электронном слое имеют 1-3 электрона (4 электрона у Ge, Sn, Pb; 5 — у Sb, Bi; 6 — у Po);
- имеют больший размер атома и меньший заряд его ядра, по сравнению с неметаллами своего периода;
- имеют высокопрочную связь внешних электронов с ядром атома;
- легко расстаются с валентными электронами, превращаясь в катионы.
При н.у. все металлы (за исключением ртути) являются твердыми веществами, обладающими прочной кристаллической решеткой, образованной за счет металлических связей. Между узлами кристаллической решетки находятся свободные электроны, которые могут переносить теплоту и проводить электрический ток. Поэтому, в отличие от неметаллов, металлы хорошо проводят тепло и обладают высокой электропроводностью.
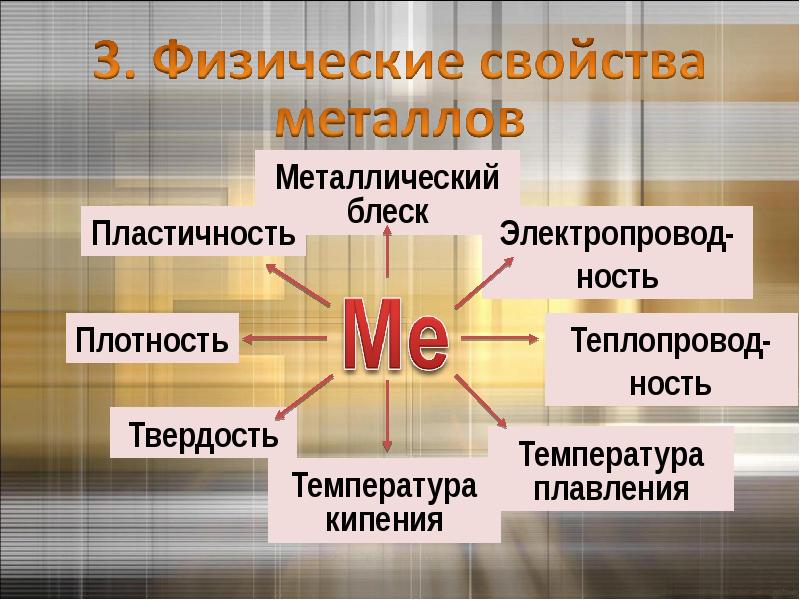
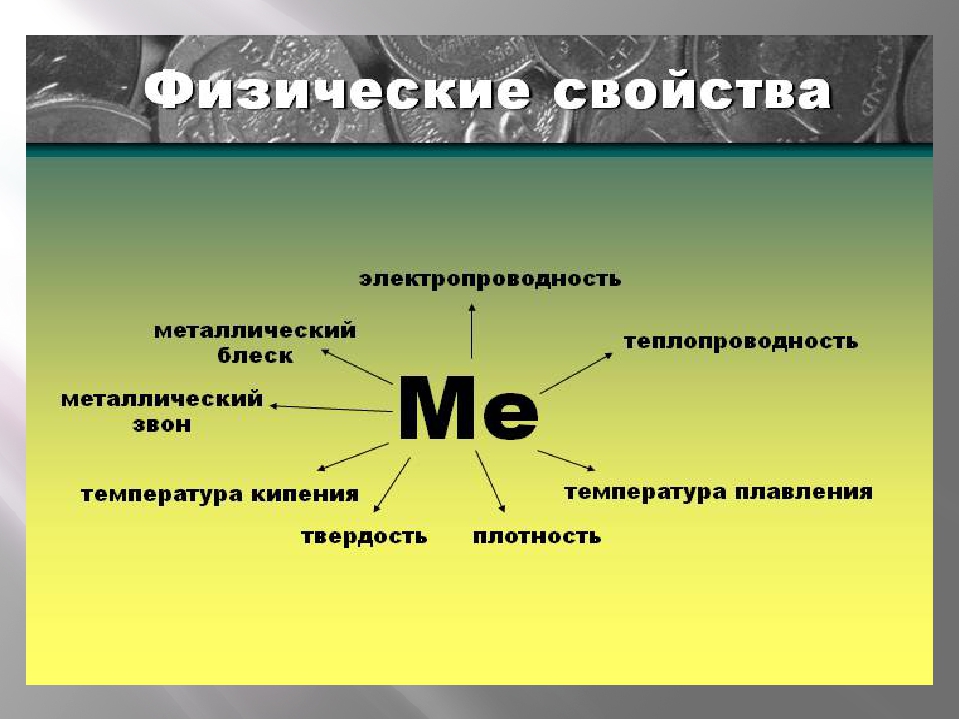
Физические свойства металлов:
- твердые вещества (кроме ртути);
- обладают характерным металлическим блеском;
- обладают высокой электро- и теплопроводностью;
- обладают высокими механическими качествами: упругостью, пластичностью, прочностью.
Самыми мягкими металлами являются калий и натрий (их можно резать ножом), самый твердый металл — хром (царапает стекло).
Самый легкоплавкий металл ртуть (-38,9°C), самый тугоплавкий — вольфрам (3380°C).
Самая низкая плотность у лития (0,59 г/см3), самая высокая — у осмия (22,48 г/см3).
Еще одной характерной особенностью металлов является их способность намагничиваться:
- ферромагнетики обладают высокой способностью намагничиваться даже под действием незначительного магнитного поля (железо, никель);
- парамагнетики проявляются слабую способность к намагничиванию (алюминий, хром);
- диамагнетики не намагничиваются (олово, медь).