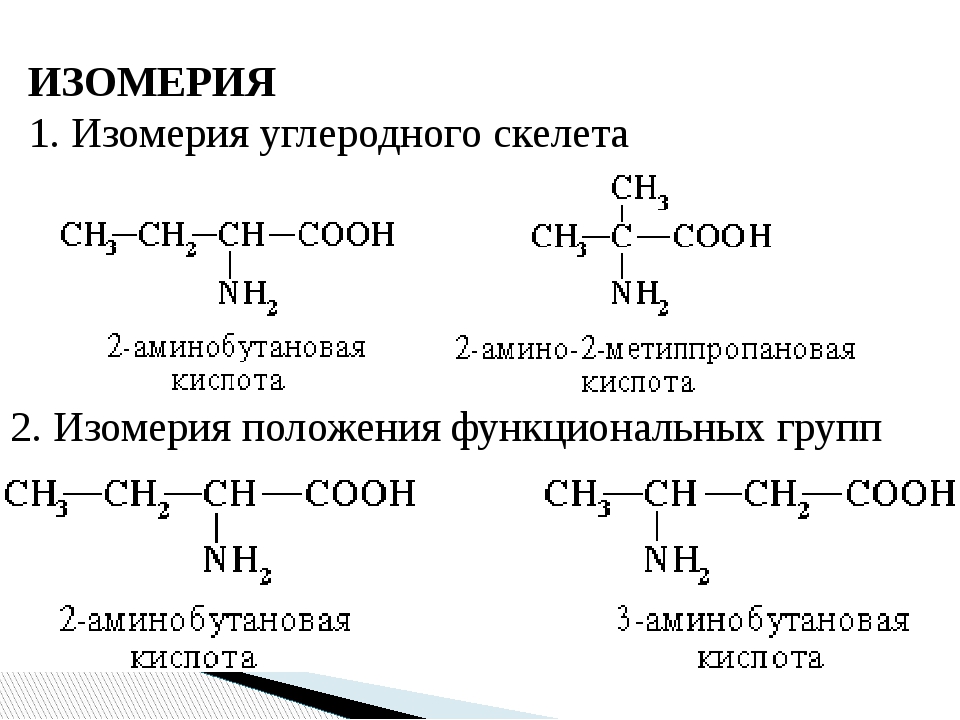
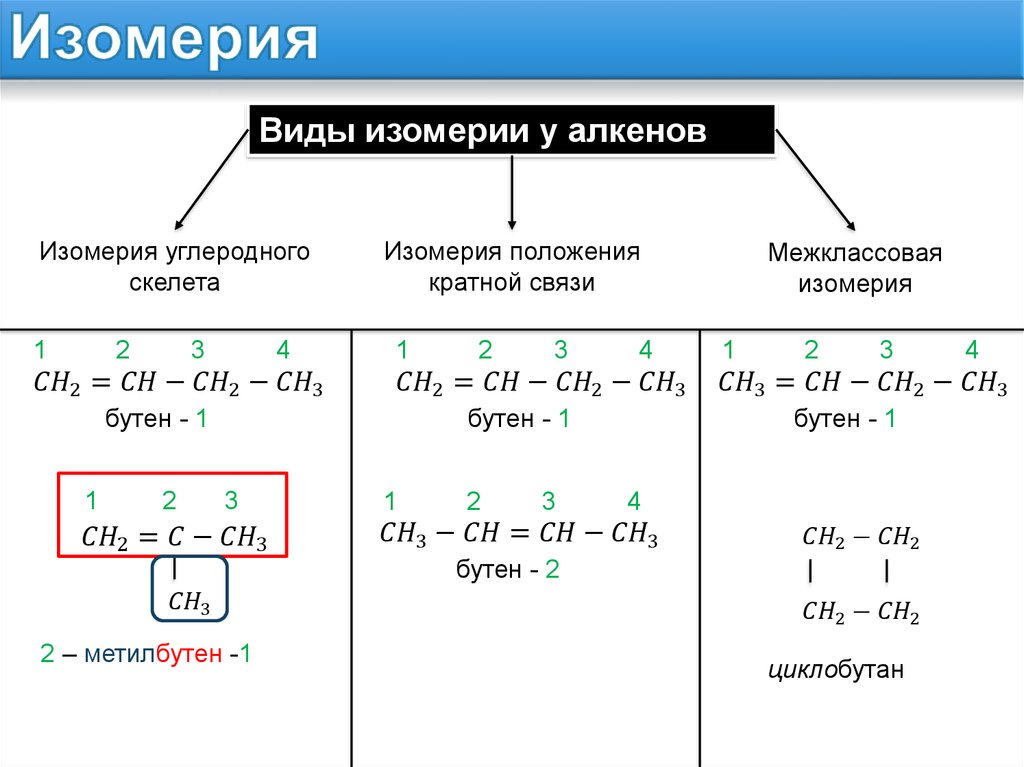
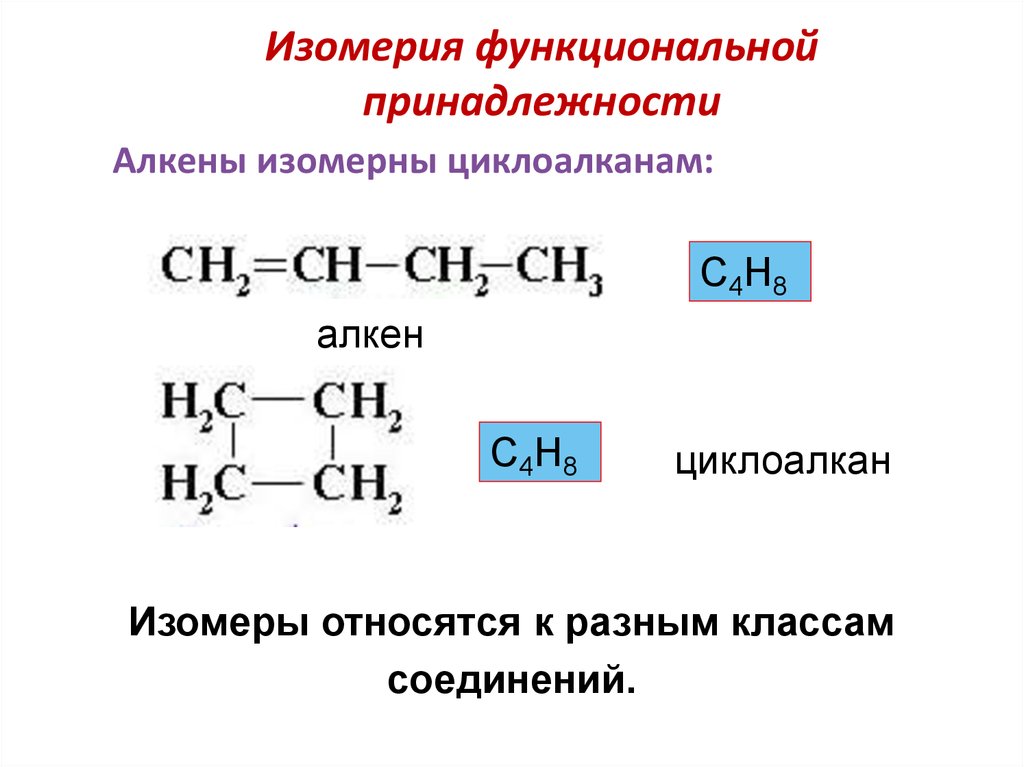
Изомерия положения.
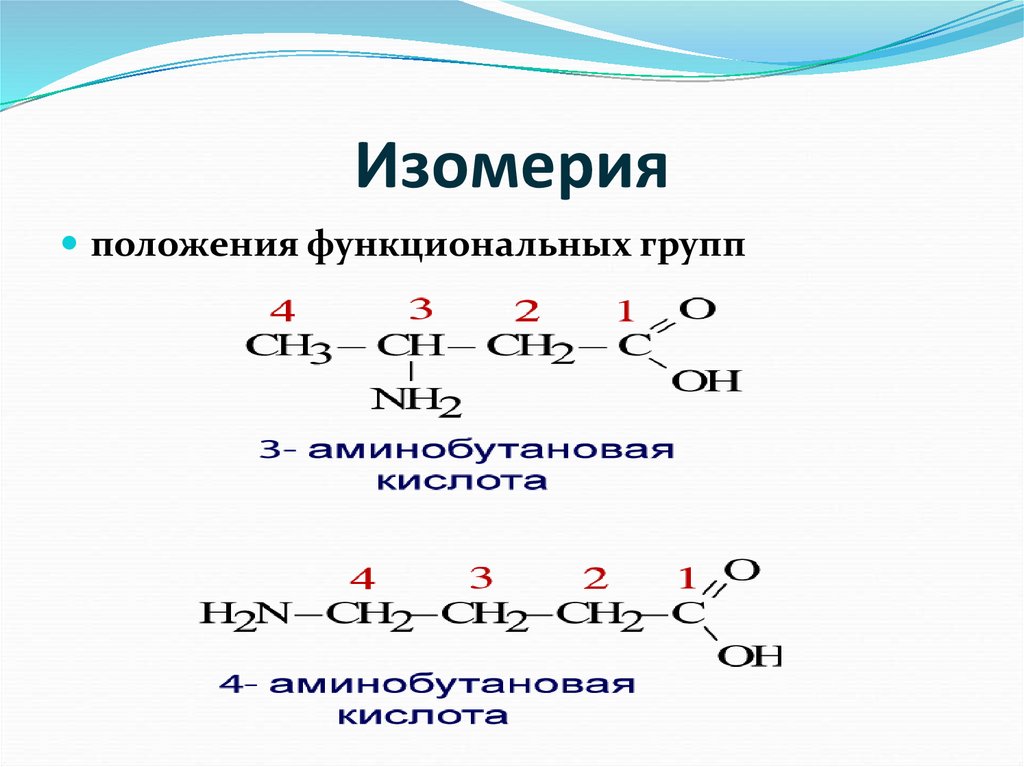
Другой вид структурной изомерии – изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета. Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами. На рис. 5 показаны три изомера для соединения С3Н8О, два из них – спирты, а третье – простой эфир

Рис. 5. Изомеры положения
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола (рис. 6):

Рис. 6. Изомеры бутена и дихлорбензола
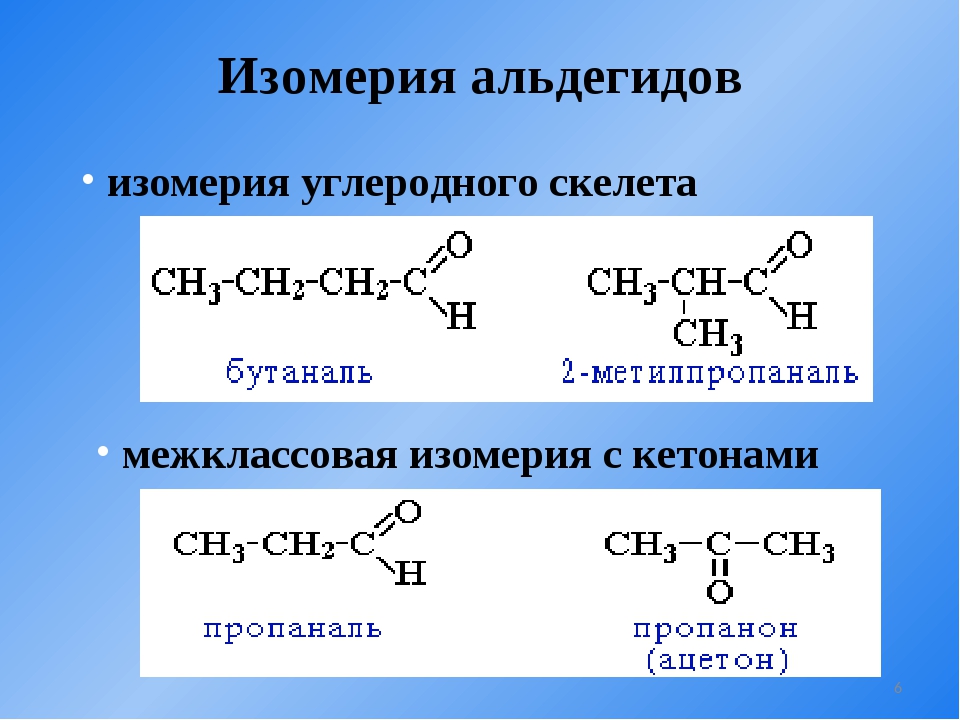
Иногда структурные изомеры сочетают признаки изомерии углеводородного скелета и изомерии положения (рис. 7).
Рис. 7. Сочетание двух видов структурной изомерии
В вопросах изомерии теоретические рассмотрения и эксперимент взаимосвязаны. Если рассмотрения показывают, что изомеров быть не может, то эксперименты должны показывать то же. Если вычисления указывают на определенное число изомеров, то их может быть получено столько же, или меньше, но не больше – не все теоретически рассчитанные изомеры могут быть получены, поскольку межатомные расстояния или валентные углы в предполагаемом изомере могут выходить за пределы допустимого. Для вещества, содержащего шесть групп СН (например, бензол), теоретически возможно 6 изомеров (рис. 8).

Рис. 8. Изомеры бензола
Первые пять из показанных изомеров существуют (второй, третий, четвертый и пятый изомеры были получены спустя почти 100 лет, после того, как было установлено строение бензола). Последний изомер, скорее всего, никогда не будут получен. Представленный в виде шестиугольника, он наименее вероятен, его деформации приводят к структурам в форме скошенной призмы, трехлучевой звезды, незавершенной пирамиды и сдвоенной пирамиды (незавершенному октаэдру). Каждый из этих вариантов содержит либо весьма различающиеся по величине связи С-С, либо сильно искаженные валентные углы (рис. 9):
Химические превращения, в результате которых структурные изомеры превращаются, друг в друга, называют изомеризацией.
Исторические сведения
В итоге дискуссии Ю. Либиха и Ф. Вёлера в 1823 году было установлено, что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO (англ.)русск.) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть, в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Пространственная
Данный вид классифицируется на две группы:
- оптическую или зеркальную изомерию;
- геометрическую изомерию.
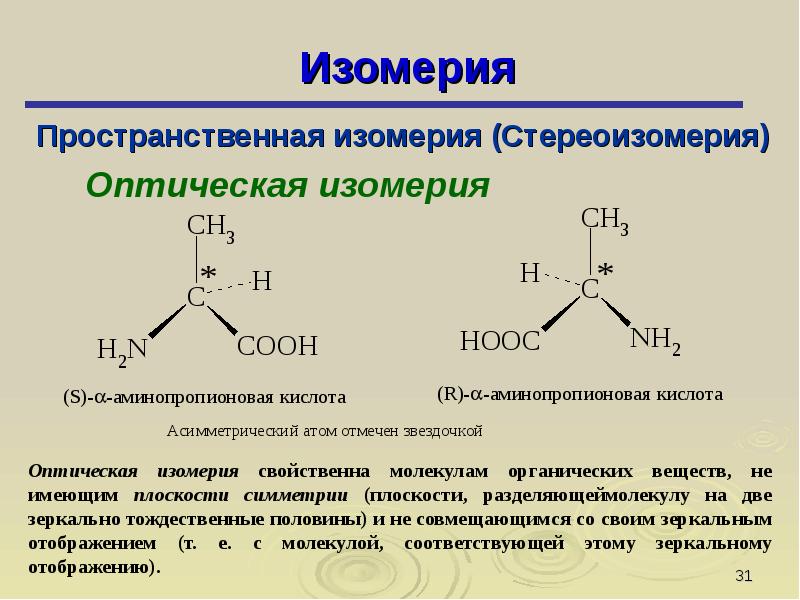
Суть оптической изомерии заключается в зеркальном отражении молекул. Изомеры будто отражают друг друга.
Геометрическая изомерия подразделяется на два типа:
- цис-изомерию – радикалы располагаются по одну сторону условной плоскости, разделяющей молекулу пополам;
- транс-изомерию – радикалы лежат по разным сторонам условной плоскости.
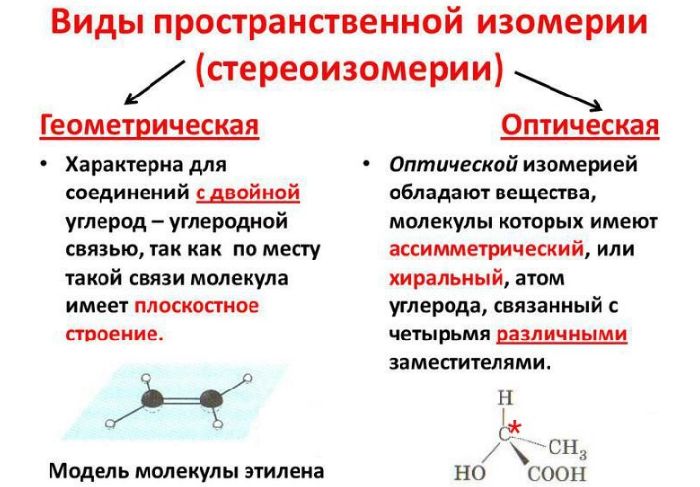
Рис. 3. Оптическая и геометрическая изомерия.
Изомеры пространственной изомерии называются стереоизомерами или пространственными изомерами. Зеркальные молекулы называются энантиомерами. Если молекулы не отражают друг друга, они называются диастереомерами или геометрическими изомерами.
Что мы узнали?
Изомерия – явление возникновения изомеров. Это вещества, одинаковые по составу, но разные по строению и положению в пространстве. Выделяют два вида – структурную и пространственную изомерию. Структурная изомерия отражает строение молекул. Она может проявляться по углеродному скелету, положению функциональной группы, кратных связей, заместителя. Также выделяют межклассовую структурную изомерию. Пространственная изомерия бывает оптической и геометрической. Она обусловлена особенностями положения молекулы в пространстве.
Изомеризация
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией
Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен
Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (−)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров это обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы.
Наименования изомеров
Как упоминалось ранее, структурные изомеры – это вещества, имеющие сходную формулу структуры вещества, но отличаются по формуле молекулы. Такие соединения имеют классификацию, которая соответствует особенностям их свойств, строения и положения атомов в молекуле изомера, отличия в количестве функциональных групп, валентных связях, наличии атомов определенного элемента в веществе и т.д. Названия структурных изомеров получают различными способами. Рассмотрим это на примере 3-метилбутанола 1, как представителя спиртов.
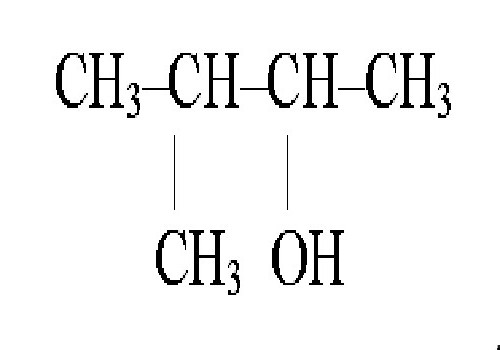
В случае со спиртами при получении названия спиртов все начинается с выбора цепи углерода, которая является главенствующей, проводят нумерацию, цель которой – это присвоение группе ОН наименьшего, возможного номера, с учетом порядка. Само название начинают составлять с заместителя в цепи углеродов, затем следует название главной цепи, а после добавляется суффикс –ол, а цифрой указывается углеродный атом, связанный с группой ОН.
Пространственная изомерия (стереоизомерия)
Основная статья: Стереоизомеры
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Для обозначения пространственных изомеров разных типов разработана стереохимическая номенклатура, собранная в разделе E номенклатурных правил ИЮПАК по химии[источник не указан 3511 дней].
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерия (оптическая изомерия)
Основная статья: Оптическая изомерия
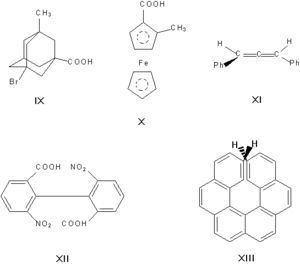
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идёт об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
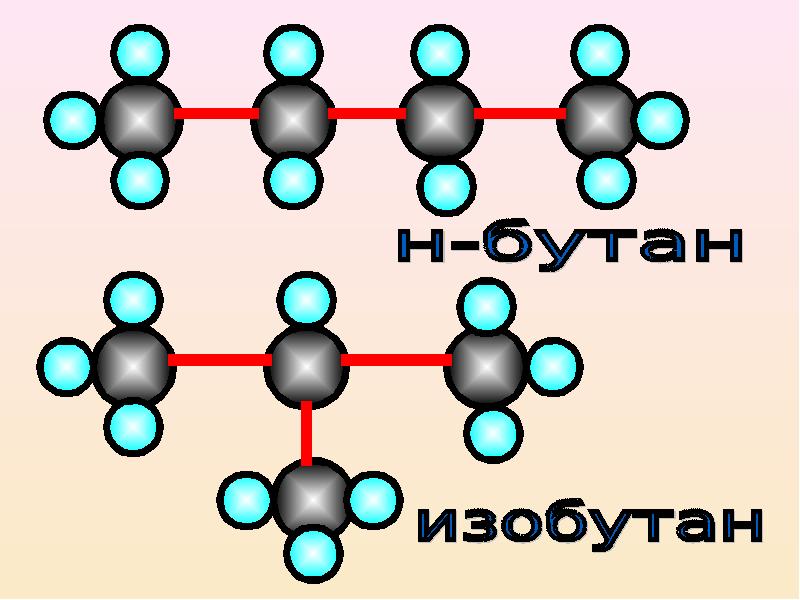
Изомерия углеводородного скелета.
Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С4Н10 (бутан) возможно существование двух изомеров, для пентана С5Н12 – трех изомеров, для гексана С6Н14 – пяти (рис.2):
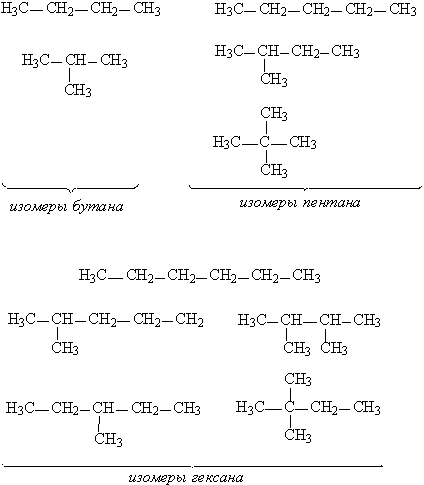
Рис. 2. Изомеры простейших углеводородов
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С7Н16 существует девять изомеров, для углеводорода С14Н30 – 1885 изомеров, для углеводорода С20Н42 – свыше 366 000.
В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую (рис. 3). Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение:
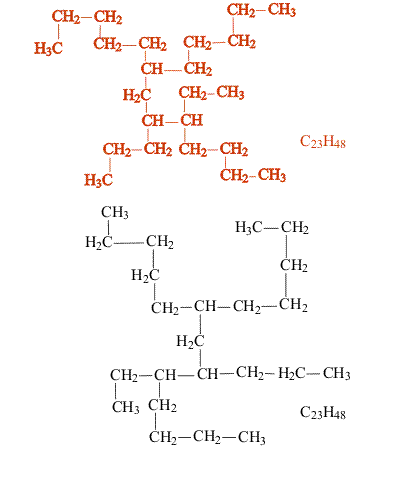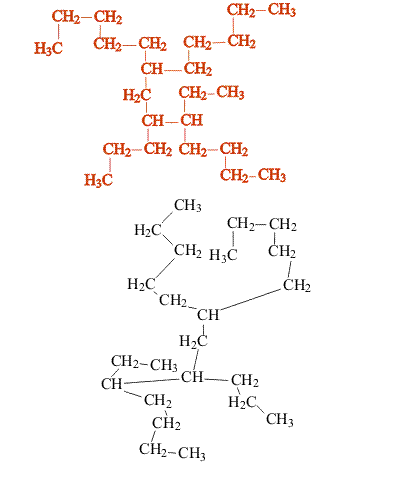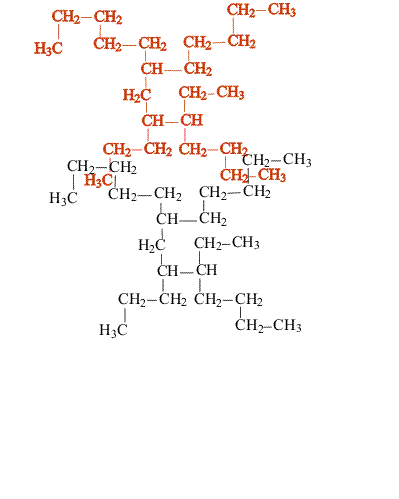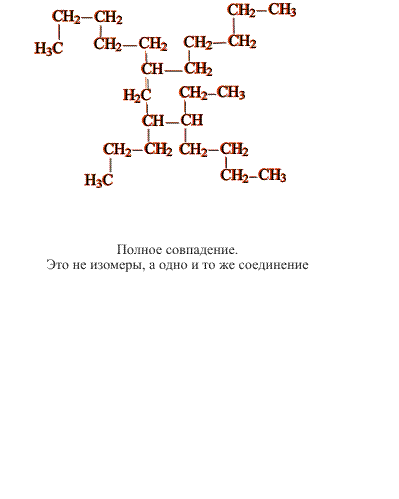
Изомеры, отличающиеся структурой скелета, обычно имеют разные физические свойства (температура плавления, температура кипения и т.п.), что позволяет отделить один от другого. Изомерия такого типа существует и у ароматических углеводородов (рис. 4):
Рис. 4. Ароматические изомеры