Другие предшественники глюкозы
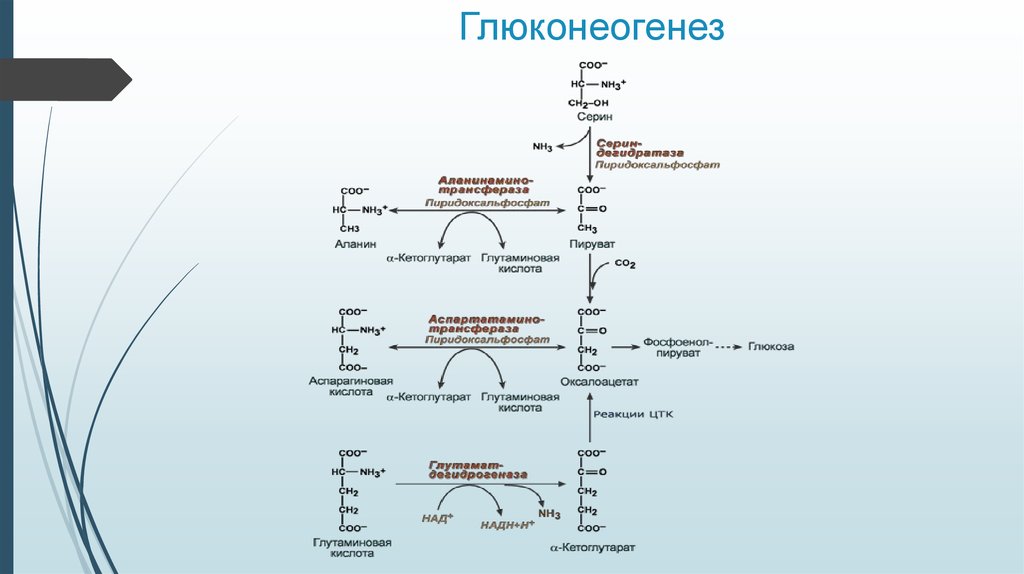
Описанный выше биосинтетический путь образования глюкозы относится к синтезу глюкозы не только из пирувата, но также 4-, 5- и 6-углеродных промежуточных соединений цикла трикарбоновых кислот. Цитрат, изоцитрат, α-кетоглутарат, , сукцинат, фумарат и малат — все промежуточные продукты цикла трикарбоновых кислот могут окисляться до оксалоацетата. Некоторые или все атомы углерода большей части аминокислот могут быть катаболизированы в пируват или промежуточные соединения цикла трикарбоновых кислот. Поэтому эти аминокислоты могут подвергнуться превращению в глюкозу и называются . Аланин и глутамин — важнейшие молекулы, переносящие аминогруппы в печень из других тканей — служат особенно важными глюкогенными аминокислотами у млекопитающих. После того, как эти аминокислоты отдают свои аминогруппы в митохондриях печени, их углеродные скелеты (пируват и α-кетоглутарат соответственно) вовлекаются в глюконеогенез. Аминокислоты образуются при распаде белков мышц и соединительной ткани, их включение в глюконеогенез происходит при продолжительном голодании или длительной физической нагрузке.
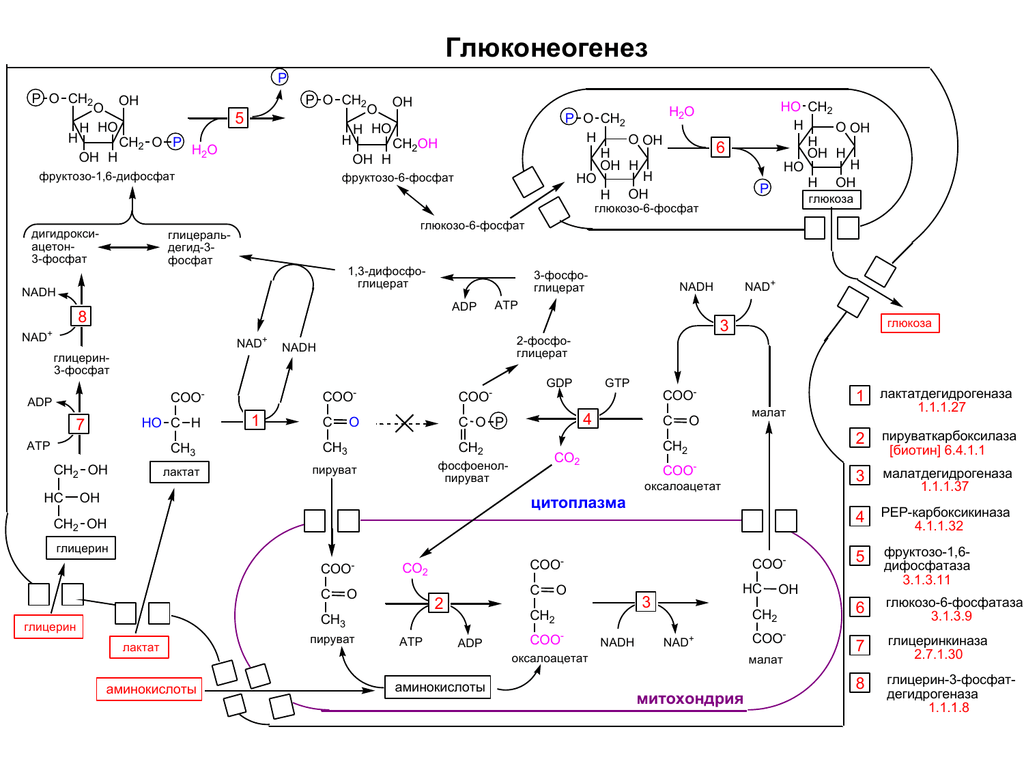
У растений, дрожжей и многих бактерий имеется путь, позволяющий получать углеводы из жирных кислот — глиоксилатный цикл. У животных ключевых ферментов этого цикла нет, и, ввиду необратимости пируватдегидрогеназной реакции, они не могут получать пируват из ацетил-КоА, а значит, образовывать углеводы из жирных кислот (следовательно, и из липидов). Тем не менее, они могут использовать для глюконеогенеза те небольшие количества глицерола, который образуется при распаде жиров. При этом глицерол фосфорилируется , далее следует окисление центрального атома углерода с образованием дигидроксиацетонфосфата, который является промежуточным соединением глюконеогенеза.
Глицеролфосфат является необходимым промежуточным соединением при синтезе жиров (триглицеридов) в адипоцитах, однако эти клетки лишены глицеролкиназы и поэтому не могут осуществлять фосфорилирование глицерола. Вместо этого адипоциты могут осуществлять сокращённый вариант глюконеогенеза, известный как глицеронеогенез: преобразование пирувата в дигидроксиацетонфосфат через первые реакции глюконеогенеза, вслед за которым следует восстановление дигидроксиацетонфосфата до глицеролфосфата.
Глюконеогенез
Глюконеогенез – это трансформация дезаминированных остатков аминокислот, глицерола и лактата в глюкозу. Как правило, глюконеогенез сопровождается быстрым поступлением новообразованной глюкозы в кровь, поскольку те физиологические условия, которые характеризуются высокой скоростью глюконеогенеза, обусловливают и «гипертрофию» фермента глюкозо-б-фосфатазы в печени, как бы ставящей штамп «только на экспорт» на большем, чем в норме, количестве молекул глюкозо-б-фосфата. Печень обладает уникальной способностью извлекать из притекающей крови определенные аминокислоты. Источником аминокислот, используемых для длительного подержания постоянной концентрации глюкозы в крови при голодании и других состояниях, служат белки других тканей организма, особенно мышц, на долю которых приходится около 50% общей массы тела. Важную роль в мобилизации белка периферических тканей с поступлением в печень аминокислот, большинство которых используется для глюконеогенеза, играют глюкокортикоиды. Часть аминокислот, несомненно, используется и для синтеза определенных белков в печени и других тканях.
Природа гормональных эффектов, определяющих блокаду периферического окисления глюкозы при голодании, точно не известна
В «торможении» утилизации глюкозы мышцами важное значение придается глюкокортикоидам и гипофизарному гормону роста.. Если бы в условиях углеводного голодания или хронической потери сахара через почечные канальцы скорость утилизации глюкозы тканями (кроме ЦНС) оставалась столь же высокой, как и в состоянии сытости, то проблема постоянного снабжения глюкозой мозга приобретала бы большую остроту, чем это есть на самом деле
Поэтому при голодании периферические ткани адаптивно снижают потребление глюкозы. Отчасти это происходит за счет общего снижения интенсивности обмена
Если бы в условиях углеводного голодания или хронической потери сахара через почечные канальцы скорость утилизации глюкозы тканями (кроме ЦНС) оставалась столь же высокой, как и в состоянии сытости, то проблема постоянного снабжения глюкозой мозга приобретала бы большую остроту, чем это есть на самом деле. Поэтому при голодании периферические ткани адаптивно снижают потребление глюкозы. Отчасти это происходит за счет общего снижения интенсивности обмена.
На примере мышц голодающих или получающих жировой рацион крыс можно наблюдать и истинную адаптацию тканей. Такие мышцы, инкубируемые in vitro с глюкозой и радиоактивно меченными жирными кислотами, окисляют меньше глюкозы и больше жирных кислот, чем мышцы контрольных сытых животных. Окисление углеводов в периферических тканях блокируется, и они начинают в большей степени использовать жирные кислоты. Это конечно, существенно облегчает задачу печени по поддержанию постоянной концентрации глюкозы в крови путем глюконеогенеза, поскольку большая доля новообразуемой глюкозы может поступать в жизненно важные ткани, особенно нуждающиеся в ней.
Голодание
Примерно через 6 часов после его начала, глюконеогенез начинает стимулироваться глюкагоном (одноцепочечный полипептид, который составляет 29 аминокислотных остатков).
Но активным данный процесс становится лишь на 32-й час. Просто в этот момент к нему подключается кортизол (катаболический стероид). После этого начинают расщепляться белки мышц и прочие ткани. Они превращаются в аминокислоты, являющиеся предшественниками глюкозы в процессе глюконеогенеза.Это атрофия мышц. Для организма она является вынужденной мерой, на которую ему приходится идти, дабы мозг получил определенную порцию глюкозы, необходимую для функционирования
Именно поэтому очень важно, чтобы больные люди, восстанавливающиеся после операций и болезней, получали хорошее дополнительное питание. Если этого не будет, то мышцы и ткани начнут истощаться
Общий обзор
| Внешние изображения |
|---|
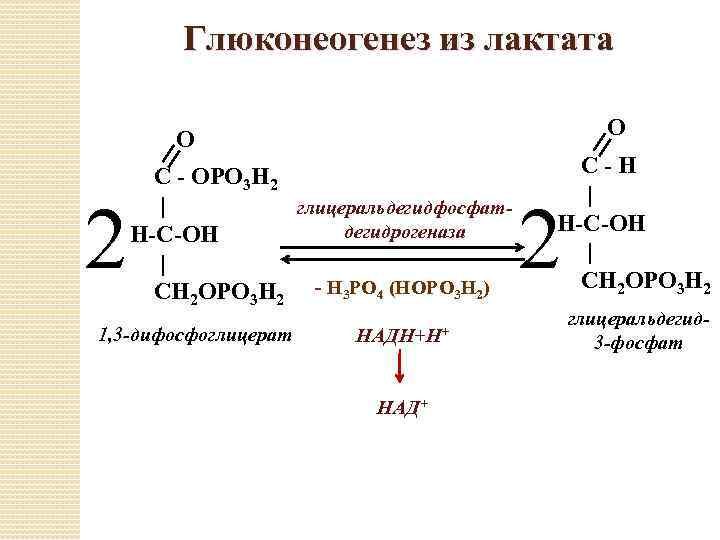
Глюконеогенез происходит у животных, растений, грибов и микроорганизмов. Его реакции одинаковы для всех тканей и биологических видов. Важными предшественниками глюкозы у животных выступают трёхуглеродные соединения, такие как лактат, пируват, глицерол, а также некоторые аминокислоты. У млекопитающихглюконеогенез происходит главным образом в печени, в меньшей степени — в корковом слое почек и эпителиальных клетках, выстилающих тонкую кишку. Образованная в ходе глюконеогенеза глюкоза уходит в кровь, откуда доставляется к другим тканям. После интенсивной физической работы лактат, образовавшийся при анаэробном гликолизе в скелетных мышцах, возвращается в печень и превращается там в глюкозу, которая снова поступает в мышцы или превращается в гликоген (этот круговорот известен как цикл Кори). У проростков растений запасённые в семени жиры и белки превращаются, в том числе и через глюконеогенез, в дисахарид сахарозу, который транспортируется по всему развивающемуся растению. Глюкоза и её производные служат предшественниками для синтеза растительной клеточной стенки, нуклеотидов, коферментов и многих других жизненно важных метаболитов. У многих микроорганизмов глюконеогенез начинается с простых органических соединений, содержащих два или три атома углерода, например, ацетата, лактата и пропионата, которые содержатся в питательной среде.
Хотя реакции глюконеогенеза одинаковы у всех организмов, соседние метаболические пути и регуляторные пути глюконеогенеза отличаются у различных видов и в различных тканях. В этой статье рассмотрены особенности глюконеогенеза млекопитающих; о механизмах синтеза глюкозы растениями из первичных продуктов фотосинтеза см. Фотосинтез.
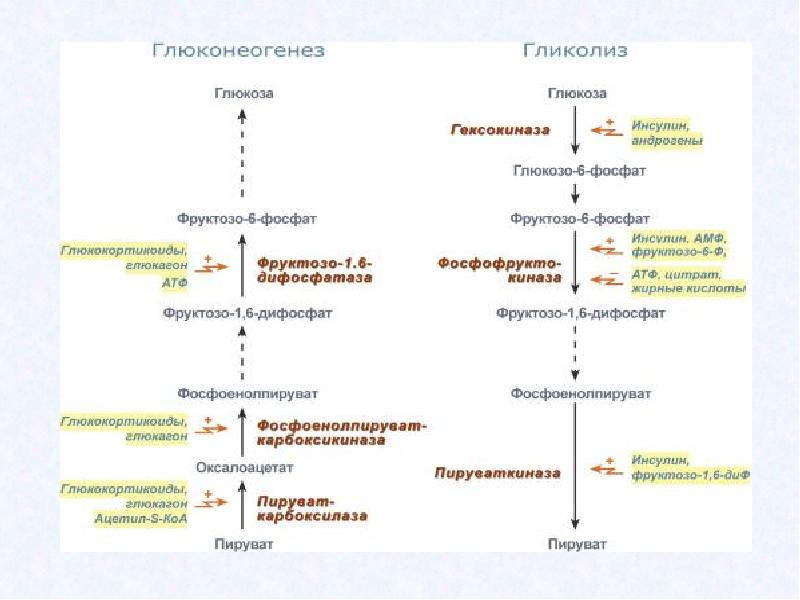
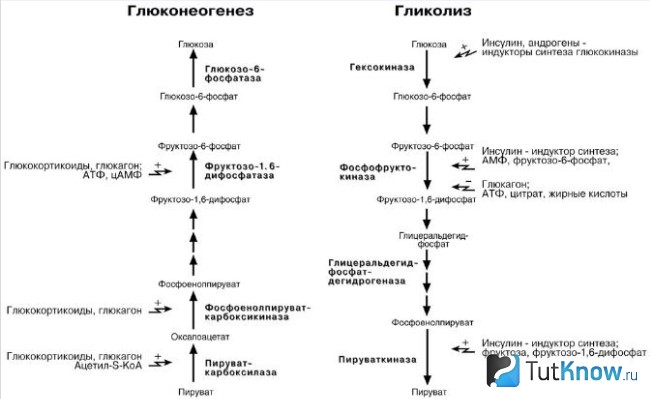
Глюконеогенез и гликолиз не являются полностью идентичными процессами, протекающими в противоположных направлениях, хотя несколько стадий являются общими для обоих процессов: 7 из 10 ферментативных реакций глюконеогенеза обратны соответствующим реакциям гликолиза. Однако 3 реакции гликолиза необратимы in vivo и не могут использоваться в глюконеогенезе: образование глюкозо-6-фосфата из глюкозы под действием ферментагексокиназы, фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бифосфата фосфофруктокиназой-1 (PFK-1), а также превращение фосфоенолпирувата в пируват под действием пируваткиназы. В клеточных условиях эти реакциии имеют большое отрицательное изменение энергии Гиббса, в то время как другие реакции гликолиза имеют ΔG около 0. При глюконеогенезе три необратимые стадии гликолиза заменены «обходными» реакциями, катализируемыми другими ферментами, и эти реакции также очень экзергоничны и потому необратимы. Таким образом, в клетках как гликолиз, так и глюконеогенез являются необратимыми процессами. У животных гликолиз происходит только в цитозоле, как и большая часть реакций глюконеогенеза, хотя некоторые его реакции происходят в митохондриях и эндоплазматическом ретикулуме. Это даёт возможность для их координированной и взаимно обратной регуляции. Регуляторные механизмы, различающиеся у гликолиза и глюконеогенеза, действуют на ферментативные реакции, уникальные для каждого процесса.
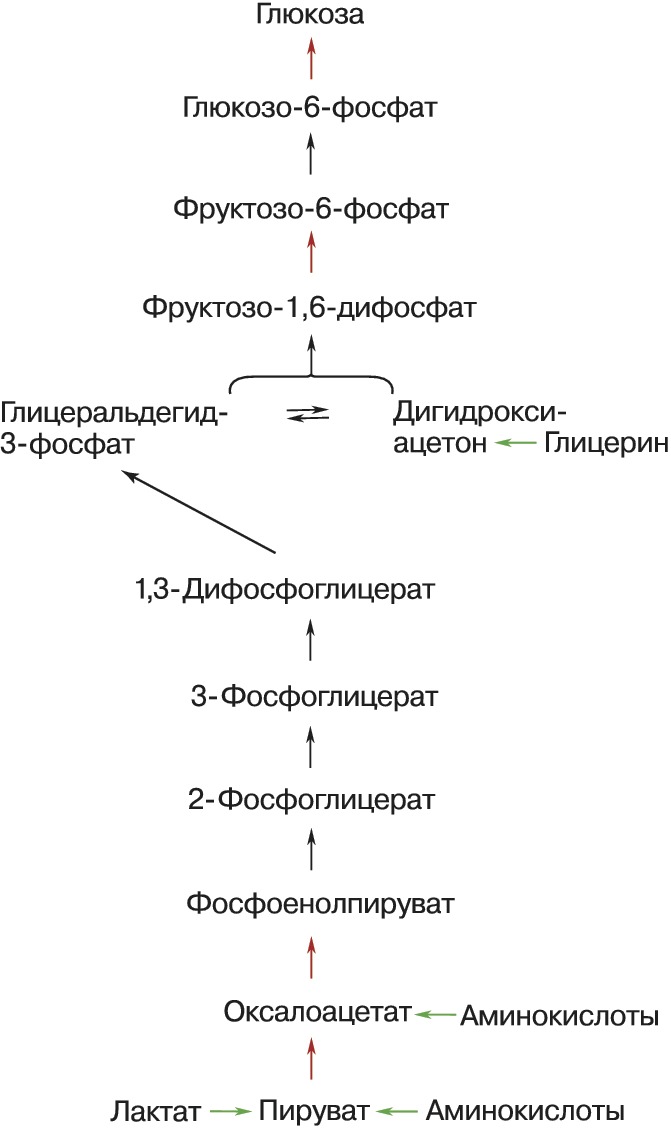
Ниже представлена схема реакций глюконеогенеза:

Гликогенозы
Синдром гликогеноза возникает в результате дефекта фермента синтеза или мобилизации гликогена, что приводит к накоплению или изменению структуры гликогена в разных тканях, чаще в печени и мышцах. Следует отметить, что при гликогенозах количество гликогена не всегда изменено, изменения могут быть только в структуре его молекулы.
Всего известно 12 типов гликогенозов. По патогенетическому признаку гликогенозы делят:
- печеночные – 0, I, III, IV, VI, VIII, IX, Х, ХI типов,
- мышечные – V и VII типов,
- смешанные – II типа.
Печеночные гликогенозы
Самый частый гликогеноз I типа или болезнь фон Гирке (частота 1 : 50000-100000 новорожденных) обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликогена не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.
Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз – это аутосомно-рецессивный дефект амило-α1,6-глюкозидазы, «деветвящего» фермента, гидролизующего α1,6-гликозидную связь. Болезнь имеет более доброкачественное течение, и частота ее составляет примерно 25% от всех гликогенозов. Для больных характерна гепатомегалия, умеренная задержка физического развития, в подростковом возрасте возможна небольшая миопатия.
При гликогенозе IV типа (болезнь Андерсена, 1% всех гликогенозов), связанного с дефектом ветвящего фермента, образуется гликоген с малым количеством ветвлений, что резко уменьшает скорость гликогенолиза.
Гликогеноз VI типа (болезнь Херса, 25% всех гликогенозов), связан с дефицитом печеночной фосфорилазы гликогена. При этом отсутствует мобилизация гликогена, развивается гепатомегалия и гипогликемия.
Мышечные гликогенозы
Для этой группы гликогенозов характерны изменения ферментов мышечной ткани. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, к болям в мышцах, судорогам.
Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем.

Схематичное расположение дефектных ферментов при различных гликогенозах
Смешанные гликогенозы
Эти заболевания касаются и печени, и мышц, и других органов.
Гликогеноз II типа (болезнь Помпе, 10% всех гликогенозов) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной (кислой) α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные при отсутствии лечения умирают в раннем возрасте из-за кардиомегалии и тяжелой сердечной недостаточности.
Разница между гликолизом и глюконеогенезом
Определение
Гликолиз: Набор реакций, которые превращают глюкозу в две молекулы пирувата, известен как гликолиз.
Глюконеогенез: Глюконеогенез — это производство неуглеводных источников глюкозы, таких как глицерин, аминокислоты и лактат.
Сырье
Гликолиз: Сырьем для гликолиза является глюкоза.
Глюконеогенез: Сырьем для глюконеогенеза является лактат, аминокислоты, такие как аланин и глицерин.
Вхождение
Гликолиз: Гликолиз происходит в цитоплазме всех клеток.
Глюконеогенез: Глюконеогенез происходит как в митохондриях, так и в цитоплазме.
В тканях
Гликолиз: Гликолиз происходит практически во всех клетках организма.
Глюконеогенез: Глюконеогенез происходит в печени и почках.
метаболизм
Гликолиз: Гликолиз — это катаболический процесс, когда молекулы глюкозы распадаются на две молекулы пирувата.
Глюконеогенез: Глюконеогенез — это анаболический процесс, при котором две молекулы пирувата соединяются вместе, образуя молекулу глюкозы.
Использование энергии
Гликолиз: Гликолиз является экзергонической реакцией, при которой образуются два АТФ.
Глюконеогенез: Глюконеогенез является эндергонической реакцией, где шесть АТФ используются на одну молекулу глюкозы.
переписка
Гликолиз: Гликолиз происходит через десять реакций.
Глюконеогенез: Две по существу необратимые реакции в гликолитическом пути обойдены четырьмя новыми реакциями в глюконеогенезе.
Шаг ограничения скорости
Гликолиз: Ферменты, участвующие в стадиях ограничения скорости, представляют собой гексокиназу, фосфофруктокиназу и пируваткиназу.
Глюконеогенез: Ферменты, участвующие в стадиях ограничения скорости, представляют собой пируваткарбоксилазу, фосфоенолпируваткарбоксикиназу, фруктозу 1,2-бисфосфатазу, глюкозо-6-фосфатфосфатазу.
Заключение
Гликолиз и глюконеогенез являются двумя процессами, участвующими в метаболизме глюкозы. Глюкоза является источником энергии практически всех форм жизни на Земле. Глюкоза расщепляется для выработки энергии в форме АТФ во время процесса, называемого клеточным дыханием. Гликолиз является первым этапом клеточного дыхания, расщепляющим шесть углеродных глюкоз на две молекулы пирувата, каждая из которых содержит три атома углерода. Гликолиз происходит в цитоплазме практически всех клеток организма. Во время голодания уровни глюкозы в крови снижаются, и печень и почки начинают вырабатывать глюкозу из неуглеводных производных, таких как аминокислоты, глицерин и лактат, в процессе, называемом глюконеогенезом. Глюконеогенез и гликолиз являются взаимно регулируемыми событиями, поддерживая постоянный уровень глюкозы в крови. Основное различие между гликолизом и глюконеогенезом заключается в их типах обмена веществ в организме.
Ссылка:1. Берг, Джереми М. «Гликолизис — путь преобразования энергии во многих организмах». Биохимия. 5-е издание. Национальная медицинская библиотека США, 1 января 1970 г. Веб. 06 апреля 2017 г. 2. Берг, Джереми М. «Резюме». Биохимия. 5-е издание, Национальная медицинская библиотека США, 1 января 1970 г. Веб. 06 апреля 2017 г.
Другие предшественники глюкозы
Описанный выше биосинтетический путь образования глюкозы относится к синтезу глюкозы не только из пирувата, но также 4-, 5- и 6-углеродных промежуточных соединений цикла трикарбоновых кислот. Цитрат, изоцитрат, α-кетоглутарат, , сукцинат, фумарат и малат — все промежуточные продукты цикла трикарбоновых кислот могут окисляться до оксалоацетата. Некоторые или все атомы углерода большей части аминокислот могут быть катаболизированы в пируват или промежуточные соединения цикла трикарбоновых кислот. Поэтому эти аминокислоты могут подвергнуться превращению в глюкозу и называются . Аланин и глутамин — важнейшие молекулы, переносящие аминогруппы в печень из других тканей — служат особенно важными глюкогенными аминокислотами у млекопитающих. После того, как эти аминокислоты отдают свои аминогруппы в митохондриях печени, их углеродные скелеты (пируват и α-кетоглутарат соответственно) вовлекаются в глюконеогенез. Аминокислоты образуются при распаде белков мышц и соединительной ткани, их включение в глюконеогенез происходит при продолжительном голодании или длительной физической нагрузке.
У растений, дрожжей и многих бактерий имеется путь, позволяющий получать углеводы из жирных кислот — глиоксилатный цикл. У животных ключевых ферментов этого цикла нет, и, ввиду необратимости пируватдегидрогеназной реакции, они не могут получать пируват из ацетил-СоА, а значит, образовывать углеводы из жирных кислот (следовательно, и из липидов). Тем не менее, они могут использовать для глюконеогенеза те небольшие количества глицерола, который образуется при распаде жиров. При этом глицерол фосфорилируется , далее следует окисление центрального атома углерода с образованием дигидроксиацетонфосфата, который является промежуточным соединением глюконеогенеза.
Глицеролфосфат является необходимым промежуточным соединением при синтезе жиров (триглицеридов) в адипоцитах, однако эти клетки лишены глицеролкиназы и поэтому не могут осуществлять фосфорилирование глицерола. Вместо этого адипоциты могут осуществлять сокращённый вариант глюконеогенеза, известный как глицеронеогенез: преобразование пирувата в дигидроксиацетонфосфат через первые реакции глюконеогенеза, вслед за которым следует восстановление дигидроксиацетонфосфата до глицеролфосфата.
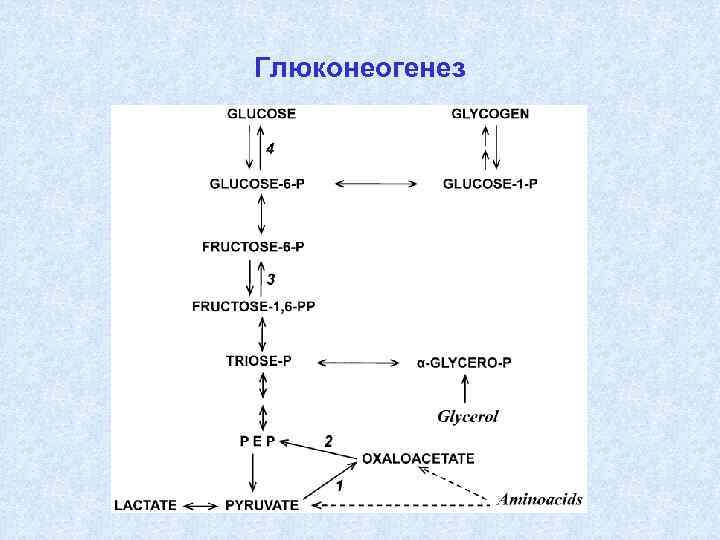
Что такое глюконеогенез
Глюконеогенез — это процесс, при котором глюкоза вырабатывается в печени; этот процесс начинается с неуглеводных источников, таких как аминокислота или молочная кислота. Небольшое количество глюконеогенеза происходит в коре почки. Помимо этого, другие ткани с высоким спросом на глюкозу, такие как мозг, сердечные мышцы и скелетные мышцы, также служат участками глюконеогенеза. Аминокислота обеспечивается расщеплением белков в мышечных клетках путем глюконеогенеза. Гидролиз липидов обеспечивает жирные кислоты и глицерин, и этот глицерин используется в глюконеогенезе для производства глюкозы. Хотя глюконеогенез является полной противоположностью гликолизобразует молекулу глюкозы путем соединения двух молекул пирувата. Инициирование глюконеогенеза происходит во время углеводного голодания, когда для метаболизма доступно меньше глюкозы. Синтезированная глюкоза транспортируется в клетки, где обмен веществ происходит через кровь. Реакция глюконеогенеза показана в фигура 2.
Рисунок 2: Глюконеогенез
Что такое гликогенолиз
Гликогенолиз — это процесс, при котором накопленный гликоген расщепляется на мономеры глюкозы в печени под действием гормонов. Глюкагон и адреналин регулировать расщепление гликогена в печени, когда для метаболизма в клетках доступно меньше глюкозы. Глюкагон высвобождается в ответ на низкий уровень глюкозы. Адреналин выделяется в ответ на угрозу или стресс. Фермент, гликогенфосфорилаза производит 1-фосфат глюкозы путем фосфорилирования альфа (1,4) связей. Второй фермент, фосфоглюкомутазы преобразует глюкозо-1-фосфат в глюкозо-6-фосфат. Альфа (1,6) связи ответственны за разветвление гликогена. Действие гликоген Разветвленный фермент и ферменты альфа (1,6) глюкозидазы участвуют в удалении молекул глюкозы, которые образуют ветви в гликогене. Превращение глюкозо-1-фосфата в глюкозо-6-фосфат осуществляется Гексокиназный, Фосфатная группа удаляется глюкозо-6-фосфатазой во время кровообращения, и свободная глюкоза легко доступна для поглощения клетками. Связи в структуре гликогена показаны в Рисунок 1.
Рисунок 1: Гликоген
Регуляция
Если бы гликолиз и глюконеогенез протекали бы одновременно и на большой скорости, то результатом стали бы расход ATP и образование тепла. Например, фосфофруктокиназа-1 и фруктозо-1,6-бифосфатаза-1 катализируют противоположные реакции:
- ATP + фруктозо-6-фосфат → ADP + фруктозо-1,6-бифосфат (PFK-1)
- Фруктозо-1,6-бифосфат + H2O → фруктозо-6-фосфат + Pi (FBPаза-1).
Суммой этих двух реакций является
- ATP + H2O → ADP + Pi + теплота.
Эти две ферментативные реакции, как и ряд других реакций этих двух путей, регулируются и ковалентных модификаций. Гликолиз и глюконеогенез регулируются реципрокно, то есть если поток глюкозы, проходящей через гликолиз, растёт, то поток пирувата, проходящего через глюконеогенез, спадает, и наоборот. Например, FBPаза-1 строго подавляется аллостерическим связыванием AMP, так что когда клеточные запасы ATP невелики, а уровень AMP высок, ATP-зависимый синтез глюкозы приостанавливается, а катализирующая соответствующую реакцию гликолиза PFK-1, наоборот, активируется AMP. Хотя PFK-1 активируется , на FBPазу-1 это соединение имеет противоположный эффект: он снижает его сродство к субстратам и тем самым замедляет глюконеогенез.
Транскрипционные факторы и глюконеогенез
Механизм работы CREB
Механизм работы FOXO1
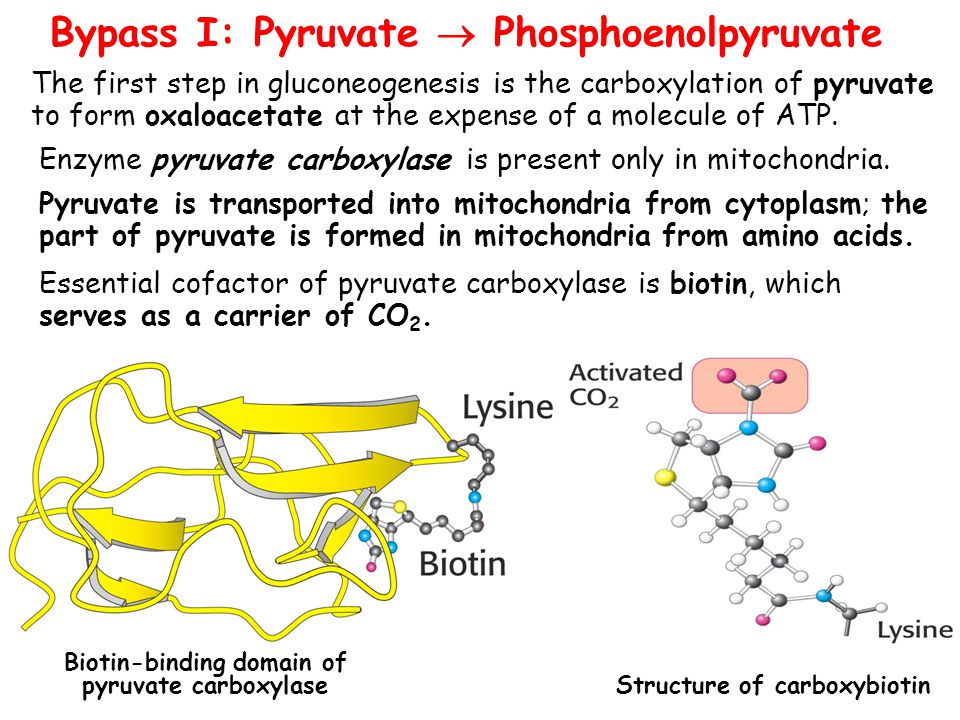
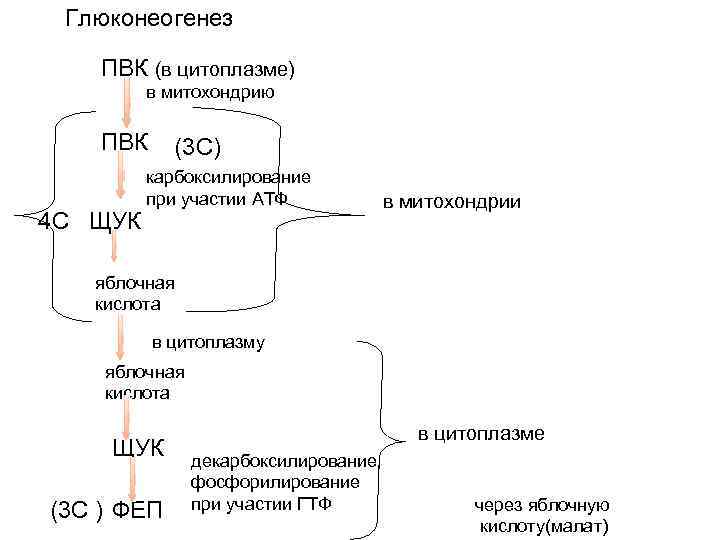
На пути преобразования пирувата в глюкозу первой контрольной точкой, на которой определяется дальнейшая судьба пирувата в митохондрии, является то, будет ли он превращён в ацетил-КоА пируватдегидрогеназным комплексом с дальнейшим вовлечением в цикл трикарбоновых кислот или же в оксалоацетат под действием пируваткарбоксилазы, чтобы начать глюконеогенез. Когда в качестве источника энергии доступны жирные кислоты, то при их разложении в митохондриях образуется ацетил-КоА, выступающий в качестве сигнала о том, что в дальнейшем окислении глюкозы нет нужды. ацетил-КоА являются положительным аллостерическим модулятором пируваткарбоксилазы и отрицательным модулятором пируватдегидрогеназного комплекса; его действие опосредуется стимуляцией протеинкиназы, которая инактивирует дегидрогеназу. Когда энергетические потребности клетки удовлетворены, окислительное фосфорилирование замедляется, концентрация NADH по сравнению с NAD+ увеличивается, цикл трикарбоновых кислот подавляется, и происходит накопление ацетил-КоА. Повышенная концентрация ацетил-КоА подавляет пируватдегидрогеназный комплекс, тем самым замедляя образование ацетил-КоА из пирувата и стимулируя глюконеогенез через активацию пируваткарбоксилазы, что позволяет превратить излишек пирувата в оксалоацетат (а впоследствии и глюкозу).
Полученный таким образом оксалоацетат превращается в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы. У млекопитающих регуляция этого важнейшего фермента глюконеогенеза осуществляется на уровне его синтеза и распада под влиянием режима питания и гормональных сигналов. Так, его промотор имеет более 15 или более регуляторных элементов, распознаваемых по крайней мере 12-ю известных транскрипционных факторов, и, как предполагается, ещё большим числом пока не описанных. Голодание или высокий уровень глюкагона увеличивают транскрипцию этого фермента и стабилизируют его мРНК. Действие глюкагона опосредовано транскрипционным фактором CREB (англ. cyclic AMP response element binding protein), который активирует синтез глюкозо-6-фосфатазы и фосфоенолпируваткарбоксилазы в ответ на вызванное глюкагоном увеличение внутриклеточной концентрации cAMP. Инсулин или высокое содержание глюкозы в крови имеют противоположный эффект. Эти изменения, вызываемые в основном внеклеточными сигналами (питание, гормоны), могут длиться от нескольких минут до нескольких часов. Инсулин также замедляет экспрессию генов глюкозо-6-фосфатазы и фруктозо-1,6-бифосфатазы. Другим транскрипционным фактором, регулирующим экспрессию генов ферментов глюконеогенеза, является FOXO1 (англ. forkhead box other). Инсулин активирует протеинкиназу В, которая фосфорилирует FOXO1, находящийся в цитозоле. С фосфорилированным FOXO1 связывается убиквитин, и FOXO1 разрушается в протеасоме, однако в отсутствие фосфорилирования или при дефосфорилировании FOXO1 может проникать в ядро, связываться с соответствующим регуляторным элементом на ДНК и запускать транскрипцию генов фосфоенолпируваткарбоксикиназы и глюкозо-6-фосфатазы. Фосфорилированию FOXO1 протеинкиназой В препятствует глюкагон.
Клиническое значение
Выше было вкратце рассказано о реакциях глюконеогенеза и прочих особенностях данного процесса. Напоследок стоит обсудить клиническое значение.
Если снизится использование лактата в качестве субстрата, необходимого для глюконеогенеза, то будут последствия: понижение рН крови и последующее развитие лактатацидоза. Произойти это может из-за дефекта ферментов глюконеогенеза.
Следует оговориться, что недолговременный лактоацидоз может одолеть и здоровых людей. Случается это при условии интенсивной мышечной работы. Но тогда данное состояние быстро компенсируется гипервентиляцией легких и выведением из организма углекислого газа.
К слову, на глюконеогенез оказывает влияние и этанол. Его катаболизм чреват увеличением количества NADH, а это отражается на равновесии в лактатдегидрогеназной реакции. Оно просто смещается в сторону образования лактата. Также из-за этого снижается образование пирувата. Итогом становится замедление всего процесса глюконеогенеза.
Другие предшественники глюкозы
Описанный выше биосинтетический путь образования глюкозы относится к синтезу глюкозы не только из пирувата, но также 4-, 5- и 6-углеродных промежуточных соединений цикла трикарбоновых кислот. Цитрат, изоцитрат, α-кетоглутарат, , сукцинат, фумарат и малат — все промежуточные продукты цикла трикарбоновых кислот могут окисляться до оксалоацетата. Некоторые или все атомы углерода большей части аминокислот могут быть катаболизированы в пируват или промежуточные соединения цикла трикарбоновых кислот. Поэтому эти аминокислоты могут подвергнуться превращению в глюкозу и называются . Аланин и глутамин — важнейшие молекулы, переносящие аминогруппы в печень из других тканей — служат особенно важными глюкогенными аминокислотами у млекопитающих. После того, как эти аминокислоты отдают свои аминогруппы в митохондриях печени, их углеродные скелеты (пируват и α-кетоглутарат соответственно) вовлекаются в глюконеогенез. Аминокислоты образуются при распаде белков мышц и соединительной ткани, их включение в глюконеогенез происходит при продолжительном голодании или длительной физической нагрузке.
У растений, дрожжей и многих бактерий имеется путь, позволяющий получать углеводы из жирных кислот — глиоксилатный цикл. У животных ключевых ферментов этого цикла нет, и, ввиду необратимости пируватдегидрогеназной реакции, они не могут получать пируват из ацетил-СоА, а значит, образовывать углеводы из жирных кислот (следовательно, и из липидов). Тем не менее, они могут использовать для глюконеогенеза те небольшие количества глицерола, который образуется при распаде жиров. При этом глицерол фосфорилируется , далее следует окисление центрального атома углерода с образованием дигидроксиацетонфосфата, который является промежуточным соединением глюконеогенеза.
Глицеролфосфат является необходимым промежуточным соединением при синтезе жиров (триглицеридов) в адипоцитах, однако эти клетки лишены глицеролкиназы и поэтому не могут осуществлять фосфорилирование глицерола. Вместо этого адипоциты могут осуществлять сокращённый вариант глюконеогенеза, известный как глицеронеогенез: преобразование пирувата в дигидроксиацетонфосфат через первые реакции глюконеогенеза, вслед за которым следует восстановление дигидроксиацетонфосфата до глицеролфосфата.
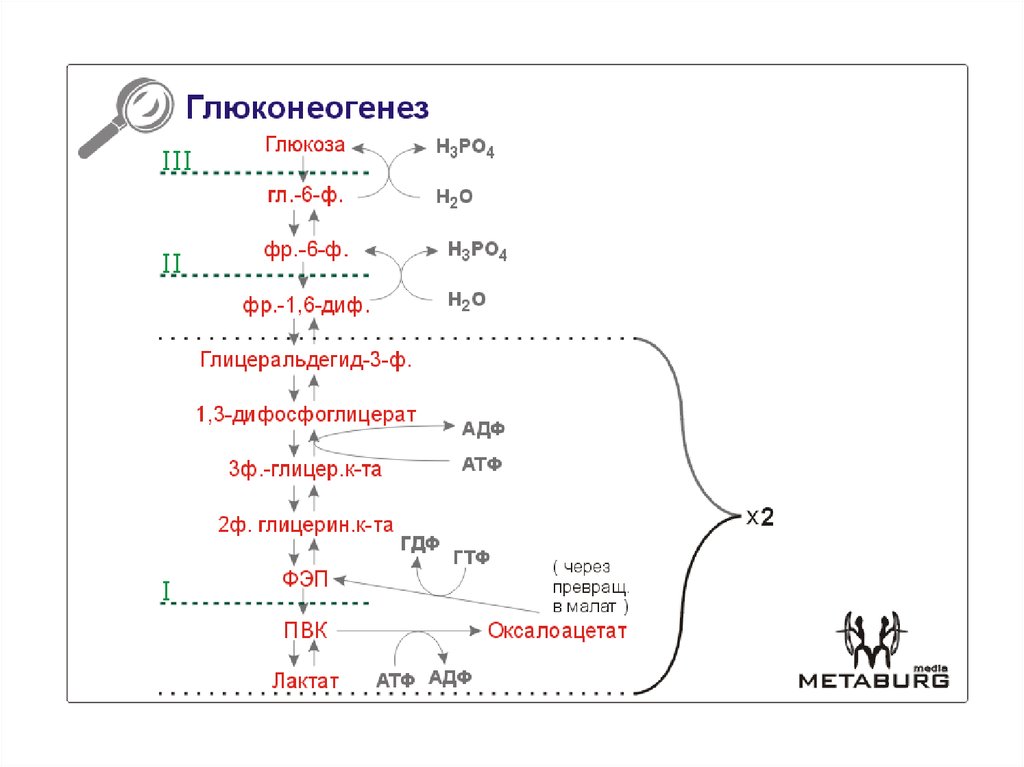
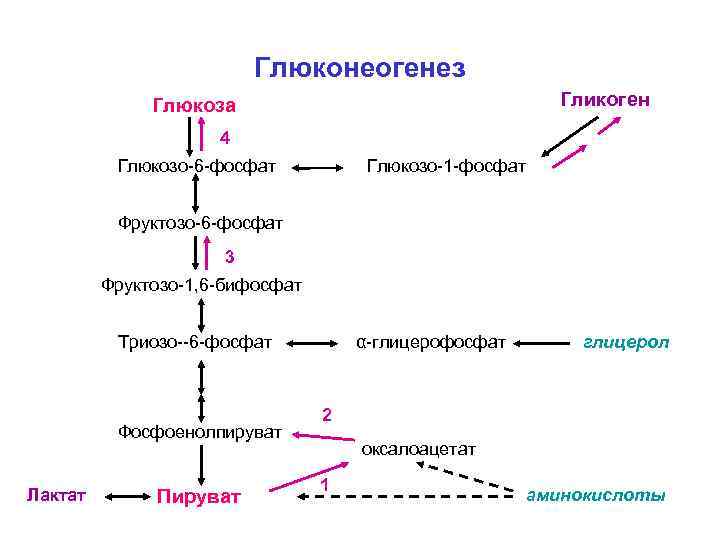
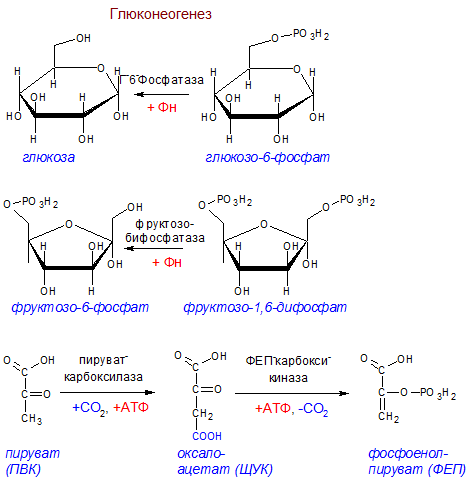
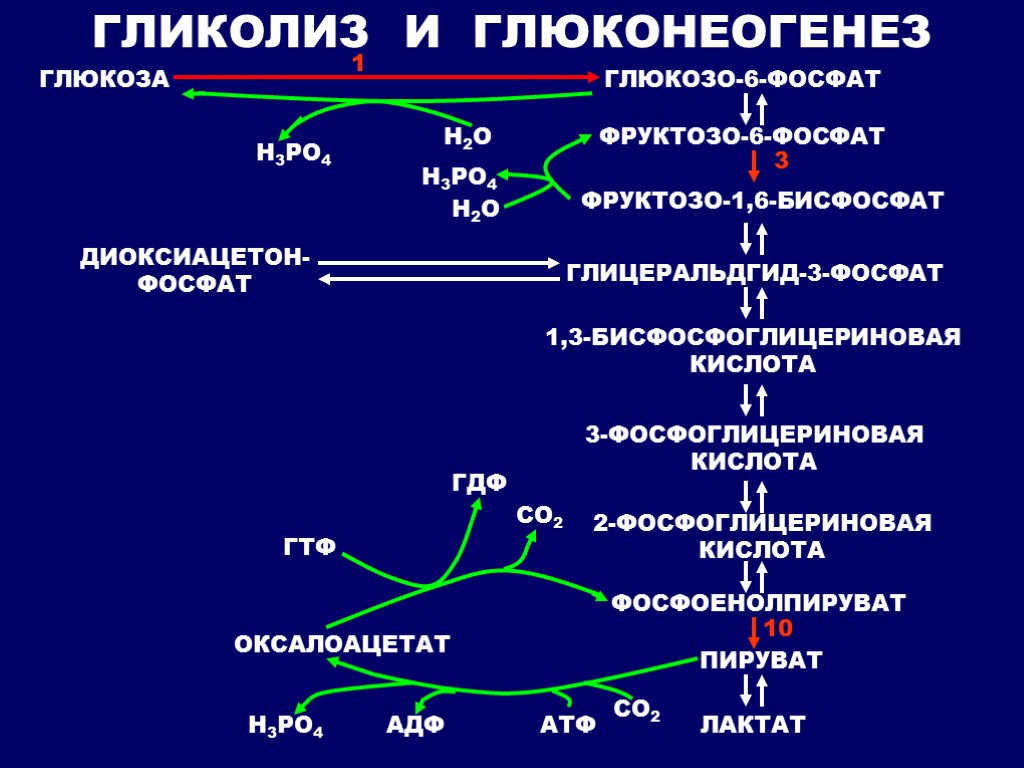
Глюконеогенез[править | править код]
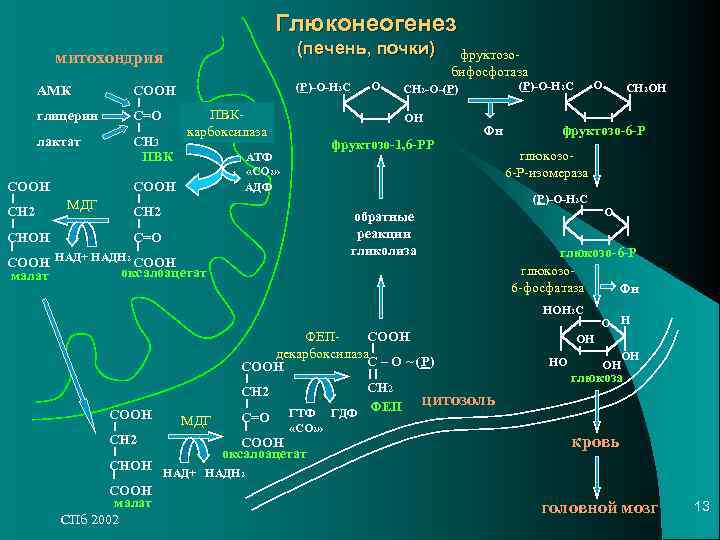
Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. Свободные жирные кислоты у млекопитающих для глюконеогенеза не используются.
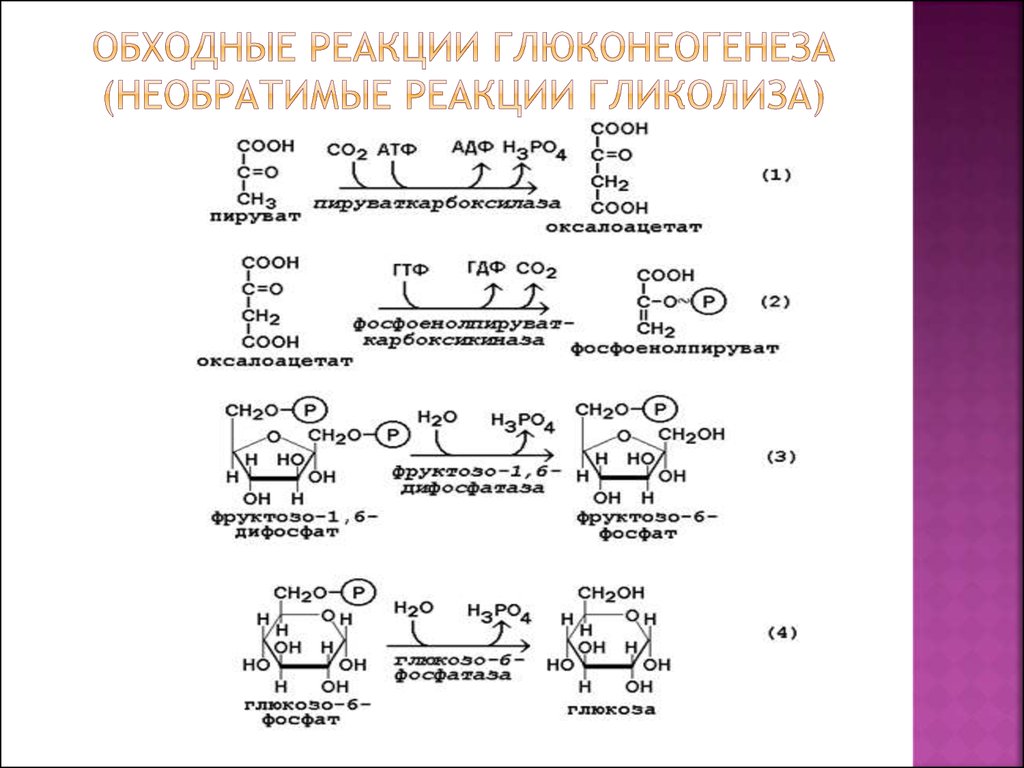
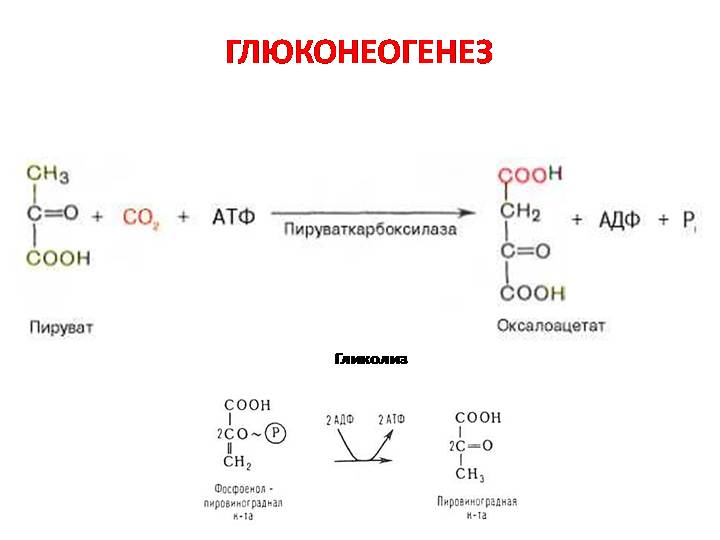
Стадии глюконеогенеза повторяют стадии гликолиза в обратном направлении и катализируются теми же ферментами за исключением 4 реакций:
- Превращение пирувата в оксалоацетат (фермент пируваткарбоксилаза)
- Превращение оксалоацетата в фосфоенолпируват (фермент фосфоенолпируваткарбоксикиназа)
- Превращение фруктозо-1,6-дифосфата в фруктозо-6-фосфат (фермент фруктозо-1,6-дифосфатаза)
- Превращение глюкозо-6-фосфата в глюкозу (фермент глюкозо-6-фосфатаза)
Суммарное уравнение глюконеогенеза: 2 CH3COCOOH + 4ATP + 2GTP + 2NADH.H+ + 6 H2O = C6H12O6 + 2NAD + 4ADP + 2GDP + 6Pn.
Роль в организмеправить | править код
При голодании в организме человека активно используются запасы питательных веществ (гликоген, жирные кислоты). Они расщепляются до аминокислот, кетокислот и других неуглеводных соединений. Большая часть этих соединений не выводится из организма, а подвергаются реутилизации. Вещества транспортируются кровью в печень из других тканей, и используются в глюконеогенезе для синтеза глюкозы — основного источника энергии в организме. Таким образом, при истощении запасов организма, глюконеогенез является основным поставщиком энергетических субстратов.
О влиянии алкоголя на глюконеогенезправить | править код
Существует ещё один аспект, о котором следует помнить, рассматривая глюконеогенез с точки зрения биологии человека и медицины. Потребление больших количеств алкоголя резко тормозит глюконеогенез в печени, вследствие чего понижается содержание глюкозы в крови. Такое состояние называется гипогликемией. Это действие алкоголя сказывается особенно резко после тяжёлой физической нагрузки или на голодный желудок. Если человек выпьет спиртного после длительной и тяжёлой физической работы, уровень глюкозы в крови может понизиться до 40 и даже до 30% от нормы. Гипогликемия неблагоприятно сказывается на функции мозга. Она особенно опасна для тех его областей, которые контролируют температуру тела, так что, например, под влиянием гипогликемии температура тела может понизиться на 2°С и более (при измерении в прямой кишке). Если человеку в таком состоянии дать выпить раствор глюкозы, то нормальная температура тела быстро восстановится. Старый обычай, предписывавший давать спасённым на море или в пустыне голодным или обессилевшим людям виски или бренди, физиологически неоправдан и даже опасен; в таких случаях следует давать глюкозу.
Глюконеогенез, атрофия мышц и плохое заживление ранправить | править код
Глюкагон начинает стимулировать глюконеогенез примерно после 6 ч голодания, но интенсивная стимуляция глюконеогенеза наступает через 32 ч голодания, когда подключается гормон кортизол. Примечание: глюкокортикостероидный гормон кортизол — катаболический стероид. Он активирует расщепление белков мышц и других тканей до аминокислот, которые выступают в роли предшественников глюкозы в глюконеогенезе. Атрофия мышц — вынужденная мера, на которую приходится идти, чтобы обеспечить головной мозг глюкозой. Поэтому необходимо обеспечить дополнительное питание больным, восстанавливающимся после хирургического вмешательства или обширных травм (например, синдрома длительного сдавливания или сильных ожогов). Если больной не получает достаточное количество пищи, в его организме преобладают катаболические процессы и происходит истощение мышц и тканей. Чтобы раны заживали, необходимо усилить анаболические процессы, для чего и требуется дополнительное питание.
Субстраты
Обсуждая специфику регуляции гликолиза и глюконеогенеза, нужно затронуть вниманием и эту тему. Субстраты – это реагенты, образующие питательную среду
В случае с глюконеогенезом в их роли выступают:
- Пировиноградная кислота (ПВК). Без нее невозможно переваривание углеводов и обмен аминокислот.
- Глицерин. Отличается сильным дегидратирующим свойством.
- Молочная кислота. Является важнейшим участником регуляторных обменных процессов.
- Аминокислоты. Они являются главным строительным материалом любого живого организма, в том числе и человеческого.
Включение этих элементов в процесс глюконеогенеза зависит от того, в каком физиологическом состоянии пребывает организм.