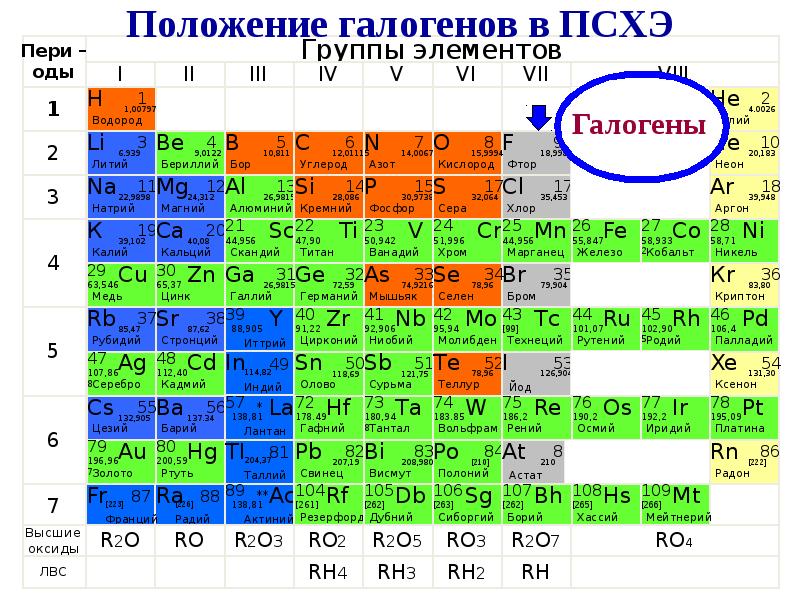
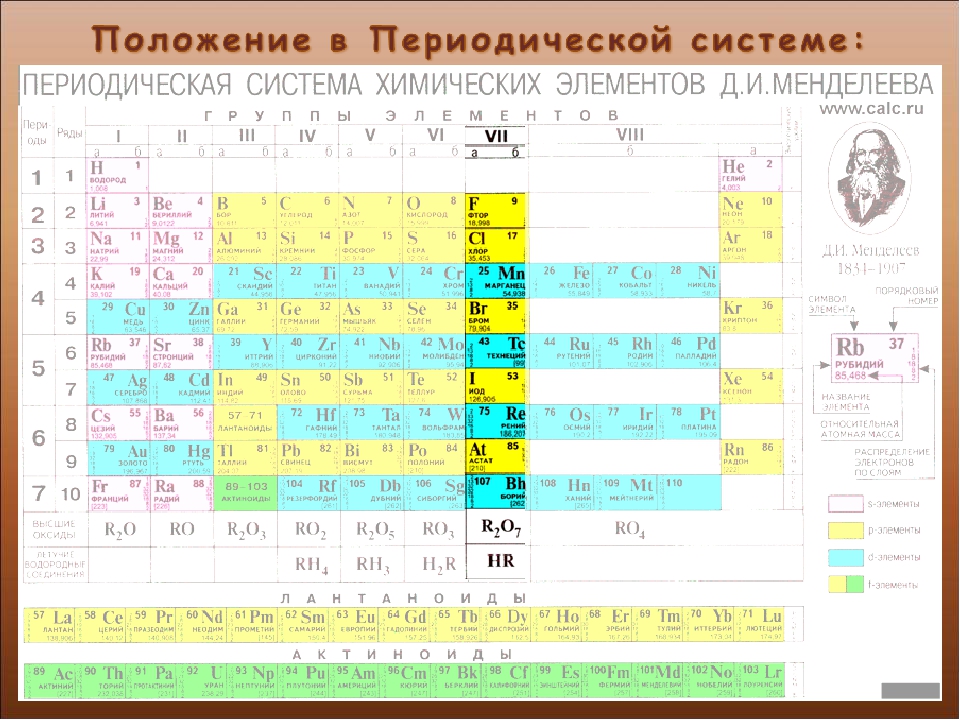
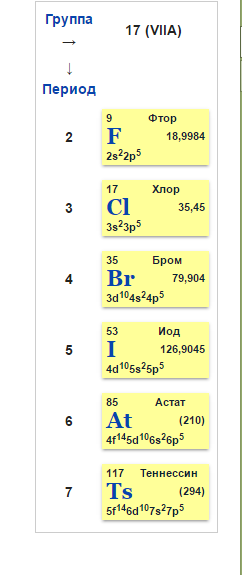
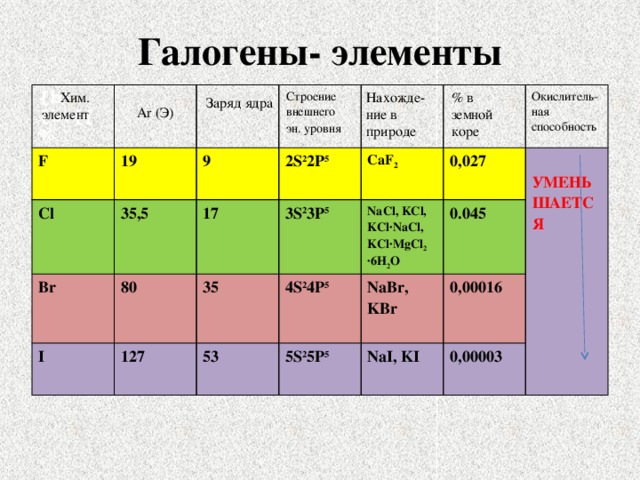
Использование
Значение любого галогена в жизни человека огромно.
Без фтора невозможно представить себе зубную пасту. Практически все ее виды содержат соединения этого элемента. Основной потребитель фтора — ядерная промышленность. Не меньше фтора потребляет и электротехника. В жизни все чаще применяются фторсодержащие пластмассы — тефлоны.
Хлор используют для отбеливания бумаги, ткани. Без него невозможен синтез пластмасс, каучука, почти всех видов красителей, клеев и растворителей. Большинство хлорсодержащих соединений ядовиты, поэтому их применяют для борьбы с сельскохозяйственными вредителями. До недавнего времени хлор использовали для хлорирования воды. К сожалению, история знает случаи применения хлора в качестве отравляющих веществ.
Без брома сложно представить развитие фотографии. Фотобумага содержит слой бромида серебра, которое под воздействием света разлагается. В ходе этой реакции серебро выпадает в осадок.
Йод широко применяется в медицине в качестве обеззараживающего средства в виде настойки на спирту. Входит в состав большого количества лекарственных препаратов. Используется и при получении фотоматериалов высокой светочувствительности.
Изотоп астата применяется в медицине для проведения специальных исследований для определения рака. Существуют способы применения галогенов в медицине для лечения рака.
Применение галогенов и их соединений
Использование солеродов находит широкое применение в жизни человека. Быт, медицина, химическая промышленность, военное производство – далеко не все области использования солеродов.
По каждому элементу можно рассмотреть следующие моменты:
- F – значимая часть состава фторополимеров, имеющих высокую химическую, коррозионную и термическую стойкости. Фторсодержащие хлорфторуглероды раньше использовались в хладагентах и в аэрозолях.
- Cl – в натуральном виде газ жёлто-зелёного цвета. Хлор употребляется для обеззараживания скважин, воды для питья и искусственных водоёмов. Наиболее частое применение хлора в быту – отбеливание вещей и очищение загрязнённых поверхностей сантехники. Соляная (муриевая) кислота также содержит хлор.
- Br – негорючее вещество, применяется для тушения огня в огнетушителях. Применим бром и в медицине, в качестве успокоительных препаратов и мегалитических средств. В военных целях входит в состав химии отравляющих веществ.
- I – применяется в виде антисептика, является необходимым элементом в организме человека для работы щитовидной железы.
- At – применения не находит ввиду своей сильной радиоактивности.
 Спектр применения галогенов
Спектр применения галогенов
Добавленный в баллон лампы накаливания газ галоген позволяет повысить температуру встраиваемой нити и качество отдачи света. Пары брома или йода, закачанные в колбу, послужили созданию галогенных ламп и светильников.
Важно! У таких источников света реже сгорают спирали, лампы имеют компактные размеры и могут питаться как переменным, так и постоянным напряжением. Галогеновый свет используется в лампах автомобильных фар, причём конструкция позволяет выполнять установку, как галогенных ламп накаливания в фару, так и обычных
В соревнованиях светодиодного источника в фаре или галогенового пока лидирует последний
Галогеновый свет используется в лампах автомобильных фар, причём конструкция позволяет выполнять установку, как галогенных ламп накаливания в фару, так и обычных. В соревнованиях светодиодного источника в фаре или галогенового пока лидирует последний.
Бром, йод и астат
Химическая активность брома чуть меньше, чем у вышеназванных фтора или хлора, однако она тоже довольно велика. Бром часто применяют в жидком виде. Он, как и хлор, очень хорошо растворяется в воде. Происходит частичная реакция с ней, позволяющая получать «бромную воду».
Химическая активность йода заметно отличается от остальных представителей этого ряда. Он почти не взаимодействует с неметаллами, а с металлами реакция идёт очень медленно и только при нагреве. При этом происходит большое поглощение тепла (эндотермическая реакция), которая сильно обратима. К тому же йод нельзя никаким образом растворить в воде, этого не достичь даже при нагреве, поэтому в природе не бывает «йодной воды». Йод можно растворить только в растворе йодида. При этом образуются комплексные анионы. В медицине такое соединение называется раствором Люголя.
Астат реагирует с металлами и водородом. В ряду галогенов химическая активность уменьшается по направлению от фтора к астату. Каждый галоген в ряду F — At способен вытеснять последующие элементы из соединений с металлами или водородом. Астат — самый пассивный среди этих элементов. Но ему присуще взаимодействие с металлами.
Распространённость элементов и получение простых веществ
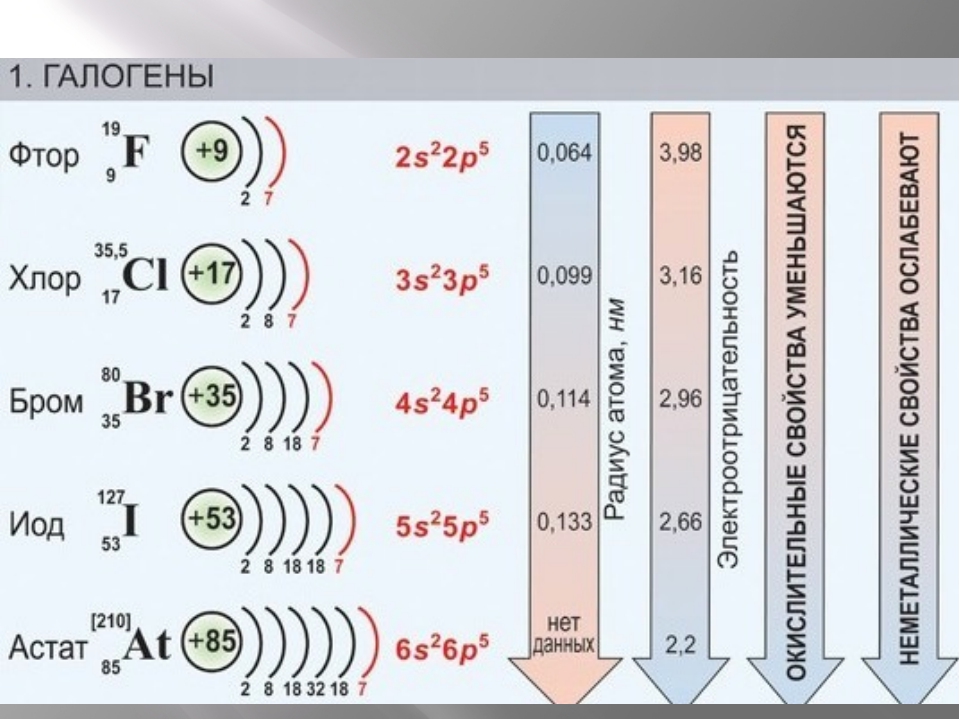
Чем больше величина атомного радиуса, тем меньше наличие солеродов в теле планеты. Величина r – радиуса атома фтора, по сравнению с радиусом атома иода, говорит о том, что фтор более распространён, нежели йод. Астата в коре планеты всего лишь граммы.
Промышленность производит галоиды (устаревшее название) в больших объёмах. При этом по количеству изготовленной продукции лидирует хлор.
Простые вещества получают при помощи галогенидов, окисляя их. Для этого используется электролитическое окисление. Причём из-за того, что положительные потенциалы у фтора и хлора достаточно высокие, приходится применять сильные окислители.
Важно! Электролиз фтора осложнён невозможностью использования водных растворов. Его потенциал окисления выше, и он может вступать в реакцию с водой, поэтому используют плавиковую кислоту
Электролиз NaCl с применением анодов из графита позволяет добывать хлор. Катоды при этом могут быть:
- железные;
- жидкие ртутные;
- стальные.
Уравнение, описывающее эту реакцию, имеет вид:
2Cl- —› Cl2 (г.) + 2е-.
Выполняя химическое окисление бромида-иона из морской воды, получают бром.
Так же добывают и йод, используя насыщенные им рассолы. Оба процесса проводят, применяя хлор в виде окислителя. Воздушным потоком, проходящим через раствор, удаляются I2 и Br2.
 Производство галогенов, формулы окисления
Производство галогенов, формулы окисления
Химические свойства галогенов
По характеру химических свойств, как отмечено выше, все галогены являются типичными неметаллами, обладающими значительной электроотрицательностью. Наиболее электроотрицательным элементом, обладающим наибольшей неметаллической активностью, является фтор, наименее активен иод.
Рис. 21. Горение водорода в хлоре. 1- хлор 2- водород
Взаимодействие галогенов с простыми веществами. Проследить уменьшение химической активности от фтора к хлору можно на примерах разных реакций. Особенно интересно взаимодействие разных галогенов с водородом. Условия реакций у них при этом разные. Так, фтор реагирует с водородом со вз рывом даже в темноте. При этом образуется фтористый водород по уравнению. H2 + F2 = 2HF
Фтористый водород является наиболее прочным соединением среди галогеноводородов. Взаимодействие хлора с водородом происходит со взрывом только на свету: Сl2+ Н2 = 2НСl Если же поджечь струю водорода в атмосфере хлора, то он будет сгорать спокойно бесцветным пламенем (рис. 21).
С водородом бром образует бромистый водород. Вr2 + Н2 = 2НВг Процесс идет при слабом нагревании. Иод с водородом реагирует только при нагревании с образованием йодистого водорода: Н2 + I2 = 2НI Однако это соединение весьма неустойчивое и легко распадается с образованием водорода и иода. Во всех этих случаях галогены ведут себя как окислители. Галогено-водороды при растворении в воде образуют кислоты.
Окислительные свойства галогены проявляют и при взаимодействии с металлами, которое протекает обычно очень активно. Фтор реагирует практически почти со всеми металлами. Легко проследить взаимодействие х л о р а с металлами. Многие металлы в хлоре горят, например сурьма самовоспламеняется (рис. 22). Другие металлы реагируют с хлором при нагревании, например натрий (рис. 23). 2Na + Сl2 = 2NaCl Если металлы могут иметь различную степень окисления, то при реакции с хлором они обычно проявляют высшую.
Рис. 22. Самовоспламенение сурьмы в хлоре
Например. 2Fe + 3Сl2 = 2FeCl3
Сu + Сl2 = СuСl2
Здесь железо в реакции с хлором проявляет степень окисления, равную +3 — Fe+3, а медь равную +2— Cu+2. Во всех приведенных случаях хлор ведет себя как окислитель .
Бурно реагирует с металлами и бром. Если насыпать в пробирку с жидким бромом немного алюминиевых опилок, то они сгорают в броме с образованием бромистого алюминия, что сопровождается выделением бурых паров брома и снопом искр. Реакция идет по следующему уравнению: 2Аl + ЗВr2 = 2АlВr3
Опыт производится в приборе, изображенном на рис. 24. Длинная трубка 1 выполняет роль воздушного холодильника. Горят в броме также олово, сурьма, а калий с бромом дает сильный взрыв.
Рис. 22. Самовоспламенение сурьмы в хлоре
Иод также реагирует с металлами, образуя йодистые соли. Особенно интересно происходит реакция алюминия с иодом. Для этого кристаллы иода растирают в ступке до образования мелкого порошка, а затем на асбестированной сетке смешивают иод с алюминиевой пылью. Смесь, посуда и материалы должны быть совершенно сухими. Если после этого добавить к смеси каплю воды, которая является катализатором в этом процессе, то смесь воспламеняется и горит, выделяя фиолетовые клубы паров иода 2Аl + 3I2 = 2АlI3
Следует отметить, что иод реагирует с металлами труднее, чем хлор и бром. В отличие от большинства других простых веществ галогены в непосредственное взаимодействие с кислородом не вступают, так как кислород и галогены обладают близкими значениями электроотрицательности. Вместе с тем кислородные соединения галогенов косвенным путем получены и существуют.
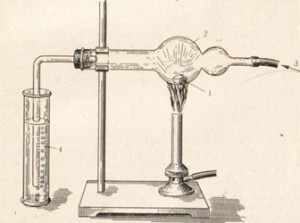
Рис. 23. Горение натрия в хлоре. 1- металлический натрий 2- хлоркальцивая трубка 3- хлор 4- едкий калий
■ 14. Докажите путем составления электронного баланса, что в реакциях с водородом и металлами галогены ведут себя как окислители. Обоснуйте такое поведение строением атома галогенов.
15. Какой объем хлористого водорода может быть получен при реакции с водородом 20 л хлора? (эта задача решается целиком в объемах). 16. Для того чтобы образующийся хлористый водород не был загрязнен хлором, при взаимодействии хлора с водородом последнего берут на 5% больше требуемого количества. Рассчитайте, какой объем водорода следует взять для получения 50 л хлористого водорода. (См. Ответ)
Статья на тему Галогены
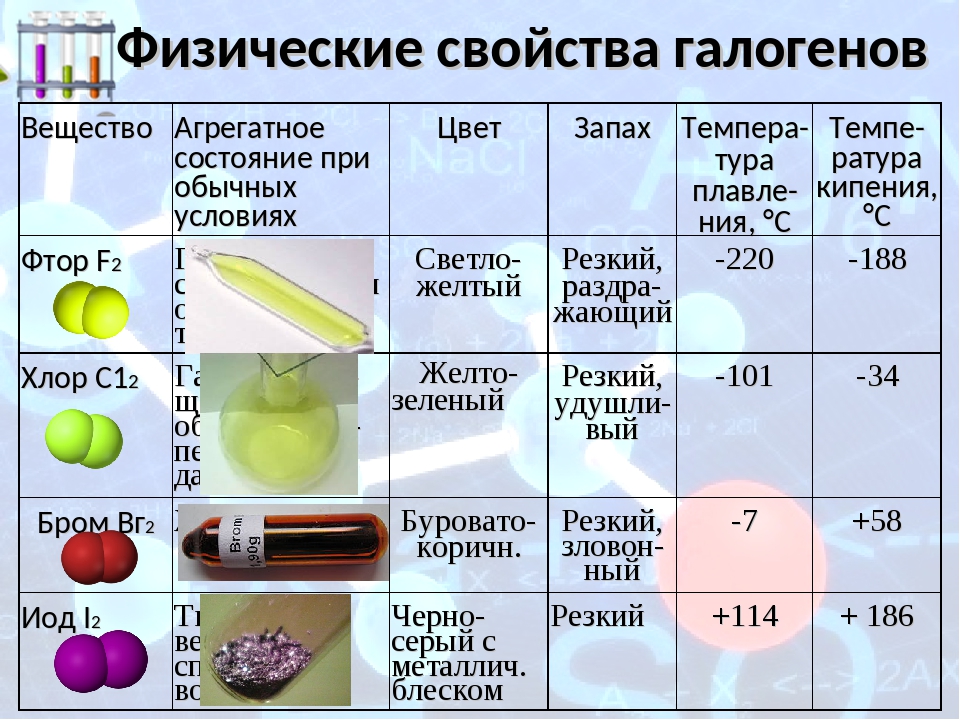
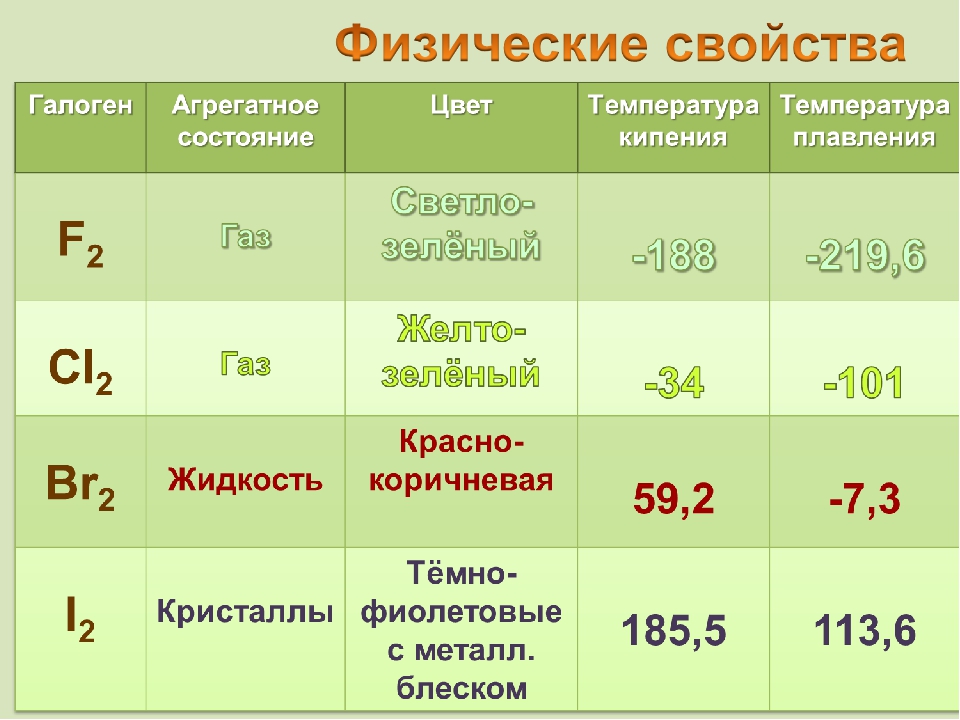
Физические свойства галогенов
Все свойства галогенов, как физические, так и химические, зависят от строения атомов элементов. Эти свойства различных галогенов во многом сходны, но в то же время каждому галогену присущ ряд особенностей. Фтор — газ светло-зеленого цвета, отличающийся чрезвычайно ядовитыми свойствами. Температура кипения фтора —188°, температура затвердевания —218°. Плотность 1,11 г/смъ. Хлор — газ желто-зеленого цвета. Он также ядовит, имеет резкий, удушливый, неприятный запах. Хлор тяжелее воздуха, сравнительно хорошо растворяется в воде (на 1 объем воды 2 объема хлора), образуя хлорную воду; Cl2agi при температуре— 34° превращается в жидкость, а при— 101° затвердевает. Плотность 1,568 г/см3.. Бром —единственный жидкий неметалл. Это вещество красно-бурого цвета, тяжелое, летучее. Сосуд, в котором находится бром, всегда окрашен его парами в красно-бурый цвет. Бром имеет тяжелый неприятный запах («бром» в переводе на русский язык значит «зловонный»). В воде растворяется плохо, образуя бромную воду Br2aq. Гораздо лучше бром растворяется в органических растворителях — бензоле, толуоле, хлороформе. Если к бромной воде прилить небольшое количество бензола и хорошенько взболтать, то после расслаивания жидкостей можно заметить, как окраска бромной воды исчезает, а собравшийся наверху бензол окрашивается растворенным бромом в ярко-оранжевый цвет. Это объясняется тем, что бензол извлек из воды бром вследствие его лучшей растворимости в бензоле. Хранят бром в склянках с притертыми пробками и притертыми колпаками. Резиновые пробки для работы с бромом, как и для работы с хлором, неприменимы, так-как они быстро разъедаются. Бром намного тяжелее воды (плотность 3,12 г/см3). Температура кипения брома 63°, температура затвердевания —7,3°. Йод — вещество кристаллическое, темно-серого цвета, в парах — фиолетового. Плотность йода 4,93 г/см3, температура плавления 113°, температура кипения 184°. Довести йод до плавления, а тем более до кипения при обычных условиях не удается, так как уже при слабом нагревании он из твердого состояния сразу переходит в пар —возгоняется. Переход вещества из твердого состояния в газообразное, минуя жидкое, и обратно называется возгонкой. Это свойство характерно не только для йода, но и для некоторых других веществ. Его удобно использовать для очистки веществ от примесей. Иод плохо растворяется в воде. Окраска йодной воды I2aq всегда светло-желтая. Но зато он прекрасно растворяется в спирте. Этим пользуются для приготовления 5—10% раствора иода в спирте, называемого йодной настойкой. Иод растворяется также в бензоле, толуоле, эфире, сероуглероде и других органических растворителях. Интересно, что иод очень хорошо растворяется в растворе собственных солей, например в йодистом калии. Этот раствор, называемый раствором Люголя, широко применяется в клинических лабораториях. Если в йодную воду I2aq добавить немного бензола, то при встряхивании на поверхности также образуется окрашенное бензольное кольцо, но только малинового цвета.
■ 7. Как меняется интенсивность окраски галогенов с возрастанием зарядов ядер? 8. Какое название имеют растворы хлора, брома и иода в воде? 9. Как меняется плотность галогенов с возрастанием зарядов ядер? (См. Ответ)
| Галоген | Заряд | Агрегаторное состояние | Плотность | Цвет |
Температура кипения |
Температура плавления |
Наилучшие растворители |
|
Фтор F Хлор Cl Бром Br Йод I |
10. Составьте и заполните таблицу «Физические свойства галогенов» по следующему образцу: 11. Как объяснить с точки зрения строения кристаллической решетки низкие температуры плавления и кипения галогенов? 12. Какова относительная плотность фтора и хлора по воздуху и водороду? Если вы не знаете, что такое относительная плотность газов, как она определяется и как ею пользоваться при расчетах, обратитесь к приложению II, стр. 387. После этого вы сможете ответить на вопрос. 13. Какой объем займут 20 кг хлора при нормальных условиях? Если вы забыли, как вычислять объем газа при нормальных условиях, обратитесь к приложению. (См. Ответ)
Химические свойства галогенов
Способность вступать в реакцию с разными веществами под воздействием сторонних факторов индивидуальна для каждого из рассматриваемых элементов.
 Химические особенности солеродов
Химические особенности солеродов
При вступлении галогенов в связь с медью (малоактивный металл) получаются галогениды с формулой:
CuHal2, где Hal2 – солероды Br, Cl, F.
Когда галогениды вступают в реакцию с галогенами, то тот солерод, который активнее, вытесняет малоактивный из его же раствора. Хлор, являясь окислителем, вступает во взаимодействие в смесях солей йода и брома. Бром не реагирует на хлориды, но может из иодидов выдавить йод.
При воздействии на органические соединения при хлорировании воды или йодировании соли происходит галогенирование. При этом атом галогена вводится в соединение. Галогенирование может осуществляться замещением, расщеплением или присоединением атома солерода к атомной структуре органических соединений.
Области применения
Соединения галогенов широко применяются человеком в самых разнообразных областях деятельности. Природный криолит (Na3AlF6) используют для получения Al. Бром и йод в качестве простых веществ часто используют фармацевтические и химические компании. При производстве запчастей для машин часто используют галогены. Фары – это одна из таких деталей
Качественно выбрать материал для данной составной части машины очень важно, так как фары освещают дорогу в ночное время и являются способом обнаружения как вас, так и других автомобилистов. Одним из лучших составных материалов для создания фар считается ксенон
Галоген тем не менее ненамного уступает по качеству этому инертному газу.

Хороший галоген – это фтор, добавка, широко используемая при производстве зубных паст. Он помогает предотвращать возникновение заболевания зубов – кариеса.
Такой элемент-галоген, как хлор (Cl), находит свое применение в получении HCl, часто используется при синтезе органических веществ, таких как пластмасса, каучук, синтетические волокна, красители и растворители и т. д. А также соединения хлора используют в качестве отбеливателей льняного и хлопчатобумажного материала, бумаги и как средство для борьбы с бактериями в питьевой воде.

Физиологическое действие галогенов
Все галогены ядовиты по своему физиологическому действию. Особенно ядовит фтор: при вдыхании в небольших количествах он вызывает отек легких, в больших — разрушение легочной ткани и смерть. Хлор — также вещество очень ядовитое, хотя в несколько меньшей степени. Во время первой мировой войны он применялся как боевое отравляющее вещество, потому что он тяжелее воздуха и хорошо удерживается над поверхностью земли, особенно при безветренной погоде. Предельно допустимая концентрация свободного хлора в воздухе 0,001 мг/л. Хроническое отравление хлором вызывает изменение цвета лица, легочные и бронхиальные заболевания. При отравлениях хлором в качестве противоядия нужно применять смесь паров спирта с эфиром, а также водяных паров с примесью нашатырного спирта, причем предварительно обязательно вынести пострадавшего на свежий воздух. В небольших же количествах хлор может излечивать заболевания верхних дыхательных путей, так как губительно действует на бактерии. Благодаря дезинфицирующему действию хлор применяется для обеззараживания водопроводной воды. Пары брома вызывают удушье. Ядовит и жидкий бром, причиняющий при попадании на кожу сильные ожоги. Переливать бром из одного сосуда в другой рекомендуется в резиновых перчатках и под тягой. При попадании на кожу бром следует смывать органическим растворителем — бензолом или четыреххлористым углеродом, протирая пораженное место ватой, смоченной этими растворителями. При смывании брома водой нередко ожога избежать не удается.
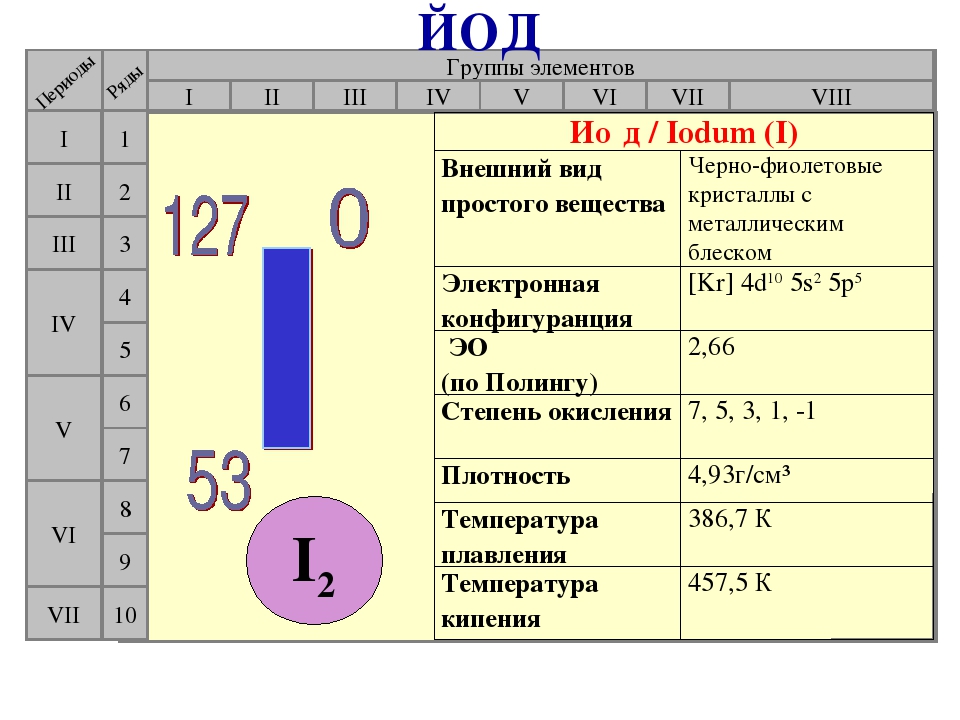
Иод наименее ядовит из всех галогенов. Вдыхание паров иода при его нагревании может вызвать отравление, но работать с парообразным иодом приходится редко, например при очистке его возгонкой. Кристаллический иод руками брать не следует, так как при попадании на кожу он вызывает появление характерных желтых пятен. Все работы с галогенами следует производить в вытяжном шкафу. Вместе с тем галогены являются жизненно важными элементами. Хлор в виде поваренной соли постоянно применяется в пищу, а также входит в состав зеленого вещества растений — хлорофилла. Недостаток соединений фтора в питьевой воде вызывает разрушение зубов. Иод необходим всем живым организмам, как растительным, так и животным. Он участвует в регулировании обмена веществ. В организме человека иод сосредоточен главным образом в щитовидной железе и участвует в образовании ее гормона. Недостаток иода вызывает болезненные изменения щитовидной железы. Для предотвращения заболевания в пищу в очень небольших количествах добавляют иод, разводя несколько капель йодной настойки на стакан воды, но чаще в виде иодида натрия и иодида калия.
• Запишите в тетрадь меры техники безопасности в работе с галогенами и первой помощи при отравлениях.
О галогенах
Из галогенов лишь йод способен обладать признаками свойств, характеризующих металлы. Другие вещества (бром, хлор, астат и фтор) лишены даже косвенных признаков металлов. Когда в 1811 году И. Швейггер, немецкий химик, предложил так называть новое выделенное вещество – хлор, название не прижилось. С 1841 года галогенами стали называть всю группу «солеродов». Так переводится с греческого языка слово галогены.
Можно лучше понять, что такое галоген, если охарактеризовать каждый из элементов, входящих в этот ряд:
- Фтор (F) – содержится в солях горных пород. Преимущественно им насыщены криолит, шпат плавиковый и минералы флюорита;
- Хлор (Cl) – популярный из галогенов, в мире имеется в хлориде натрия, являющегося главным сырьём для хлористых соединений;
- Бром (Br) – элемент, встречающийся в морских водах и солёных водоёмах в качестве соли калия и натрия в сочетании с сульфатами хлора;
- Йод (I) – встречается повсеместно, больше всего йода в морской капусте и водорослях;
- Астат (At) – искусственное вещество в природе не встречается, получают в результате оседания частиц при облучении висмута или тория.
К сведению. Хлорид натрия (NaCl) – один из источников хлора. В быту называется поваренной солью. Присутствует в водной жидкости моря, в естественном состоянии находится как серый минерал – галит.
 Кристаллы каменной соли
Кристаллы каменной соли
Особенности атомной и молекулярной структуры галогенов
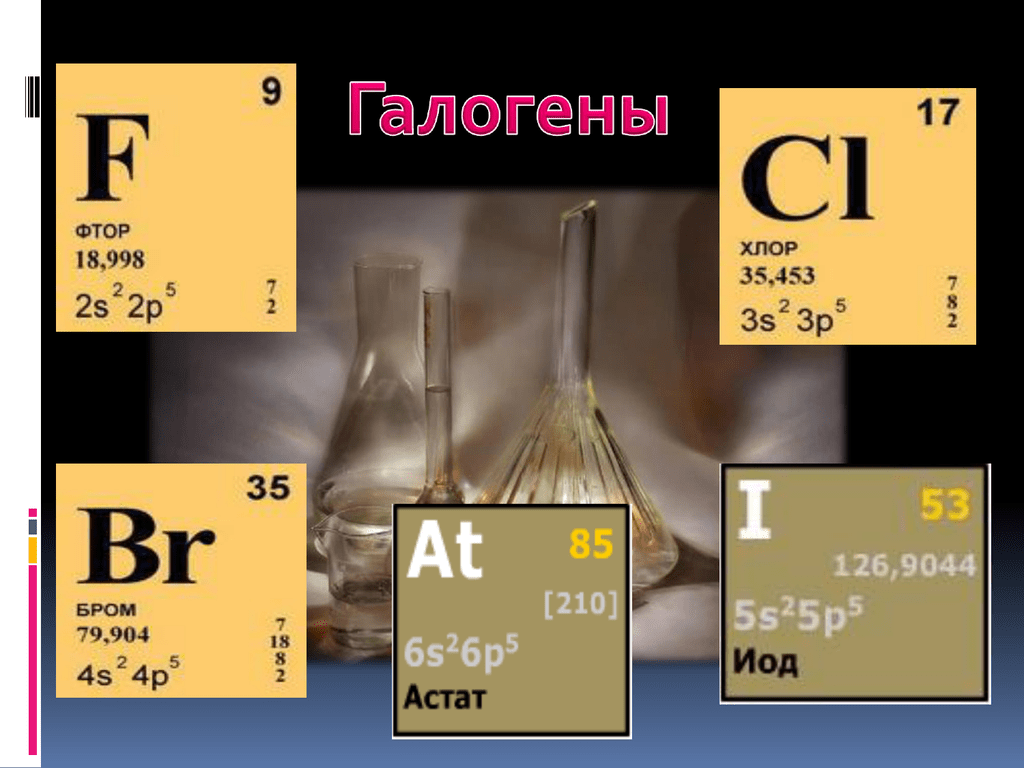
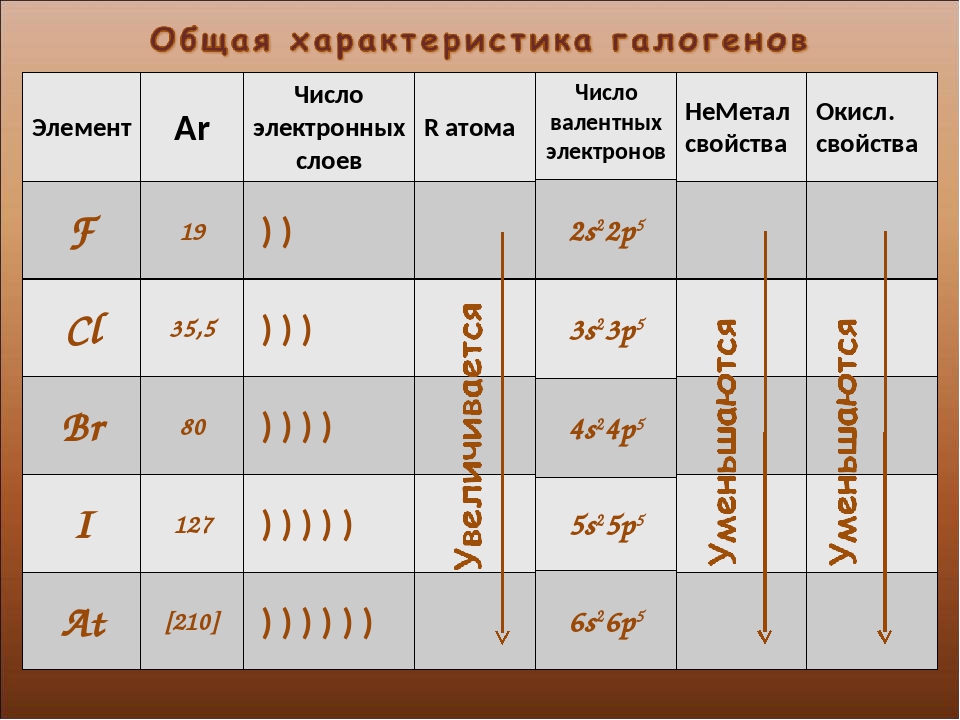
Элементы группы галогенов очень сходны по свойствам, поэтому рассматриваются вместе. Несколько отличен от других фтор. «Галогены» в переводе означает «солероды». Действительно, все галогены — фтор F, хлор Сl, бром Вr и иод I — при непосредственном взаимодействии с металлами образуют соли. Галогеном является и астат At, открытый в 1940 г. Электронные конфигурации галогенов: F — 1s22s22p5; Cl — 1s22s22p63s23p5; Br — 1s22s22p63s23p63d104s24p5; I — 1s2s22p63s23p63d104s24p64d105s25p5.
| Галоген | Атомный вес | Заряд ядра | Число электронов | Величина атомного радиуса,Å | ||||
| К | L | М | N | О | ||||
|
Фтор F Хлор Сl Бром Вг Иод I |
18,98 35,45 79,90 126,90 |
+9 + 17 + 35 +53 |
2 2 2 2 |
7 8 8 8 |
7 |
7 |
7 |
0,71 0,99 1,14 1,33 |
Распределение по орбиталям электронов внешнего электронного слоя у всех галогенов однотипное
Галогены имеют много общего в строении атомов и молекул. У них завершается застройка р-оболочки внешнего слоя, поэтому все они принадлежат к числу р-элементов. Внешнему электронному слою атомов галогенов недостает до завершения одного электрона, поэтому электроотрицательность у этих элементов выражена ярко и в окислительно-восстановительных реакциях они ведут себя в основном как окислители. Молекулы галогенов состоят из д вух атомов (F2, Сl2, Вr2, l2), соединенных между собой посредством ковалентной неполярной связи. Между атомами в молекулах галогенов возникает одна общая электронная пара. Это свидетельствует о том, что в простых веществах данные элементы одновалентны. Кристаллическая решетка галогенов молекулярного типа. Атомы разных галогенов различаются числом электронных слоев, в связи с чем радиусы атомов галогенов различны (табл. 11). С возрастанием зарядов ядер радиусы атомов увеличиваются, что ведет к постепенному уменьшению величины электроотрицательности от фтора к иоду и снижению неметалличности свойств. Наиболее ярко выраженным неметаллом среди галогенов является фтор, наименее ярким — йод.
■ 1. Как меняется величина атомного радиуса в зависимости от возрастания заряда ядра атома? 2. Какого типа химическая связь в молекулах галогенов? 3. Какого типа кристаллическая решетка у галогенов? 4. Какова валентность галогенов в свободном состоянии? 5. Почему при образовании молекулы галогена между атомами возникает лишь одна электронная пара? 6. Как меняется величина электроотрицательности с возрастанием радиусов атомов? (См. Ответ)
Перечень галогенов
Галогены являются хорошими окислителями, по этой причине в природе их можно встретить только в каких-либо соединениях. Чем выше порядковый номер, тем химическая активность элементов этой группы меньше. К группе галогенов относятся нижеперечисленные элементы:
- хлор (Cl);
- фтор (F);
- иод (I);
- бром (Br);
- астат (At).
Последний разработан в институте ядерных исследований, который расположен в городе Дубна. Фтор относится к ядовитым газам бледно-жёлтого цвета. Хлор также ядовит. Это газ, имеющий довольно резкий и неприятный запах светло-зелёного цвета. Бром имеет красно-бурый окрас, это ядовитая жидкость, которая может даже поражать обоняние. Он очень летуч, поэтому его хранят в ампулах. Йод — кристаллическое легко возгоняющееся вещество тёмно-фиолетового цвета. Астат радиоактивен, цвет кристаллов: чёрный с синевой, период полураспада составляет 8,1 часа.