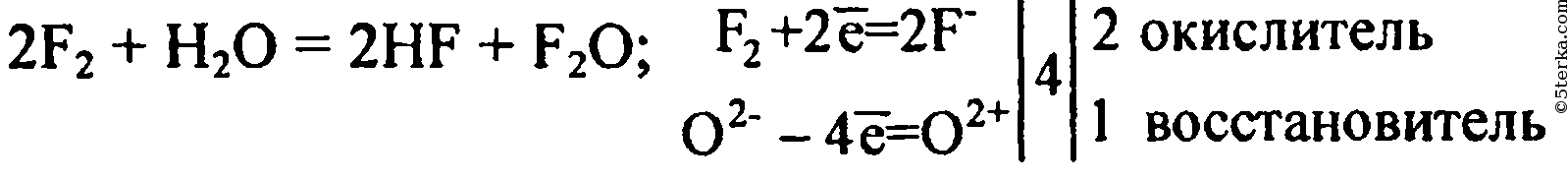Тефлон
Случайные открытия играют большую роль в научных исследованиях. Примером удачной и очень прибыльной случайности может служить материал тефлон – пластик, изготавливаемый компанией DuPont Chemical Company. Он стал важным коммерческим продуктом, потому что к нему практически почти ничего не прилипает. Сегодня у каждого есть сковороды, внутренняя поверхность которых покрыта этим материалом, поскольку во время готовки пища не пригорает. Кроме того, тефлоновые сковороды не нуждаются в растительном или животном масле.

Тефлон был случайно обнаружен в 1938 г. химиком компании «Дюпон» Роем Планкеттом (1911-1994), который занимался разработкой хлорфторуглеродов (ХФУ). Он хотел узнать, что произойдет, если смешать тетрафторэтилен (ТФЭ) C2F4 с хлорной кислотой. Для проведения эксперимента он установил оборудование таким образом, чтобы газообразный ТФЭ должен был поступать в емкость с HCl. Но когда он открыл вентиль, ничего не произошло. Планкетт мог выбросить сосуд, но он этого не сделал. Вместо этого химик распилил его и обнаружил, что ТФЭ полимеризовался в одну массу, т. е. тысячи отдельных молекул ТФЭ объединились в одну, называемую политетрафторэтиленом (ПТФЭ).
Планкетт выскреб образовавшийся белый порошок и отправил его ученым «Дюпона», занимавшихся разработкой искусственных волокон. Они изучили новый материал и обнаружили его антипригарные свойства. Вскоре для нового материала началась разработка ряда применений.
Компания DuPont зарегистрировала торговую марку Teflon в 1945 г. и через год выпустила свои первые продукты. С тех пор антипригарное покрытие стало обычным на кухонной посуде, тефлон появился в спреях для выпечки и в качестве защиты от пятен для тканей и текстиля.
Нахождение в природе
В свободном состоянии элемент фтор не встречается. Наиболее распространенными фторсодержащими минералами являются плавиковый шпат, фторапатит и криолит. Апатит представляет собой сложный минерал, содержащий прежде всего кальций, фосфор и кислород, как правило, в соединении с фтором. Криолит также известен как гренландский шпат, поскольку остров Гренландия является единственным коммерческим источником этого минерала. В основном он состоит из натрийалюминийфторида Na3ALF6.
Главными мировыми производителями сырья для получения фтора являются Китай, Мексика, Монголия и Южная Африка. Соединенные Штаты когда-то добывали небольшое количество плавикового шпата, но последняя шахта была закрыта в 1995 г., и страна стала импортировать фторсодержащие руды.
В земной коре фтор содержится в изобилии. Его доля оценивается примерно в 0,06%. Это делает его примерно 13-м наиболее распространенным элементом в земной коре, что примерно соответствует содержанию марганца или бария.
Ложь в красивой упаковке
ftorid-natrija9Все больше ученых начинают заявлять, что одним из самых грандиозных обманов человечества является фторирование. Зубные пасты, вода насыщенная фтором – мы думаем, что это приносит пользу, обогащает зубную эмаль фтором, сохраняя наши зубы здоровыми и красивыми. На протяжении десятилетий ведущие ученые говорили о пользе фтора, велась пропаганда зубных паст с фтором, фторирование воды рекомендовалось и использовалось повсеместно.
Концерны давно уже смекнули, что лучший способ избавится от отходов промышленного производства – продать их людям, чтобы они эту гадость потребили внутрь, то есть съели. Одним из самых вопиющих глобальных преступлений этого рода – это программа фторирование воды и зубных паст на Западе. Токсические Фториды начали накапливаться в огромных количествах при развёртывании производства атомных бомб в рамках “Проекта Манхеттен”.
В штате Нью-Джерси на свалках концерна Дюпон начали накапливаться горы токсических фторидов, они стали смываться дождями и попадать в почву. Сразу вокруг пожухла и погибла вся растительность и домашние животные, и жители подали на компанию Дюпон в суд. Концерн Дюпон наняли юристов и врачей с заданием найти фториду какое-либо “лечебное применение”.
Таким образом, была высосана из пальца фальшивка о том, что фторид укрепляет зубы. В итоге концерн Дюпон не только вылез сухим из судебного иска, но и получил идеальную возможность избавляться от токсических отходов, продавая для внутреннего потребления людей. Миллиарды людей пьют с водой и едят с зубной пастой этот фторид натрия, и этот фторид не укрепил зубы ещё ни одному человеку.
Теперь приведём список токсических эффектов фторида натрия, применяемого для хлорирования воды и в зубные пасты. Большинство станций фторирования воды применяют вместе Алюминия сульфат и Фториды. Оба вещества, смешиваясь, образуют токсический Алюминия Фторид. Алюминий является инородным элементом для живого организма.
Он токсичен для почек и практически не выводится из организма, и накапливаясь в головном мозгу вызывает болезнь Альцгеймера или по-русски преждевременный старческий маразм. Фторид выпитой воды или из зубной пасты быстро всасывается в организм человека и по большей части концентрируется в местах скопления кальция, в костях и зубах.
ftorid-natrija10В начале 1980-х годов было обнаружено, что фторид стимулирует рост кости, но при этом вызывает костные деформации типа костных, в том числе и пяточных шпор. Несколько исследований связали рост переломов шейки бедра с потреблением фтора. Были опубликованы также данные, что фторид ингибирует и другие ферменты в дозе меньше, чем присутствует в питьевой воде.
Некоторые исследователи считают, что фториды – это канцерогены. Национальная лаборатория Агонны (США) в 1988 году опубликовала исследование о том, что фториды превращают нормальные клетки в раковые. Японский доктор Цуцуи показал, что фториды вызывают не только превращение нормальных клеток в раковые, но и генетические повреждения клеток в связи с чем он вреден беременным женщинам.
Даже правительственное исследование в самих США, проанализировав 156 случаев смерти от рака, пришло к выводу, что накапливаемый в тканях фторид так и ли иначе вызывает рак и другие смертельные болезни. Научная работа доктора Дина Бёрка – главного химика Национального Онкологического Центра США показала, что питьевым и находящимся в зубных пастах фтором непосредственно вызываются в США не менее десяти тысяч раковых смертей в год.
Исследование компании Проктер и Гэмбл показало, что концентрация фторида даже в половине концентрации, содержащейся в питьевой воде, вызывает генетические повреждения. В культурах тканей человека и подопытных мышей фторид вызывает хромосомные абберации. Доктор Джон Ямоянис считает, что от фторидного отравления умирает ежегодно 30-50 тысяч человек. (Dr.
John Yiamouyiannis The Aging Factor). В этой книге доктор Ямоянис показывает, что фторид вызывает повреждение иммунной системы человека, то есть, говоря своими словами, – вызывает синдром иммунодефицита, то есть способствует возникновению СПИДа. Он отмечает, что всеобщее угнетение фторидами ферментной системы человека вызывает преждевременное старение от тотального разрушения коллагена, то есть соединительной ткани, иммунной системы и генетики. Кроме этого, доказана связь фтора с бесплодием.
Свойства фтора
Фтор имеет следующие свойства:
- сильный и неприятный запах, напоминающий смесь хлора и озона;
- молекулу хлора образуют 4 связывающие и 3 разрыхляющие орбитали, порядок связи равен одному;
- по своему составу хлор является моноизотопным веществом, так как науке известен только один устойчивый изотоп фтора – F19, 17 радиоактивных изотопов и один ядерный изомер F18;
- при температуре от -188 до -288 это вещество превращается в жидкое или твердое состояние;
- в газообразном состоянии фтор не имеет цвета, в жидком – его цвет желтоватый, в твердом – желто-зеленый;
- фтор – мощный окислитель, он является самым легким веществом из всех галогенов;
- температура кипения этого вещества равна -188 градусам, плавления – — 219.
Дефицит вещества в организме
Нередко при недостаточном потреблении симптоматика развита слабо, негативные проявления возникают не сразу. Из-за этого люди часто обращаются к врачам лишь при запущенной стадии болезней.
Кости становятся хрупкими, ломкими, легче травмируются. Зубная эмаль тоже истончается, из-за чего повышается риск развития стоматологических патологий, кариеса. Ногти становятся ломкими, слоятся. Волосы тускнеют, секутся, изредка могут выпадать.
Поскольку при недостатке фтора снижается количество усваиваемого железа, концентрация гемоглобина в крови тоже становится низкой. Развивается анемия. Снижается острота зрения. Искривляется позвоночный столб. Иммунная система слабеет, человек начинает чаще болеть.
Суточная потребность фтора
Суточное потребление изменяется по мере взросления. Кроме того, нормы немного отличаются для мужчин и женщин. Разнятся дозировки и по весу: если масса тела ниже нормальной, потребление микроэлемента придется немного сократить.
Для детей
По мере взросления дозировка увеличивается. Младенцам до полугода в сутки необходимо употреблять всего 0,1 мг. С 7 до 12 месяцев дневная дозировка составляет 0,5 мг. Затем до 3 лет каждый день нужно получать по 0,7 мг вещества. С 4 до 8 лет дозировка составляет 1 мг, с 9 до 13 лет – 2 мг.

Для женщин
Достигшие 14 лет девушки нуждаются в 3 мг фтора ежедневно. Дозировка не меняется: такое же количество требуется и взрослым женщинам.
Промышленное применение
В атомарном и молекулярном состоянии фтор используется для плазменного травления в производстве полупроводников, плоских дисплеев и микроэлектромеханических систем. Плавиковая кислота применяется для травления стекла в лампах и других изделиях.
Наряду с некоторыми из его соединений, фтор – это важная составляющая производства фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Химический элемент необходим для получения галогенированных алканов (галоны), которые, в свою очередь, широко использовались в системах кондиционирования воздуха и охлаждения. Позже такое применение хлорфторуглеродов было запрещено, поскольку они способствуют разрушению озонового слоя в верхних слоях атмосферы.

Гексафторид серы – чрезвычайно инертный, нетоксичный газ, относящийся к веществам, вызывающим парниковый эффект. Без фтора невозможно производство пластмасс с низким коэффициентом трения, таких как тефлон. Многие анестетики (например, севофлуран, десфлуран и изофлуран) являются производными фторуглеводородов. Гексафторалюминат натрия (криолит) применяется в электролизе алюминия.
Соединения фтора, в том числе NaF, используются в зубных пастах для предотвращения кариеса. Эти вещества добавляются в системы муниципального водоснабжения для фторирования воды, однако из-за воздействия на здоровье человека эта практика считается спорной. При более высоких концентрациях NaF используются в качестве инсектицида, особенно для борьбы с тараканами.
В прошлом фториды применялись для снижения температуры плавления металлов и руд и повышения их текучести. Фтор – это важный компонент производства гексафторида урана, который применяется для разделения его изотопов. 18F, радиоактивный изотоп с периодом полураспада 110 минут, излучает позитроны и часто используется в медицинской позитронно-эмиссионной томографии.
Зубная паста – как выбрать?
Зубная паста – что может быть проще и более знакомым. Чистить зубы зубной пастой одно из первых чему учат родители детей. Но как купить хорошую натуральную зубную пасту, чтобы наш выбор был не навязан рекламой или привычкой? – необходимо проинформировать себя на предмет качества и состава – ингредиентов входящих в вашу зубную пасту.
Потому что очень часто получается так – покупает человек 10-ую по счёту зубную пасту, а воз и ныне там – ни отбеливания, ни ощутимого эффекта для чувствительных зубов, ни тем паче лечебного от зубной пасты – нет. А в рекламе говорилось , что это самая лучшая зубная паста, хотя о производстве, качестве и полном составе ни слова.
Рассмотрим вопрос выбора зубной пасты на примере очень популярного и часто рекламируемого компонента фтора. Зубная паста с фтором или без? Должен ли фтор содержаться в зубных пастах или нет? Этот вопрос горячо обсуждается. Согласно д-ру Р.Картону, бывшему учёному ЕРА, “Фторирование это величайший научный обман нашего века, если не всей истории”.
Дин Берк, бывший химик Национального Института рака США утверждает, что “фторирование вызывает больше смертей от рака, чем другие химические вещества”.
Д-р А.Е. Банник в своей книге “Выбор чистота”, утверждает: “Фторирование питьевой воды преступно, крайне ненаучно, это химическая война. Фтор не только не укрепляет зубы, от него также отвердевают артерии и мозг”. Фтор получают промыванием воздушной эмиссии фтора от расплавленных металлов или удобряемых фосфатами растений.
В 40-х годах, когда впервые предположили пользу фтора для профилактики разрушения зубов, алюминеплавильная промышленность убедила правительство добавлять фтор в воду удобный и экономичный путь избавиться от токсических отходов. Интересно отметить, что те исследования, на которых базировалось применение фтора для профилактики кариеса, позже выявились несостоятельными, возможно, фальсифицированными. Напротив, как показывает большинство исследований, ни фторированная вода, ни фторированные зубные пасты не уменьшают распад зубов.
Сегодня люди глотают огромное количество фтора из множества источников. Фтор не только в зубных пастах, но и в воде, напитках, соках, во всех продуктах, приготовленных с фторированной водой. Зубной флюороз, отравления фтором, характеризуется испещрением и размягчением зубной эмали. У 60% детей обнаружены эти симптомы. Не пользуйтесь зубными пастами с фтором. Гораздо лучше пасты с пополисом, миррой, пищевой содой или маслом чайного дерева
Д-р Дж. Йамуяннис в своей книге “Фтор фактор старения” пишет: “С таким союзником, как правда, легко победить. Правда в том, что фторирование хронически отравляет миллионы”. Этот выдающийся биохимик был редактором по биохимии Chemical Abstracts Service величайшего мирового химического информационного центра.
Особенностью хорошей зубной пасты является ультратонкий порошок двуокиси кремния, который прекрасно помогает удалить пятна с зубов, а также полирует зубы, не нарушая эмали. Выбор за вами.
Фторфосфат, фторид натрия, натрия монофторфосфат отсутствуют в таких зубных пастах, как: “Новый жемчуг с кальцием” (Россия), “Лесной бальзам”, “Кедровый бальзам”, “Splat”, “Sunshine Brite”, “ROCS” (Швейцария-Россия).
Польза или вред?
Некоторые беспокоятся о долгосрочном воздействии фторидов в общественном водоснабжении на здоровье населения. Они указывают на то, что фтор является смертельным ядом, и что его соединения также могут быть токсичными. Это правда, F2 очень опасен, но свойства соединений отличаются от составляющих их элементов. Так что беспокойство является беспочвенным.
Сильный характерный запах фтора позволяет обнаружить его утечку и избежать контакта с ним.
Фториды, как правило, опасны только в больших дозах. Их концентрация в воде обычно очень мала, всего несколько частей на миллион. Большинство экспертов в области стоматологии и здравоохранения считают, что такой фтор является полезным и не несет угрозу здоровью людей.
Получение, определение, использование
Промышленное производство фтора основано на методе Муассана. Электрический ток напряжением 8-12 В пропускают через смесь HF и KF с образованием H2 и F2.
Определение фтора в растворах производится методом потенциометрии, т. е. измерения электродного потенциала. Мембрана электрода изготавливается из монокристаллического LaF3, легированного дифторидами драгоценных металлов.
В элементарном состоянии фтор применяется относительно мало. Он слишком активен для этого. Используется в ракетном топливе, обеспечивая горение, подобно кислороду. Больше всего востребован в связанном состоянии. Фториды представляют собой соединения фтора с металлом. Примерами являются фторид натрия (NaF), кальция (CaF2) и олова (SnF2).
Важнейшие свойства фтора
В периодической таблице элемент находится в верхней части 17 группы (бывшая группа 7А), которую называют галогенной. К другим галогенам относятся хлор, бром, йод и астат. Кроме того, F находится во втором периоде между кислородом и неоном.
Чистый фтор – это коррозионный газ (химическая формула F2) с характерным резким запахом, который обнаруживается в концентрации 20 нл на литр объема. Как наиболее реактивный и электроотрицательный из всех элементов, он легко образует соединения с большинством из них. Фтор слишком реактивный, чтобы существовать в элементарной форме и имеет такое сродство с большинством материалов, включая кремний, что его нельзя готовить или хранить в стеклянных емкостях. Во влажном воздухе он реагирует с водой, образуя не менее опасную плавиковую кислоту.
Фтор, взаимодействуя с водородом, взрывается даже при низкой температуре и в темноте. Он бурно реагирует с водой, образуя плавиковую кислоту и газообразный кислород. Различные материалы, в том числе мелкодисперсные металлы и стекла, в струе газообразного фтора горят ярким пламенем. Кроме того, данный химический элемент образует соединения с благородными газами криптоном, ксеноном и радоном. Однако непосредственно с азотом и кислородом он не реагирует.
Несмотря на крайнюю активность фтора, сегодня стали доступны методы его безопасной обработки и транспортировки. Элемент может храниться в емкостях из стали или монеля (богатого никелем сплава), так как на поверхности этих материалов образуются фториды, которые препятствуют дальнейшей реакции.
Фториды – это вещества, в которых фтор присутствует в виде отрицательно заряженного иона (F-) в сочетании с некоторыми положительно заряженными элементами. Соединения фтора с металлами являются одними из наиболее стабильных солей. При растворении в воде они делятся на ионы. Другими формами фтора являются комплексы, например, [FeF4]-, и H2F+.

История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», — по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления шлака при восстановлении металлов из руд и увеличивать текучесть его расплава).
Недостаток фтора в организме
Поскольку основным источником фтора для человека является вода, необходимо следить за тем, чтобы этот элемент содержался в ней в достаточном количестве.
Недостаток фтора в организме может выражаться следующими симптомами:
- секущиеся кончики, ломкость, сухость и выпадение волос:
- развитие кариеса, повышенная чувствительность эмали, крошение зубов, повышенная стираемость, эрозии и некрозы десен;
- частые и повторные переломы, трещины и трудности со срастанием костей, что может быть признаком остеопороза;
- подверженность простудным и вирусным заболеваниям по причине ослабленного иммунитета.
Наиболее эффективным способом устранения недостатка фтора в организме является замена источника питьевой воды. Необходимо выбирать бутилированную воду с содержанием данного элемента. При значительном дефиците фтора, подтвержденном анализами, назначается соответствующая терапия. Улучшить состояние зубов можно при помощи фторсодержащей пасты, подбирать которую должен профессиональный стоматолог.
Способ восполнения минерала выбирается исходя из симптоматики и наличия либо отсутствия сопутствующих заболеваний и противопоказаний. Рассчитывая дозировку того или иного препарата для пополнения запасов фтора, следует избегать превышения дозы, так как этот элемент содержится в некоторых продуктах, воде и витаминах. По этой причине лучше обратиться к врачу для выбора необходимого средства и его дозировки.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
-
- 2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑{\displaystyle {\mathsf {2K_{2}MnF_{6}+4SbF_{5}\rightarrow 4KSbF_{6}+2MnF_{3}+F_{2}\uparrow }}}
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
История открытия
Химия всегда была опасной наукой. А ранняя химия являлась смертельно опасным занятием. Ученые работали с веществами, о которых они знали очень мало. Открытие новых соединений и элементов часто имело трагические последствия.
Фтор является чрезвычайно опасным веществом. Пытаясь изолировать элемент, химики получали ужасные ожоги и даже умирали. Газ фтор повреждает мягкие ткани дыхательных путей.
В начале 1500-х годов немецкий ученый Георгий Агрикола (1494-1555) описал плавиковый шпат, который назвал «флюоритом». Это слово происходит от латинского глагола fluere («течь»). Агрикола утверждал, что плавиковый шпат, добавленный к расплавленным металлическим рудам, делал их более жидкими, что облегчало работу с ними. Немецкий ученый не знал, что данный минерал содержит фтор в виде фторида кальция (CaF2).
Флюорит стал предметом интенсивного изучения. В 1670 г. немецкий стеклодув Генрих Шванхард обнаружил, что смесь плавикового шпата и кислоты образует вещество, которое можно использовать для травления стекла, т. е. химической реакции образования матовой поверхности. Этот процесс используется для нанесения на стекло узоров, а также для создания точных научных измерительных приборов.
В 1771 г. шведским химиком Карлом Вильгельмом Шееле (1742-86) было найдено новое вещество для травления. Он подробно описал свойства фтористоводородной кислоты (HF). Работа Шееле способствовала интенсивному изучению этого соединения.
Химики искали способы разложить фтористоводородную кислоту на составляющие. Они предполагали, что должен быть обнаружен элемент, которого они никогда не видели прежде. Однако они не знали, что такое фтор и каким опасным он является. Многие исследователи фтористоводородной кислоты стали инвалидами, вдохнув газообразный HF. Один из них, бельгийский химик Paulin Louyet (1818-1850), умер от воздействия этого вещества.

Наконец, в 1888 г. проблема была решена. Французский химик Анри Муассан получил раствор фтористоводородной (HF) кислоты во фториде калия (KHF2). Затем он охладил его до -23 °C и пропустил через него электрический ток. На одном конце аппарата появился газ. Новый химический элемент получил название fluorine, производное от латинского наименования плавикового шпата. Слово «фтор» в 1810 г. предложил Андре Ампер. Оно имеет греческое происхождение и означает «разрушение».
Примечания
- ↑
- ↑
- Главным образом в эмали зубов
- Ахметов Н. С. «Общая и неорганическая химия».
- Pauling L., Keaveny I., Robinson A. B. J. Solid State Chem., 1970, Vol. 2, Issue 2, p. 225—227.
- J. Chem. Phys. 49 (1968) 1902.
- Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- Гринвуд Н., Эрншо А. «Химия элементов» т. 2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- По данным National Toxicology Program
- в виде фторидов и фторорганических соединений
- Н. В. Лазарев, И. Д. Гадаскина. «Вредные вещества в промышленности». Том 3, страница 19.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Электронное строение
Применение метода МО для молекулы F2
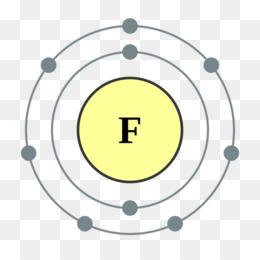
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
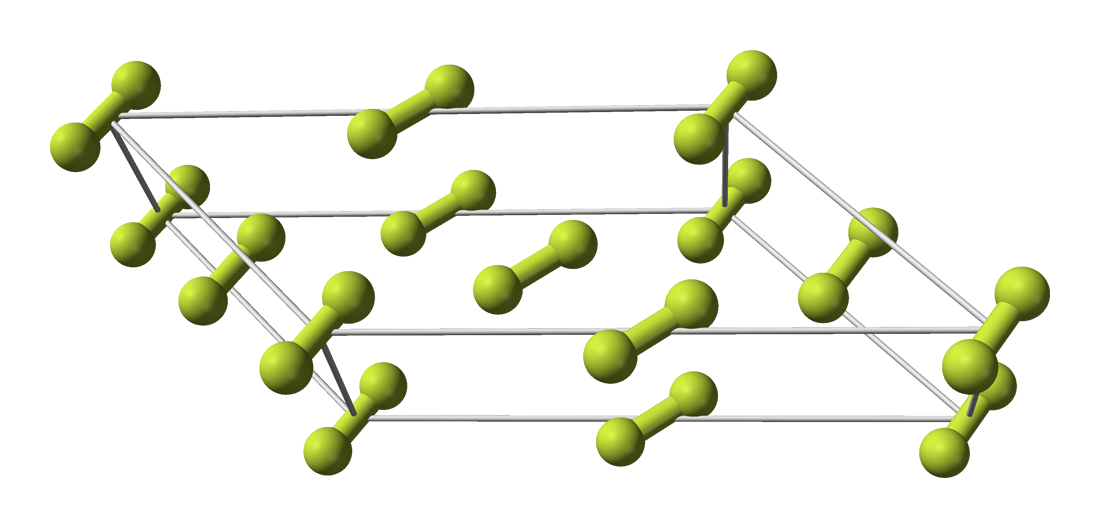
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре ниже 45,6 K, кристаллическая решетка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4, d = 1,97 г/см3;
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубической сингонии, параметры ячейки a = 0,667 нм, Z = 8, d = 1,70 г/см3.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Защита для зубов
Фтор входит в состав зубных паст. Исследования показали, что небольшое количество фторидов может помочь снизить заболеваемость кариесом. Они осаждаются по мере образования нового материала зуба, что делает его сильным и устойчивым к разрушению.
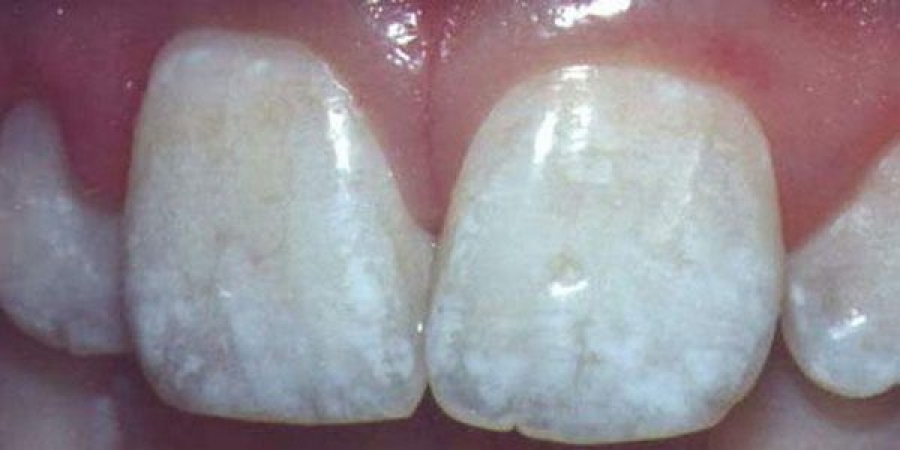
В некоторых городах фториды добавляются в систему водоснабжения. Поступая таким образом, власти надеются улучшить стоматологическое здоровье горожан. Больше всего от этого выигрывает молодежь, чьи зубы все еще развиваются. Процесс добавления фторидов в систему водоснабжения называется фторированием. Слишком большое содержание фтора в воде приводит к потемнению зубов и появлению постоянных пятен.

Противокариозное действие фтора –
Фтор является одним из самых распространенных веществ на земле (13-ое место). Ионы фтора есть в организме каждого человека в определенной концентрации – они попадают к нам в организм преимущественно в составе куриного мяса, рыбы, злаков, чая и вина, молочных и других продуктов
И что самое важное для зубов – ионы фтора после всасывания в кишечнике будут находиться не только в сыворотке крови, но и в секрете слюнных желез – в слюне. Почему это важно…
Дело в том, что эмаль зубов состоит из вещества с высоким содержанием кальция – гидроксиапатита. Кариесогенные бактерии полости рта, метаболизируя пищевые остатки, производят молочную кислоту, которая снижает рН ротовой жидкости (т.е. увеличивает ее кислотность). Когда рН ротовой жидкости падает ниже критического уровня, а для гидроксиапатита зубной эмали критическим уровнем является рН 5,5 – происходит процесс деминерализации, т.е. растворения кристаллов гидроксиапатита.
Ионы фтора, содержащиеся в слюне или поступающие вместе с зубной пастой, способны уменьшать степень деминерализации эмали при кислом pH 5,5 и ниже. Дело в том, что ионы фтора адсорбируются на поверхности кристаллов гидроксиапатита, превращая его в новое соединение – «фторгидроксиапатит». Это соединение уже намного более устойчиво к кислотам, чем обычный гидроксиапатит (критическим значением pH для него будет уже не 5,5, а примерно – 4,5).
Важно: как только вы выпили сладкий напиток или не почистили зубы после еды – бактерии начинают перерабатывать сахара/ пищевые остатки, выделяя молочную кислоту. Эта кислота и является пусковым фактором в возникновении кариеса
Ионы фтора делают эмаль зубов менее восприимчивой к воздействию кислоты (препятствуют растворению гидроксиапатита кислотой). Поэтому, содержащиеся в слюне ионы фтора, в также фтор в зубной пасте – позволяют снизить риск развития кариеса.
В каких продуктах содержится фтор?
Источники фтора необходимо включать в рацион ежедневно. Их длительное отсутствие приведет к дефициту, негативно повлияет на функционирование внутренних органов и систем. Однако не следует есть и слишком много, поскольку избыточное содержание фтора в продуктах тоже приведет к нежелательным последствиям, к ухудшению состояния. Рекомендуется комбинировать разные продукты, чтобы получать достаточное количество и других полезных веществ.
Подбирать следует только полезные источники. Фторированная вода и вино с обработанных пестицидом криолитом виноградников тоже нередко содержат немало вещества, но для организма они вредны, употреблять их в пищу не рекомендуется.

Растительного происхождения
Содержание микроэлемента в еде можно увидеть в специальных таблицах. Больше всего вещества содержится в рыбе, морепродуктах. Но продукты, богатые фтором, могут быть растительными
Особенно важно включать их в меню вегетарианцам, веганам
| Продукт | Содержание микроэлемента, мкг/100 г |
| Грецкий орех | 685 |
| Соя | 120 |
| Овес | 117 |
| Ячмень | 106 |
| Миндаль | 91 |
| Тыква | 86 |
| Пшеница, рис | 80 |
| Рожь | 67 |
| Белые грибы, перловая крупа | 60 |
| Лисички | 55 |
| Фасоль | 44 |
Продукты, содержащие фтор, следует регулярно употреблять в пищу. Полезно также пить черный, зеленый и белый чаи. Эти напитки богаты микроэлементом, содержат антиоксиданты.
Пить допустимо и минеральную воду: на 100 мл может приходиться до 0,8 мг вещества.
Следует добавить в рацион и травяные чаи, отвары лекарственных растений. Особенно высоко содержание микроэлемента в мятном и шиповниковом отварах. Ромашковый тоже содержит фтор, хотя концентрация его намного меньше.

Животного происхождения
Концентрация фтора в пище животного происхождения.
| Продукт | Содержание микроэлемента, мкг/100 г |
| Скумбрия | 1400 |
| Минтай, треска | 700 |
| Вобла, кета, камбала, горбуша, ставрида, семга, килька | 430 |
| Сельдь | 380 |
| Яичный порошок | 200 |
| Угорь | 160 |
| Обезжиренное сухое молоко | 150 |
| Морской окунь | 140 |
| Куриное мясо | 130 |
| Баранина | 120 |
| Жирное сухое молоко | 110 |
| Креветки, тунец | 100 |
| Свинина | 69 |
| Говядина | 63 |
| Куриное яйцо | 55 |
| Сгущенное молоко | 35 |
| Творог | 32 |
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.