Лечение
Лечение апластической анемии, несмотря на кажущиеся одинаковыми симптомы, врачи назначают в зависимости от предполагаемого главного фактора в этиологии болезни.
Впервые выявленные случаи обязательно лечатся в гематологическом отделении стационарно. Только специализированная терапия позволяет подобрать нужную дозировку и оптимальный препарат.
Основные методики:
- переливание донорской крови или отдельных элементов с замещающей целью;
- пересадка костного мозга;
- лекарства, активизирующие кроветворение.
Для переливания используют цельную кровь, эритроцитарную и тромбоцитарную массу, гранулоциты. Их готовят на «Станциях переливания» из крови доноров. Метод считается временным, поскольку просто восполняет недостающее количество собственных кровяных клеток, но не действует на костный мозг. Если доказан аутоиммунный механизм патологии, его применять нельзя. Организм вырабатывает антитела на чужеродные клетки.
Частые переливания приводят к накоплению железа и его отложению во внутренних органах, нарушая их работу. Это вынуждает добавлять препараты, способствующей выведению железа из крови.
 Забор костного мозга для трансплантации проводится в условиях операционной проколами бедренной кости, шприцами отсасывается до 2л массы
Забор костного мозга для трансплантации проводится в условиях операционной проколами бедренной кости, шприцами отсасывается до 2л массы
Трансплантация костного мозга является самым результативным способом лечения. Перед процедурой прекращают переливания крови, чтобы снизить возможность отторжения. Донором может стать родственник с одногруппной кровью и индивидуальной совместимостью. Метод более показан в молодом возрасте пациента.
Перед пересадкой проводится лучевая и химиотерапия. Необходимо подавить возможный иммунный ответ на отторжение стволовых клеток донора. Метод проводится только в специализированных отделениях, является дорогостоящим.
В качестве иммунодепрессантов используют: Циклоспорин, антимоноцитарный и антилимфоцитарный глобулины. Комплексным препаратом этой группы является Атгам (содержит необходимые антиглобулины). Он показан в случаях невозможности пересадки костного мозга. Для предупреждения анафилактических реакций применяют кортикостероиды.
Стимуляцию кроветворения в костном мозге осуществляют применением таких препаратов, как Филграстим, Лейкомакс. Они активизируют выработку гранулоцитов, поэтому показаны только при лейкопении. Курс лечения – две недели.
Доказана способность мужских половых гормонов (андрогенов) стимулировать все ростки крови. Для лечения мужчин применяются длительные курсы Тестостерона пропионата, Сустанона.
Удаление селезенки дает эффект у 85% больных. Метод основан на механизме прекращения выработки антител на собственные клетки. Можно проводить всем пациентам, не имеющим инфекционных осложнений.
 Лекарства вводят преимущественно в инъекциях
Лекарства вводят преимущественно в инъекциях
Если у больного имеется кровоточивость, вводятся кровоостанавливающие средства: Дицинон, Аминокапроновая кислота.
Выведения железа из организма добиваются с помощью Десферала.
От лечения апластической анемии народными средствами следует отказаться. Эта патология требует очень вдумчивого и точного учета лекарственных препаратов. А как можно просчитать полезные составляющие в растениях? Есть упоминания о стимулирующем действии чеснока, лугового клевера, редьки, моркови и свеклы. Но оно настолько мало, что применение только вызывает необоснованные надежды у пациентов и родственников.
Симптомы и признаки апластической анемии
Хотя начало апластической анемии, как правило, постепенное, часто спустя несколько недель или месяцев после воздействия токсина, однако в некоторых случаях дебют заболевания может быть острым. Признаки анемии (к примеру, бледность) обычно являются ярко выраженными.
Тяжелая тромбоцитопения может сопровождаться образованием петехий и экхимозов, кровотечениями из десен, конъюнктивы и других тканей. Агранулоцитоз обычно приводит к возникновению жизнеугрожающих инфекций. Спленомегалия отсутствует до момента развития трансфузионного гемосидероза.
Клиническая картина состоит из ряда быстро нарастающих тяжелых синдромов.
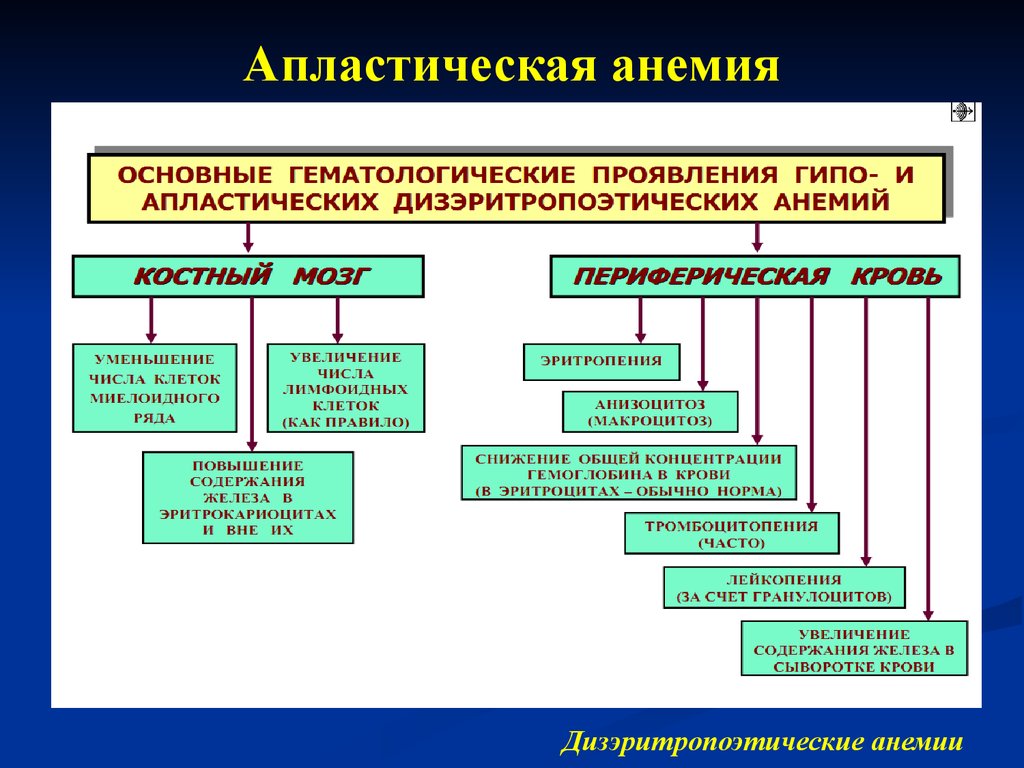
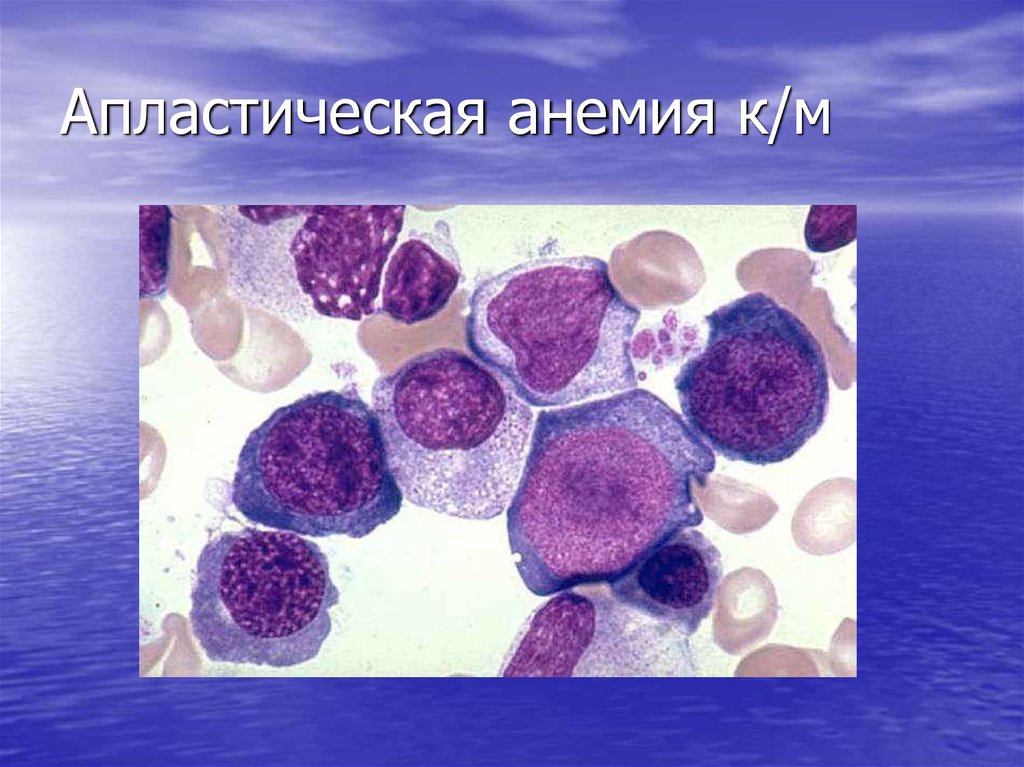
Анемический синдром характеризуется развивающимся па глазах побледнением больных, губы обескровливаются и по цвету почти не отличаются от кожи, ушные раковины бледны. Больные жалуются на одышку, частые обмороки. Гемоглобин каждые два-три дня падает на -5—8%, снижаясь через немного недель до катастрофически низких цифр— 10—8% и ниже. Признаки повышенного распада крови отсутствуют: нет следов желтушности, сыворотка крови бесцветна, дуоденальная желчь слабо окрашена, селезенка не увеличена. Эритроциты сохраняют нормальную форму и окраску, цветной показатель близок к единице, пойкилоцитоз и анизоцитоз отсутствуют; несмотря на резкую анемию, не удается обнаружить регенеративные формы: ядерные эритроциты, полихроматофилы, ретикулоциты. В пунктате костного мозга не находят молодых форм, что подтверждает паралич кроветворения.
Геморрагический синдром тромбопенического типа проявляется бурно нарастающими петехиями, экхимозами на коже и слизистых, упорными, требующими тампонады носовыми кровотечениями, кровавой рвотой, меленой, гематурией. Кровоизлияния в коже легко вызвать, ущипнув кожу или перетянув конечность жгутом; обычный укол иглой при подкожном введении лекарств уже дает кровоподтеки и т. д. В мазке крови отсутствуют пластинки, а в пунктате костного мозга—мегакариоциты; ретракция кровяного сгустка не наступает; время кровотечения резко удлинено. Свертываемость крови изменяется мало.
Некротически-язвенный синдром характеризуется тягостным поражением миндалин, неба, десен, слизистой щек и т. д., как при острой лейкемии,—характера номы за счет фузоспириллярного симбиоза.
Больные жалуются на кровотечение из десен, foetor ex ore, не могут глотать пищу, при распаде небной занавески поперхиваются даже при попытке пить и т. д. Изъязвления могут локализоваться и на коже, в фолликулах кишечника, вызывая болезненные явления со стороны живота и т. д. Число нейтрофилов падает до немногих сотен в 1 мм3 или они полностью исчезают так же, как и эозинофилы. Вследствие этого агранулоцитоза (т. е. отсутствия зернистых форм лейкоцитов—нейтрофилов и эозинофилов в первую очередь) и происходит внедрение в ткани анаэробных и гноеродных возбудителей, что часто приводит к смертельному сепсису. Общее число лейкоцитов падет до 1 000—800 и ниже. Лимфоциты относительно преобладают, составляя до 85—90% всех белых шариков.
Селезенка, лимфатические узлы, печень не увеличены, нет усиления кроветворения и в костном мозгу; грудина и ребра безболезненны при поколачивании. Ахилии желудка не находят. Отсутствуют и признаки органического поражения нервной системы.
При быстром течении болезни постоянным признаком является изнуряющая лихорадка, особенно в терминальной стадии. Больные адинамичны, испытывают крайнюю слабость; жалобы могут вариировать от случая к случаю, в зависимости, например, от различных локализаций кровоизлияний — в забрюшинной клетчатке, в мозговых оболочках и т. д.
Классификация
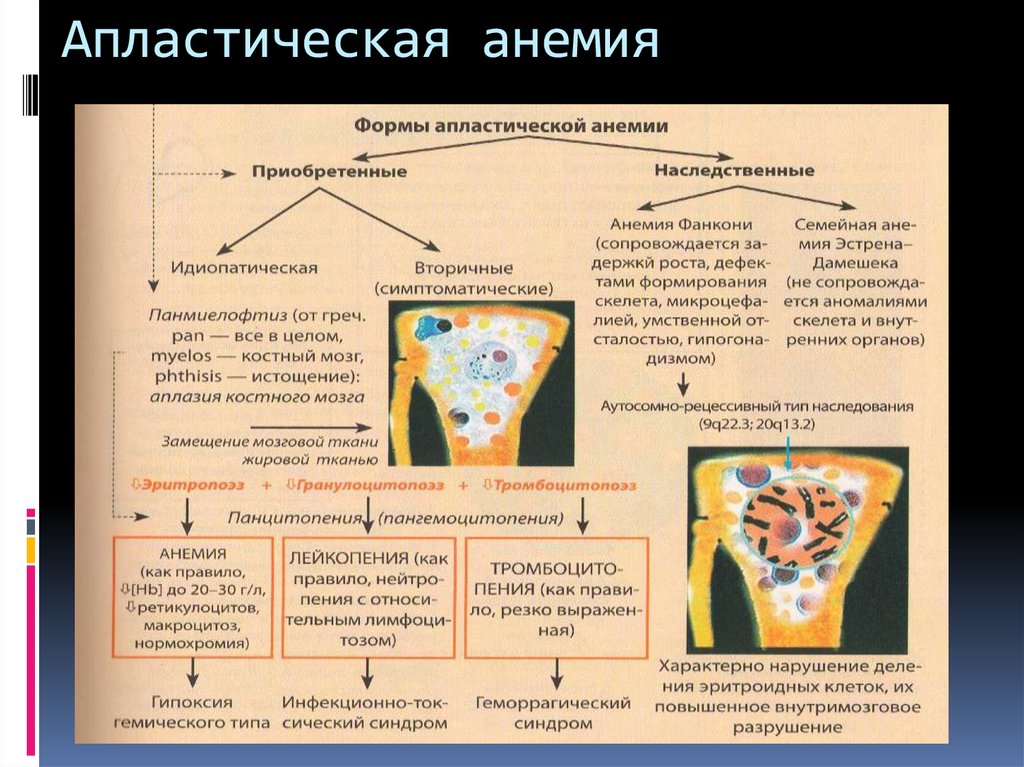
Патологию разделяют в зависимости от этиологических факторов на наследственную и приобретенную. Приобретенная может быть идиопатической, лекарственной, токсической, вирусной. Кроме классической панцитогемопении с угнетением всех ростков кроветворения существует и парциальная эритроцитарная гипоплазия, затрагивающая только эритроциты. По степеням тяжести выделяют:
- нетяжелую (снижение числа гранулоцитов > 0,5х109),
- тяжелую (<0,5х109),
- сверхтяжелую (<0,2х109).
Тяжесть болезни определяется результатами трех анализов крови до начала терапии. Об устойчивой форме говорят в случае неэффективности комбинированной иммуносупрессивной терапии на протяжении 6 месяцев. Выделяются варианты течения с присоединением пароксизмальной ночной гемоглобинурии или без нее.
Диагностика
Изучение анамнеза заболевания — первая мера, позволяющая установить факт наличия заболевания. Врач опрашивает больного, устанавливая частоту и время появления признаков, присутствие других признаков. Имеет большое значение и анализ жизни пациента, так как можно выявить возможные причины.
При осмотре больного выявляют пониженное артериальное давление, учащённый пульс и бледный оттенок кожи. В некоторых местах на слизистых оболочках и кожных покровах могут присутствовать незначительные кровоизлияния.
Для получения полной информации о патологии прибегают к помощи инструментальных и лабораторных методов диагностики:
- Анализ крови. Наблюдается снижение уровня гемоглобина, количество тромбоцитов, лейкоцитов и эритроцитов тоже ниже нормы.
- Биохимический анализ крови. Применяется для обнаружения поражённых органов, изучают уровень глюкозы, холестерина, мочевой кислоты и креатинина.
- Анализ мочи. Обнаруживают проявления инфекций (лейкоциты и микроорганизмы в моче), а также признаки кровотечения.
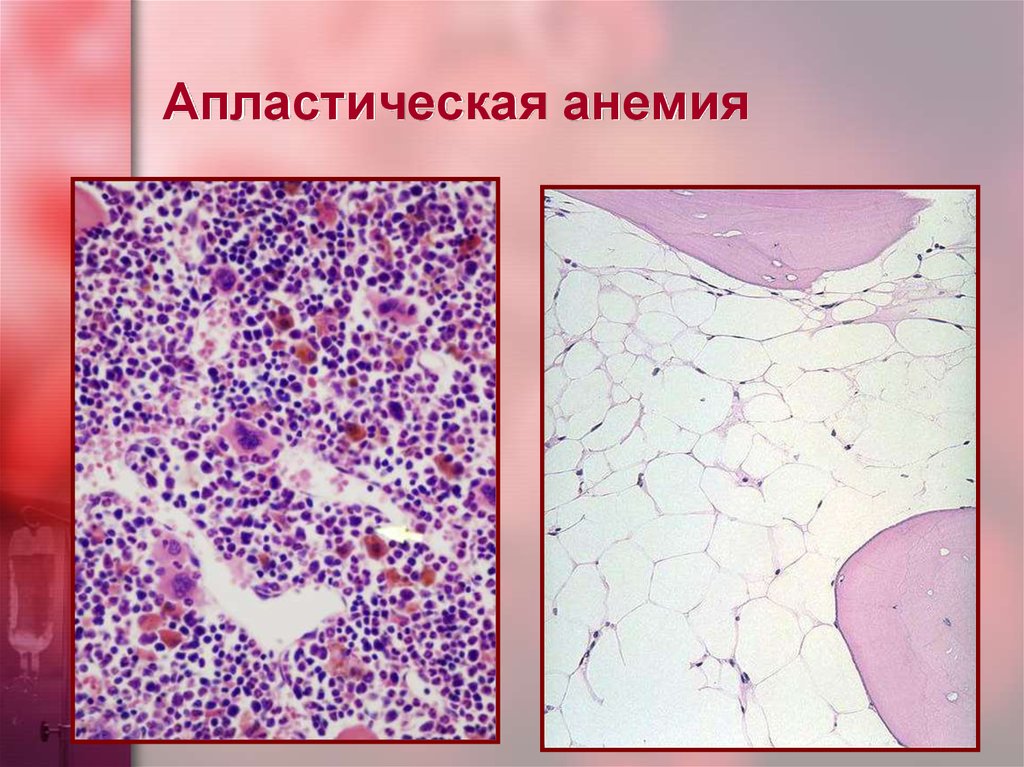
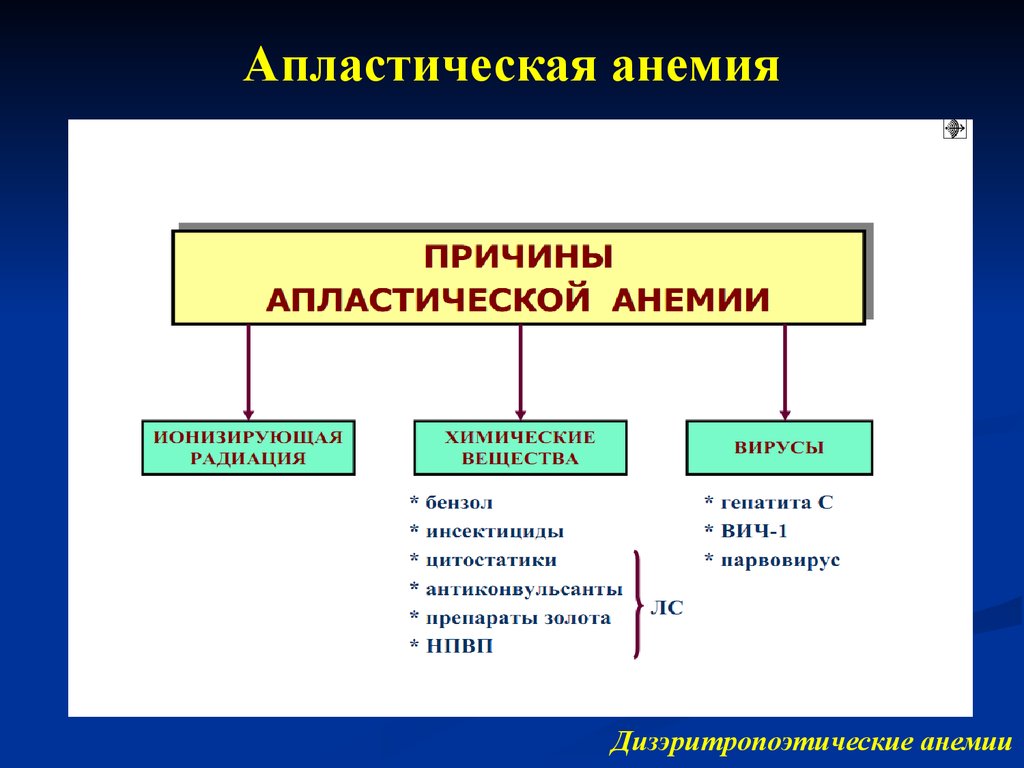
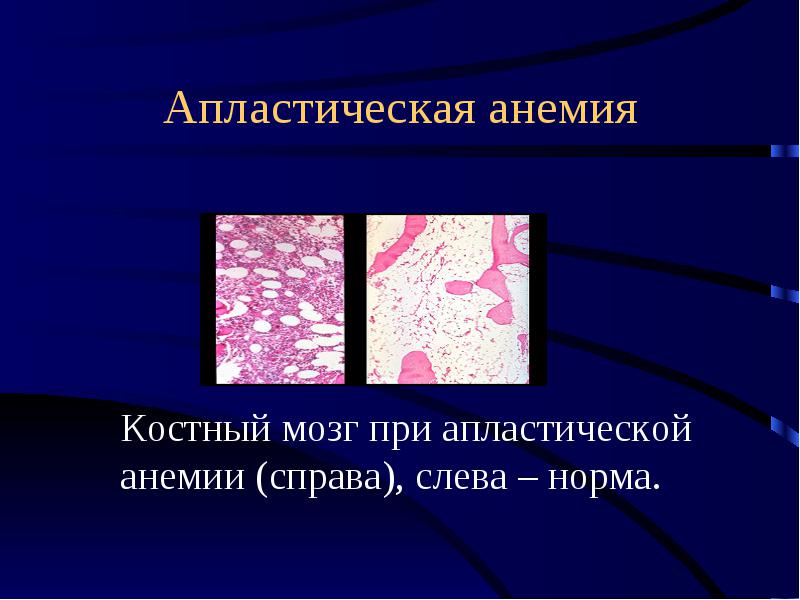
- Пункция костного мозга. Выявляют замещение предшественников клеток крови на рубцовую или жировую ткань.
- Ультразвуковая диагностика. Позволят отследить поражение других органов.
- Электрокардиография. Диагностируют нарушение питания сердца и увеличенную частоту сокращений органа.
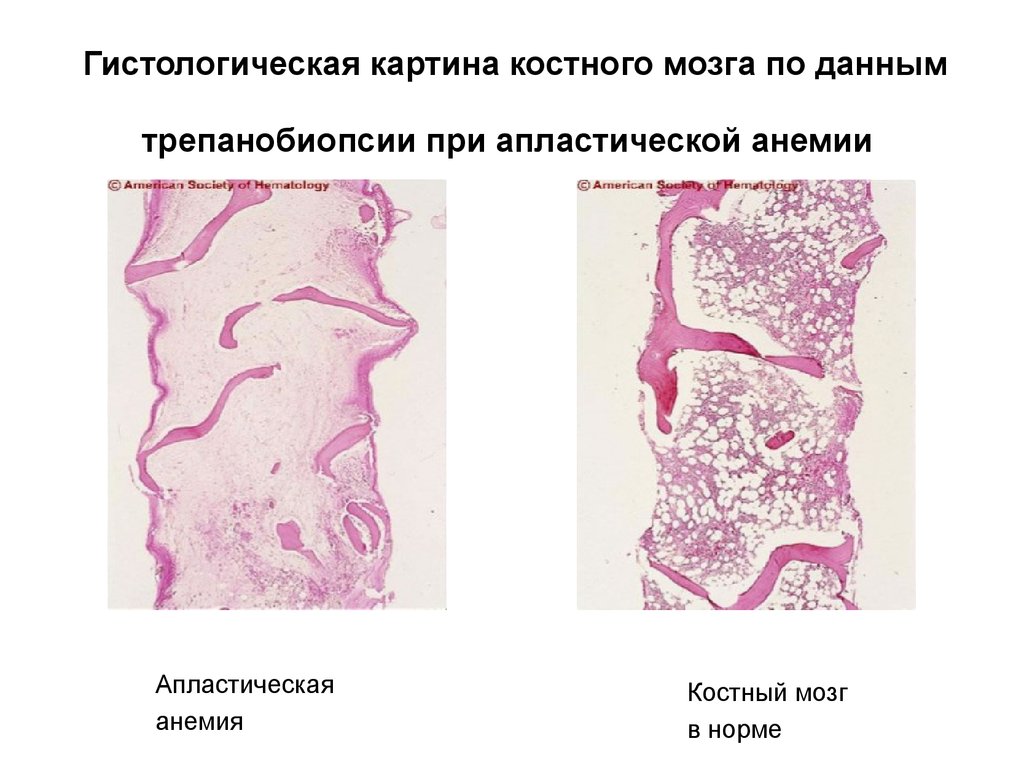
- Трепанобиопсия позволяет охарактеризовать состояние костного мозга.
 Трепанобиопсия — метод диагностики, позволяющий изучить костный мозг
Трепанобиопсия — метод диагностики, позволяющий изучить костный мозг
Показатели исследования крови и их расшифровка — таблица
| Общий анализ крови | Биохимический анализ крови |
|
|
Классификация апластической анемии
Апластическую анемию классифицируют по форме заболевания:
- острая — анемия, протекающая менее 1 месяца,
- подострая — от 1 до 6 месяцев,
- хроническая — более 6 месяцев.
Также патологию разделяют на виды по природе происхождения и тяжести заболевания.
Виды апластической анемии

Химиотерапия — причина приобретенной апластической анемии
- Приобретённая. Данная форма заболевания может стать следствием облучения при химиотерапии либо воздействия рентгеновских лучей. Другой причиной является повышенная чувствительность отдельных пациентов к соединениям, входящим в лекарственные препараты. Причина чувствительности чаще всего заложена генетически и проявляется не только у одного члена семьи, но и у его ближайших родственников. Вирусная этиология встречается у пациентов с наличием вирусных гепатитов, вируса Эпштейн-Барра, герпес вируса. Аутоиммунные системные патологии, вызывающие анемию — ревматоидный артрит, красная волчанка.
- Врожденная. Редкое наследственное заболевание анемия Фанкони провоцирует недостаточность производительности костного мозга. Патология определяется в возрасте 4 — 12 лет, её наличие отражается и внешними признаками — физическими дефектами. Сопровождается отставанием в развитии и повышенной склонностью к появлению опухолевых образований. Ещё одно наследственное заболевание, являющееся источником апластической болезни — анемия Блекфена-Даймонда. Характерная особенность — поражение только эритроидного ростка костного мозга. Определяется патология при рождении, максимум в течение первого года жизни. Характерными признаками являются аномалии развития внешних и внутренних органов, выраженная бледность кожных покровов.
- Идиопатическая. Патология возникает по неустановленной причине.
Степени тяжести апластической анемии:

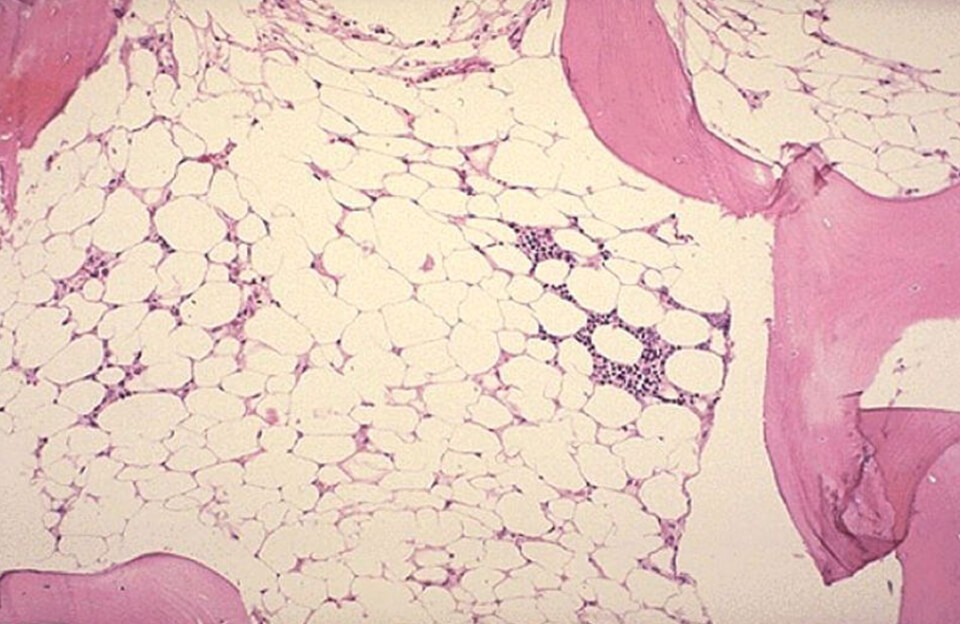
Клеточность костного мозга определеяет степень анемии
- Умеренная. Показатели тромбоцитов составляют > 20 * 10 9/л; нейтрофилы, эозинофилы, базофилы (то есть гранулоциты) превышают значение 0,5 * 10 9/л.
- Тяжёлая. При изучении образца костного мозга определяется клеточность < 30% от нормы. Значения тромбоцитов < 20 * 10 9; гранулоциты — < 0,5 * 10 9/л.
- Крайне тяжёлая. Происходит жировое перерождение костного мозга. Гранулоциты определяются < 0,2 * 10 9/л; тромбоциты — < 20* 10 9/л.
Классификация апластических анемий
Болезнь, описанная еще в конце 19 века, не хочет сбавлять обороты, ведь стремительное движение человечества к новым познаниям и изобретениям подталкивает людей к очень тесному контакту с факторами, способными привести к аномальному состоянию стволовой клетки. В итоге – частота заболеваемости только растет, смертность от данной патологии хоть и падает, благодаря развитию трансплантологии и лечению новейшими иммуносупрессивными препаратами, но не в той мере, как хотелось бы.

В настоящее время выделено два типа АА, содержащие по несколько видов, каждый из которых имеет свои подвиды, исходя из причин и клинических проявлений. Следует отметить, что классификация в разных источниках, хоть и не существенно, но отличается, к тому же классификация, используемая для установления диагноза и лечения взрослых, не совсем подходит для детского и подросткового периода (например, у детей часто встречается такая форма, как транзиторная АА – о ней также будет упомянуто ниже).
Итак, выделяют:
а) Приобретенные формы:
-
Истинная АА, которая ≈ в 50% случаев представлена идиопатической апластической анемией (для нее характерно подавление всех линий кроветворения без видимых причин), имеет три формы течения:
- острую, которая продолжается до 2 месяцев и заканчивается 100-процентной гибелью больных;
- подострую (гипо- и апластическая анемия с кратковременной стабилизацией при АА и с чередованием ремиссий и обострений при ГА, длительность болезни от 2 месяцев и дольше);
- хроническую гипо- и апластическую анемию, имеющую относительно спокойное течение, страдания костного мозга и организма больного продолжаются от года до 3 – 5 лет, иногда процесс затягивается до 10 лет и более и в отдельных случаях приводит к выздоровлению.
- Парциальная красноклеточная аплазия костного мозга (ПККА) – анемия аутоиммунного характера, обусловленная воздействием аутоантител на антигены эритрокариоцитов КМ, в результате чего сильно угнетается продукция красных клеток крови. Наиболее часто встречаемая форма – идиопатическая, иногда развитие ПККА обусловлено формированием опухоли вилочковой железы (тимомы). Отдельные авторы напоминают о существовании еще одного вида такой анемии, которая проявляется у детей старшего возраста – подростковой ПККА, имеющей благоприятное течение;
- Гипопластическая анемия с гемолитическим компонентом – в отношении этой формы существуют постоянные разногласия, поскольку отдельные авторы утверждают, что данная патология выступает в качестве определенной стадии пароксизмальной ночной гемоглобинурии. Хроническая гипопластическая анемия с гемолитическим компонентом при рецидивах болезни сопровождается гемолитическими кризами, что является ее особенностью.
б) Врожденные и наследственные формы:
- Конституциальная анемия Фанкони (аутосомно-рецессивный тип наследования, проявляется у гомозигот в возрасте 4-10 лет), представлена двумя типами: 1) анемия с грубыми аномалиями развития органов, 2) анемия с малыми (незначительными) дефектами развития;
- Анемия Джозефа-Даймонда-Блекфена (красноклеточная аплазия КМ, тип наследования – не выяснен, предположительно – аутосомно-доминантный, но другие утверждают, что аутосомно-рецессивный), болезнь проявляет себя очень рано, уже к 4 месяцам у 2/3 детей дебютируют первые признаки, у остальной трети они появятся к году. Анемия Даймонда-Блекфена имеет две разновидности: 1) анемия с аномалиями развития органов, 2) анемия без аномалий;
- Семейная гипопластическая анемия Эстрена-Дамешека (семейная гипопластическая анемия у детей, которая характеризуется общим поражением кроветворения при отсутствии дефектов развития).
Поскольку гипопластическая анемия в случае врожденных форм выступает, как один из симптомов основной патологии, к тому же, болезнь становится видимой с раннего детства, нет смысла останавливаться на ней в данной работе. Читателей, скорее всего, больше волнует та форма, которая в течение жизни может настигнуть любого человека, даже если он родился вполне себе здоровым.
Апластическая анемия у детей
В детском возрасте чаще дебютируют врожденные типы апластических анемий, к которым относятся анемии Фанкони и Блекфена-Даймонда.
Анемия Фанкони представляет собой наследственную патологию, наследуемую по аутосомно-рецессивному типу, то есть случаи заболевания наблюдаются только в семьях, где оба родителя являются носителями патологического гена. Проявляется анемия Фанкони не только в глубоком угнетении всех типов кроветворения, но и в появлении аномалий развития.
Дебют заболевания приходится на возраст 4-12 лет, но гематологические проблемы могут возникнуть непосредственно после рождения ребенка. К врожденным аномалиям относятся: несоответствие костного возраста паспортному, врожденные пороки сердечно-сосудистой системы, микроцефалия, аномалии развития костной ткани, органов мочеполовой системы, отставание в психомоторном развитии. Гематологические изменения проявляются в более позднем возрасте (в среднем по достижению 9 лет) и в клинической картине преобладают симптомы геморрагического симптомокомплекса, после чего прогрессивно нарастают признаки лейкоцитопении и эритроцитопении.
Данная патология имеет стремительное прогрессирующее течение, поэтому при отсутствии адекватного лечения летальный исход наступает в течение 6 месяцев. Причиной смерти чаще всего является массивное желудочно-кишечное кровотечение или мозговое кровоизлияние. Осложнениями анемии Фанкони является трансформация заболевания в острый лейкоз, а также онкопатология органов желудочно-кишечного тракта. Единственным эффективным методом лечения врожденной анемии Фанкони является трансплантация костного мозга.
Анемия Блекфена-Даймонда относится к группе спорадических наследственных патологий крови и характеризуется поражением исключительно эритроцитарного ростка кроветворения. Дебют заболевания наблюдается в течение первого года жизни ребенка.
Дети с анемией Блекфена-Даймонда имеют типичный фенотип: бледные кожные покровы, крупная верхняя губа, широко поставленные глаза, сухие секущиеся волосы, отставание костного возраста от паспортного.
Характерным изменением лабораторных показателей периферической крови является прогрессирующая нормохромная анемия при полной сохранности пролиферации клеток тромбоцитарного и гранулоцитарного ряда.
Данная патология характеризуется вялотекущим хроническим течением со склонностью к спонтанной ремиссии. Предпочтительным методом лечения является применение кортикостероидной терапии, а также по жизненным показаниям переливание эритроцитарной массы.
В детском возрасте приобретенные формы апластической анемии встречаются крайне редко и проявляются теми же симптомами, что и у взрослых при полном отсутствии врожденных патологий.
При наличии у ребенка признаков нарушения кроветворной функции костного мозга обязательно необходимо проводить дифференциальную диагностику с такими заболеваниями как: острый лимфобластный и миелобластный лейкоз, мегалобластная анемия, синдром гиперспленизма, метастатическое поражение костного мозга.
Ребенок с подозрением на врожденную апластическую анемию обязательно подлежит комплексному обследованию, к которому относятся: цитогенетический анализ после трепанобиопсии, анализ крови на предмет наличия антител к клеткам крови, рентгенография с определением костного возраста, миелограмма. Также обследованию подлежат все ближайшие родственники больного ребенка.
Лечение апластической анемии
Лечение данного заболевания включает в себя 3 компонента: этиологический, патогенетический и симптоматический. Если известны причины, которые могли бы вызвать анемию (например, длительный контакт с инсектицидами), необходимо как можно быстрее устранить их – очень вероятно, что функция кроветворения после этого нормализуется. Поскольку анемия, являющаяся обязательным признаком заболевания, приводит к серьезным нарушениям микроциркуляции в органах и тканях и к их кислородному голоданию, то необходимо стремиться нормализовать это звено: пациенту назначают переливания эритроцитарной массы, стремясь при этом к значению гемоглобина 80 г/л. Ведущей причиной смерти лиц, страдающих апластической анемией, являются кровотечения. Чтобы устранить тромбоцитопению, пациенту должны быть назначены концентраты тромбоцитов – тромбомасса. Кроме того, чтобы не спровоцировать кровотечение, больным не рекомендуются физические нагрузки, запрещается прием аспирина и других противовоспалительных препаратов, женщинам следует принимать препараты, ингибирующие (подавляющие) овуляцию.
Сниженное количество лейкоцитов и нейтрофилов – лейкопения и нейтропения – являются третьим гематологическим признаком апластической анемии. Скорректировать уровень этих элементов в крови путем переливаний взвеси лейкоцитов невозможно, поскольку они циркулируют в организме лишь несколько часов, а затем погибают. В данной ситуации на первый план выходят меры профилактики и своевременного лечения инфекционных заболеваний. С этой целью могут быть назначены антибактериальные (Норфлоксацин), противовирусные (Ацикловир) и противогрибковые (Флуконазол) препараты. Если на фоне указанной терапии температура тела больного не нормализуется, рекомендованы препараты, стимулирующие кроветворение. В случае, когда отсутствует эффект и от этого препарата, больному могут быть назначены инфузии гранулоцитов. Для восстановления кроветворной функции костного мозга используются препараты нескольких групп.
- Кортикостероиды, или стероидные гормоны. Могут быть назначены лишь в сочетании с другими препаратами, изолированно не применяются, поскольку на фоне их приема повышается риск инфекционных осложнений.
- Андрогены. Широко используются в лечении апластических анемий. Эффект этих препаратов зависит от тяжести заболевания. Для достижения положительного результата необходим длительный непрерывный прием андрогенов – в течение нескольких месяцев и лет. В результате их приема снижается частота переливаний крови, улучшается качество жизни больных. Побочными эффектами являются поражение печени и вирилизация (появление мужских черт (оволосение, грубый тембр голоса) у женщин).
- Цитокины (КСФ-ГМ). Применение этих препаратов может частично скорректировать цитопению лишь в том случае, если не утрачена остаточная функция кроветворения (т. е. костный мозг работает, но очень слабо). Больший эффект от цитокинов отмечается после трансплантации костного мозга и применения препаратов, угнетающих иммунитет.
- Иммуносупрессоры (препараты, угнетающие иммунитет: Циклофосфамид, Циклоспорин и др.). Применение этих препаратов иногда приводит даже к полному восстановлению функции гемопоэза.
Наиболее эффективным методом лечения идиопатической апластической анемии является ТКМ – трансплантация костного мозга. Идеальный вариант – костный мозг однояйцевого близнеца больного. В этом случае выживаемость составляет порядка 80–86 %. Чем моложе реципиент, тем выше его шансы на 5-летнюю выживаемость после ТКМ. Однако даже после полного восстановления функции кроветворения через 5 лет возможно повторное развитие заболевания.