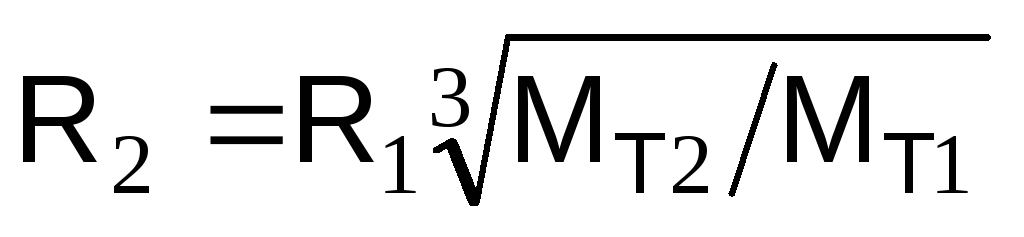Токсичность
- Нитротолуолы токсичны, всасываются через кожу, окисляют гемоглобин крови в метгемоглобин, вызывают анемию, отрицательно влияют на центральную нервную систему, функцию почек и печени. Для всех мононитротолуолов ПДК 3 мг/м³, ЛД50 1,46-1,68 г/кг (мыши, перорально). Для динитротолуолов ПДК 1 мг/м³, ЛД50 0,5-0,8 г/кг (мыши, перорально).
- При остром отравлении любым из изомеров — двигательное возбуждение, затем заторможенность, нарушение координации движений, клонико-тонические судороги, слюнотечение, акроцианоз, вздутие кишечника.
- Лица, контактирующие с нитротолуолом в условиях производства, жаловались на головную боль, изжогу, повышенную утомляемость, гипергидроз.
Применение
Применяется в промышленности и военном деле как самостоятельно в гранулированном (гранулотол), прессованном или литом виде, так и в составе многих взрывчатых смесей (алюмотол, аммонал, аммонит, аммотол и другие). Применяется также в хозяйстве, строительно-демонтажных работах и т.д.
Применяется для получения алмазов методом детонационного нагружения при взрыве тринитротолуола с отрицательным кислородным балансом, при котором алмазы образуются непосредственно из продуктов взрыва.
Тротил менее чувствителен к трению и нагреванию, чем многие другие взрывчатые вещества, например динамит, и загорается только при температуре 290 °C, поэтому может быть относительно безопасно нагрет до температуры плавления. Это очень удобно, так как позволяет легко придать нужную форму при помощи литья. Литой или прессованный тротил можно поджечь. Он горит без взрыва желтоватым пламенем. Для взрыва обычно необходимо использование детонатора, однако порошкообразный тротил с примесями может иметь повышенную чувствительность к внешним воздействиям, в том числе и к пламени.
Несмотря на широкую распространённость тринитротолуола, в настоящее время его стараются заменить на более экономичные и более безопасные малочувствительные взрывчатые вещества. Например, Вооружённые силы США, начиная с 2010 года, заменяют тротил в крупнокалиберных снарядах на вещество IMX-101.
Обладает свойствами антимикотика, ранее применялся в медицине в составе противогрибковых препаратов «Ликватол» и «Унгветол». В 90-е годы профессором В. Ф. Можаровским были проведены исследования влияния тротила на грибки, вирусы и микроорганизмы, которые выявили его крайнюю эффективность при лечении разных заболеваний. Были созданы и запатентованы препараты «Тринол», «Ликвацид», «Тротицид».
Применение
- 2- и 4-нитротолуолы применяют в синтезе толуидинов, хлорнитротолуолов, нитротолуолсульфокислот, нитротолуолсульфохлоридов, основных красителей,
- 2-Нитротолуол — реагент для обнаружения и фотометрического определения различных окислителей (Сl2, N03-, NO-2, Au(III), Cr(VI), Cu(II), Cu(III)), а также HCN в воздухе.
- 4-Нитротолуол — получение 4-нитробензойной кислоты, в производстве гербицидов и каучуков. Применяется в качестве летучего маркера пластических взрывчатых веществ для облегчения обнаружения в целях борьбы с терроризмом согласно Конвенции о маркировке пластических взрывчатых веществ.
- Динитротолуолы используются в органическом синтезе, красках, взрывчатых веществах, и как топливные добавки.
- 2,4,6-Тринитротолуол является одним из наиболее широко применяемых в военном деле и промышленности взрывчатых веществ.
Первая помощь и лечение
При острых интоксикациях пострадавшего следует немедленно вывести из загазованного помещения, снять загрязненную Т. одежду. При попадании продукта на кожу обильно промывают загрязненные места водой и слабо-розовым раствором перманганата калия. Противопоказаны тепловые процедуры, усиливающие образование метгемоглобина, в частности горячая ванна или душ. При выраженной метгемоглобинемии с целью усиления процесса деметгемоглобинизации показано введение 1% р-ра метиленового синего в 40% р-ре глюкозы. При гипоксемии с целью повышения количества растворенного в плазме кислорода — оксигенотерапия, при гипокапнии — карбоген. При тяжелых поражениях печени — в первые сутки форсированный диурез, трасилол, контрикал, липотропные средства — холина хлорид, метионин, липамид. При высокой активности процесса — стероидные гормоны. По показаниям назначают сердечно-сосудистые средства.
При хрон. интоксикациях, сопровождающихся преимущественным поражением печени, показаны витамины группы В, препараты липотропного действия (холина хлорид, липоевая, фолиевая к-ты). В последующем показаны сан.-кур. лечение (Ессентуки, Железноводск), препараты аминохинолинового ряда. При дискинезии желчных путей применяют желчегонные и спазмолитические средства.
Экспертиза трудоспособности. При начальных легкообратимых проявлениях воздействия Т. больного временно переводят на другую работу, при выраженных стойких явлениях — направляют на ВТЭК.
Профилактика отравлений включает механизацию производственных процессов, герметизацию аппаратуры, улучшение вентиляции. Большое значение имеют частая смена спецодежды, ежедневный теплый душ после работы, периодический сан. инструктаж работающих. Обязательно проведение предварительного и периодических мед. осмотров (см. Медицинский осмотр).
Библиогр.: Артамонова В. Г. и Шаталов H. Н. Профессиональные болезни, с. 293, М., 1982; Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 2, с. 259, Л., 1976; Кончаловская Н. М., Попова Т. Б. и Бялко Н. К. Современное состояние проблемы токсического гепатита, Гиг. труда и проф. заболев., № 12, с. 10, 1974; Профессиональные болезни, под ред. E. М. Тареева и А. А. Безродных, с. 209, М., 1976; Раше век а я А. М. и др. Профессиональные болезни, с. 283, М., 1973; Руководство по профессиональным заболеваниям, под ред. Н. Ф. Измерова, т. 1, с. 125, М., 1983.
Полимерный азот
Идеальной взрывчаткой могло бы стать соединение, в котором
присутствуют только атомы азота. Создание такого полимерного азота ученые
предсказали еще в начале 90-х. Впервые вещество экспериментально получили в
2004 году в России, однако для его синтеза требуется давление свыше миллиона
атмосфер, что исключает практическое применение такой взрывчатки.
Ученые продолжают поиски самого лучшего взрывчатого вещества
— согласно прогнозам, некоторые виды нитридов, в которых несколько атомов азота
особым образом соединены с атомами хрома, циркония или гафния, могут обладать
чудовищным энергетическим потенциалом, схожим с полимерным азотом.
Физические свойства
| Изомер | Молекулярнаямасса, г/моль | Внешний вид | Тплав.°С | Ткип.°С | Плотность,г/см³ | Растворимость,г/100 г р-рителя |
|---|---|---|---|---|---|---|
| 2-нитротолуол | 137,15 | желтоватая жидкость | -10,6; -9,55метаст.; -4,1; -3,85 | 219-219,5; 222-223 | 1,1629 | Бесконечно в этаноле и эфире |
| 3-нитротолуол | желтоватая жидкость | 15,5-16 | 231 | 1,1571 | Легко растворим в этаноле и эфире | |
| 4-нитротолуол | бесцветные ромбические иглы | 51,4; 54,5 | 238 | 1,2860 | Легко растворим в этаноле и эфире | |
| 2,3-динитротолуол | 182,14 | иглы | 63 | |||
| 2,4-динитротолуол | желтые иглы | 69,5-70,5 | 300разл. | 1,521 | в эфире 9,4 | |
| 2,5-динитротолуол | иглы | 50,5; 52,5 | 1,282 | Легко растворим в этаноле | ||
| 2,6-динитротолуол | ромбические иглы | 61; 66 | 1,283 | Растворим в этаноле | ||
| 3,4-динитротолуол | желтые иглы | 59,8 | 1,259 | Растворим в этаноле и эфире | ||
| 3,5-динитротолуол | желтые иглы | 93 | возгоняется | 1,277 | Растворим в этаноле и эфире | |
| 2,3,4-тринитротолуол | 227,14 | призмы | 112 | 290-310взрыв. | 1,620 | Легко растворим в эфире |
| 2,3,5-тринитротолуол | 92.5 | 1,620 | ||||
| 2,3,6-тринитротолуол | 109.8 | 1,620 | ||||
| 2,4,5-тринитротолуол | желтые ромбические пластинки | 104 | 290-310взрыв. | 1,620 | Легко растворим в эфире | |
| 2,4,6-тринитротолуол | бесцветные многогранники | 80,7 | 240взрыв. | 1,654 | в эфире 3,33; в ацетоне 109 | |
| 3,4,5-тринитротолуол | 132.0 | 313разл. | 1,620 |
Получение
Первый этап: нитрование толуола смесью азотной и серной кислот до моно- и динитротолуолов. Серная кислота используется как водоотнимающий агент.
-
- 2C6H5CH3→HNO3,H2SO4C6H4CH3(NO2)+C6H3CH3(NO2)2{\displaystyle {\mathsf {2C_{6}H_{5}CH_{3}{\xrightarrow{HNO_{3},H_{2}SO_{4}}}C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}}}}
Второй этап: смесь моно- и динитротолуола нитруют в смеси азотной кислоты и олеума.
-
- C6H4CH3(NO2)+C6H3CH3(NO2)2→HNO3,H2SO4C6H2CH3(NO2)3{\displaystyle {\mathsf {C_{6}H_{4}CH_{3}(NO_{2})+C_{6}H_{3}CH_{3}(NO_{2})_{2}{\xrightarrow{HNO_{3},H_{2}SO_{4}}}C_{6}H_{2}CH_{3}(NO_{2})_{3}}}}
Излишек кислоты от второго этапа можно использовать для первого.

Олеум используется как водоотнимающий агент.
Из-за активирующих заместителей 1 рода электронная плотность в бензольном кольце возрастает, но особенно увеличивается в орто-, пара-положениях (статические электронные эффекты заместителей в нереагирующей молекуле). Электронное влияние метильной группы на π-систему бензольного кольца осуществляется по механизму σ,π-сопряжения (гиперконъюгация).

CL-20
Одно из самых мощных на сегодня взрывчатых веществ появилось
в недрах секретных лабораторий Пентагона в 1986 году. Взрывчатка примерно на
40% эффективнее октогена. Считается, что всего один килограмм CL-20 вызывает
разрушения, на которые требуется 20 килограммов тротила.

Массовое внедрение CL-20 сдерживается высокой ценой, а также
низкой устойчивостью к ударам. Военные США смешивают CL-20 с октогеном в
соотношении 2:1, получается взрывчатка с высочайшей скоростью детонации,
большой плотностью и высокой стабильностью. Перспективной сферой применения CL-20
может стать использование в качестве ракетного топлива.
Литература
- Нитротолуолы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. В 2-х томах. — М.: «Химия», 1970. — Т. 2. — 824 с.
- Общая органическая химия / Под ред. Бартон Д. — М.: «Химия», 1982. — Т. 3. — 738 с.
- Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ. — Изд. второе, перер. и доп. — Л.: «Химия», 1972. — 688 с.
Октоген
Американские химики впервые получили это вещество в качестве
побочного продукта одного из процессов получения гексогена в 1941 году. Через
несколько лет октогеном заинтересовались в Пентагоне — оказалось, что новая
взрывчатка мощнее гексогена. Считается, что октоген по своей разрушительной
мощи превосходит тротил в четыре раза.
- При
взрыве килограмма тротила выделяется в шесть–восемь раз меньше энергии, чем при
сгорании килограмма угля, эффект разрушения достигается за счет того, что
энергия при взрыве выделяется в десятки
миллионов раз быстрее, чем при горении.
Однако процесс производства такой взрывчатки на тот момент
был дороже по сравнению с гексогеном, поэтому вытеснить его новое вещество не
смогло, хотя американская армия применяла новинку во Вьетнаме. Только в 1980-х
ученые придумали эффективную и недорогую технологию синтеза октогена.
Как взрывается?
Тротил после детонации оставляет шанс уцелеть только тем, кто оказался вдали от эпицентра взрыва. При срабатывании тринитротолуола характерно выделение большого количества энергии, которая перерастает в основной поражающий фактор ВВ — ударную волну. Во время терракта, кроме нее, опасной считается начинка взрывного устройства. Поражающими элементами для этой цели являются гвозди, гайки, болты и куски арматуры.
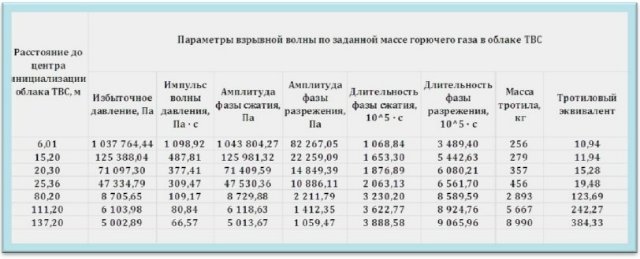
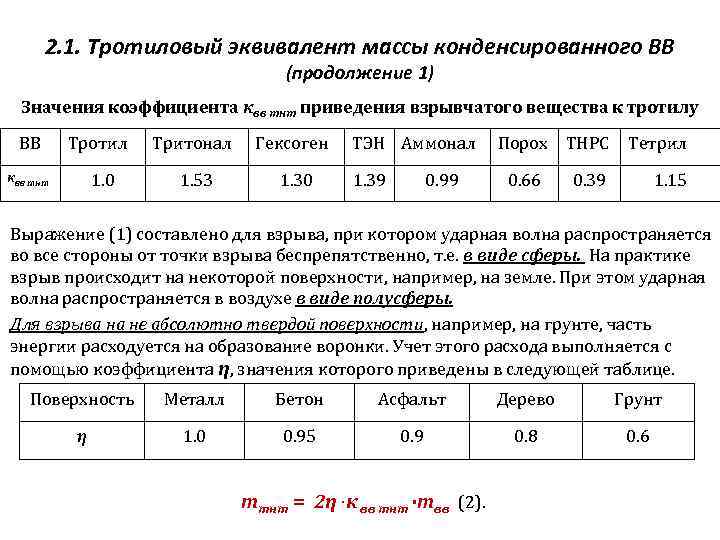
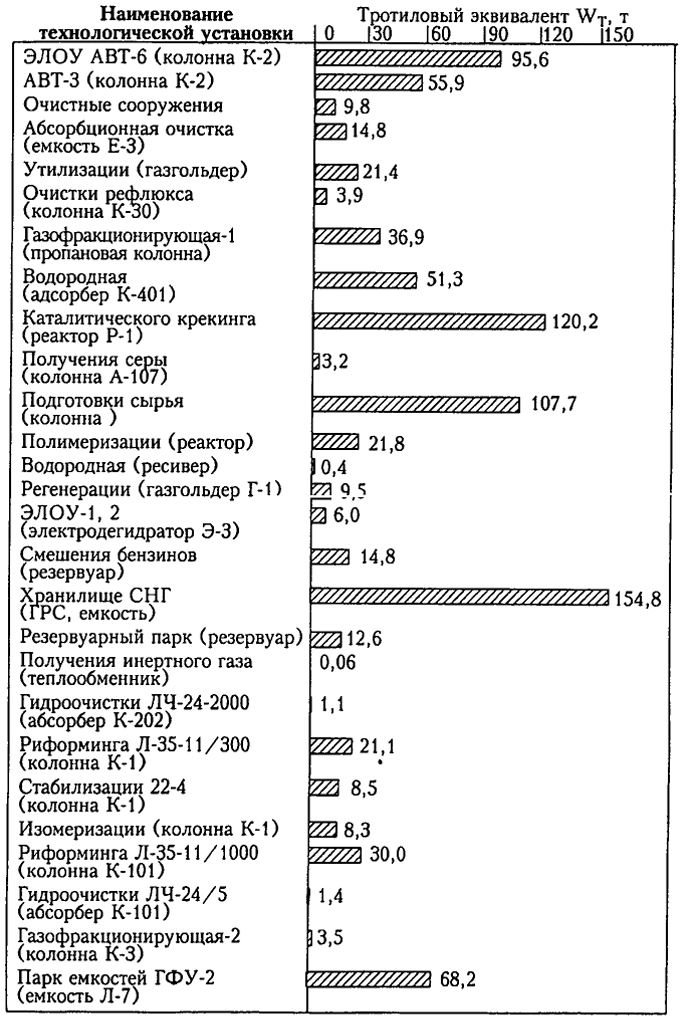
Для определения мощности взрыва используется тротиловый эквивалент: энергия, выделяемая при взрыве ВВ, равняется его массе. Взорвавшийся килограмм тротила вырабатывает достаточное количество энергии, чтобы убить человека, находящегося от эпицентра на расстоянии три метра. При взрыве выделяется 4,19х106 Дж. В безопасности он может быть на дистанции 15 метров. Тонна тротила выделяет 4,19х109 Дж. энергии.
Тринитротолуол
Тринитротолуол ( тротил, тол) CH3C6H2 ( NO2) 3 применяется как взрывчатое вещество.
Тринитротолуол, тротил, тол, или ТНТ, CH3C6H2 ( NO2) 3 получается нитрованием толуола.
Тринитротолуол ( тротил, тол) CH3C6H2 ( NO2) 3 применяется как взрывчатое вещество.
Тринитротолуол ( 2 4 6-тринитротолуол) кристаллизуется из спирта в виде бесцветных или слабо окрашенных примесями в желтоватый цвет ромбических кристаллов или в виде длинных, плоских, легко ломающихся игол.
Тринитротолуол ( ТНТ) наиболее широко применяется для снаряжения снарядов и фугасных авиабомб. Он достаточно устойчив к удару, получаемому при вылете снаряда из канала ствола орудия под давлением газов порохового заряда, но взрывает под действием ударного взрывателя или дистанционной трубки, снаряженных капсюлем-детонатором и промежуточным детонатором. Это единственное из взрывчатых нитросоединений ароматического или гетероциклического ряда ( см. циклонит, или гексоген, том I; 12.37), которое плавится при температуре ниже 100 QC. Поэтому ТНТ расплавляют паром и заливают его в артиллерийские снаряды и бомбы. Плавленый ТНТ менее чувствителен, чем кристаллический или прессованный, и не взрывает от одного лишь гремучертутного или азидо-свинцового капсюля-детонатора. Кроме любого из них, требуется еще тетриловый заряд, который, детонируя под действием капсюля-детонатора, создает ударную волну достаточной силы, чтобы вызвать взрыв тринитротолуола. Более чувствительная кристаллическая форма ТНТ применяется для снаряжения детонирующих шнуров Кордо, которые готовят следующим образом. Свинцовые трубки диаметром 25 4 мм наполняют расплавленным ТНТ, затем их несколько раз вытягивают до 9 мм в диаметре, при этом взрывчатое вещество раздробляется и превращается в тонкий кристаллический порошок.
Тринитротолуол находится в тротиловом масле в количестве, отвечающем его растворимости в холодном маточном спирте.
Тринитротолуол образует мало стойкий в слабых сульфитных растворах ( меньше 5 % Na2SOs) продукт присоединения, окрашенный в яркокрасный цвет. При подкислении раствора это соединение разрушается и выделяется неизмененный тротил.
Тринитротолуол, поступающий из промывки в сушилку, содержит небольшое количество осадка, состоящего из сернокислого свинца, песка, побочных продуктов и волокон дерева от промывных чанов.
Тринитротолуол был впервые получен Вильбрандом в 1863 г. В 1891 г. Гайзерман указал на его взрывчатые свойства; в том же году он разработал технический способ получения тринитротолуола, ж вскоре производство тринитротолуола было установлено в Германии на химическом заводе Грисгейм. Изготовлявшийся здесь тротил применялся для производства аммонитов.
Тринитротолуол ( тротил, тол) CH3C6H2 ( NO2) 3 применяется как взрывчатое вещество.
Тринитротолуол ( тротил, тол) СвН2 ( МО2) зСНз является одним из высокобризантных взрывчатых веществ.
Тринитротолуол является также возбудителем метгемогло-бина. В течение Первой мировой войны было обнаружено, что у рабочих, которые бьии задействованы в производстве военной амуниции, имели место серьезные поражения печени и анемия, при этом по крайней мере 25 % из приблизительно 500 случаев заболеваний заканчивались летальным исходом.
Тринитротолуол ( тротил) CH3C6H2 ( NO2) 3 получают нитрованием толуола. Желтоватые кристаллы, т.пл. 80 8 С; почти нерастворим в воде ( 0 013 %), растворяется в бензоле, ацетоне.
Тринитротолуол является самым распространенным взрывчатым вещество.
Тринитротолуол ( тротил) — основное штатное взрывчатое вещество со скоростью детонации 7000 м / с, широко применяющееся для снаряжения боеприпасов и проведения взрывных работ.
Получение
- Прямым нитрованием толуола можно присоединить одну, две или три нитрогруппы. Тетранитротолуолы можно получить лишь непрямыми способами. Присутствие метильной группы существенно облегчает процесс нитрования по сравнению с бензолом.
- В промышленности нитротолуолы получают жидкофазным нитрованием толуола нитрующей смесью (55-66 % H2SO4, 28-32 % HNO3 и 12-20 % Н2О) по непрерывной технологии. Продукт нитрования содержит обычно 55-60 % 2-нитротолуола, 3-4 % 3-нитротолуола и 35-40 % 4-нитротолуола, которые выделяют после отгонки с паром избытка толуола и высушивании остатка. 4-Нитротолуол вымораживают, а 2- и 3-нитротолуолы разделяют перегонкой в вакууме.
- Технический динитротолуол получают нитрованием технического мононитротолуола нитрующей смесью при 70-80°С. Продукт состоит из 2,4- и 2,6-изомеров (соотв. 75 и 20 %). Обычно их используют без разделения изомеров для получения тринитротолуола.
- Из тринитротолуолов практический интерес представляет 2,4,6-тринитротолуол — широко используемое взрывчатое вещество. Впервые был получен в 1863 году Юлиусом Вильбрандом. В 1891 году началось промышленное производство в Германии. В промышленности получают непрерывным противоточным нитрованием. От несимметричных изомеров, динитропроизводных, следов тетранитрометана очищают обработкой водным раствором сульфита натрия Na2SO3 или перекристаллизацией из горячего спирта (1:3) или толуола.