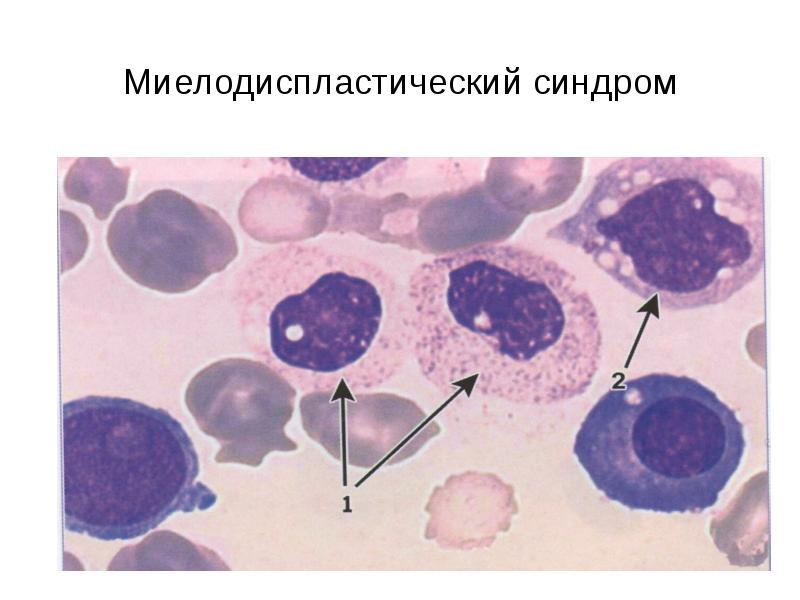
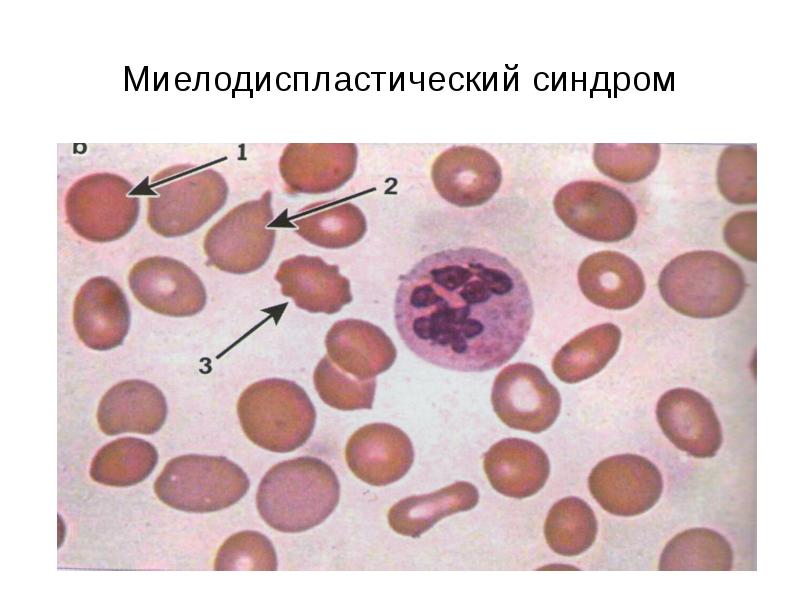
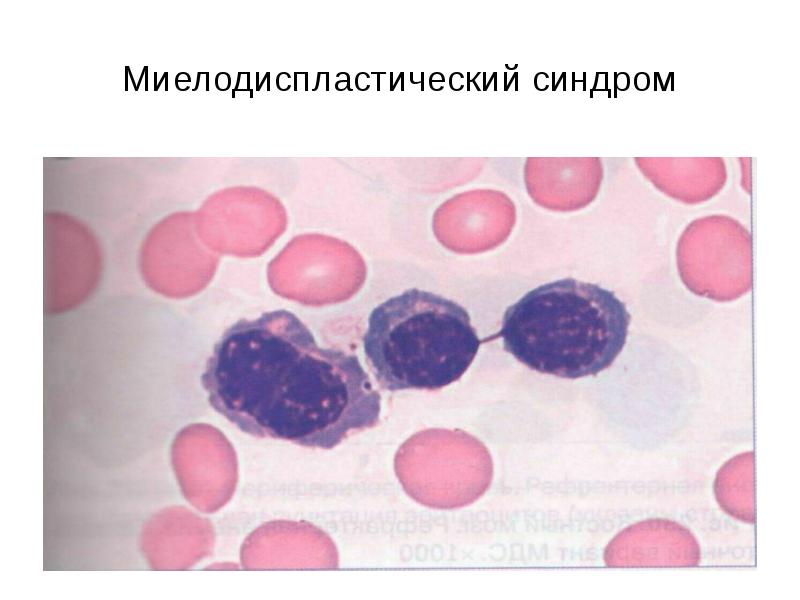
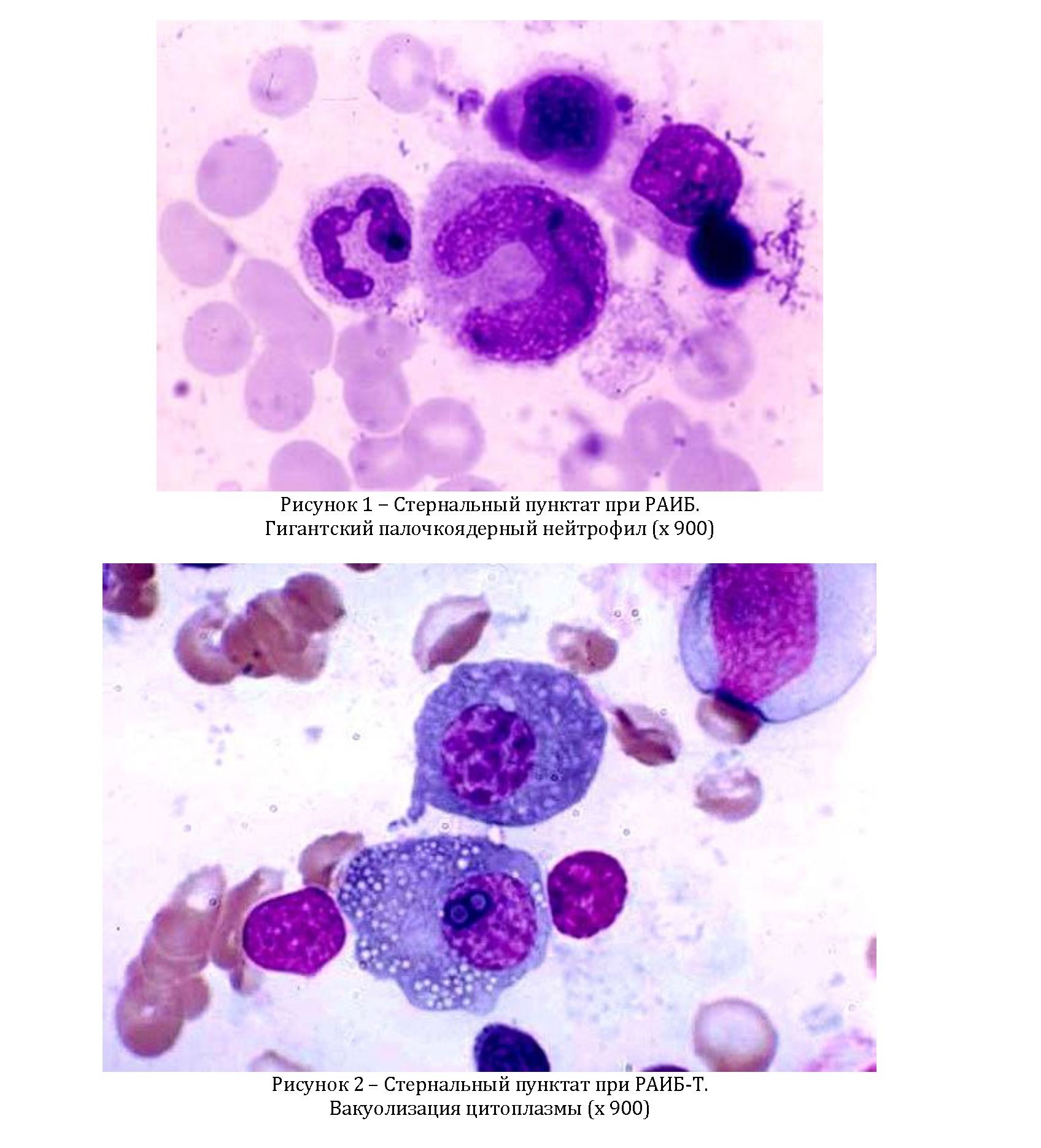
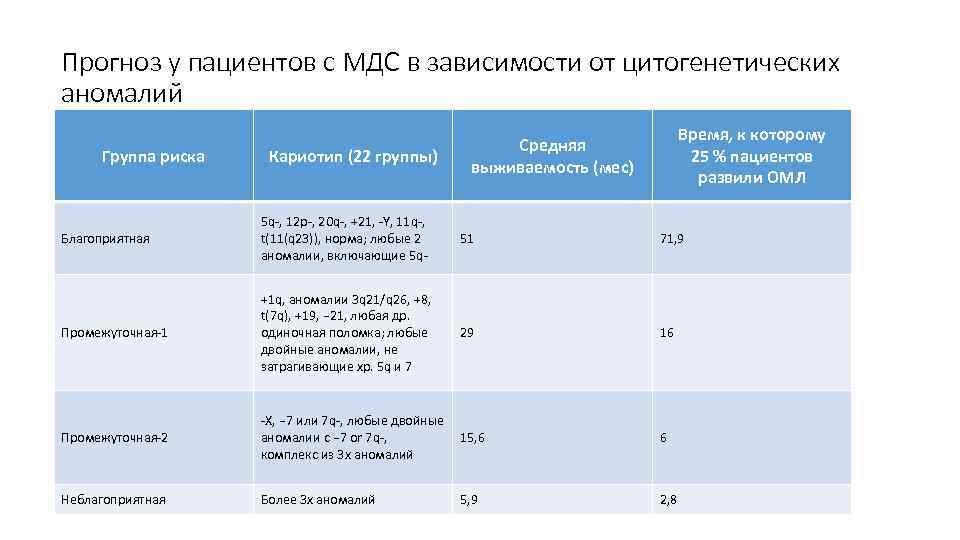
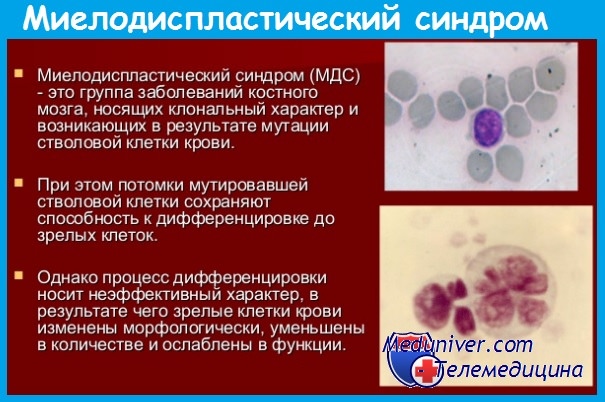
Клиническая картина
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией. При этом необходимо дифференцировать МДС от железо- или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
В связи с этим диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Прогностическая система ВОЗ (WPSS)
| Баллы | 1 | 2 | 3 | |
|---|---|---|---|---|
| Вид МДС по классификации ВОЗ | РА, РАКС, 5q− | РЦМД, РЦМД-КС | РАИБ1 | РАИБ2 |
| Кариотип | Хороший | Средний | Плохой | — |
| Потребность в гемотрансфузиях | Нет | Регулярная | — | — |
Кариотип:
- Хороший: нормальный, −Y, del 5q, del 20q.
- Плохой: более 3 аномалий или аномалии 7-й хромосомы.
- Средний: все другие.
Регулярные гемотрансфузии — переливание минимум 1 ЭМ каждые 8 недель в течение 4 месяцев.
| Группа риска | Баллы | Медиана выживаемости (мес) |
|---|---|---|
| Очень низкий | 136 | |
| Низкий | 1 | 63 |
| Средний | 2 | 44 |
| Высокий | 3—4 | 19 |
| Очень высокий | 5—6 | 8 |
Симптоматические проявления
МДС не имеет специфической симптоматики. Его клинические проявления определяются степенью тяжести и формой недуга.
- Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, – признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия – стенокардия, инфаркт миокарда, аритмии.
- Нейтропения характеризуется лихорадкой, снижением сопротивляемости организма к патогенным биологическим агентам, частым развитием инфекционных заболеваний бактериальной и вирусной этиологии. У больных повышается температура тела, потливость, возникает слабость, увеличиваются лимфоузлы. Сепсис и пневмония у таких пациентов часто заканчиваются летальным исходом.
- При тромбоцитопении кровоточат десна, появляются гематомы и петехии, часто течет кровь из носа, возникают длительные кровотечения после мелких хирургических вмешательств и различных инвазивных манипуляций. Возможно развитие внутренних кровотечений, меноррагий, кровоизлияний в головной мозг. Массивная потеря крови часто становится причиной смерти пациентов.
- У больных возникает лимфаденит, гепатомегалия, спленомегалия, специфическое поражение кожи — лейкемиды.
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).

В КМ – аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
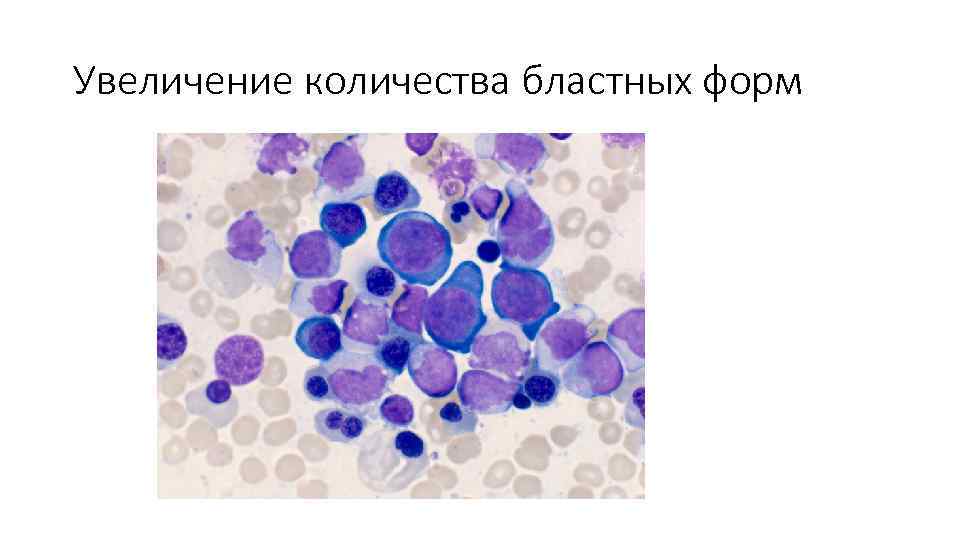
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов – клеток-родоначальниц гранулоцитарного ряда.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного – до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Миелодиспластический синдром прогноз
В большей степени прогноз при том или ином виде миелодиспластического синдрома зависит от патогенетического варианта течения данной патологии, а также от наличия или отсутствия тяжелых осложнений.
Последние научные исследования в гематологии были посвящены разработке критериев оценки прогноза для жизни пациентов, страдающих миелодиспластическим синдромом. В практической деятельности гематологи и трансфузиологии используют международную классификацию IPSS, согласно которой выделяется три основных группы риска (низкая, промежуточная и высокая). Главными параметрами в оценке прогноза при миелодиспластическом синдроме выступает процентное содержание бластных клеток в костном мозге, профиль хромосомных аномалий, а также выраженность цитопении. Наиболее благоприятное течение наблюдается у пациентов, у которых отмечается 0 баллов по классификации IPSS. Средняя продолжительность жизни при высоком риске по данной классификации составляет не более 6 месяцев.
Миелодиспластический синдром – какой врач поможет? При наличии или подозрении на развитие миелодиспластического синдрома следует незамедлительно обратиться за консультацией к таким врачам как гематолог, гемотрансфузиолог, иммунолог и онколог.
Лечатся все по-разному
Следует сразу настроить пациента, что лечение МДС не будет одинаковым для всех его разновидностей. Набор терапевтических мероприятий рассматривается в индивидуальном порядке, исходя из формы болезни и категории риска, которой принадлежит пациент (согласно клинической классификации Международной Прогностической Системы – IPSS для МДС: низкий, промежуточный 1 и 2, высокий). Словом, существуют определенные каноны, которых доктор придерживается, прежде чем приступить к непосредственному лечению. К примеру:
- Люди, не перешагнувшие 60-летний рубеж, имеющие минимальные признаки болезни, но отнесенные к категории промежуточного или высокого риска с ожидаемой выживаемостью 0,3 – 1,8 года, подвергаются высокоинтенсивной терапии;
- Пациенты, принадлежащие к группе промежуточного и низкого риска с ожидаемой выживаемостью 5-12 лет, проходят лечение низкой интенсивности;
- Молодые люди и больные среднего возраста (до 60 лет) с относительно неплохими показателями (ожидаемая выживаемость от полугода до 5 лет) первоначально лечатся по схемам низкой интенсивности, хотя в любой момент им грозит оказаться в группе, получающей более жесткое лечение (высокие дозы химиотерапии, пересадка КМ).
Таким образом, схемы лечения миелодиспластического синдрома довольно сложны и знает их только врач, получивший в свое время определенную специализацию (гематолог). Он в своей лечебной тактике опирается на рекомендации, разработанные Британским комитетом по стандартизации в гематологии (редакция 2009 года). Читателю же, на наш взгляд, достаточно познакомиться с основными методами проведения терапевтических мероприятий, особо не вникая в тонкости, не ставя диагноз и не причисляя себя или своих близких к той или иной группе риска. И еще, наверное, не помешает знать, что:
- Лечение высокой интенсивности – это, во-первых, обязательное пребывание в специализированном стационаре, во-вторых, назначение высоких доз химиотерапии и, возможно, подготовка к пересадке стволовых клеток и сама пересадка;
- Низкоинтенсивная терапия подразумевает пребывание в больнице (или даже в условиях дневного стационара) время от времени для получения заместительной терапии, низких доз химиопрепаратов, симптоматического лечения.
К сожалению, способа избавиться от такого тяжелого недуга, как МДС, раз и навсегда, пока не придумали. Разве что пересадка главного кроветворного органа (костного мозга) могла бы решить проблему, однако она тоже сопряжена с определенными трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора по всему миру). Правда, в последние годы, как на территории Российской Федерации и ближайшей соседки – Беларуси, так и на территории других государств бывшего СССР, создаются новые лаборатории тканевого типирования, объединяющие свои реестры в единый банк, чтобы иметь возможность помочь друг другу. На них и возлагаются будущие надежды.
Симптоматические проявления
Симптомы рассматриваемой болезни зависят от типа патологии и степени ее тяжести. В целом, они не имеют специфического проявления, во многом похожи на признаки других заболеваний, а потому дифференцировать миелодиспластический синдром достаточно сложно. Во многих случаях начальная стадия болезни протекает со слабой выраженностью симптомов, поэтому больные не спешат к врачу, что усугубляет последующее осложнение.
Симптоматические проявления связаны с такими процессами:
- Анемия возникает при снижении уровня эритроцитов и гемоглобина. Она наиболее часто встречается при МДС. Основные признаки — бледность кожных покровов, быстрая утомляемость и общая слабость, одышка, головокружение, низкая переносимость физических нагрузок, иногда появляется болевой синдром в грудной области.
- Нейтропения обнаруживается почти у половины больных. Для нее характерно пониженное содержание полноценных, зрелых нейтрофилов. Если данный фактор преобладает в течении болезни, то повышенная температура приобретает стойкий характер. Снижается резистивность организма к инфекционным поражениям, что выражается в учащении заболеваний разного типа (простуды, стоматит, синусит и т.п.).
- Тромбоцитопения возникает при низком уровне тромбоцитов. В таком варианте появляются кровоточивость, что может выражаться кровотечениями десен и носовой полости, учащением кровотечений разного характера и появлением синяков.
- Достаточно часто (почти 25 процентов) патология приводит к увеличению лимфатических узлов, а также расширению печени и селезенки.
Причины миелодиспластического синдрома
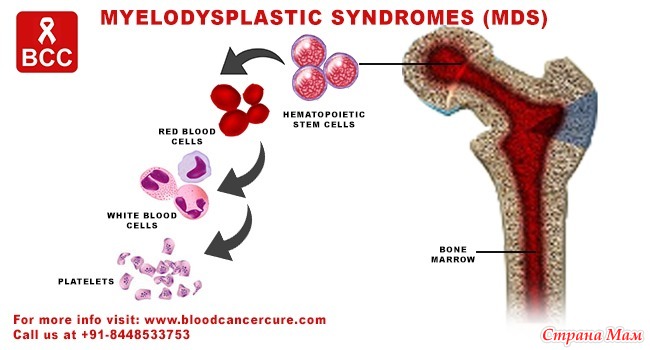
Миелодиспластический синдром (МДС) является группой заболеваний часто называемых предлейкозом, рефрактерной анемией, Ph-негативным хроническим миелолейкозом, хроническим миеломоноцитарным лейкозом или идиопатической миелоидной метаплазией, возникающих в результате соматической мутации гемопоэтических клеток-предшественников. Этиология часто неизвестна, но риск развития заболевания повышается при воздействии бензола, радиации, химиотерапевтических препаратов (особенно при длительных или интенсивных режимах химиотерапии, при использовании алкилирующих агентов и эпиподофиллотоксинов).
Миелодиспластический синдром характеризуется клональной пролиферацией гемопоэтических клеток, включая эритроидные, миелоидные и мегакариоцитарные формы. Костный мозг нормоклеточный или гиперклеточный с неэффективным гемопоэзом, что может приводить к анемии (наиболее часто), нейтропении и/или тромбоцитопении. Нарушение клеточной продукции также сопровождается морфологическими изменениями в костном мозге или крови. Встречается экстрамедуллярный гемопоэз, приводящий к гепатомегалии и спленомегалии. Миелофиброз в некоторых случаях случайно обнаруживается при установлении диагноза, а может развиваться в течение всего заболевания. Классифицируется миелодиспластический синдром в соответствии с особенностями крови и костного мозга. Клон миелодиспластического синдрома нестабилен и имеет тенденцию к трансформации в острый миелобластный лейкоз.
Лечение
Если врач считает, что патологический процесс идет как бы доброкачественно (если можно так выразиться), с небольшим количеством бластов, то больные группы низкого риска, периодически получающие заместительное и поддерживающее лечение (эритроцитарную массу, тромбовзвесь), могут довольно продолжительное время работать и вести почти привычный образ жизни. В основном, лечение таких больных выглядит следующим образом:
- Больной направляется в стационар, чтобы не допустить значительного снижения гемоглобина и развития тяжелого анемического синдрома, поэтому борьбу с ним (анемическим синдромом) считают первостепенной задачей (переливание эритроцитарной массы, заготовленной от доноров);
- Не упускается из виду и такое проявление МДС, как геморрагический синдром, возникающий на почве снижения числа и функциональной неполноценности тромбоцитов. В принципе, симптоматическая терапия, которая позволяет удерживать количество форменных элементов на нужном уровне (гемотрансфузии – эрмасса, тромбовзвесь и т. д.), в общем-то, всегда присутствует в схеме лечения больных, имеющих относительно благоприятную форму болезни;
- Получая от случая к случаю донорские эритроциты, организм больного начинает перегружаться железом, что ликвидируется применением медикаментозных средств, образующих комплексы с этим химическим элементом (эксиджад, десферол);
- Иной раз больные нуждаются в назначении низких доз «химии» (цитарабин, децитабин), а также иммунодепрессивных средства для предотвращения иммунной агрессии против костного мозга (леналидомид), с добавлением к ним ATG (антимоноцитарный глобулин) и циклоспорина;
- Присоединение инфекционного агента требует лечения антибиотиками и противогрибковыми препаратами.
Гораздо сложнее лечить формы миелодиспластического синдрома с избытком бластов, входящие в категорию высокого риска, когда химиотерапевтические препараты почти не приносят желаемого результата и не «отправляют» больного в долгосрочную ремиссию. Однако это не значит, что от них отказываются вовсе, ведь новые, недавно разработанные лекарства, дают некоторую надежду в отношении МДС и даже применяются для лечения ОМЛ (острого миелобластного лейкоза). Однако при таких обстоятельствах существуют рекомендации разработчиков – применять подобные средства для лечения больных, не достигших 60-летнего возраста и имеющих неплохой иммунологический статус, в противном случае – есть риск развития серьезных осложнений, способных преждевременно прервать жизнь.
Пересадка стволовых клеток (возможна тоже только до 60 лет) на сегодняшний день – единственный способ избавить человека от страданий на долгие-долгие годы. К сожалению, трансплантация КМ – операция хоть и несложная в техническом плане, но трудновыполнимая в плане подбора по лейкоцитарной системе HLA совместимого с реципиентом (больным) донора (идентичными, то есть, имеющими абсолютно одинаковый набор генов являются только однояйцевые близнецы – это идеальные доноры друг другу).
Методы диагностики
Миелодиспластический синдром устанавливается на основе результатов лабораторного исследования крови и гистологии костного мозга. Врач также изучает анамнез, что помогает определить образ жизни пациента, наличие профессиональных вредностей, генетической предрасположенности.
Также назначается ряд инструментальных методов и лабораторных исследований для установления полной картины заболевания.
Гемограмма
Метод лабораторного исследования крови, который позволяет выявить наличие анемии, нейтропении или моноцитоза. При установлении пенцитопении пациенту назначается гистологическое исследование образцов костного мозга.
Биохимический анализ
Помогает определить уровень железа в крови, а также фолиевой кислоты, мочевины и щелочной фосфатазы.
Кровь нужно сдать в утреннее время натощак. Перед процедурой запрещены физические упражнения, прием пищи, стрессы и курение.
Иммунограмма
Это комплексный анализ крови, который помогает специалисту определить состояние иммунитета.
Сниженные показатели указывают на то, что защитные силы подавлены, а организм не в состоянии справиться с заболеванием самостоятельно.
Гистология
Перед лабораторным исследованием проводится биопсия, при которой специалист делает забор образца костного мозга. Для этого используется специальный прибор, на одном конце которого особая игла.
Полученные образцы направляются в лабораторию, где их изучают под микроскопом. По результатам исследования устанавливается наличие или отсутствие раковых клеток.
УЗИ, КТ и МРТ
Ультразвуковое исследование, компьютерная или магнитно-резонансная томография помогают определить нарушение работоспособности внутренних органов.
На основе полученных исследований специалист устанавливает степень развития заболевания, степень изменений работы внутренних органов, снижения иммунитета и другие особенности течения болезни.
Также врач в обязательном порядке должен провести дифференциальную диагностику, так как миелодиспластический синдром по своим клиническим проявлениям схож со следующими заболеваниями:
- Лейкоз острой формы.
- Заболевания печени.
- Нарушение обмена белковых соединений в организме.
- Отравление токсическими и ядовитыми веществами, испарениями.
- Лимфома злокачественного характера.
- Миелодепрессивный синдром.
Только после комплексного исследования и изучения результатов специалист может установить точный диагноз и провести терапию.
Частные симптомы и диагностика
Клинические проявления и степень их выраженности по причине многообразия форм МДС позволяют себе широкие вариации. Случайной находкой синдром выступает редко (это бывает, если человек неплохо себя чувствует, а анализы назначаются в силу других обстоятельств). В основном же, больные направляются в поликлинику с определенными жалобами (постоянное ощущение усталости, одышка, физическая слабость, головокружения, частые подъемы температуры тела), где после тестирования крови становятся очевидными и другие признаки миелодиспластического синдрома:
- Цитопения (снижение количества полноценных форменных элементов крови);
- Анемия (низкий гемоглобин, мало эритроцитов), которая и определяет симптомы, заставившие пойти к врачу;
- Нейтропения (недостаточное содержание в крови нейтрофильных лейкоцитов, обладающих способностью поглощать бактериальные клетки в очаге воспаления – она становится причиной частых инфекций и лихорадки);
- Тромбоцитопения (уменьшение численности тромбоцитов, что обуславливает появление геморрагического синдрома – кровотечений, мелкоточечных подкожных кровоизлияний, синяков).
Между тем, отдельные пациенты относительно долго могут жить и не подозревать, что здоровье «пошатнулось». И тогда МДС становится случайной находкой уже на стадии проведения общего анализа крови.
Чаще всего поводом все же обратиться в поликлинику служат жалобы больного, которые в наибольшей степени связаны с анемией. Пробовать повысить уровень красного пигмента крови (Hb) и содержание красных кровяных телец (Er) препаратами железа и витаминами бесполезно, лечение успехов не приносит, ведь анемия при МДС – рефрактерная. При подозрении на МДС, которое возникает в ходе проведения общего анализа крови (ОАК), добавляются другие исследования:
- Подсчет молодых форм красного ростка, которым уже «позволено» присутствовать в циркулирующей крови – ретикулоцитов, они «подскажут», насколько быстро идет процесс воспроизводства новых зрелых кровяных телец;
- Цитологическое исследование аспирата КМ (у пожилых пациентов данный тест не принадлежит к обязательным анализам);
-
Трепанобиопсия (процедура обязательна для всех больных) – после изучения морфологических особенностей гистологический анализ развеет сомнения или подтвердит подозрения;
- Цитогенетический тест (поскольку МДС зачастую связан с хромосомными дефектами), который находит аномальный клон (если он есть на самом деле) и подтверждает его вмешательство в процесс кроветворения, в противном случае – картину МДС может давать какое-то реактивное состояние.
Безусловно, диагностика миелодиспластического синдрома, начинается с жалоб больного и ОАК, но в дальнейшем опирается на более сложные лабораторные исследования. Здесь врачу есть над чем подумать, чтобы правильно оценить нарушения кроветворения, ведь изменения клеточного состава и морфологических особенностей клеток крови и костного мозга могут быть весьма многочисленны и многообразны. Впрочем, как и сама болезнь…

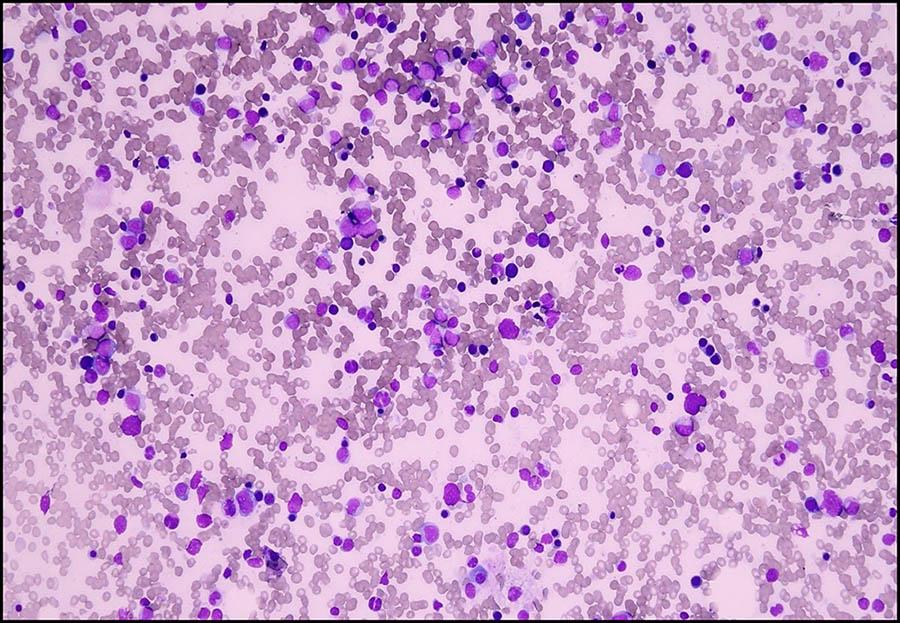
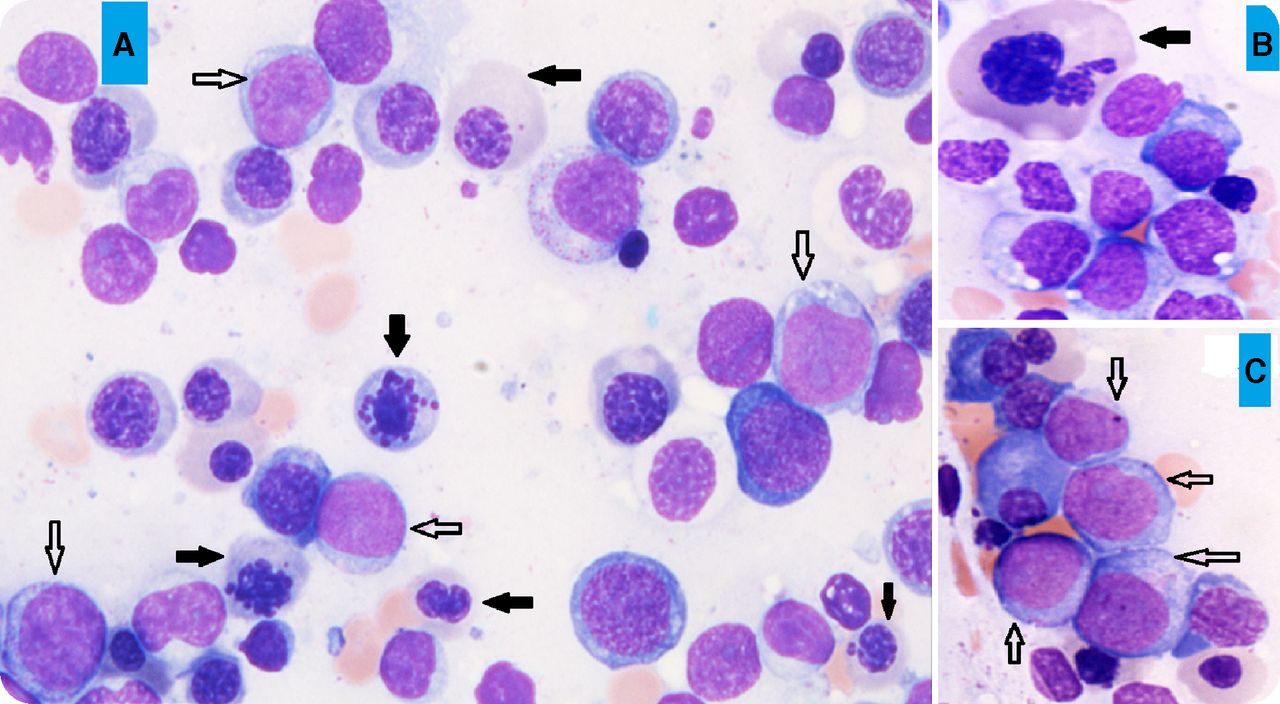
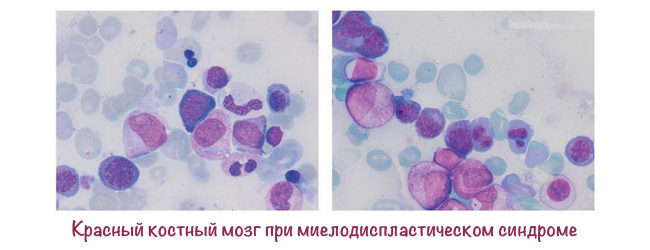
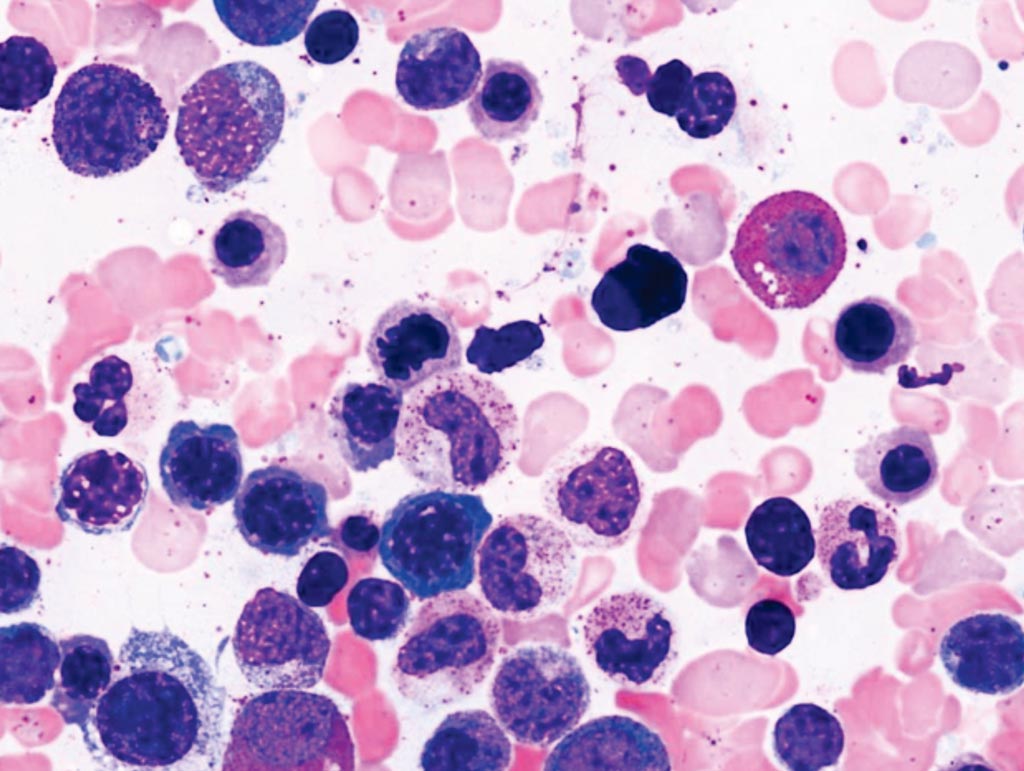
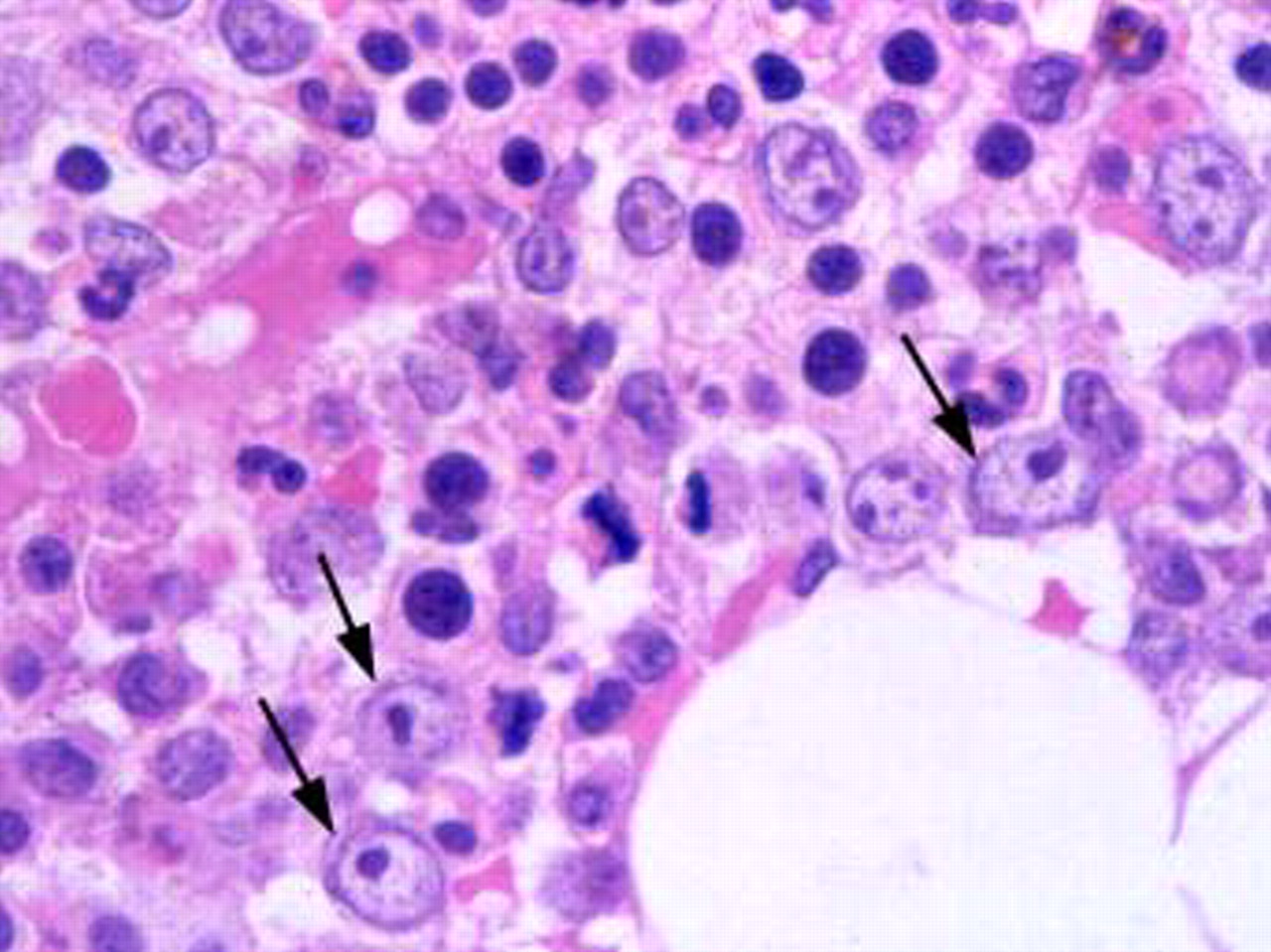
костный мозг при МДС
Синдром миелодиспластический

- Описание
- Причины
- Симптомы (признаки)
- Диагностика
- Лечение
Синдром миелодиспластический: Краткое описание
Миелодиспластический синдром (МДС) — группа патологических состояний, характеризующихся нарушением гемопоэза во всех ростках, проявляющемся панцитопенией. МДС часто трансформируется в острый лейкоз или апластическую анемию.
Преобладающий возраст
— старше 65 лет.
Код по международной классификации болезней МКБ-10:
D46 – Миелодиспластические синдромы
Генетика. При миелолейкозе наблюдают межгенный сплайсинг генов MDS1 и AML1 (*600049, Â ).
Факторы риска
Эндогенные: хромосомные и генетические нарушения • Экзогенные: длительный контакт с продуктами органической химии, радиация, инсоляция, применение некоторых ЛС (например, хлорамфеникол, цитостатики).
Морфологическая классификация • Рефрактерная анемия — 5% бластов в крови, или наличие палочек Ауэра (палочковидные цитоплазматические красного цвета включения в моноцитах, миелоцитах и миелобластах) • Хронический миеломоноцитарный лейкоз — 1– 20% бластов в костном мозге, 1´ 109/л
Клиническая картина
Интоксикация — субфебрильная температура тела, усиленное потоотделение, слабость, вялость, понижение аппетита, снижение массы тела • Анемия — бледность кожных покровов и видимых слизистых оболочек, нарушение микроциркуляции • Геморрагический синдром — экхимозно – петехиальная сыпь, кровотечения из слизистых оболочек • Спленомегалия, гепатомегалия (редко) • Кожные инфильтраты • Инфекционные осложнения вследствие лейкопении.
Лабораторные исследования
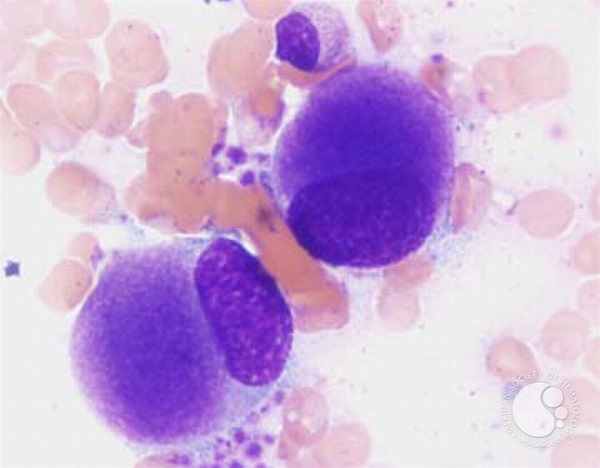
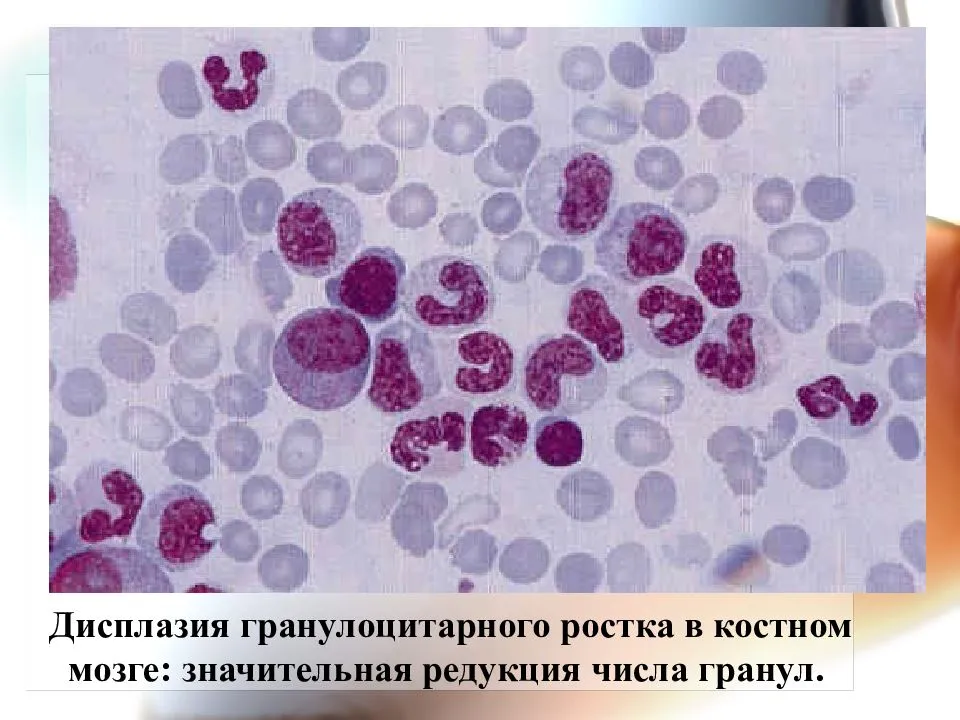
Периферическая кровь — анемия макроцитарная, возможны ретикулоцитоз, гранулоцитопения (гипогранулярные или агранулярные нейтрофилы со слабо конденсированным хроматином), тромбоцитопения • Биохимический анализ крови — увеличение уровня HbF до 70% • Прямой антиглобулиновый тест Кумбса положителен в некоторых случаях • Миелограмма — незначительное увеличение содержания бластов, гипоплазия эритроидного и миелоидного ростков, ретикулярный фиброз выражен слабо, аномальная локализация незрелых предшественников. мегакариоцитов снижено. Количество клеток красного костного мозга обычно нормально, у 10% возможно выявление гипоплазии.
Специальные исследования
Цитогенетические • Тест определения функций гранулоцитов — снижение миелопероксидазной активности, фагоцитоза, хемотаксиса и адгезии • Тест определения функций тромбоцитов — нарушение агрегации, адгезии • Иммунофенотипирование — используют неспецифические миелоидные маркёры • Рентгенография органов грудной клетки • УЗИ — увеличение печени и селезёнки • Гепатосцинтиграфия.
Режим
Амбулаторный • Показания к стационарному лечению • Тяжёлое состояние больного, истощение • Геморрагический синдром • Присоединение инфекционных осложнений • Панцитопения, требующая заместительных гемотрансфузий.
Лекарственная терапия
— симптоматическая • Антибактериальная терапия (предпочтительнее антибиотики широкого спектра действия), противогрибковые, антивирусные препараты • Гемостатики, ангиопротекторы (например, аминокапроновая кислота, этамзилат) • Общеукрепляющая, дезинтоксикационная терапия (р – р глюкозы, препараты калия, витамины, трифосаденин, кокарбоксилаза, инозин) • Биопрепараты при выраженной лейкопении (например, эшерихия коли, бифидобактерии бифидум) • Трансфузионная терапия по показаниям — см. Анемии апластические (переливания отмытой эритроцитарной массы, тромбоцитарной взвеси) • Даназол или преднизолон — при сопутствующей аутоиммунной тромбоцитопении.
Трансплантация костного мозга показана больным моложе 35 лет.
Ведение больного. Наблюдение 1 р/мес в перерывах между курсами поддерживающей терапии. Необходим контроль периферической крови, миелограммы (для исключения трансформации МДС в острый лейкоз или аплазию).
Прогноз
Средняя продолжительность жизни для больных с рефрактерной анемией, рефрактерной анемией с кольцевыми сидеробластами составляет 5 лет • Средняя продолжительность жизни больных с рефрактерной анемией с избытком бластов, рефрактерной анемией с избытком трансформирующихся бластов и хронической миеломоноцитарной анемией составляет 1 год • Отягощают течение и ухудшают прогноз геморрагический синдром, генерализованные инфекции.
Сокращение
МДС — миелодиспластический синдром
МКБ-10 • D46 Миелодиспластические синдромы
гемопоэтическая дисплазия
Эта статья Вам помогла? Да -5 Нет -3 Если статья содержит ошибку Нажмите сюда 2531 Рэйтинг:
Примечания
- ↑ Monarch Disease Ontology release 2018-06-29sonu
- Гематология / Под редак. О. А. Рукавицына. — СПб., 2007. — С. 193—226.
- Corey S. J., Minden M. D., Barber D. L. et al. Myelodysplastic syndromes: the complexicity of stem-cell diseases. Cancer. Nature reviews. 2007. V. 7; 118—129.
- Pedersen-Bjergaard J., Pedersen M., Roulston D., Philip P.. (1995) Different genetic pathways in leukemogenesis for patients presenting with therapy-related myelodysplasia and therapy-related acute myeloid leukemia. Blood. 86(9): 3542—3552.
- Greenberg P. L. Apoptosis and its role in the in the myelodysplastic syndromes; implications for disease natural history and treatment. Leuk res, 1998; 22: 1123—1136
- Onley H. J., Le Beau M. M. Cytogenetic Diagnosis of Myelodysplastic syndromes. in book H. J. Deeg, D. T. Bowen, S. D. Gore, T. Haferlach, m. M. Le Beau, C. Niemeyr. Hematologic Malignancies: Myelodysplastic syndromes // Springler Berlin Heidelbery. 2006, P. 55—79.
- ↑ [прояснить]
- Bennett J. M., Catovsky D., Daniel M. T., Flandrin G., Galton D. A., et al. (1982) Proposals for the classification of the myelodysplastic syndromes. Br. J. Haematol. 51(2): 189—199.
- Brunning R., Bennett J., Flandrin G. et al. Myelodysplastic Syndromes. In: Jaffe E, Harris N, Stein H et al., eds. WHO Classification of Tumours. Pathology and Genetics of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press 2001; 61—73.
- Harris N., Jaffe E., Diebold J. et al. WHO Classification of Neoplastic Diseases of the Hematopoietic and Lymphoid Tissues: Report of the Clinical Advisory Committee Meeting. J. Clin. Oncol. 1999; 17:3835—3849.
- Vardiman J. W., Harris N. L., Brunning R. D. The World Health Organization (WHO) classification of the myeloid neoplasms. Blood 2002; 100:2292—2302.
- Bruning R. D., Orazi A., Germing U. et al., 2008. WHO classification of tumors of hematopoietic and lymphoid tissues. Chapter 5, p. 88—107.
- Hollstrem Lindberg E., Cazzola M. The role of JAK2 mutations in RARS and other MDS. 2008. Hematology, 52—59.
- Greenberg P. L., Baer M., Bennett J. et al. NCCN Practice Guidelines for Myelodysplastic Syndromes, Version1, 2001, In «The Complete Library of NCCN Guidelines », Rockledge, PA.
- Cheson B. D., Bennett J. M., Kantarjian H. et al. Report of an international working group to standardize response criteria for myelodysplastic syndromes. Blood 2000; 96:3671—3674.
- ↑ Greenberg P., Cox c., Le Beau M. M. et al., International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89:2079—2088.
- Malcovati L., Germing U., Kuendgen A. et al. Time-dependant prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25: 3503—3510.
- A WHO Classification-Based Prognostic Scoring System (WPSS) for Predicting Survival in Myelodysplastic Syndromes. Luca Malcovati et al. ASH Annual Meeting Abstracts 2005 106: Abstract 788.
- Scott BL, Sandmaier BM, Storer B et al. Myeloablative vs nonmyeloablative allogeneic transplantation for patients with myelodysplastic syndrome or acute myelogenous leukemia with multilineage dysplasia: a retrospective analysis. Leukemia 2006;20:128—135.
- Wallen H, Gooley TA, Deeg HJ et al. Ablative allogeneic hematopoietic cell transplantation in adults 60 years of age and older. J Clin Oncol 2005;23:3439—3446.
- Demuynck H, Verhoef GE, Zachee P et al. Treatment of patients with MDS with allogeneic bone marrow transplantation from genotypically similar HLA-identical sibling and alternative donors. Bone Marrow Transplant 1996;17:745—751.
- Bowen D. Is traditional low dose chemotherapy (cytarabine/melphalan) still on option? // Leukemia Research, Volume 31, Supplement 1, May 2007, Page S19
- Miller K.B. et al. The evaluation of low-dose cytarabine in the treatment of myelodisplastic syndromes: a phase III intergroup study. Annals of hematology, 1992; 65: 162—168.
- Burnett A.K., Milligan D., Prentice A.G. et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer. 2007. 109: 1114—1124