Полезные свойства железа
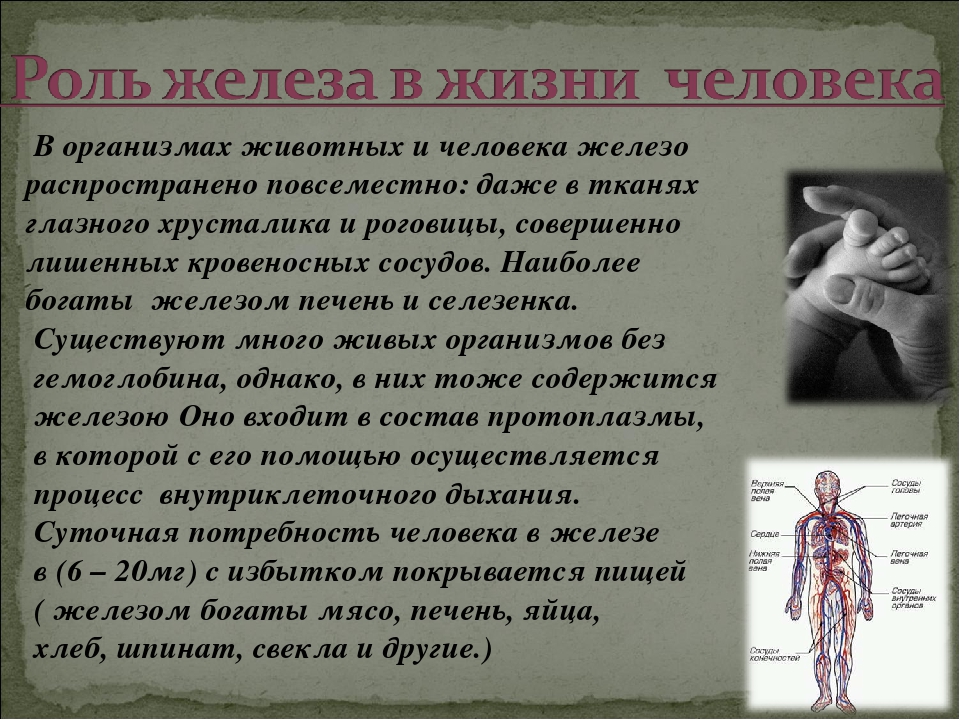
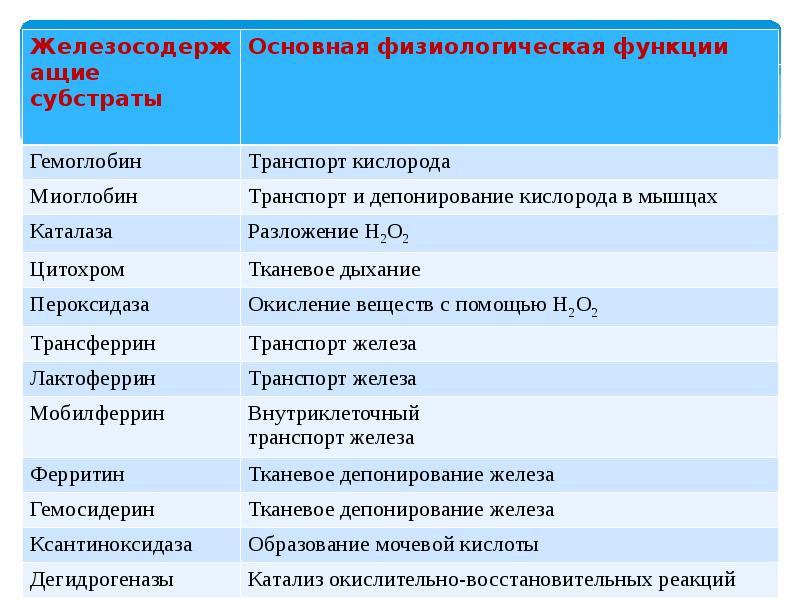
Микроэлемент железо в организме человека жизненно необходим, и играет большую роль, ускоряя процессы обмена кислородом. Участвует в поставке его из легких ко всем тканям и органам по кровеносной системе. Основным накопителем железа служит ферритин ‒ глобулярный белковый комплекс. Микроэлемент содержится в ферментах в виде гема, который присутствует в большом количестве в гемоглобине крови и окрашивает ее в красный цвет
Другие комплексы, отличающиеся от гема, встречаются в важном ферменте, участвующем в синтезе ДНК. Также небольшое количество железа содержится в костном мозге, печени, мышцах и селезенке
В организм оно поступает с пищей, а выводится через потоотделение и мочевыводящую систему.
Полезные свойства железа в организме человека:
- препятствует развитию анемии;
- выводит из организма углекислоту;
- поддерживает работу щитовидной железы;
- повышает иммунитет и сопротивляемость бактериям;
- борется с токсинами в печени;
- усиливает действие витаминов группы B.
Гемоглобин, состоящий в большей части из железа, связываясь с кислородом, доставляет его ко всем органам и тканям. Отдавая кислород и соединяясь с углекислым газом, гемоглобин переправляет его к легким, из которых он выдыхается человеком.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2III)O4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 )
Fe + H2SO4(разб.) → FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе3+:
2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t°→ Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Усвоение железа
В организме человека усвоение железа зависит от нескольких факторов, например таких, как форма поступления, сочетание с другими элементами в продуктах. Есть два вида железа, попадающего в организм из еды. Гемовое содержится в продуктах животного происхождения, а негемовое находится в растительной пище. Первое усваивается организмом в три раза лучше второго. Исходя из этого, при лечении железодефицитной анемии или для нормализации уровня железа, пациенту желательно перейти на употребление животной пищи. Еще можно прибегнуть к приему витаминов, железосодержащих таблеток или биологически активных добавок.
Попадая в желудок, пища расщепляется на белки, жиры и углеводы, в это же время происходит всасывание в организм витаминов и микроэлементов. Количество их зависит от сочетания потребленных продуктов. Каждый день в меню должны присутствовать мясные или рыбные продукты вместе с бобовыми, сухими завтраками и большим количеством зелени. А вот молочные продукты можно употреблять не ранее, чем через четыре часа после приема железосодержащей пищи. Делается это потому, что кальций, содержащийся в молочных продуктах, препятствует усвоению железа организмом.
Не последнюю роль в усвоении железа играют витамин C, содержащийся в больших количествах в цитрусовых, томатах, черной смородине, капусте, перце. Так же B6 и B12, который есть в мясе, морепродуктах, сырах. Основное содержание витамина B9 приходится на овощи зеленого цвета: салат, капуста брокколи, авокадо. Алкоголь разрушает железо, содержащееся в организме, но немного выпитого за обедом вина способствует лучшему его усвоению.
Для полноты картины стоит обратить внимание на продукты, содержащие медь, цинк, кобальт и молибден, которые также помогают усвоению организмом железа. Молибден находится в рисе, бобовых и зелени петрушки
Кобальт присутствует в шпинате, субпродуктах и напитках из цикория. Цинком богаты семечки, орехи, гречка. Медь в большом количестве есть в авокадо. Поэтому, составляя меню, стоит обратить внимание на совместимость продуктов.
Норма железа в крови
Норма железа в крови зависит от пола и возраста человека. Из-за конституционной особенности организма, скорости обмена веществ, меньшей мышечной массы, у женщин потребность в железе ниже, чем у мужчин.
Показатель колеблется:
- у девушек от шестнадцати до восемнадцати лет норма микроэлемента составляет 5,8-18 мкмоль/л;
- в репродуктивный период увеличивается до 11,5-30,4;
- в период после 45 до 65 лет 12-31;
- после 65 лет показатели незначительно понижаются.
Показатели железа у беременных, в зависимости от срока, должны колебаться приделах 8,9-30,3 мкмоль/л.
У мужчин:
- в подростковый период норма составляет 5-25 мкмоль/л;
- с 19 до 45 лет увеличивается до 11,5-30,5;
- 45-65 лет 12-32 мкмоль/л.
У мужчин старше шестидесяти пяти лет норма уменьшается до 12-29,7 мкмоль/л.
У новорожденных первого месяца жизни норма железа 5-20 мкмоль/л, у малышей до года 5-21, до пяти лет 5-18, до 11 ‒ 5,5-11,5.
Даже зная норму железа в крови, самостоятельно разобраться в анализах невозможно, поскольку еще учитываются лабораторные данные в системе.
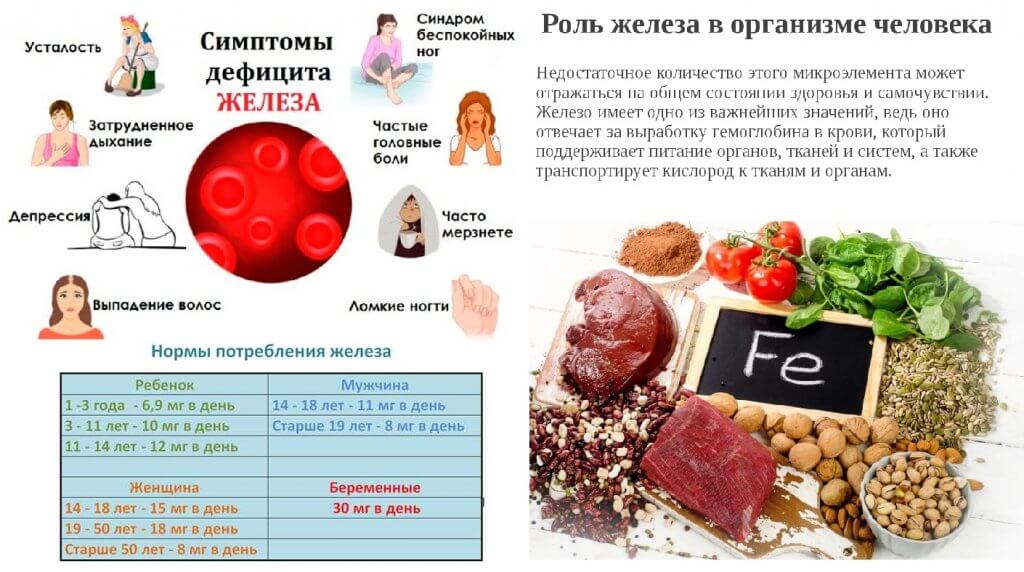
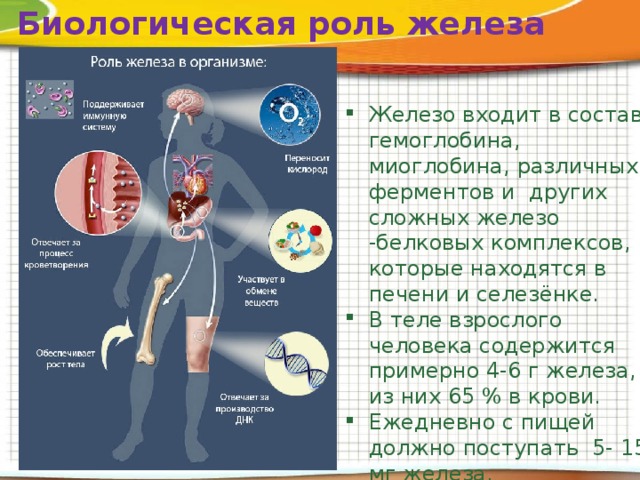
Роль железа в организме человека
Невозможно переоценить роль железа в организме человека. Это один из главных составляющих жизнедеятельности всего живого. Микроэлемент помогает росту клеток и внутриклеточному метаболизму. Активизирует интерферон, повышая защитные силы организма. Нейтрализует ядовитые вещества и токсины в печени. Предупреждает снижение уровня гемоглобина и эритроцитов в крови, препятствуя возникновению анемии. Улучшает состояние кожи, волос и ногтей. Участвует в холестериновом и энергетическом обмене.
При нормальном содержании железа в крови, человек чувствует себя более бодрым и здоровым, меньше подвергнут заболеваниям и усталости. Особое значение микроэлемент имеет для беременных женщин, поскольку благотворно влияет на формирование здорового плода.
Избыток железа в организме
Избыток железа так же, как и недостаток негативно сказывается на здоровье и самочувствии человека. Существует несколько причин, которые приводят к превышению нормы железа в организме:
- Заболевания: гемохроматоз, нефрит, лейкоз, хронический гепатит B и C, опухоли печени, закупорка протока поджелудочной железы.
- Не контролируемый прием препаратов железа.
- Употребление плохо очищенной воды с высоким содержанием данного микроэлемента.
- Загазованность воздуха.
- Злоупотребления спиртными напитками.
Продукты с высоким содержанием железа не могут привести к избытку Fe в организме.
По определенным симптомам человек может определить есть ли у него переизбыток данного микроэлемента:
- Появление пигментных пятен в области подмышек, ладоней.
- Желтоватый оттенок языка, неба, глаз.
- Быстрая утомляемость, сонливость.
- Расстройство желудка, тошнота, рвота.
- Нарушение сердечного ритма.
Наличие таких недомоганий должно послужить поводом для обращения к врачу. Избыток железа может привести к циррозу печени, сахарному диабету, инфаркту миокарда.
Специалисты помогут пациенту, при помощи комплексного лечения понизить содержание железа в организме. Из рациона больного убирают продукты с высоким содержанием данного микроэлемента и витамина C. Для ограничения всасывания железа рекомендуется ежедневное употребление молочных продуктов. Назначается Цитоферез и необходимые препараты.
ПРОИСХОЖДЕНИЕ
Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Продукты богатые железом
Чтобы восполнить ежедневную норму, каждый человек должен включить в свой рацион продукты, богатые железом.
Продукты, содержащие железо есть двух видов.
В первом случае Fe поступает в организм человека с пищей, приготовленной из мяса и рыбы.
В 100 граммах продукта содержится:
- субпродукты: свиная печень содержит 20 мг железа, куриная 17,5 мг, говяжья 16,7 мг. Говяжье сердце 9,1 мг, язык 5 мг;
- мясо: говядина 6,7 мг, баранина 5,8 мг, свинина 4,8 мг, курятина 3,7 мг. Чем темнее мясо, тем выше содержание железа в нем;
- морепродукты: сто грамм мидий содержат 13 % дневной нормы микроэлемента.
Во втором случае железо поступает в организм из продуктов растительного происхождения.
К ним относятся:
- овсяная и гречневая крупа;
- чечевица;
- нут;
- пшеничные отруби;
- свекла;
- капуста белокочанная.
Еще высоким содержанием микроэлемента железа отличаются такие продукты, как белые грибы, морская капуста, семена тыквы, курага и чернослив.
Чтобы не пополнять организм железом за счет витаминов, купленных в аптеке, лучше каждый день готовить полезные блюда и соки, используя продукты богатые железом.
Нехватка железа в организме
При нехватке железа в организме, человек испытывает постоянную усталость, головокружения, снижение работоспособности, затруднительное дыхание, головные боли. Женщины замечают ухудшения состояния волос, ногтей, кожа становится сухой и шершавой, в уголках губ появляются трещинки.
Дефицит железа в организме человека может спровоцировать неправильное питание, диеты, голодание, вегетарианство, болезни, при которых не усваивается данный микроэлемент. Часто нехватка железа наблюдается у подростков в момент активного роста, беременных, доноров, регулярно сдающих кровь. При малейшем подозрении на анемию необходимо обратиться к врачу для дальнейшего лабораторного исследования крови и назначении лечения.
При выявлении легкой и средней тяжести заболевания пациентам рекомендуют включить в рацион продукты богатые железом. Если гемоглобин очень низкий, помимо скорректированного питания назначаются препараты, содержащие железо.
Существуют народные рецепты и советы, которые помогут увеличить количество необходимого микроэлемента:
- Ежедневно употреблять сок граната или готовить фреш из свеклы, яблок, морковки.
- Включить в рацион запеченный картофель. Его можно употреблять как самостоятельное блюдо или добавлять в салаты.
- Два раза в день пить чай, приготовленный из сухих листьев крапивы. Две чайные ложки травы заваривают в стакане кипятка десять минут. Процеживают, отвар можно пить с добавлением меда.
Для приготовления салатов можно использовать листья пажитника. Растение способствует выработке эритроцитов.
СВОЙСТВА
Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O2,500-600°С, -CO2)
б) сжигание кокса при горячем дутье:
С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe2O3→(CO) (FeIIFe2III)O4→(CO) FeO→(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
СТРУКТУРА
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна