Применение тяжёлой воды
Учёные, которые открыли тяжелую воду – D2О, долго не понимали, какую пользу она может приносить. И только через определённый промежуток времени другие исследователи раскрыли её промышленные и научные возможности. На сегодняшний день её активно применяют:
- в ядерных технологиях;
- в работе ядерных реакторов, где с их помощью осуществляется торможение нейтронов. Также её используют как теплоноситель;
- как изотопный индикатор в физике, химии, гидрологии, биологии;
- в качестве детектора определённых элементарных частиц.
Поскольку сегодня активно изучается вероятность применения дейтерия в качестве топлива при управляемом термоядерном синтезе, возможно, что очень скоро тяжёлую воду будут использовать как новый источник энергии. Стоит отметить, что, кроме тяжёлой, существуют ещё полутяжёлая, сверхтяжёлая вода, а также некоторые модификации изотопов.
Биологическая роль и физиологическое воздействие
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки) показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90 % дейтерировании воды в теле. Простейшие способны адаптироваться к 70 % раствору тяжёлой воды, а водоросли и бактерии способны жить даже в чистой тяжёлой воде. Человек может без видимого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. Так, в одном из экспериментов по изучению связи вестибулярного аппарата и непроизвольных движений глаз (нистагма) добровольцам предлагалось выпить от 100 до 200 граммов тяжёлой воды; в результате поглощения более плотной тяжёлой воды купулой (желатинообразной структурой в полукружных каналах) её нейтральная плавучесть в эндолимфе каналов нарушается, и возникают лёгкие нарушения пространственной ориентации, в частности нистагм. Этот эффект аналогичен возникающему при приёме алкоголя (однако в последнем случае плотность купулы уменьшается, поскольку плотность этилового спирта меньше плотности воды).
Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах от 10 до 675 г D2O в день.
В человеческом организме содержится в качестве естественной примеси столько же дейтерия, сколько в 5 граммах тяжёлой воды; этот дейтерий в основном входит в молекулы полутяжёлой воды HDO, а также во все прочие биологические соединения, в которых есть водород.[источник не указан 114 дней]
Примечания
- Петрянов И. В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
- ↑
- Зельвенский Я. Д. Дейтерий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 16—17. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- ↑ . — «used in boron neutron capture therapy … D2O is more toxic to malignant than normal animal cells … Protozoa are able to withstand up to 70% D2O. Algae and bacteria can adapt to grow in 100% D2O».
- Лобышев В. Н., Калиниченко Л. П. Изотопные эффекты D2O в биологических системах. — М.: Наука, 1978. — 215 с.
- Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution (англ.). — Dordrecht: Kluwer Acad. Publ., 2004. — 112 p.
- Trotsenko, Y. A., Khmelenina, V. N., Beschastny, A. P. (1995) The Ribulose Monophosphate (Quayle) Cycle: News and Views. Microbial Growth on C1 Compounds, in: Proceedings of the 8th International Symposium on Microbial Growth on C1 Compounds (Lindstrom M. E., Tabita F. R., eds.). San Diego (USA), Boston: Kluwer Academic Publishers, pp. 23-26
- Мосин О. В., Швец В. И., Складнев Д. А., Игнатов И. Микробный синтез дейтерий-меченного L-фенилаланина факультативной метилотрофной бактерией Brevibacterium Methylicum на средах с различными концентрациями тяжелой воды // Биофармацевтический журнал. — 2012. — Т. 4, вып. 1. — С. 11—22.
- Мосин О. В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и микроводорослей при росте на тяжелой воде (D2O) // Вода: химия и экология. — 2012. — Вып. 3. — С. 83—94.
- Crespi H. L. Fully deuterated microorganisms: tools in magnetic resonance and neutron scattering. Synthesis and Applications of Isotopically Labeled Compounds / in: Proceedings of an International Symposium. Baillie T, Jones J.R eds. Amsterdam: Elsevier. 1989. pp. 329—332.
- Mosin O. V., Ignatov I. Microbiological Synthesis of 2H-Labeled Phenylalanine, Alanine, Valine, and Leucine/Isoleucine with Different Degrees of Deuterium Enrichment by the Gram-Positive Facultative Methylotrophic Bacterium Вrevibacterium Methylicum (англ.) // International Journal of BioMedicine. — 2013. — Vol. 3, iss. 2. — P. 132—138.
- (англ.) (недоступная ссылка). Science News Staff (9 February 1935). Дата обращения 7 сентября 2013.
- Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- Илья Леенсон. . Энциклопедия Кругосвет. Дата обращения 7 сентября 2013.
- Андреев Б. М., Зельвенский Я. Д., Катальников С. Г. Тяжелые изотопы водорода в ядерной технике. — М.: Энергоатомиздат, 1987.
- Зельвенский Я. Д. Тритий // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 5—7. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Применение
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для замедления нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии, агрохимии и др. (в том числе в опытах с живыми организмами и при диагностических исследованиях человека). В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Дейтерий — ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетических реакторах такого типа предполагается осуществить реакцию D + T → 4He + n + 17,6 МэВ.
В некоторых странах (например, в Австралии) коммерческий оборот тяжёлой воды поставлен под государственные ограничения, что связано с теоретической возможностью её использования для создания «несанкционированных» реакторов на природном уране, пригодных для наработки оружейного плутония.
Другие виды тяжёлой воды
Полутяжёлая вода
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещён дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и H2O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода
Основная статья: Сверхтяжёлая вода
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) ещё заметнее отличается от обычной: кипит при 104 °C, замерзает при +9 °C и имеет плотность 1,21 г/см³. Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода (16O, 17O и 18O). Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжелокислородные изотопные модификации воды
Термин тяжёлая вода применяют также по отношению к тяжелокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжелокислородных модификаций. Их физические свойства также несколько отличаются от свойств обычной воды; так, температура замерзания 1H218O составляет +0,28 °C.
Тяжелокислородная вода, в частности, 1H218O, используется в диагностике онкологических заболеваний (из неё на циклотроне получают изотоп фтор-18, который используют для синтеза препаратов для диагностики онкозаболеваний, в частности 18-фдг).
Общее число изотопных модификаций воды
См. также: Изотопы водорода и Изотопы кислорода
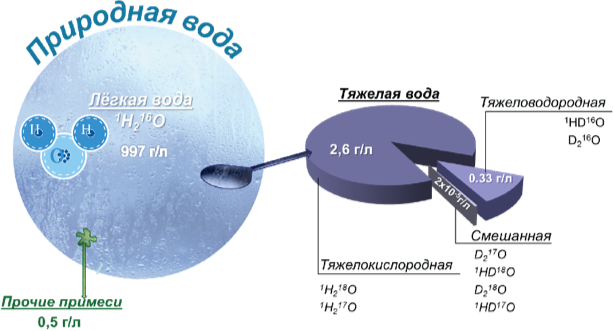
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжелокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18:
- T216O — сверхтяжёлая вода
- T217O
- T218O
- DT16O
- DT17O
- DT18O
- HT16O
- HT17O
- HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 радиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1H215O).
История открытия
Молекулы тяжеловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что учёный был удостоен Нобелевской премии по химии в 1934 году. Уже в 1933 году Гилберт Льюис впервые выделил чистую тяжеловодородную воду. При электролизе обычной воды, содержащей наряду с обычными молекулами воды незначительное количество молекул (НDО) и ещё меньшее количество молекул тяжёлой воды (D2O), включающих в себя тяжёлый изотоп водорода, остаток постепенно обогащается молекулами этих соединений. Из такого остатка после многократного повторения электролиза Льюису удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул соединения кислорода с дейтерием и получившей название тяжёлой. Этот способ производства тяжёлой воды остаётся основным и сейчас, хотя используется в основном на окончательной стадии обогащения от 5—10 % до >99 % (см. ниже).
После открытия в конце 1938 года деления ядер и осознания возможности использования цепных ядерных реакций деления, индуцированных нейтронами, возникла необходимость в замедлителе нейтронов — веществе, позволяющем эффективно замедлять нейтроны, не теряя их в реакциях захвата. Наиболее эффективно нейтроны замедляются лёгкими ядрами, и самым эффективным замедлителем должны были бы быть ядра обычного водорода (протия), однако они обладают высоким сечением захвата нейтронов. Напротив, тяжёлый водород захватывает очень мало нейтронов (сечение захвата тепловых нейтронов у протия в более чем 100 тысяч раз выше, чем у дейтерия). Технически наиболее удобным соединением дейтерия является тяжёлая вода, причём она способна также служить теплоносителем, отводя выделяющееся тепло от области, где происходит цепная реакция деления. С самых ранних времён ядерной энергетики тяжёлая вода стала важным компонентом в некоторых реакторах, как энергетических, так и предназначенных для наработки изотопов плутония для ядерного оружия. Эти так называемые тяжеловодные реакторы имеют то преимущество, что могут работать на природном (необогащённом) уране без использования графитовых замедлителей, которые на этапе вывода из эксплуатации могут представлять опасность взрыва пыли и содержат наведённую радиоактивность (углерод-14 и ряд других радионуклидов). Однако в большинстве современных реакторов используется обогащённый уран с нормальной «лёгкой водой» в качестве замедлителя, несмотря на частичную потерю замедленных нейтронов.
Производство тяжёлой воды в СССР
Промышленное производство и применение тяжёлой воды началось с развитием атомной энергетики. В СССР при организации Лаборатории № 3 АН СССР (современный ИТЭФ) перед руководителем проекта А. И. Алихановым была поставлена задача создания реактора на тяжёлой воде. Это обусловило потребность в тяжёлой воде, и техническим советом Специального комитета при СНК СССР был разработан проект Постановления СНК СССР «О строительстве полупромышленных установок по производству продукта 180», работы по созданию производительных установок тяжёлой воды в кратчайшие сроки были поручены руководителю атомного проекта Б. Л. Ванникову, народному комиссару химической промышленности М. Г. Первухину, представителю Госплана Н. А. Борисову, народному комиссару по делам строительства СССР С. З. Гинзбургу, народному комиссару машиностроения и приборостроения СССР П. И. Паршину и народному комиссару нефтяной промышленности СССР Н. К. Байбакову. Главным консультантом в вопросах тяжёлой воды стал начальник сектора Лаборатории № 2 АН СССР М. И. Корнфельд.
Некоторые сведения
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока. В 1935 году, сразу после открытия тяжёлой воды, её цена составляла ориентировочно 19 долларов за грамм. В настоящее время тяжёлая вода с содержанием дейтерия 99 % ат., продаваемая поставщиками химических реактивов, при покупке 1 кг сто́ит около 1 евро за грамм, однако эта цена относится к продукту с контролируемым и гарантированным качеством химического реактива; при снижении требований к качеству цена может быть на порядок ниже.
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье, из-за публикации предположения В. В. Похлёбкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году. В действительности повышение концентрации тяжёлой воды при кипячении ничтожно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация дейтерия равна 0,15 %, то есть всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1⋅1030 тонн воды, что в 300 млн раз превышает массу Земли. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей, переход в раствор веществ из стенок посуды и термическое разложение органических примесей.
Свойства тяжелой воды
Ученые множество лет изучали данный вопрос
и выявили: легкая кардинально отличается от свойств тяжелой воды. Практически все из них утверждают, что такая
жидкость непригодна для живых организмов. Рыбы, черви, микробы в ней не смогут
жить, а животные погибнут после употребления. Кроме того, даже аэробные
растения не могут выживать в ней. Основные свойства:
- не имеет запаха, вкуса или цвета;
- кристаллизация тяжелых вод происходит при температуре 3,813°C;
- закипает при температуре 101, 43 °C;
- обладает вязкостью на 20% больше, чем питьевая Н2О;
- имеет молекулярную массу в 20,034 г/моль;
- отличается плотностью в 1,1042 грамм на кубический сантиметр (при температуре 25°C);
- имеет определенное давление паров: 10 мм ртутного столба при 13 градусах и 100 мм при 54 градусах.
Растворить соли в ней гораздо труднее, чем
в питьевой жидкости. Кроме того, жесткая вода не способна поглощать
нейтроны. Существовать могут в ней только водоросли и бактерии. Для
человека сверхтяжелая водав
минимальных объемах практически безопасна и быстро выводится из организма, плюс
ко всему она содержится в обычной в небольшой концентрации.

Тяжелая вода
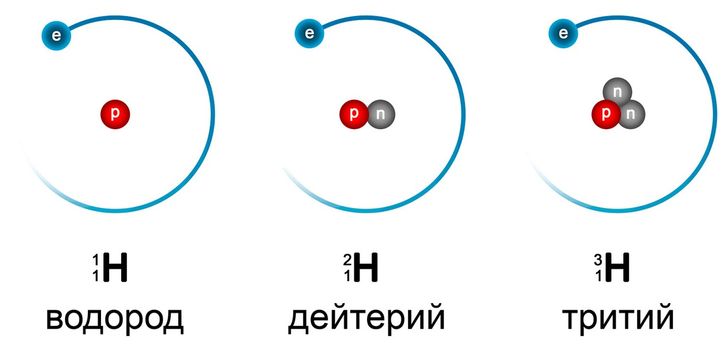
В 1931 году Гарольд Юри впервые обнаружил тяжелую воду, однако через год Гилберт Ньютон Льюис получил чистую тяжеловодородную воду. Именуют ее нередко окисью дейтерия, имеет формулу D20. Если сравнивать с водородом, то дейтерий в 2 раза тяжелее (молекулярная масса простой воды равняется 18 г/моль), и именно это объясняет почему же дейтериевую воду d2o называют тяжелой водой.
Сразу хочется развеять один из мифов.
Многие уверены, что при длительном кипячении в воде повышается концентрация
дейтерия и может привести к последствиям при употреблении. К счастью, это всего
лишь миф, так как концентрация настолько мала, что не вредит человеку.
Если посмотреть на простую и тяжелую воду,
то провести сравнение свойств на
глаз легкой и тяжелой воды невозможно. Организм же человека явно
ощущает разницу между двумя жидкостями. После употребления последней
замедляется метаболизм, при накоплении дейтерия возможно торможение обменных
процессов и развитие необратимых последствий. Одно из них — образование
злокачественных опухолей. Легкая вода человеку необходима, ведь она питает
клетки и обеспечивает им антиоксидантную защиту.
Даже с точки химического состава между
двумя жидкостями практически нет разницы. Обе выделяют водород, одинаково
разлагаются при электролизе и имеют один и тот же состав. Однако физические
свойства кардинально отличаются: температура кипения и замерзания, упругость
пара, плотность, время разложения при электролизе — все это отличает тяжелую
воду от простой.

Химические свойства дейтерия
Дейтерий — легкий газ, он легче воздуха. D2 отлично горит, температура короны исходящего пламени составляет 1 600 °С, поэтому огонь способен плавить стекло. Термические реакции с дейтерием не проводятся, так как в современных условиях важны более энергообъемные ядерные реакции, на которые элемент без сомнения способен.
 Из-за большой плотности D2O лед из нее тонет в обычной воде, что не наблюдается в случае с H2O
Из-за большой плотности D2O лед из нее тонет в обычной воде, что не наблюдается в случае с H2O
При реакции между атомами дейтерия образуется He3. Это фундаментальная реакция, так как по такому же принципу зажигаются протозвезды в процессе формирования, еще до выхода из стадии коррекционного диска. Ей же живут коричневые карлики. Именно на основе дейтерия в США создали первую атомную бомбу.
Где применяется тяжелая вода
Довольно долго после открытия было
непонятно куда и как можно применять тяжелую воду. Несколько десятилетий
исследований все-таки привели к тому, что D20 стали использовать в промышленных и научных
целях. Список огромен, но самыми основными считают следующие сферы:
- ядерная энергетика, медицина, оружие;
- другие направления ядерных технологий, где необходимо торможение нейтронов;
- наука (физика, химия, гидрология, биология);
- детектор частиц.
Например, тяжелая вода предотвращает
размножение грибов и бактерий, что необходимо в медицине. Увеличение
концентрации дейтерия до 50% приведет к антимутагенным свойствам, а это
ускоряет половое созревание у человека и рост биологической массы.
Многолетние исследования и опыты на мышах
с раковыми опухолями привели к следующему результату. Болезнь действительно
отступала после применения жесткой воды, однако подопытный умирал. Употребление
жидкости животными приводит к разрушению органов мочеполовой системы и
нарушению обмена веществ. Если дозировка дейтерия превышает норму в несколько
раз, то организм погибает. Нередко жесткую воду называют мертвой ведь она
тормозит все биологические процессы.
Есть и положительная сторона применения тяжелой
воды. Небольшой объем (до 20-25%) увеличивает вес животных и улучшает приплод,
например, куры начинают нести больше яиц. Человек сталкивается с мертвой водой,
как минимум, несколько раз в год. Реки, моря, озера, осадки — все это содержит
определенное количество дейтерия. Удивительный факт: в дожде сверхтяжелая вода содержитсяв
более высокой концентрации, чем в снегу.
Необходимо различать и контролировать
жесткость воды, иначе не избежать последствий. Превышение концентрации приводит
к преждевременному старению (это касается не только красоты, но и всего
организма в целом) и даже развитию онкологических заболеваний. Как правило, это
касается регионов, где используются для очистки фильтры обратного осмоса или
опреснение морской воды. Иногда процент заболеваемости в таких местах превышает
показатели ближайших регионов.
Пока науке не до конца понятно, стоит ли
окончательно избавляться от дейтерия и как это вообще сделать. Не исключено,
что жидкость в скором времени будут использовать в виде нового источника
энергии. К удивлению, многих, есть не только простая и тяжелая вода. Ученые
выделяют полутяжелую и сверхтяжелую жидкости, а также различные модификации
изотопов.
Тяжелая вода была открыта почти 90 лет
назад. Все это время ученые продолжают изучать ее и искать ответы на многие
вопросы, касающиеся свойств, сферы применения и опасности жидкости. Точно можно
сказать, что она отличается от обычной несколькими характеристиками, но при
этом ее невозможно отличить по вкусу или запаху.
Свойства
| Энтальпия образования ΔH | −294,6 кДж/моль (ж) (при 298 К) |
| Энергия Гиббса образования G | −243,48 кДж/моль (ж) (при 298 К) |
| Энтропия образования S | 75,9 Дж/моль·K (ж) (при 298 К) |
| Критическая плотность | 0,363 г/см³ |
| Параметр | D2O | HDO | H2O |
|---|---|---|---|
| Температура плавления, °C | 3,82 | 2,04 | 0,00 |
| Температура кипения, °C | 101,4 | 100,7 | 100,0 |
| Плотность при 20 °C, г/см³ | 1,1056 | 1,054 | 0,9982 |
| Температура максимальной плотности, °C | 11,6 | 4,0 | |
| Вязкость при 20 °C, сантипуаз | 1,2467 | 1,1248 | 1,0016 |
| Поверхностное натяжение при 25 °C, дин·см | 71,87 | 71,93 | 71,98 |
| Молярное уменьшение объёма при плавлении, см³/моль | 1,567 | 1,634 | |
| Молярная теплота плавления, ккал/моль | 1,515 | 1,436 | |
| Молярная теплота парообразования, ккал/моль | 10,864 | 10,757 | 10,515 |
| pH при 25 °C | 7,41 | 7,266 | 7,00 |
Общие сведения
Что такое тяжелая вода, впервые поведал Гарольд К. Юри ещё в 1931 году. А два года спустя Гилбертом Ньютоном Льюисом впервые была получена чистая тяжёловодородная вода. Её второе название – окись дейтерия. Формула тяжёлой воды — D2О. Она состоит из атомов кислорода и водорода, которые содержатся в ней в форме дейтерия. По сравнению с водородом, дейтерий приблизительно в два раза тяжелее. Поэтому молекулярная масса обычной воды составляет 18 г/моль, в то время как вес тяжёлой – примерно 20.
Существует миф, который гласит, что долгое кипячение природной воды приводит к повышению концентрации тяжёлой, что может негативно сказаться на человеческом здоровье. Однако это далеко не так: в действительности эта концентрация ничтожно мала. Кроме этого, доказан факт, что тяжёлая вода не является ядовитой. Она считается слаботоксичной. В её среде продолжительность химических реакций, по сравнению с простой водой, снижается.
«Битва за воду».
Для промышленного получения тяжелой воды очень важно наличие дешевой электроэнергии. Уже в довоенные годы стало понятно, что идеальные условия для этого имеются в Норвегии, где давно работали мощные электролизные установки для получения водорода
Завод по производству тяжелой воды вошел в строй в 1934; к 1938 он производил 40 кг D2О в год, а в 1939 – второе больше. В то время уже стало очевидным огромное стратегическое значение тяжелой воды для разработки ядерного оружия. Поэтому не удивительно, что немцы, оккупировавшие Норвегию в мае 1940, приняли самые энергичные меры по засекречиванию завода тяжелой воды и его охране. К концу 1941 Германия вывезла из Норвегии 361 кг чистой D2O, а через год – уже 800 кг.
Союзники отдавали себе отчет в смертельной для себя опасности норвежского производства и потому решили во что бы то ни стало уничтожить завод. Главный инженер завода Йомар Брун с риском для жизни достал исключительно ценную информацию – чертежи и фотографии завода. Все материалы были пересняты на микропленку и в тюбике для зубной пасты переправлены через Швецию в Англию. Немцы ожидали нападения с воздуха на завод и усиленно укрепляли особо важные цеха. Поэтому было решено послать в Норвегию специально подготовленную команду подрывников. Диверсионной группе удалось взорвать электролизные баки в цехе концентрирования тяжелой воды. На восстановление оборудования ушло полгода – срок огромный в условиях войны. Немцы решили подстраховаться, и в мае 1943 их делегация, состоящая из ученых и промышленников, выехала в Италию, чтобы наладить там производство тяжелой воды на электролизном заводе в поселке Маренго на севере страны. Но было уже поздно: 3 сентября король Виктор-Эммануил III подписал на Сицилии акт о капитуляции Италии, а 9 сентября около Неаполя на территорию Италии вступили англо-американские войска. Так что норвежский завод оставался для немцев единственным источником тяжелой воды. Однако и он уже был обречен: 16 ноября на завод был произведен массированный воздушный налет. В течение 33 минут 140 тяжелых бомбардировщиков «Летающая крепость» сбросили на завод 800 бомб! В результате была выведена из строя гидроэлектростанция, однако установки для производства тяжелой воды, защищенные толстым слоем бетона, практически не пострадали. Не обошлось и без жертв среди мирного норвежского населения – погибло 22 человека.
Немцы понимали, что и после бомбежки союзники не оставят завод в покое, и потому приняли решение вывезти в Германию все имеющиеся запасы тяжелой воды – а было ее ни много ни мало 15 тонн! Разведка союзников сработала четко и своевременно: в результате тщательно продуманной и с блеском проведенной операции 20 февраля 1944 был взорван паром, на котором находились железнодорожные цистерны с тяжелой водой. Паром, переправлявшийся в этот момент через озеро Тинсьё, пошел на дно, и поднять его было практически невозможно, так как озеро было очень глубоким – около 400 м. И в этом эпизоде битвы за тяжелую воду не обошлось без трагедии: за уничтожение практически всего запаса тяжелой воды заплатили жизнью 14 норвежцев, находившихся на пароме. Но немцы лишились всякой возможности запустить ядерный реактор и получить атомную бомбу.
Илья Леенсон
Интересные факты о применении тяжелой воды
Во время Второй мировой войны большая часть трудов физиков-атомщиков уходила на создание ядерного оружия. В Германии его решили создавать из плутония.

Но чтобы получить этот изотоп, необходимо было облучать уран, а полученные нейтроны значительно замедлять. В качестве замедлителя подходил графит и тяжелая вода, но ни того, ни другого у немцев не было. Тогда они приняли решение построить в оккупированной Норвегии электролизную электростанцию. Груз с тяжелой водой они так и не получили, в 1943 г. паром затонул.
Реакторы на тяжелой воде нашли дальнейшее применение, так как в них можно использовать природный, а не обогащенный уран, хотя над получением воды тоже необходимо потрудиться. Сегодня несколько канадских реакторов продолжают работать на тяжелой воде.