Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na+ и анионы кислотного остатка соляной кислоты Cl-. Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Соли
Главная страница —>
Учебное пособие по общей и неорганической химии —>
Соли
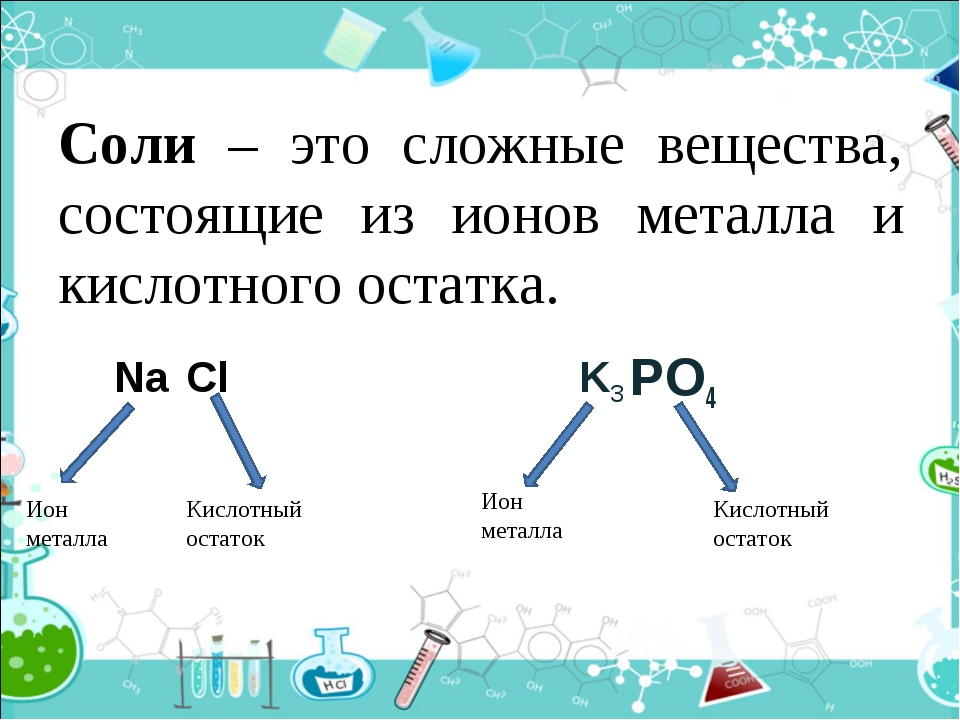
Соли – сложные вещества, которые являются продуктом полного или неполного замещения атомов водорода кислоты на атомы металла, или замещения гидроксогрупп основания кислотным остатком.
В зависимости от состава соли делятся на средние (Na2SO4, K3PO4), кислые (NaHCO3, MgHPO4), основные (FeOHCl2, Al(OH)2Cl, (CaOH)2CO3, двойные (KAl(SO4)2), комплексные (AgCl, K4).
Средние соли
Средними солями называются соли, которые являются продуктом полного замещения атомов водорода соответствующей кислоты на атомы металла или ион NH4+. Например:
H2CO3 (NH4)2CO3; H3PO4 Na3PO4
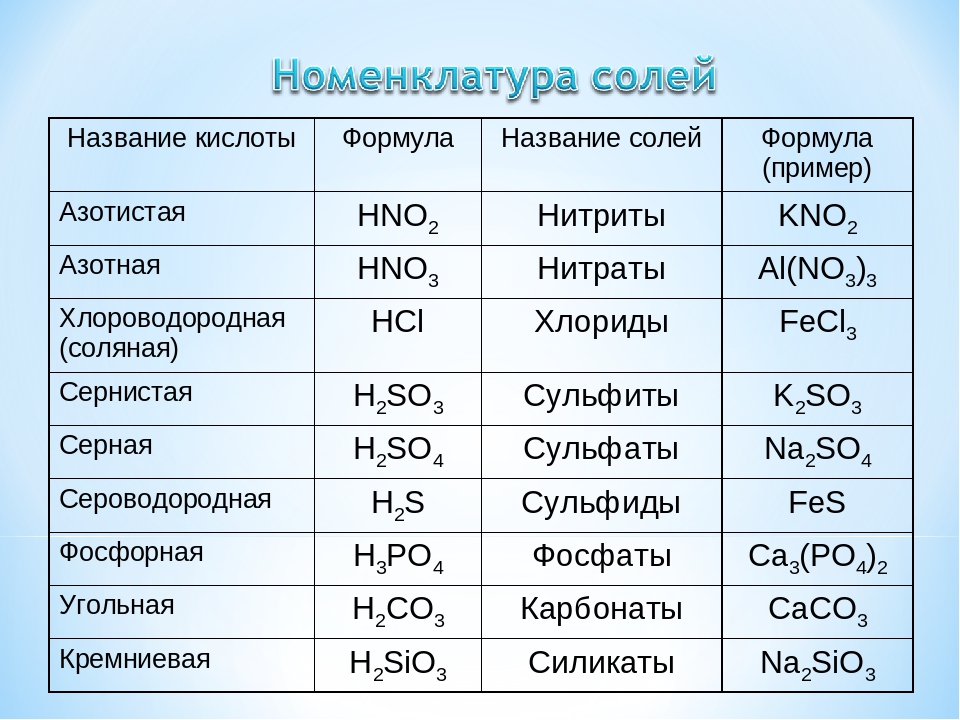
Название средней соли образуется из названия аниона, за которым следует название катиона. Для солей бескислородных кислот наименование соли составляется из латинского названия неметалла с добавлением суффикса –ид, например, NaCl – хлорид натрия. Если неметалл проявляет переменную степень окисления, то после его названия в скобках римскими цифрами указывается степень окисления металла: FeS – сульфид железа (II), Fe2S3 – сульфид железа (III).
Для солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание –ат для высших степеней окисления, -ит для более низких. Например,
K2SiO3 – силикат калия, KNO2 – нитрит калия,
KNO3 – нитрат калия, K3PO4 – фосфат калия,
Fe2(SO4)3
– сульфат железа (III), Na2SO3 – сульфит натрия.
Для солей некоторых кислот используется приставка –гипо
для более низких степеней окисления и –пер для высоких степеней окисления. Например,
KClO – гипохлорит калия, KClO2 – хлорит калия,
KClO3 – хлорат калия, KClO4 – перхлорат калия.
Способы получения средних солей:
— взаимодействием металлов с неметаллами, кислотами и солями:
2Na + Cl2 = 2NaCl
Zn + 2HCl = ZnCl2
+ H2
Fe + CuSO4 = FeSO4 + Cu
— взаимодействием оксидов:
основных с кислотами BaO + 2HNO3 = Ba(NO3)2 + H2O
кислотных со щелочами 2NaOH + SiO2 = Na2SiO3 + H2O
основных оксидов с кислотными Na2O + CO2 = Na2CO3
— взаимодействием кислот с основаниями и с амфотерными гидроксидами:
KOH + HCl = KCl + H2O
Cr(OH)3 + 3HNO3
= Cr(NO3)3 + 3H2O
— взаимодействием солей с кислотами, со щелочами и солями:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
FeCl3 + 3KOH = 3KCl + Fe(OH)3¯
Na2SO4 + BaCl2 = BaSO4¯ + 2NaCl
Химические свойства средних солей:
— взаимодействие с металлами
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
— взаимодействие с кислотами
AgNO3 + HCl = AgCl¯ + HNO3
— взаимодействие со щелочами
CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4
— взаимодействие с солями
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
— разложение солей
NH4Cl = NH3 + HCl
CaCO3 = CaO + CO2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Кислые соли
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы металла.
Например: H2CO3
NaHCO3
H3PO4
NaH2PO4 Na2HPO4
При наименовании кислой соли к названию соответствующей средней соли добавляется приставка гидро-, которая указывает на наличие атомов водорода в кислотном остатке.
Например, NaHS – гидросульфид натрия, Na2HPO4 – гидрофосфат натрия, NaH2PO4 – дигидрофосфат натрия.
Кислые соли могут быть получены:
— действием избытка многоосновных кислот на основные оксиды, щелочи и средние соли:
K2O + 2H2S = 2KHS + H2O
NaOH + H2SO4
= NaHSO4 + H2O
K2SO4 + H2SO4 = 2KHSO4
— действием избытка кислотных оксидов на щелочи
NaOH + CO2 = NaHCO3
Химические свойства кислых солей:
— взаимодействие с избытком щелочи
Ca(HCO3)2 + Ca(OH)2
= 2CaCO3 + 2H2O
— взаимодействие с кислотами
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2
— разложение
Ca(HCO3)2
= CaCO3 + CO2 + H2O
Основные соли
Основные соли – это продукты неполного замещения гидроксогруппы в молекулах многокислотных оснований на кислотные остатки.
Mg(OH)2 MgOHNO3
Fe(OH)3 Fe(OH)2Cl FeOHCl2
При наименовании основной соли к названию соответствующей средней соли добавляется приставка гидроксо-, которая указывает на наличие гидроксогруппы. Например CrOHCl2 – гидроксохлорид хрома (III), Cr(OH)2Cl – дигидроксохлорид хрома (III).
Основные соли могут быть получены:
— неполной нейтрализации оснований кислотами
Mg(OH)2
+ HCl = MgOHCl + H2O
— добавлением небольших количеств щелочей к средним солям
FeCl3 + 2KOH = Fe(OH)2Cl + 2KCl
Химические свойства основных солей:
— взаимодействие с избытком кислоты:
MgOHCl + HCl = MgCl2 + H2O
FeOH(NO3)2
+ HNO3 = Fe(NO3)3 + H2O
— термическое разложение
Предыдущие материалы:
|
Следующие материалы:
|
Химические свойства солей
1. Все средние соли являются сильными электролитами и легко диссоциируют: Na2SO4 ⇄ 2Na+ + SO24— Средние соли могут взаимодействовать с металлами, стоящими ряду напряжений левее металла, входящего в состав соли: Fe + CuSO4 = Сu + FeSO4 Fe + Сu2+ + SO24— = Сu + Fe2+ + SO24— Fe + Cu2+ = Сu + Fe2+ 2. Соли реагируют со щелочами и кислотами по правилам, описанным в разделах «Основания» и «Кислоты»: FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl— + 3Na+ + 3ОН— = Fe(OH)3 + 3Na+ + 3Cl— Fe3+ + 3OH— =Fe(OH)3 Na2SO3 + 2HCl = 2NaCl + H2SO3 2Na+ + SO23— + 2H+ + 2Cl— = 2Na+ + 2Cl— + SO2 + H2O 2H+ + SO23— = SO2 + H2O 3. Соли могут взаимодействовать между собой, в результате чего образуются новые соли: AgNO3 + NaCl = NaNO3 + AgCl Ag+ + NO3— + Na+ + Cl—= Na+ + NO3— + AgCl Ag+ + Cl— = AgCl Поскольку эти обменные реакции осуществляются в основном в водных растворах, они протекают лишь тогда, когда одна из образующихся солей выпадает в осадок. Все реакции обмена идут в соответствии с условиями протекания реакций до конца, перечисленными в § 23, стр. 89.
■ 111. Составьте уравнения следующих реакций и, пользуясь таблицей растворимости, определите, пройдут ли они до конца: а) хлорид бария + сульфат натрия; б) хлорид алюминия + нитрат серебра; в) фосфат натрия + нитрат кальция; г) хлорид магния + сульфат калия; д) сульфид натрия + нитрат свинца; е) карбонат калия + сульфат марганца; ж) нитрат натрия + сульфат калия. Уравнения записывайте в молекулярной и ионных формах.
■ 112. С какими из перечисленных ниже веществ будет реагировать хлорид железа (II): а) медь; б) карбонат -кальция; в) гидроокись натрия; г) кремниевый ангидрид; д) нитрат серебра; е) гидроокись меди (II); ж) цинк? Все уравнения записывайте в молекулярной и ионной формах. 113. Опишите свойства карбоната кальция как средней соли. Все уравнения записывайте в молекулярной и ионной формах. (См. Ответ) 114. Как осуществить ряд превращений:
Все уравнения записывайте в молекулярной и ионной формах. 115. Какое количество соли получится при реакции 8 г серы и 18 г цинка? 116. Какой объем водорода выделится при взаимодействии 7 г железа с 20 г серной кислоты? 117. Сколько молей поваренной соли получится при реакции 120 г едкого натра и 120 г соляной кислоты? 118. Сколько нитрата калия получится при реакции 2 молей едкого кали и 130 г азотной кислоты? (См. Ответ)
Классификация
Классифицировать пищевую соль можно по различным критериям, среди которых:
- сорт;
- помол;
- происхождение;
- состав добавок.
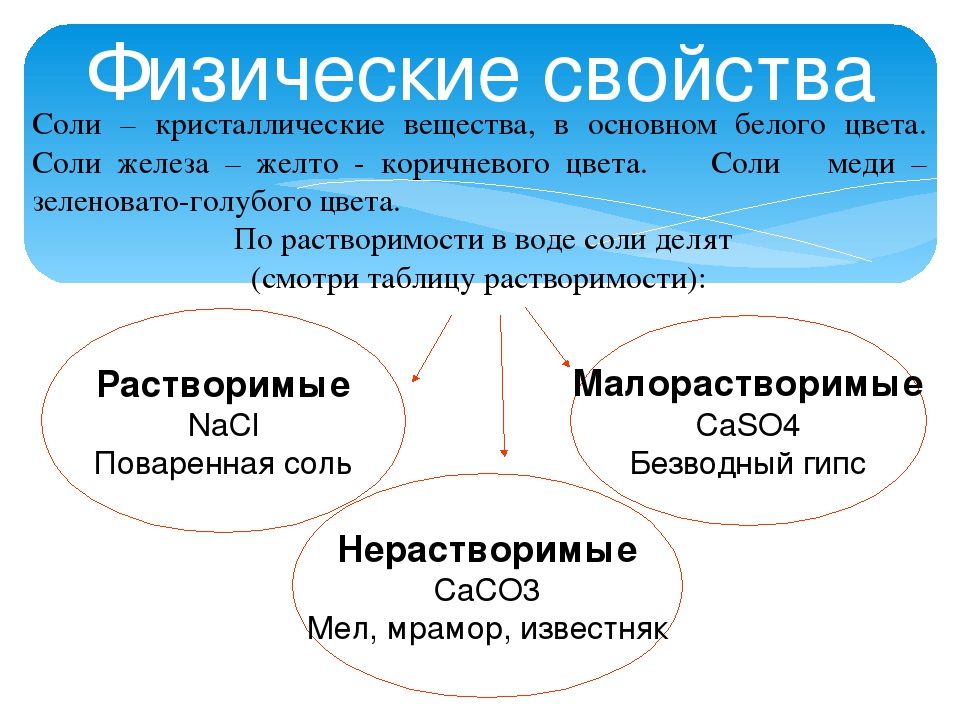
Сортами соли являются четыре разновидности, в которых колеблется содержание чистого вещества. Согласно ГОСТу, в соли сорта экстра находится не менее 99,6% хлористого натрия, в продукте высшего сорта вещества не может быть меньше, чем 98,2%. В первом сорте пищевой соли примесей может быть не более 2,5%, а второго – не более 3%.
Именно количество примесей и обуславливает качество соли как продукта. Хотя, согласно последним заключениям ученых, посвятивших свою деятельность изучению соли и ее влияния на жизнь на планете, чем чище соль, тем более вредна она для человека. Следовательно, соль высшего и экстрасорта есть можно, но как можно реже.
Чистота продукта экстра обусловлена процессом получения (технологией) и никак не связана ни с местом добычи, ни с составом, ни с происхождением. Соль этого сорта получают путем выпаривания продукта из соляного раствора. Именно поэтому данный продукт имеет мелкие кристаллы и всегда снежно-белого цвета. Прочие разновидности пищевой соли могут быть окрашены в кремовый, бело-серый, розовый, желтоватый оттенок или и вовсе иметь видимые невооруженным глазом камешки черного или зеленоватого цвета.
Помол соли бывает трех степеней: крупный, средний и мелкий. По происхождению пищевую соль делят на:
- каменную;
- самоосадочную;
- морскую.
Самоосадочная соль бывает двух видов. Делят продукт по способу получения. В первом случае соль образуется в процессе естественного выпаривания воды, насыщенной солями, а во втором – добывается в кристаллической форме со дна соляных озер или пещер. Иногда первый вид классифицируют в отдельную группу и называют садочным продуктом.

Морскую пищевую соль ранее добывали в одесских лиманах и в Крыму в районе города Саки. Также большим количеством морской соли может похвастать озеро Сиваш, расположенное у северной части Крыма, где полуостров соединяется с материковой частью. Морскую соль добывают в акватории самого соленого моря в мире – Мертвого.
Кроме перечисленных выше разновидностей соли, в природе существуют:
- розовая (иногда ее называют красной) гималайская соль;
- соль жемчужная «Джибути»;
- индийская черная вулканическая соль.
Подобием вулканической соли считается черная костромская соль, именуемая современным производителем «Четверговой». В природе такой продукт не существует. Его изготавливают из обычной соли, смешанной с:
- закваской из запаренного солода и хмеля;
- ржаной мукой;
- квашеной капустой;
- различными травами.
По составу добавок пищевые соли классифицируют как йодированные, калийные и обычные. Первая соль имеет характерный привкус йода, вторая немного горчит, а третья имеет привычный для многих вкус. Калийную соль добывают из недр земли и подвергают очистке.
Йодированную соль получают методом обогащения. Многие приравнивают ее к морской разновидности, но это суждение неверное, так как последняя имеет более богатый минеральный состав. В перечне компонентов продукта есть такие минералы, как йод, калий, марганец, сера и магний. Именно поэтому соль имеет необычный привкус.
На основе обычной соли готовят не только йодированную ее разновидность, но и такой продукт, как нитритная соль, широко используемая в пищевой промышленности при приготовлении мясных деликатесов.
Дальше всех в «обогащении» каменной соли продвинулись французы. Они окуривают продукт дымом от сжигаемых бочек из-под Шардоне. В результате продукт приобретает розовый оттенок и характерный привкус вина. Этот вариант соли наиболее дорогостоящий, называют его «мерло». Применяют его не в повседневном рационе, а при изготовлении десертов, шоколада и элитных напитков.

Производство
Основная статья: Соляная промышленность
Бассейны для получения соли испарением морской воды. Бретань (Франция), около 1880
Добыча соли на солончаке Уюни, Боливия
В глубокой древности соль добывалась сжиганием некоторых растений (например — орешника, или других лиственных деревьев) в кострах; образовывавшуюся золу использовали в качестве приправы. Для повышения выхода соли их дополнительно обливали солёной морской водой.
Самые древние солеварни на территории Европы и Передней Азии найдены в ходе раскопок одного из первых городов в Европе — поселения Провадия-Солницата на черноморском побережье Болгарии. Данное поселение с середины VI тысячелетия до нашей эры представляло собой крупный центр производства поваренной соли; вода из местного соляного источника выпаривалась в массивных глинобитных печах куполообразной формы. К концу V тысячелетия до н. э. производство соли достигло здесь промышленных масштабов, увеличившись до 4—5 тонн[].
Не менее двух тысяч лет назад добыча соли стала вестись также выпариванием морской воды. Этот способ вначале появился в странах с сухим и жарким климатом, где испарение происходило естественным путём; по мере его распространения воду стали подогревать искусственно. В северных районах, в частности на берегах Белого моря, способ был усовершенствован: пресная вода замерзает раньше солёной, а концентрация соли в оставшемся растворе соответственно увеличивается. Таким образом из морской воды одновременно получали пресную воду и концентрированный рассол, который затем вываривали с меньшими энергетическими затратами.
Также соль добывается промышленной очисткой добытого из залежей галита (каменной соли), располагающихся на месте высохших морей.
Экономика
Соляная шахта
На начало 2006 года российский рынок соли оценивается в 3,6 млн тонн в год, по другим данным — 4,5 млн тонн, из которых 0,56 млн тонн — пищевые расходы, а 4 млн тонн — использование соли в промышленных целях, в основном — химических. Из иностранных поставщиков основными являются украинские и белорусские.
| Поставщик | Объём поставок на российский рынок,млн. тонн в год |
|---|---|
| ОАО «Бассоль», Астрахань | 1,3 |
| ОАО «Уралкалий», Березники | 1,0 |
| ОАО «Илецксоль», Оренбург | 0,5 |
| ФГУП «Тыретский солерудник», Тыреть | 0,3 |
| «Астрасоль», Астрахань | 0,3 |
| Всего (Российские производители) | 3,2–3,5 |
| ГПО «Артёмсоль», Украина | 1,0 |
| ПО «Беларуськалий», Белоруссия | 0,5 |
| ОАО «Мозырьсоль», Белоруссия | 0,1 |
| Всего (внешние поставщики) | 1–1,6 |
| Всего | 4,8–5,1 |
Мировой рынок
В 2017 году Соль занимала 647-е место среди наиболее торгуемых товаров на мировом рынке, с объёмом 2,39 млрд долл. США.
Крупнейшими экспортерами соли в 2017 году были Австралия (308 млн долл.), Нидерланды (283 млн долл.), Индия (272 млн долл.), Германия (221 млн долл.) и Мексика (151 млн долл.); крупнейшими импортерами — Япония (242 млн долл.), Китай (212 млн долл.), Германия (173 млн долл.) и Индонезия (167 млн долл.).
Доля России в мировом экспорте соли — 0,3 % (7,14 млн долл.), в импорте — 3,7 % (89,2 млн долл.)