Применение Серы

Сера применяется в первую очередь для получения серной кислоты; в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения черного (охотничьего) пороха; в производстве спичек.
В медицинской практике применение Серы основано на ее способности при взаимодействии с органических веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. keras — рог и lytikos -растворяющий), противомикробные и противопаразитарные эффекты.
Сера входит в состав мази Вилькинсона и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную Серу употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и других); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и других.
Применение серы
Большая часть добытой серы уходит, чтоб изготовить серную кислоту. А роль этого вещества очень огромная в химическом производстве. Примечательно, что для получения 1 тонны серного вещества необходимо 300 кг серы.
Бенгальские огни, которые ярко светятся и имеют много красителей, также производятся с помощью серы. Бумажная промышленность – это еще одна область, куда уходит значительная часть добытого вещества.

Серная мазь используется для лечения болезней кожи
Чаще всего применение сера находит при удовлетворении производственных нужд. Вот некоторые из них:
- Использование в химическом производстве.
- Для изготовления сульфитов, сульфатов.
- Изготовление веществ для удобрения растений.
- Чтоб получить цветные виды металлов.
- Для придачи стали дополнительных свойств.
- Для изготовления спичек, материалов для взрывов и пиротехники.
- Краски, волокна из искусственных материалов – изготовляются при помощи этого элемента.
- Для отбеливания ткани.
В некоторых случаях элемент сера входит в мази, которые лечат кожные болезни.
Сера (S, Sulphur)
История серы
Сера и её соединения сопровождают историю человечества с незапамятных времён. Как правило, использовались не самые приятные запахи – горения серы, сероводорода и сернистого газа, наделяя вещество, которое могло испускать такие зловонья, поистине волшебными или даже божественными свойствами. Недаром одним из традиционных применений серы было изготовление священных курений и использование их во многих обрядах некоторых религий (calorizator). Параллельно серу вводили в состав горючих смесей, применяемых во время военных действий. Антуан Лавуазье, считающийся основателем современной науки химии, первым выяснил элементарную природу серы, которую стали получать из пиритов.
Общая характеристика серы
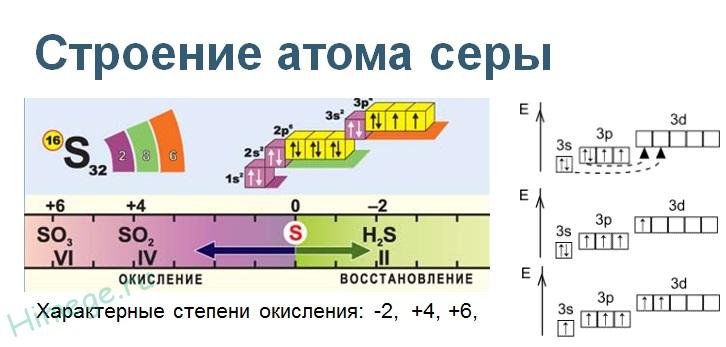
Сера является элементом XVI группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 16 и атомную массу 32,066. Принятое обозначение S (от латинского sulfur).

Физические и химические свойства
Сера является неметаллическим веществом, образующим соли и кислоты. Считается макроэлементом. При взаимодействии с воздухом происходит возгорание серы с образованием газа без цвета, но с резким запахом – сернистого ангидрида.
Суточная потребность в сере
Норма потребления серы в сутки составляет 0,5-1 г, обычного питания вполне хватает, чтобы получить суточную норму. Спортсменам перед соревнованиями, если нужно набрать массу, серы потребуется до 3 г в сутки, для этого можно увеличить количество белковой пищи или ввести в рацион минеральную воду с содержанием серы.
Полезные свойства серы и его влияние на организм
Сера – незаменимый макроэлемент, без неё невозможны многие важнейшие процессы в организме человека. Сера играет важную роль в процессе свёртываемости крови, защищает протоплазму от вредных бактерий, является важным элементом в синтезе коллагена, поэтому благотворно влияет на состояние кожи, волос и ногтей, замедляет процессы старения организма, оказывает противоаллергическое действие.

Взаимодействие с другими
Сера усваивается быстрее при нормальном количестве в организме железа и фтора, молибден, селен и свинец задерживают усвояемость серы.
Признаки нехватки серы
Признаками дефицита серы в организме считаются:
- Снижение иммунитета и жизненного тонуса;
- Хроническая усталость;
- Запоры;
- Хрупкость ногтей и тусклость волос;
- Воспаления на коже;
- Болезненность суставов.
Признаки избытка серы
Переизбыток серы в организме крайне редок, встречается лишь в регионах, где отмечается пониженное содержание серы.
Применение серы в жизни
Сера – основа для производства серной кислоты, сферы её применения – бумажная и резиновая промышленность, сельское хозяйство, производство пороха и спичек, медицина.
Распространение Серы в природе
Сера относится к весьма распространенным химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (самородная сера) и в виде соединений — сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов Серы, образующихся при эндогенных процессах.
В биосфере образуется свыше 150 минералов Сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов.
Многие процессы биосферы приводят к концентрации Серы — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озерах и солончаках. В глинах и сланцах Серы в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз.
В биосфере происходит круговорот Серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником Сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию Серы; интенсифицировалось окисление сульфидов.
ПРОИСХОЖДЕНИЕ

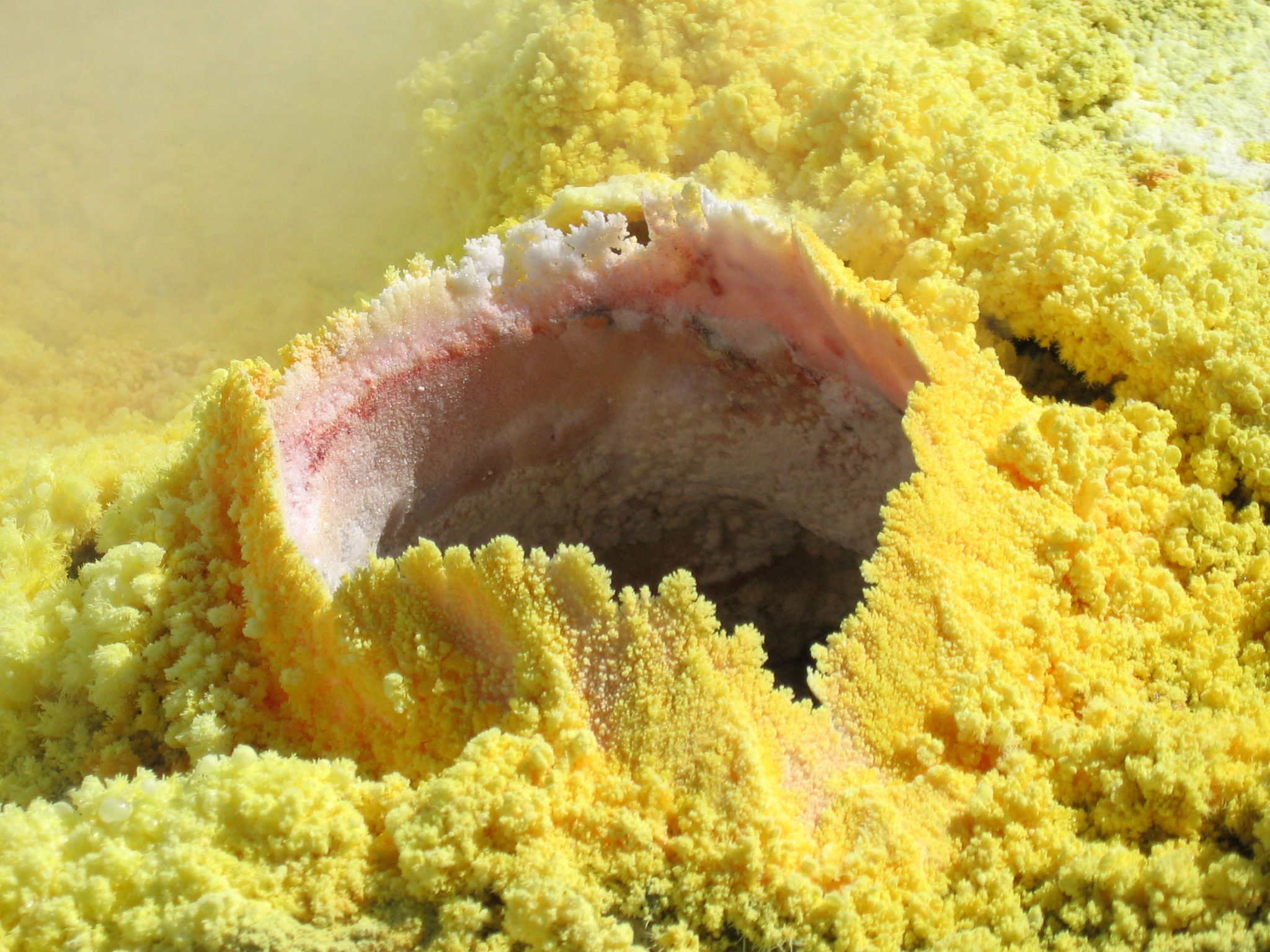
Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
Продукты богатые серой
В организм человека сера поступает вместе с продуктами питания. Регулярно организм должен получать до 1 г серы, поэтому в рацион включают в основном белковую пищу.
К продуктам с богатым содержанием серы относятся:
- мясо кролика;
- капуста;
- куриное мясо;
- рыба;
- яйца;
- орехи;
- сыр твердых сортов;
- брокколи;
- морепродукты;
- продукты из сои;
- лук и чеснок;
- печень.
Сера есть и в продуктах, растительного происхождения, которые обеспечивают нормальную работу пищеварительной системы за счет поступления клетчатки. В них также содержится белок, но уже растительный. К продуктам, которые богаты серой, относятся: бобовые, орехи и капуста разных сортов. Из фруктов выделяют: ананасы, арбуз и бананы. Овощив которых содержится сера легко определить, как правило они зеленого цвета с волокнистой структурой.
Как правильно приготовить овощи, сохранив полезные свойства серы
Конечно больше всего серы будут содержать овощи фрукты в сыром виде. Но съесть необработанный чеснок или лук решится не каждый, чаще всего они входят в состав салатов либо после термической обработки.
Лук и чеснок
Многим людям не нравится чеснок из-за резкого запаха. Его источником являются аллильные соединения серы, те самые, которые как раз направлены на борьбу с раком, предотвращением повреждения печени, кроме того они обладают антиоксидантными свойствами. Поэтому лучше всего употреблять чеснок и лук в сыром виде небольшими порциями. При измельчении запускается процесс дополнительной выработки аллильной серы, которая делает овощи более устойчивыми к нагреванию.
Белокочанная капуста
В слегка протушенной капусте содержится большее количество биодоступных сераорганических соединений, чем в той, которая тушилась на сильном огне долгое время. Чтобы сохранить этот микроэлемент капусту измельчают и оставляют на 10 минут. Тогда начинают вырабатываться полезные соединения (мирозиназа). Лучшим вариантом считается готовка на пару, но не более 5 минут.
Цветная капуста
Для активизации мирозина овощ разрезают на небольшие соцветия и оставляют в таком состоянии на 10 минут. Готовят цветную капусту на пару или в духовке.
Брюссельская капуста
Для лучшего сохранения серы брюссельскую капусту запекают или готовят в пароварке. При этом необходимо избегать высоких температур и долгого времени тушения.
Брокколи
Также, как и с капустой лучше всего брокколи готовить в пароварке, так удастся сохранить большее количество сульфата, но и здесь есть свои особенности. Слегка пропаренный овощ будет содержать в себе в несколько раз больше сульфорафана, чем тот который подвергся длительной термической обработке. Заканчивают тушение, когда брокколи становится ярко-зеленый цвета. Чаще всего это происходит после 4 минут термической обработки.
В народе этот микроэлемент называют «минералом красоты», поскольку благодаря своим полезным свойствам он обеспечивает здоровый вид ногтям, волосам и коже. Кроме того сера отвечает за многие жизненно важные процессы в нашем организме. В обычных условиях ее поступает достаточно с продуктами. Но если есть признаки дефицита этого элемента в организме, можно принимать его дополнительно в виде пищевых добавок или минеральной воды.
Сера это
(Sulfur), S — хим. элемент VI группы периодической системы элементов; ат. н. 16, ат. м. 32,06. Светло-желтые ромбические кристаллы. В соединениях проявляет степени окисления —2, +2, +3, +4, +5 и +6. Природная С. состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%). Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S
и 38S с периодами полураспада соответственно 0,195; 1,35 и 2,40— 3,18 сек; 87,9 дней; 5,04 и 172 мин. С. применяли с древних времен для изготовления косметических средств, медипрепаратов, красок, отбеливания тканей, дезинфекции и т. п. По распространенности в природе С. занимает 15 место среди др. элементов.
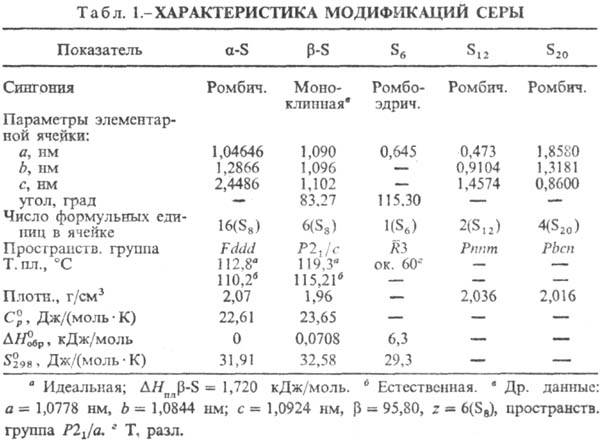
Ее содержание в земной коре 5 х 10-2%, в мировом океане 9 х 10-2%. В природе встречается в виде серы самородной и в виде соединений, напр. сульфидов (антимонит Sb2S3, аргентит Ag2S, арсенопирит FeAsS, галенит PbS, кобальтин CoAsS, ковален CuS, киноварь HgS, пирит FeS2) и сульфатов (ангидрита CaS04, барита BaS04, гипса CaS04-2H20). Кроме того, сера содержится в каменных углях, битумных сланцах, нефти, водах различных горячих минер, источников, растительных и животных тканях, газах вулканического происхождения и т. п., также служащих сырьем для пром. получения серы. Известно несколько модификаций С Энантиотропными формами являются ромбическая α-S, устойчивая ниже т-ры 95,60 С, и моноклинная β3-S, устойчивая выше т-ры 95,6° С .
Ромбическая С— желтого цвета, нерастворима в воде, растворяется в сероуглероде, анилине, толуоле, четыреххлористом углероде, феноле и в др. неполярных растворителях, обладает малой твердостью, большой хрупкостью. Моноклинную С. получают, медленно нагревая ромбическую в интервале т-р 95,6—119,25° С. Если нагревание вести быстро, то ромбическая С. плавится при т-ре 112,8° С, превращаясь в подвижную жидкость соломенного цвета, называемую лямбда-серой, или циклооктасерой λ-S. Эта жидкость растворима в сероуглероде. При резком охлаждении жидкой С. образуется аморфная темно-красная пластическая С, нерастворимая в сероуглероде и называемая мю-серой, или кетоносерой μ-S. Метастабильная мю- сера быстро переходит в ромбическую.
При нагревании жидкой С. относительное содержание мю-серы увеличивается. Вязкость мю-серы больше, чем λ-S, поэтому при нагревании она из подвижной (с вязкостью 0,065 nз при т-ре 155° С) становится вязкой (с вязкостью 933 nз при т-ре 1879 С) жидкостью. С дальнейшим повышением т-ры вязкость уменьшается до 0,83 nз при т-ре 444,6° С. В жидкой С. образуется также пи-модификация по схеме λ — S ⇄ μ — S + π — S Ее можно отделить от мю-серы, используя меньшую растворимость в сероуглероде. В процессе хранения пи-модификация превращается в мю-серу. При быстром охлаждении раствора С. в бензоле или спирте выделяется твердая нестабильная гамма-модификация.
У ромбической и моноклинной С, лямбда-серы и пи модификации — восьми-звенное кольцеобразное пространственное строение, у мю-серы — открытые цепочки. Разрыв кольцеобразных молекул наблюдается при т-ре более 160° С. Выше т-ры 190° С происходит уменьшение длины цепочек.
В парообразном состоянии С. представлена набором молекул S8, S6, S4 и S2. При повышении т-ры увеличивается относительное количество молекул с меньшим числом атомов, а выше т-ры 1500° С начинается диссоциация на атомы. Твердая и жидкая С. диамагнитна. Парообразная сера (S2) парамагнитна.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов.
Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает «замещение»). Согласно ей в недрах постоянно происходит превращение гипса CaS04 • 2Н20 и ангидрита CaS04 в серу и кальцит СаСО3. Эта теория создана в 1935 г. советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 г. в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы
Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На Земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Все это означает, что разнообразие теории и гипотез происхождении самородной серы — результат не только и не столько неполноты наших знаний , сколько сложности явлений , происходящих в недрах .
Статья на тему Сера история
Применение серы
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат.
Чистая сера:
- Необходима для того, чтобы превратить каучук в резину. Этот процесс называют вулканизацией каучука. Резиновая промышленность потребляет до 10% общего объема получаемой серы.
- Входит в состав лекарственных средств против паразитов и заболеваний кожи (чесотка, псориаз и др), средств для ванн против ревматизма и подагры, некоторых лекарств, принимаемых внутрь.
- Применяется в химической промышленности: почти 50% всей производимой в мире серы идет для получения серной кислоты, еще четверть — для получения сульфитов; до 15% используется в производстве инсектицидов для борьбы с вредителями винограда, хлопчатника и некоторых других культур.
Сера требуется для:
- изготовления красок и ультрамарина для лако-красочной промышленности, полимеров и синтетических волокон, диоксида серы, сероуглерода, сульфатов, люминофоров, эбонита, удобрений;
- изготовления многих пиротехнических и взрывчатых смесей, в том числе пороха и состава для спичечных головок;
- изготовления бумаги;
- создания некоторых сталей с особыми свойствами;
- дезинфекции овощехранилищ, птичников, подвалов в сельском хозяйстве;
- виноделия, при хранении овощей и фруктов.
Серосодержащие руды часто являются сырьем для получения цветных металлов.
Серная кислота применяется:
- в электротехнической промышленности для производства аккумуляторов;
- для очистки нефтепродуктов;
- для очистки проволоки и металлического листа от окалины, для травления металлических поверхностей;
- в изготовлении лекарственных средств и красителей;
- в химической промышленности в качестве сырья для производства широкого спектра химических веществ, для осушения газов, для повышения концентрации азотной кислоты.
Оксид серы используется для:
- получения серной и азотной кислоты, олеума, сульфитов, тиосульфатов;
- дезинфекции помещений в сельском хозяйстве, в виноделии, в консервировании плодово-ягодной продукции;
- отбеливания тканей (шерсти, шелка).
Сероводород находит применение в производстве чистой серы и серной кислоты, сульфитов и тиосульфатов.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
В каких продуктах питания содержится?
Суточная потребность в сере – 0,5–1,2 г, при сбалансированном меню, наличии в рационе достаточного количества белковых продуктов необходимое количество можно получать ежедневно из пищи. Больше всего её содержится в продуктах животного происхождения, в небольших количествах его можно встретить в растительной пище.
| Продукт | Содержание серы (мг) |
| Мясо кролика, курицы, индейки | 180–240 |
| Щука, окунь, сардина, горбуша, камбала | 190–210 |
| Соя | 240–250 |
| Зелёный горох | 180–190 |
| Сырой фундук, миндаль | 170–190 |
| Яйца куриные | 170–180 |
| Яйца перепелиные | 120–130 |
| Сгущённое молоко | 70–75 |
| Перловая, пшеничная, овсяная крупа | 70–100 |
| Репчатый лук | 60–70 |
| Рис, манка | 60–70 |
| Молоко | 30–35 |
| Капуста, картофель | 30–40 |
| Помидоры, баклажаны | 12–15 |
| Малина, земляника, крыжовник | 12–18 |
| Дыня, цитрусовые плоды | 10–12 |
Повышенное количество серы до 3 г в сутки требуется при чрезмерных физических и умственных нагрузках, подросткам в период интенсивного роста, спортсменам.
Индейка, курица, свинина, цесарка, говядина, кролик, мясо козы и большинство видов рыбы – далеко не полный список продуктов с высоким содержанием серы. Здоровому взрослому человеку с адекватным потреблением белка, порция мяса в день может полностью обеспечить необходимое количество серы. Поэтому большинство диетологов мира не рекомендуют употреблять аптечные биодобавки, содержащие этот минерал.
Почти все волокнистые, безлиственные овощи, а также темно-зеленые листовые являются богатыми источниками серы. В этом списке есть кукуруза, горох, шпинат, разные виды капусты (белокочанная, брокколи, цветная, кольраби), горчица, спаржа, бамия, листовой салат, баклажаны. И почти все овощи, богатые серой, обладают общей характерной особенностью – специфическим запахом.
Самые узнаваемые серосодержащие растения:
- крестоцветные: капуста, брокколи, цветная, брюссельская, китайская и другие виды;
- луковые: лук, шалот, чеснок, порей.
Основными источниками серы как макроэлемента считаются продукты питания. Также поставщиком вещества могут быть лекарственные препараты и биологически активные добавки. Некоторое количество серы находится в природной минеральной воде. Лекарственные препараты, содержащие соединения минерала, представлены в виде мази, кремов и пероральных медикаментов, среди которых комплексные витамины и биодобавки.
Серой богаты многие продукты питания растительного и животного происхождения, среди которых особенно ценны:
- зеленый лук;
- дыня;
- гречка;
- говяжья печень;
- говядина;
- брюссельская и цветная капуста;
- бобовые (горох, фасоль, чечевица, соя);
- баранина;
- баклажаны;
- индейка;
- коровье молоко, в том числе сгущенное;
- кроличье мясо;
- куриные и перепелиные яйца;
- морепродукты, особенно моллюски;
- овсяная крупа;
- помидоры;
- постная свинина;
- речная и морская рыба;
- спаржа;
- твердый сыр;
- телятина и нежирная говядина;
- фундук, миндаль, кешью и прочие орехи;
- чеснок.
Кроме перечисленных продуктов питания, содержится сера в картофеле, моркови и прочих корнеплодах, а также уксусе и некоторых разновидностях красителей. Последние два продукта не являются основными источниками вещества, но тем, кто подвержен риску переизбытка вещества, следует остерегаться чрезмерного употребления их.
Для лучшего усвоения сера должна поступать в организм с белками или животными жирами. Именно в такой компании вещество усвоится максимально полно.
Кролик – 1г
Рыба – 1г
Яйца – 1г
Индейка – 250 мг
Говядина, свинина – 230 мг
Печень – 180-250 мг
Фасоль – 200 мг
Самым высоким содержанием серы отличаются следующие продукты питания: мясо, молочные продукты, яйца, морепродукты, бобовые, капуста.
Средние количества серы можно получить из мучных изделий, злаков, круп, субпродуктов, чеснока. Многие овощи тоже содержат серу, особенно те культуры, при выращивании которых использовались серосодержащие удобрения. Кроме того, источниками серы являются различные виды минеральной воды.
При кулинарной обработке сера практически полностью сохраняется в продуктах питания.
Почему возникает дефицит серы
Недостаток серы встречается достаточно редко, так как многие продукты содержат ее в достаточном количестве, а усваивается она прекрасно. К нехватке этого минерала склонны главным образом те, у кого в рационе нет животных продуктов – вегетарианцы (веганы). Им стоит задуматься о применении серы в составе биологически активных добавок.
Общие признаки и различия халькогенов
Сера относится к подгруппе кислорода. Это 16-я группа в современной длиннопериодной форме изображения периодической системы (ПС). Устаревший вариант номера и индекса — VIA. Названия химических элементов группы, химические знаки:
- кислород (О);
- сера ( S);
- селен (Se);
- теллур (Te);
- полоний (Po).
Внешняя электронная оболочка вышеперечисленных элементов устроена одинаково. Всего она содержит 6 валентных электронов, которые могут участвовать в образовании химической связи с другими атомами. Водородные соединения отвечают составу H2R, например, H2S — сероводород. Названия химических элементов, образующих с кислородом соединения двух типов: сера, селен и теллур. Общие формулы оксидов этих элементов — RO2, RO3.
Халькогенам соответствуют простые вещества, которые значительно отличаются по физическим своствам. Наиболее распространенные в земной коре из всех халькогенов — кислород и сера. Первый элемент образует два газа, второй — твердые вещества. Полоний — радиоактивный элемент — редко встречается в земной коре. В группе от кислорода до полония неметаллические свойства убывают и возрастают металлические. Например, сера — типичный неметалл, а теллур обладает металлическим блеском и электропроводностью.

Химические свойства
На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом.С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фторомРасплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид).При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2.При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P2S5.Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием.При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов.Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору.Полученный сплав называется серной печенью.С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании.При увеличении температуры в парах серы происходят изменения в количественном молекулярном составе. Число атомов в молекуле уменьшается.При 800—1400 °C пары состоят в основном из двухатомной серы. А при 1700 °C сера становится атомарной.
Что такое сера
Химически очень активное вещество, природная сера состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%). Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S и 38S. Серу с давних времен применяли как краску, отбеливания тканей, для дезинфекции, для получения греческого огня (дымный порох) и т.д.
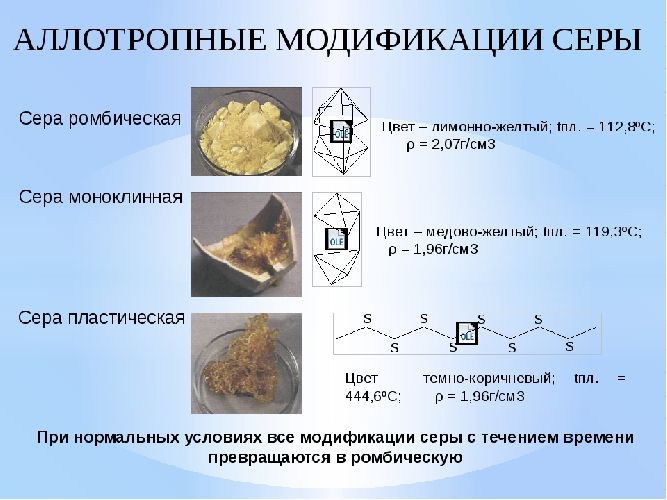
Ромбическая сера имеет желтый цвет, практически нерастворима в воде, но растворяется в органических соединения, толуол, четыреххлористый углерод и т.д.
Рис. 2. Получение пластической серы
Совершенно иной формы кристаллы получаются, если медленно охлаждать расплавленную серу в каком-нибудь сосуде и, когда она частично затвердеет, слить еще не успевшую застыть часть серы. При этих условиях стенки сосуда оказываются покрытыми изнутри множеством длинных темно-жёлтый игольчатых кристаллов моноклинической системы (рис, 4). Эта моноклиническая сера имеет уд. вес 1,96 и плавится при 119°.
Однако она может оставаться без изменения только при температуре выше 96°. При обыкновенной температуре кристаллы моноклинической серы скоро светлеют и приобретают все свойства ромбической серы. Хотя внешне эти кристаллы сохраняют еще призматическую форму, но они уже состоят из мельчайших кристалликов-октаэдров, на которые и распадаются при сотрясении.
Температура их плавления и удельный вес становятся такими же, как и у ромбической серы.
Очень интересны изменения, которые претерпевает сера, если медленно нагревать ее до точки кипения. При 112,8° она плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании жидкость темнеет, приобретая красновато-бурый цвет, и при температуре около 250° становится настолько густой, что некоторое время не выливается из опрокинутого сосуда. Выше 300° жидкая сера снова становится подвижной, но цвет ее остается таким же темным. Наконец, при 444,6° сера закипает, образуя оранжево-желтые пары. При охлаждении те же явления повторяются в обратном порядке.
Рис. 3. Кристаллы ромбической серы
Если расплавленную серу, нагретую до кипения, вылить тонкой струей в холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити. Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую серу.
Кроме трех рассмотренных видоизменений серы, известны также и другие, на которых мы не будем останавливаться. Все они неустойчивы и довольно быстро превращаются в ромбическую серу. Поэтому в природе сера встречается только в ромбической форме.
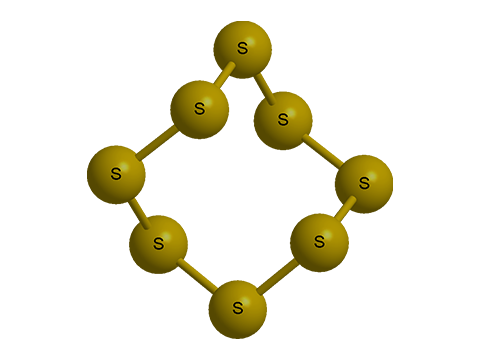
Результаты определения молекулярного веса серы по понижению точки замерзания ее растворов в бензоле приводят к заключению, что молекулы серы при этих условиях состоят из восьми атомов (S8). Из таких же молекул построены, невидимому, и кристаллы серы. Таким образом, различие в свойствах кристаллических модификаций серы обусловливается не различным числом атомов в молекулах (как, например, в молекулах кислорода и озона), а неодинаковой структурой кристаллов (полиморфизм) .
Рис. 4. Кристалл моноклинической серы
Пары серы при низких температурах состоят главным образом из молекул S6, а выше 800° — из молекул S2.
Сера является типичным металлоидом. Со многими металлами, например с медью, железом, цинком и др., она соединяется непосредственно с выделением значительного количества тепла.
Сера соединяется также почти со всеми металлоидами, но далеко не так легко и энергично, как с металлами.С кислородом сера дает несколько окислов, из которых два самые важные —SO2и SO3— являются ангидридами кислот сернистой H2SO3и серной H2SO4.Соединение серы с водородом — газ сероводород H2S — в водном растворе также обладает кислотными свойствами.
Значение природных сульфидов и сульфатов
Характеристика серы будет неполной, если не сказать, что элемент встречается не только в виде простого вещества и оксидов. Наиболее распространенные природные соединения — это соли сероводородной и серной кислот. Сульфиды меди, железа, цинка, ртути, свинца встречаются в составе минералов халькопирита, пирита, сфалерита, киновари и галенита. Из сульфатов можно назвать натриевую, кальциевую, бариевую и магниевую соли, которые образуют в природе минералы и горные породы (мирабилит, гипс, селенит, барит, кизерит, эпсомит). Все эти соединения находят применение в разных отраслях хозяйства, используются как сырье для промышленной переработки, удобрения, стройматериалы. Велико медицинское значение некоторых кристаллогидратов.
Интересные факты о сере
- Сера составляет почти 3 процента массы Земли. Это достаточно, чтобы сделать две дополнительные луны.
- Сера (как двуокись серы) использовалась для сохранения вина в течение тысячелетий и остается ингредиентом в вине сегодня, согласно Практическому Виноделию и Виноградному Журналу.
- Неясно, откуда взялось название «сера». Оно может быть получен из «суфры» или «желтого» на арабском языке. Или это может быть от санскритского «шулбари», что означает «враг меди». Второй вариант интригует, потому что сера сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и назовали её соответствующим образом?
- Двуокись серы использовалась для фумигации домов с древних времен, практика, которая продолжалась и в XIX веке. Одна статья 1889 года главного инспектора здравоохранения Нью-Йорка описала, как чиновники сжигали серу и алкоголь в домах, страдающих от оспы, скарлатины, дифтерии и кори.
- Ах, расслабьтесь! Горячие источники, наполненные растворенными соединениями серы, могут иметь сомнительный запах, но они давно ценятся за их предполагаемые лечебные свойства. Например, город Горячих Серовых Спрингсов, Колорадо, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, которые в течение столетий использовались индейцами.
- Подождите, что случилось с этим написанием? «Серна» — обычное правописание в Соединенном Королевстве, в то время как «сера» является предпочтительной в остальном мире. Но, с научной точки зрения, «серна» правильнее, согласно Международному союзу чистой и прикладной химии, организации, задачей которой является определить эти вещи.
- Сера может дать число на кораблекрушениях. В исследовании, проведенном в 2008 году на шведском военном корабле, затонувшем в 1628 году, было обнаружено более 2 тонн серы, пропитывающей древесные отходы спасенного судна.
- Извините! Основная причина, что кишечный газ имеет этот неприятный запах, заключается в том, что толстая кишка полна бактерий, которые выделяют соединения серы в качестве отходов.
http://chem100.ru/elem.php?n=16
https://tagweb.ru/2017/09/29/poleznye-fakty-o-sere/