Реакции
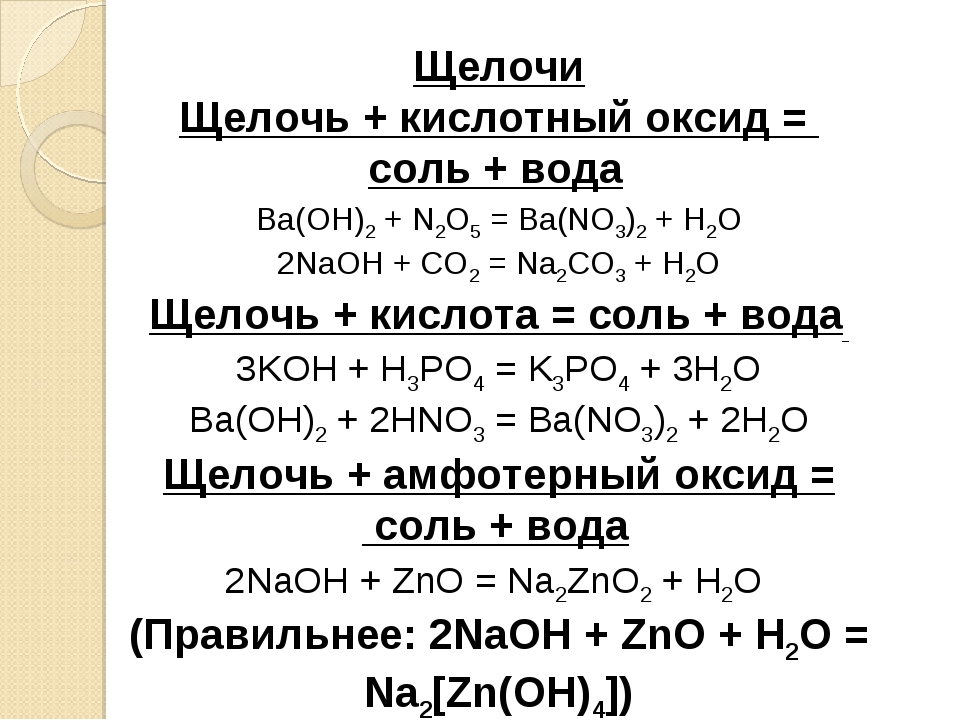
Абсолютно все щелочи реагируют с кислотами. Реакция протекает так же, как кислоты и основания — с образованием соли и воды. Пример:
NaOH+HCl=NaCl+H2O
Приведенная реакция — соляная кислота + щелочь. Формулы реакций различных щелочей с кислотами:
КОН+HCl=KCl+H2O
NaOH+HNO3=NaNO3+H2O
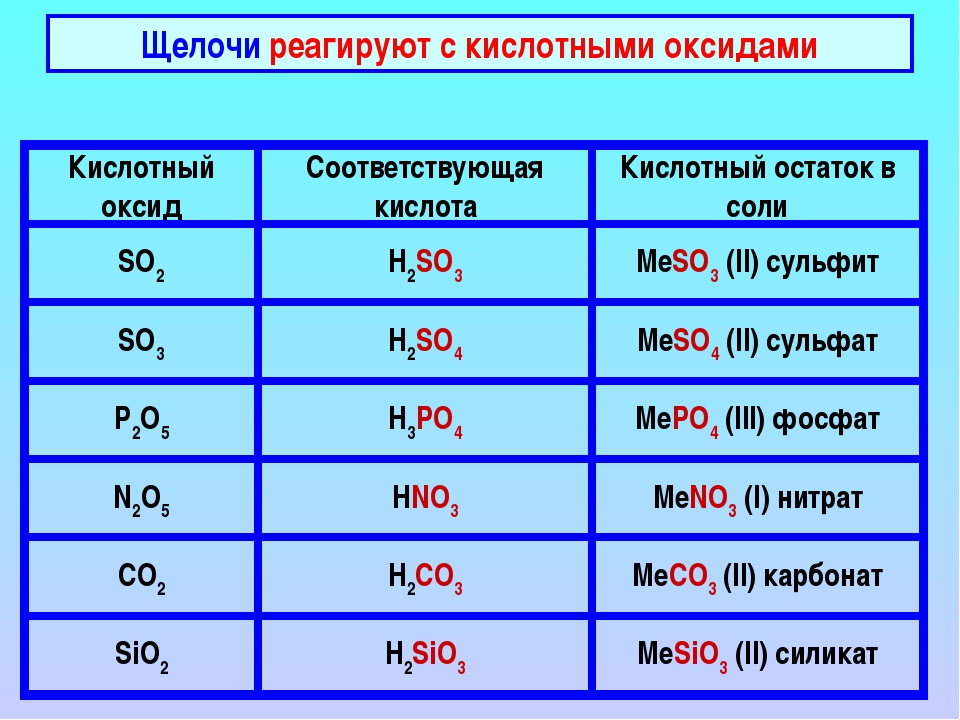
Помимо кислот, щелочи реагируют также с кислотными оксидами (SO2, SO3, CO2). Реакция проходит по тому же механизму, что и щелочи с кислотой — в результате взаимодействия образуется соль и вода.
Щелочи взаимодействуют и с амфотерными оксидами (ZnO, Al2O3). При этом образуются нормальные или комплексные соли. Самая типичная из таких реакций оксид цинка + едкая щелочь. Формула такой реакции:
2NaOH+ZnO=Na2ZnO2+H2O
В показанной реакции образуется нормальная соль натрия Na2ZnO2 и вода.
Реакции щелочей с амфотерными металлами протекают по тому же механизму. Приведем в качестве примера реакцию алюминий + щелочь. Формула реакции:
2KOH+2Al+6H2O=2K(Al(OH)4)+3H2
Это пример реакции с образованием комплексной соли.
Кислоты в почве
Оказывается, кислоты есть и в почвах, а способность почвы проявлять свойства кислот называется кислотностью. Этот показатель зависит от наличия в земле ионов водорода. От кислотности почвы зависят рост и развитие растений. Большинство из них предпочитает нейтральные или близкие к ним почвы. Однако есть ряд растений, которые отлично себя чувствуют именно на кислотных почвах, например рододендроны, гортензии, азалии. Некоторые сорта гортензии могут менять цвет бутонов в зависимости от условий выращивания и кислотности почвы. Ученые выяснили, что на цвет бутонов влияет наличие алюминия!

Большинство садовых почв характеризуется достаточным содержанием этого элемента. В кислой среде соединения алюминия превращаются в растворимые и становятся доступными для растений, поэтому и вырастают бутоны голубого цвета. В нейтральной или щелочной среде алюминий находится в виде нерастворимых соединений, поэтому он и не поступает в растения. В результате на таких почвах растут бутоны розового цвета.
Шкала pH
Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.

Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в пределах 0—7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7—14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Кислоты и щелочи в природе
Ты уже успел убедиться в том, что вокруг нас — огромное количество кислот и щелочей. Молочные продукты, овощи и фрукты содержат лимонную, яблочную, щавелевую, уксусную, молочную, аскорбиновую и другие кислоты. Трудно поверить, но в косточках вишен и миндаля содержится (хоть и в минимальных количествах) такой сильный яд, как синильная кислота! Известно, что многие насекомые предпочитают защищаться разными кислотами. Никогда не задумывался, почему укусы обыкновенного крошечного муравья бывают такими болезненными? А все потому, что он вспрыскивает в ранку капельки муравьиной кислоты. Эту же кислоту выделяют и кое-какие виды гусениц, а тропические пауки и некоторые жуки защищаются от врагов при помощи уксусной и серной кислот.
Физические свойства
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твёрдые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Самые сильные щёлочи — гидроксид цезия (поскольку из-за очень малого периода полураспада гидроксид франция не получен в макроскопических количествах) в группе Ia и гидроксид радия в группе IIa.
Кроме того, едкие щёлочи растворимы в этаноле и метаноле.
Определение и основная формула
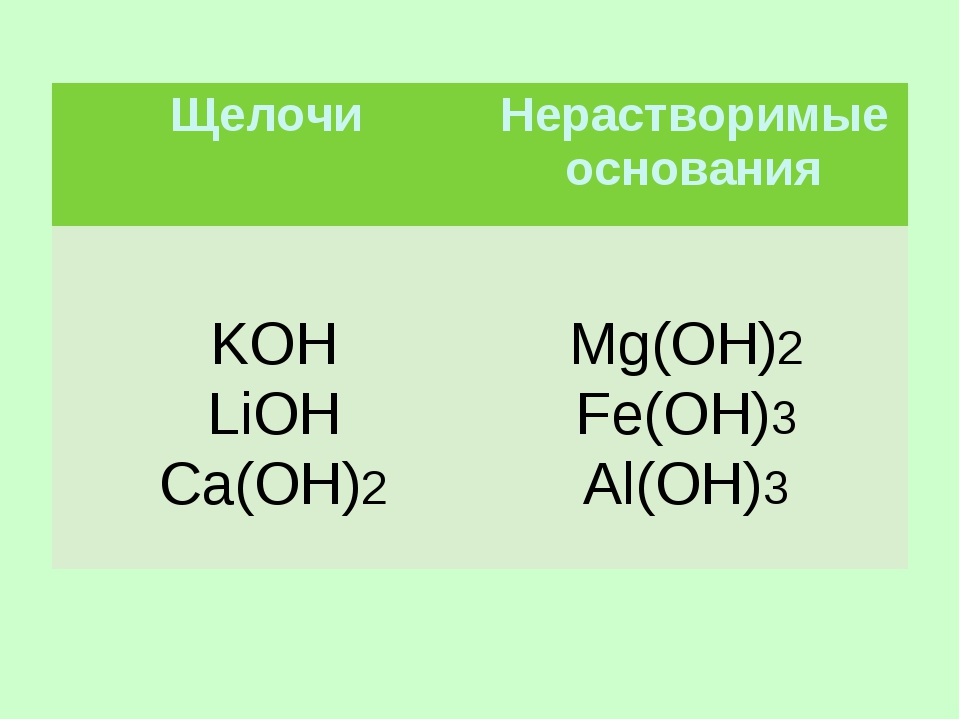
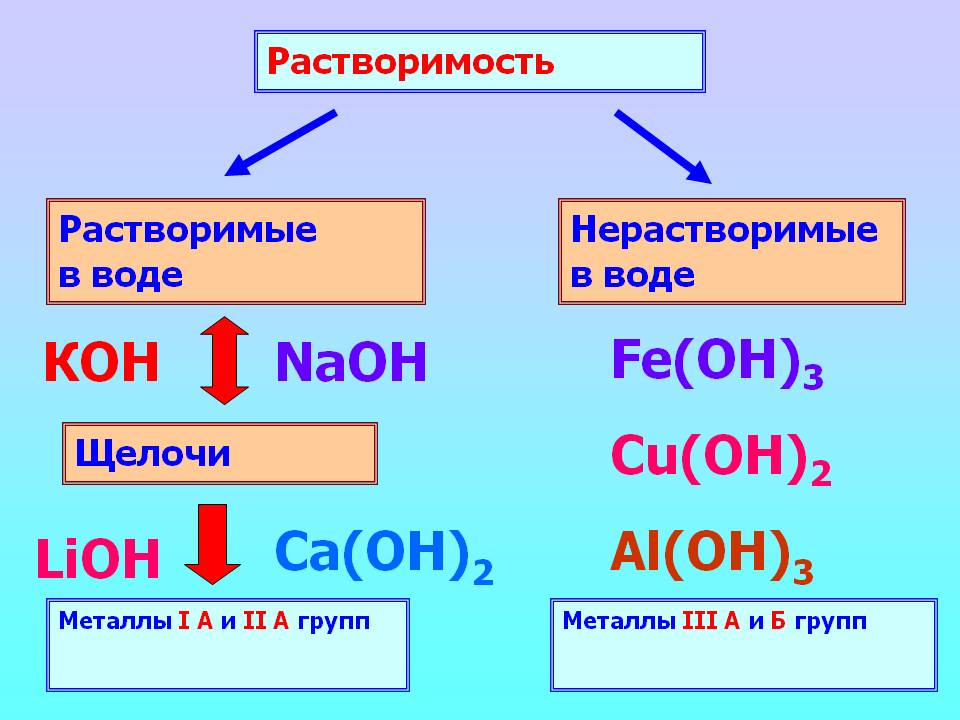
Начнем с определения. Щелочью называется хорошо растворимое в воде вещество, гидроксид щелочного (1-ая группа, основная подгруппа в таблице Менделеев) или щелочноземельного (2-ая группа, основная подгруппа в таблице Менделеева) металла. Стоит заметить, что бериллий и магний, хотя и принадлежат к щелочным металлам, щелочей не образуют. Их гидроксиды относят к основаниям.

Щелочи — самые сильные основания, растворение которых в воде сопровождается тепловыделением. Примером этого служит бурная реакция с водой гидроксида натрия. Из всех щелочей наименее растворим в воде гидроксид кальция (известный также как гашеная известь), который в чистом виде представляет собой порошок белого цвета.
Из определения можно сделать вывод, что химическая формула щелочи — ROH, где R — щелочноземельный (кальций, стронций, радий, барий) или щелочной (натрий, калий, литий, цезий, франций, рубидий) металл. Приведем некоторые примеры щелочей: NaOH, KOH, CsOH, RbOH.
Химический ожог щелочью
При использовании неразбавленных щелочей всегда стоит помнить, что они являются едкими веществами, которые при попадании на открытые участки тела вызывают покраснение, зуд, жжение, отек, в тяжелых случаях образуются пузыри. При длительном контакте такого опасного состава со слизистой органов зрения возможно наступление слепоты.
При химическом ожоге щелочью необходимо промыть пораженное место водой и очень слабым раствором кислоты — лимонной или уксусной. Даже незначительное количество едкой щелочи может вызвать обширное поражение кожи и ожог слизистых, поэтому с такими веществами стоит обращаться аккуратно и держать подальше от детей.
Химические свойства
Щёлочи проявляют основные свойства. В твёрдом состоянии все щёлочи поглощают H2O из воздуха, а также CO2 (также и в состоянии раствора) из воздуха, постепенно превращаясь в карбонаты. Щёлочи широко применяются в промышленности.
Качественные реакции на щёлочи
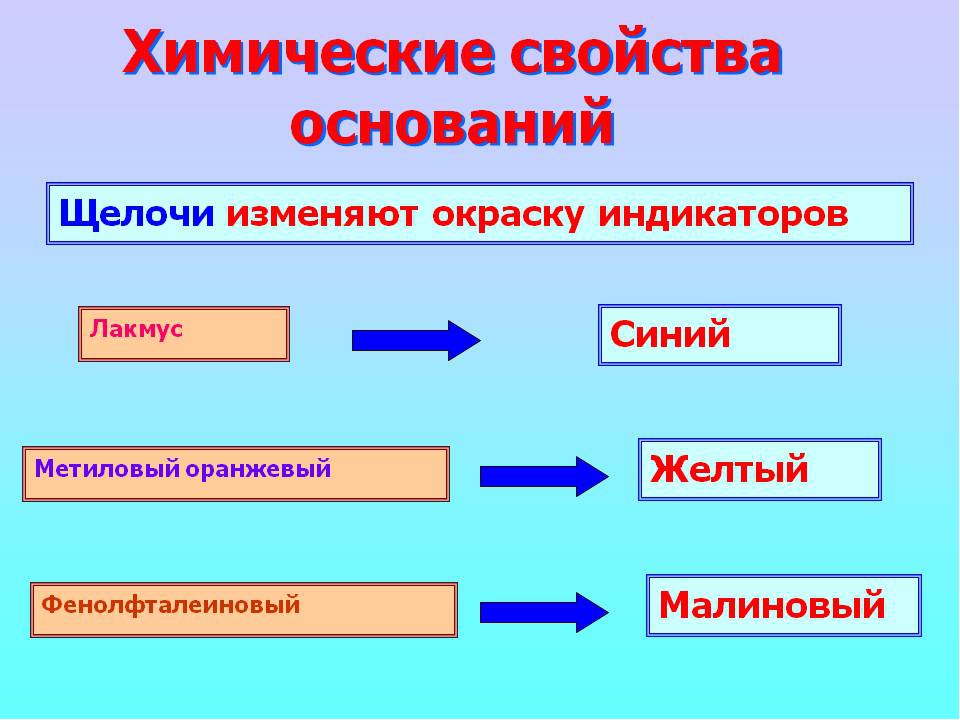
Водные растворы щелочей изменяют окраску индикаторов.
| Индикатори номер перехода | х | Интервал pHи номер перехода | Цветщёлочной формы | |
|---|---|---|---|---|
| Метиловый фиолетовый | 0,13-0,5 | зелёный | ||
| Крезоловый красный | 0,2-1,8 | жёлтый | ||
| Метиловый фиолетовый | 1,0-1,5 | синий | ||
| Тимоловый синий | к | 1,2-2,8 | жёлтый | |
| Тропеолин 00 | o | 1,3-3,2 | жёлтый | |
| Метиловый фиолетовый | 2,0-3,0 | фиолетовый | ||
| (Ди)метиловый жёлтый | o | 3,0-4,0 | жёлтый | |
| Бромфеноловый синий | к | 3,0-4,6 | сине-фиолетовый | |
| Конго красный | 3,0-5,2 | синий | ||
| Метиловый оранжевый | o | 3,1-(4,0)4,4 | (оранжево-)жёлтый | |
| Бромкрезоловый зелёный | к | 3,8-5,4 | синий | |
| Бромкрезоловый синий | 3,8-5,4 | синий | ||
| Лакмоид | к | 4,0-6,4 | синий | |
| Метиловый красный | o | 4,2(4,4)-6,2(6,3) | жёлтый | |
| Хлорфеноловый красный | к | 5,0-6,6 | красный | |
| Лакмус (азолитмин) | 5,0-8,0 (4,5-8,3) | синий | ||
| Бромкрезоловый пурпурный | к | 5,2-6,8(6,7) | ярко-красный | |
| Бромтимоловый синий | к | 6,0-7,6 | синий | |
| Нейтральный красный | o | 6,8-8,0 | янтарно-жёлтый | |
| Феноловый красный | о | 6,8-(8,0)8,4 | ярко-красный | |
| Крезоловый красный | к | 7,0(7,2)-8,8 | тёмно-красный | |
| α-Нафтолфталеин | к | 7,3-8,7 | синий | |
| Тимоловый синий | к | 8,0-9,6 | синий | |
| Фенолфталеин | к | 8,2-10,0 | малиново-красный | |
| Тимолфталеин | к | 9,3(9,4)-10,5(10,6) | синий | |
| Ализариновый жёлтый ЖЖ | к | 10,1-12,0 | коричнево-жёлтый | |
| Нильский голубой | 10,1-11,1 | красный | ||
| Диазофиолетовый | 10,1-12,0 | фиолетовый | ||
| Индигокармин | 11,6-14,0 | жёлтый | ||
| Epsilon Blue | 11,6-13,0 | тёмно-фиолетовый |
Взаимодействие с кислотами
Реакция нейтрализации между гидроксидом натрия и соляной кислотой. Индикаторный агент бромтимоловый синий.
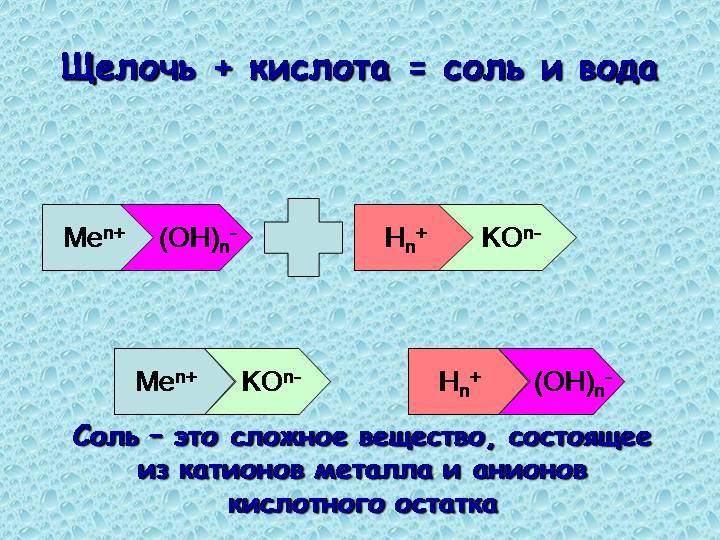
Щёлочи, как основания, взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). Это одно из самых важных химических свойств щелочей.
Щёлочь + Кислота → Соль + Вода
- NaOH+HCl⟶NaCl+H2O{\displaystyle {\mathsf {NaOH+HCl\longrightarrow NaCl+H_{2}O}}};
- NaOH+HNO3⟶NaNO3+H2O{\displaystyle {\mathsf {NaOH+HNO_{3}\longrightarrow NaNO_{3}+H_{2}O}}}.
Взаимодействие с кислотными оксидами
Щёлочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Щёлочь + Кислотный оксид → Соль + Вода
- Ca(OH)2+CO2⟶CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}\downarrow +H_{2}O}}};
Взаимодействие с переходными (амфотерными) металлами
Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды (Zn,Al{\displaystyle {\mathsf {Zn,Al}}} и др). Уравнения этих реакций в упрощённом виде могут быть записаны следующим образом:
- Zn+2NaOH⟶Na2ZnO2+H2↑{\displaystyle {\mathsf {Zn+2NaOH\longrightarrow Na_{2}ZnO_{2}+H_{2}\uparrow }}};
- 2Al+2KOH+2H2O⟶2KAlO2+3H2↑{\displaystyle {\mathsf {2Al+2KOH+2H_{2}O\longrightarrow 2KAlO_{2}+3H_{2}\uparrow }}}.
Реально в ходе этих реакций в растворах образуются гидроксокомплексы (продукты гидратации указанных выше солей):
- Zn+2NaOH+2H2O⟶Na2Zn(OH)4+H2↑{\displaystyle {\mathsf {Zn+2NaOH+2H_{2}O\longrightarrow Na_{2}+H_{2}\uparrow }}};
- 2Al+2KOH+6H2O⟶2KAl(OH)4+3H2↑{\displaystyle {\mathsf {2Al+2KOH+6H_{2}O\longrightarrow 2K+3H_{2}\uparrow }}};
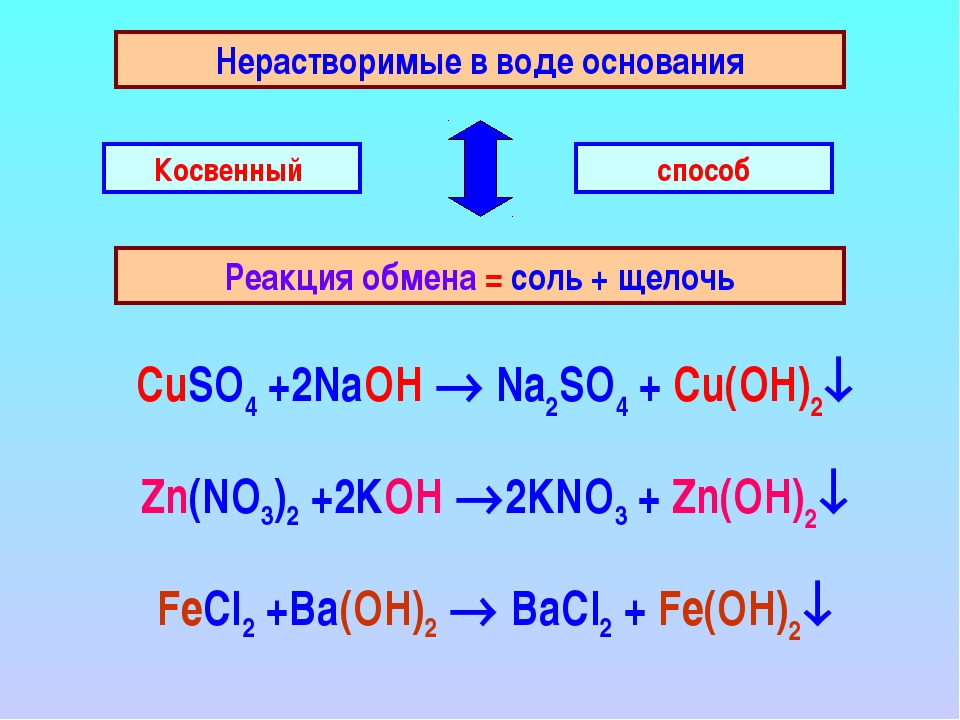
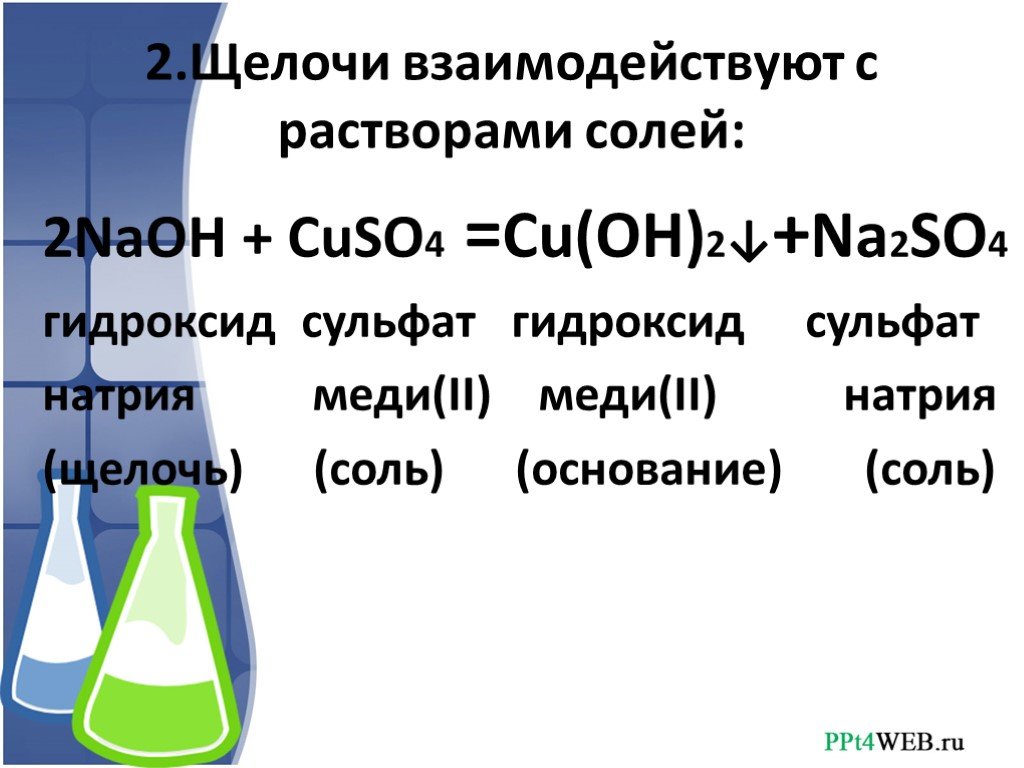
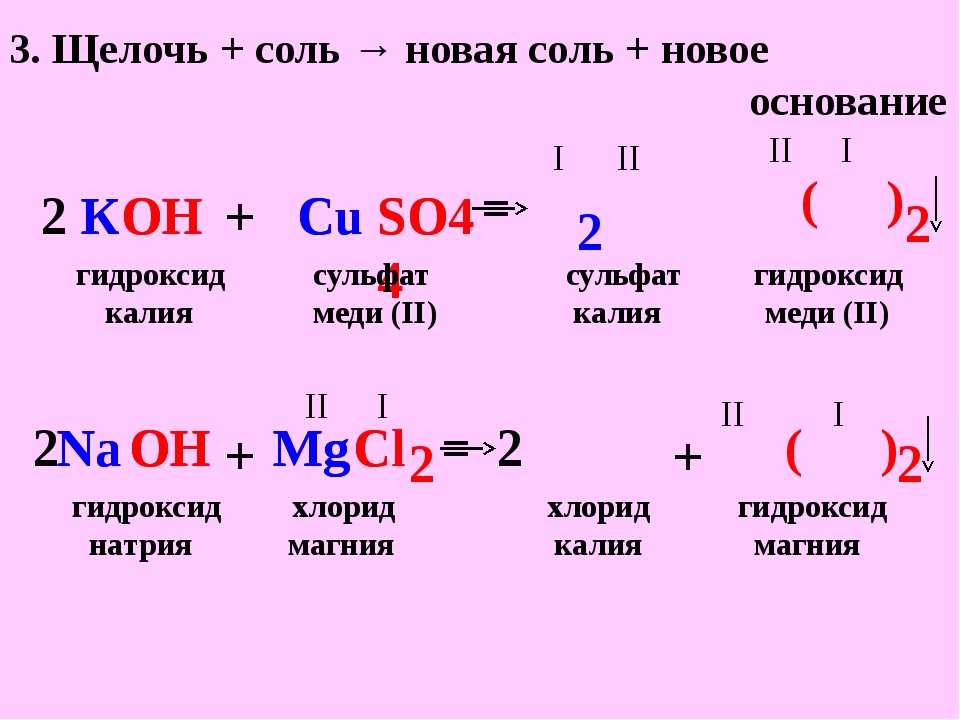
Взаимодействие с растворами солей
Растворы щелочей взаимодействуют с растворами солей, если образуется нерастворимое основание или нерастворимая соль:
Раствор щёлочи + Раствор соли → Новое основание + Новая соль
- 2NaOH+CuSO4⟶Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {2NaOH+CuSO_{4}\longrightarrow Cu(OH)_{2}\downarrow +Na_{2}SO_{4}}}};
- Ba(OH)2+Na2SO4⟶2NaOH+BaSO4↓{\displaystyle {\mathsf {Ba(OH)_{2}+Na_{2}SO_{4}\longrightarrow 2NaOH+BaSO_{4}\downarrow }}};
Взаимодействие с индикаторами
Для определения pH исследуемого раствора используются специальные химические вещества — индикаторы, которые меняют свой цвет в зависимости от значения показателя водорода в среде. Самый распространенный индикатор, используемый в химических исследованиях, — лакмус. В щелочной среде он приобретет интенсивный синий цвет.
Другой доступный индикатор, фенолфталеин, в щелочной среде приобретает малиновый окрас. Однако в очень концентрированном растворе (показатель водорода близок к 14) фенолфталеин остается бесцветным, как и в нейтральной среде. Потому лакмус при работе с концентрированными щелочами использовать предпочтительнее.

Метиловый оранжевый индикатор в щелочной среде приобретает желтый окрас, при уменьшении pH среды цвет меняется от желтого до оранжевого и красного.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
Физические свойства щелочей
Помимо этого, щелочи также хорошо растворяются в этаноле. Концентрированные и умеренные растворы имеют pH от 7.1 и выше. Растворы щелочей мыльные на ощупь
Концентрированные составы — довольно едкие химические соединения, контакт с которыми вызывает химические ожоги кожи, глаз, любых слизистых оболочек, поэтому работать с ними следует осторожно. Воздействие едкого вещества можно нейтрализовать раствором кислоты
Щелочи могут находиться как в твердом, так и в жидком состоянии. Гидроксид натрия — самая распространенная щелочь (формула NaOH), которая в твердом состоянии представляет собой вещество белого света.

Гидроксид кальция при нормальных условиях — белый порошок. Гидроксиды радия и бария в твердом агрегатном состоянии — бесцветные кристаллы. Гидроксиды стронция и лития также бесцветны. Все твердые щелочи поглощают воду из воздуха. Гидроксид цезия — самая сильная щелочь (формула CsOH). Щелочные свойства металлов 1-ой группы основной подгруппы возрастают сверху вниз. Эти вещества нашли применение в химической промышленности. В основном их используют в щелочных аккумуляторах в качестве электролитов. Чаще всего применяют гидроксиды калия и натрия.
Что такое кислота?
Кислоты представляют собой молекулы, которые при растворении в воде высвобождают ион водорода. Ионы — это положительно и отрицательно заряженные частички, которые придают кислотам их свойства.
 Молекула соляной кислоты
Молекула соляной кислоты
Давай рассмотрим этот процесс на примере соляной кислоты — HCI. Если соляную кислоту соединить с водой, она распадется на ион водорода (Н+) и ион хлора (CI ). Так как в составе молекулы воды также есть водород, то при распаде соляной кислоты общее количество ионов водорода в растворе увеличится.
А что происходит со щелочами при попадании в воду? В воде щелочи высвобождают гидроксид-ионы. Например, гидроксид натрия (NaOH) — щелочь. При соединении с водой он распадается на ионы натрия (Na+) и гидроксид-ионы (ОН ). Когда гидроксид-ионы встречаются с ионами водорода воды, общее количество ионов водорода в растворе сокращается.