Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
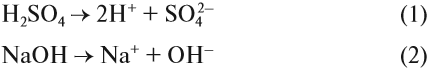
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н+ или ОН–. Но при диссоциации упомянутых солей:
ионы Н+ и ОН– не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н+ или ОН–.
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
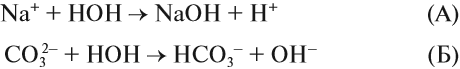
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na+ и ОН–, другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:

pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Например:
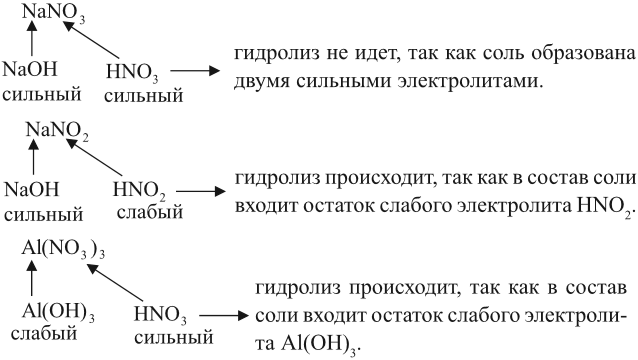
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
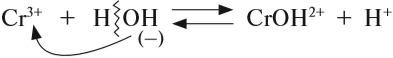
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН–;
-
сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н+, значит, среда кислая, рН< 7.
Вопрос. Какую окраску будет иметь лакмус в этом растворе?
5. Для того чтобы составить молекулярное уравнение реакции гидролиза, следует:
- дописать к каждому иону ионы, которые образуются при диссоциации, с противоположным зарядом (в данном случае ионы Cl–);
-
составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы.
Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы.
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Литература
- Растворы // Физическая энциклопедия : / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- Растворы // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Шахпаронов М. И. Введение в молекулярную теорию растворов. — М.: Государственное издательство технико-теоретической литературы, 1956. — 508 с.
- Реми Г. Курс неорганической химии. — М.: Издательство иностранной литературы, 1963, 1966. — Т. 1—2.
- Streitwieser, Andrew; Heathcock, Clayton H., Kosower, Edward M. Introduction to Organic Chemistry (неопр.). — 4th ed.. — Macmillan Publishing Company, New York, 1992.
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
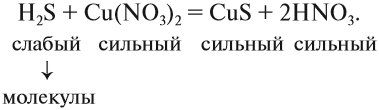
2. Для сильных электролитов определить растворимость (по таблице растворимости):
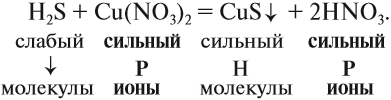
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
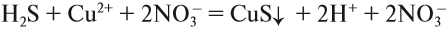
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
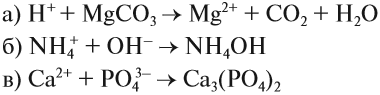
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
При растворении кристаллических веществ, растворимость которых увеличивается с увеличением температуры, происходит охлаждение раствора ввиду того, что у раствора внутренняя энергия больше, чем у кристаллического вещества и растворителя, взятых отдельно. Например, кипяток, в котором растворяют сахар, сильно охлаждается.
Концентрация растворов
В зависимости от цели для описания концентрации растворов используются разные физические величины.
- Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить ещё некоторое его количество.
- Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
- Пересыщенный раствор (изредка используется термин перенасыщенный) — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе. Пересыщенные растворы неустойчивы, избыток вещества легко выпадает в осадок. Такой раствор нельзя получить путём растворения в нормальных условиях, обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
- Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщенные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
- Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
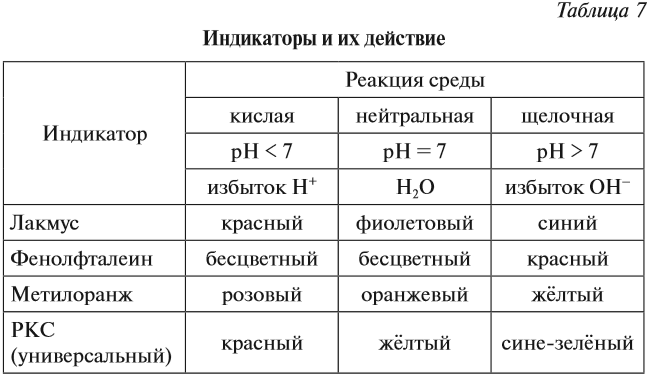
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.