Что такое pH
Как горячий и холодный — две крайности, описывающие температуру, также есть две крайности, которые описывают все химические вещества. Это кислота и щелочь.
pH — это показатель соотношения щелочи и кислоты.
Смешивание кислоты и щелочи «обнуляет» их свойства. Так же как смешивание горячей и холодной воды выравнивает ее температуру. Нейтральное вещество не является ни кислотой, ни щелочью.
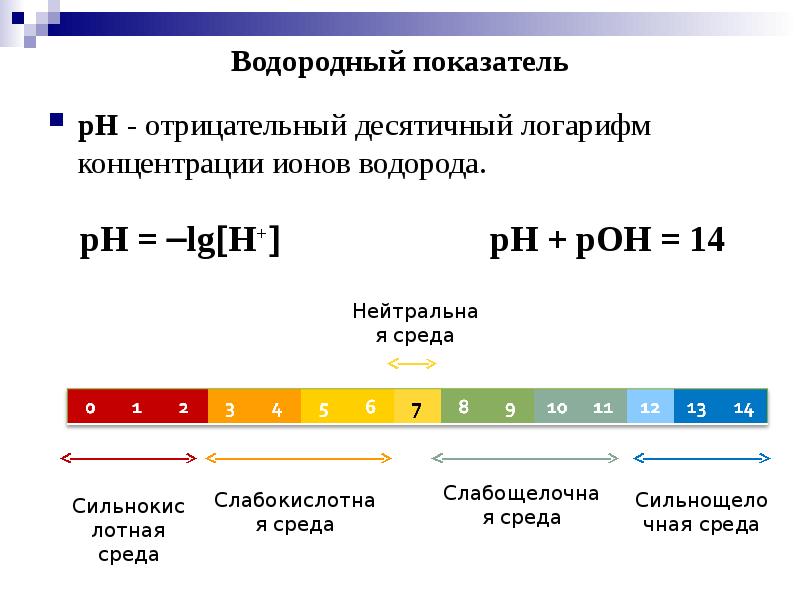
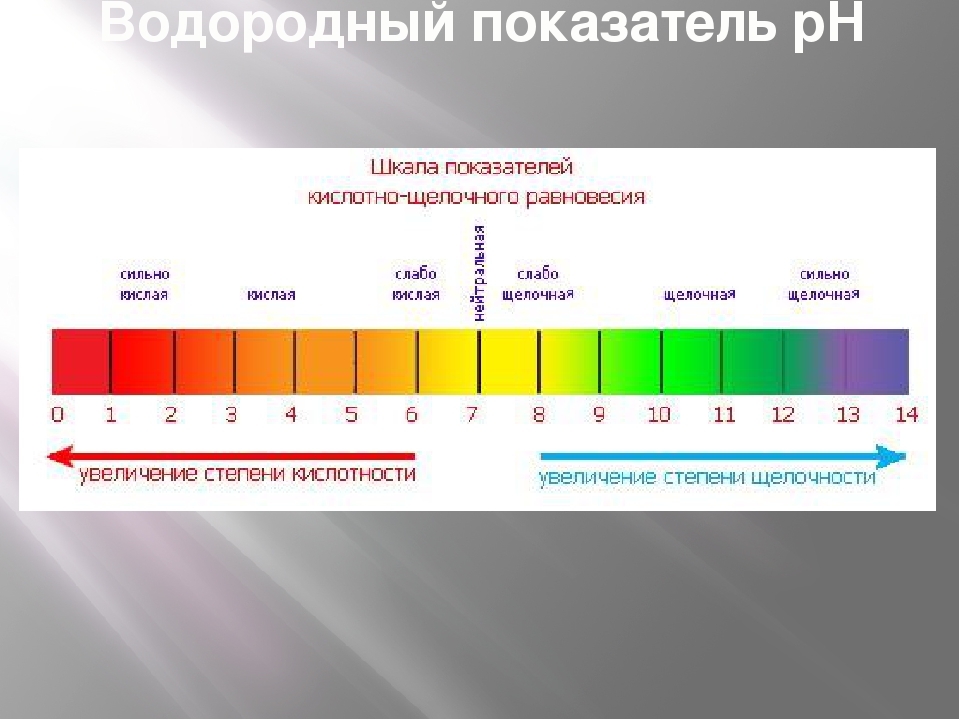
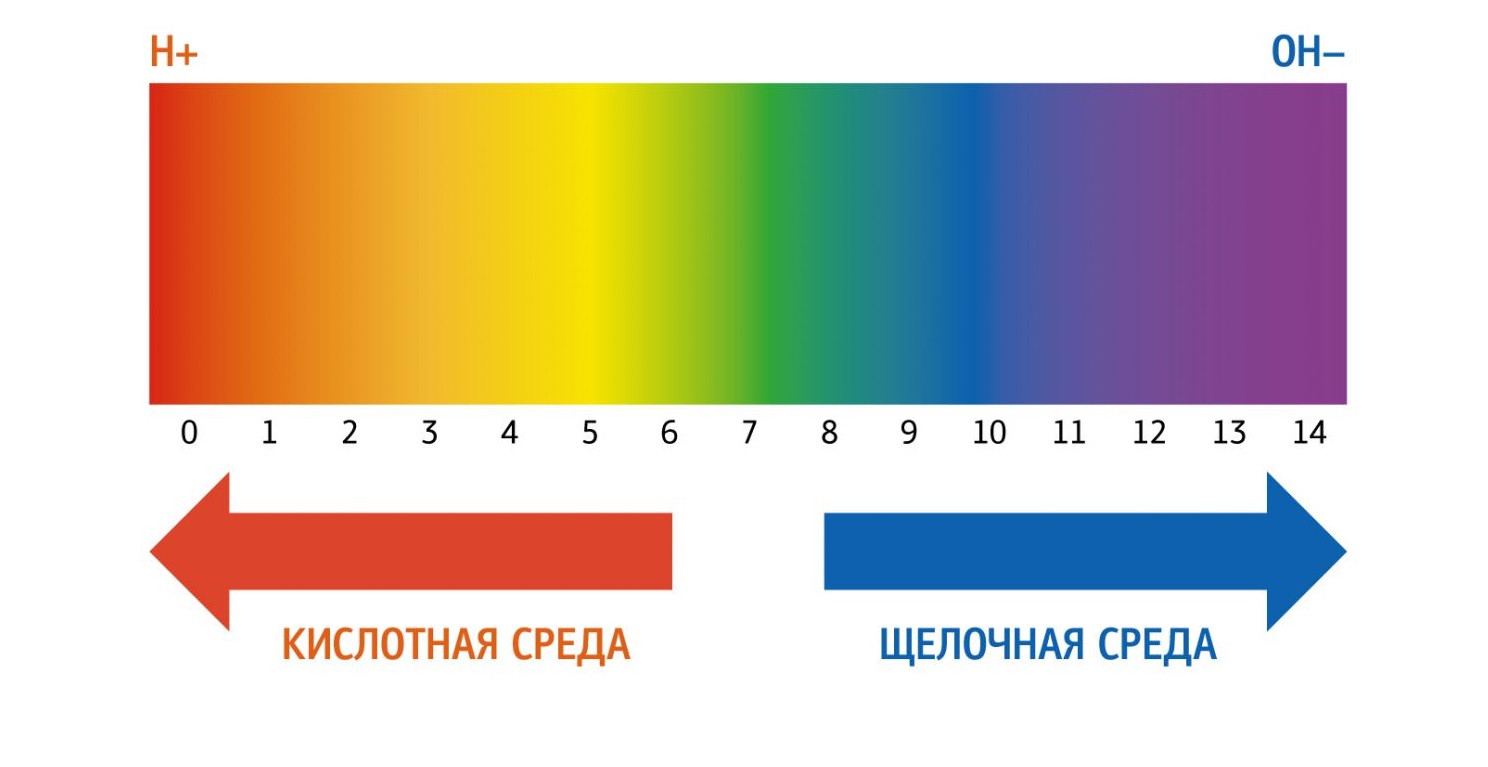
Для определения рН существует шкала — от 0 до 14. Именно она показывает насколько вещество является кислотным или щелочным.
Нейтральный рH равен 7 (это рH чистой воды). рH от 0 до 6,9 указывает на кислотную среду. рH от 7,1 до 14 определяет щелочную среду.
Запомните — чем ниже рН, тем он более кислотный, чем выше pH, тем он более щелочной.
Сильно кислые вещества (например, лимонный сок) и сильно щелочные (например, отбеливатель) могут вызвать серьёзные повреждения кожи.
Безопасный для кожи человека диапазон pН — от 3 до 9. Вещества с pН выше и ниже этих значений могут вызвать покраснение, раздражение и даже химический ожог
Это важно знать для правильного выбора и применения косметических средств
Что такое рН
Тот самый «водородный показатель» – это и есть рН, potentia hydrogeni (сила водорода). И показывает он действительно меру активности положительных ионов водорода H+ в растворе по сравнению с отрицательными ионами ОН- (формула воды Н2О, если вы еще не забыли школьный курс химии).
Но не торопитесь пугаться и удивляться, зачем вам вообще это знать. Проще говоря – величина рН выражает кислотность субстрата. Чем активнее ионы H+, тем он кислее.
Говоря другими словами, чем значение pH меньше (среднестатистическая шкала принята от 0 до 14), тем он кислее в прямом и переносном смысле. У кислотных растворов pH < 7, у основных (щелочных) растворов pH > 7, pH нейтральных растворов равен 7. Одна единица на такой шкале больше другой примерно в 10 раз (шкала логарифмическая).
При растворении в воде различных веществ этот баланс может быть нарушен, что и приводит к изменению уровня рН.
Например, идеально чистая вода будет иметь рН в районе 7 – это среднее в шкале, а значит, нейтральное значение. Морская же вода будет значительно менее, а дождевая – более кислотной, чем эталонный дистиллят. Наш желудочный сок кислый – его рН приблизительно равно 1-2. Где-то в этом же диапазоне находятся уксус, кислые соки и даже электролиты в аккумуляторах. А, например, известный всем отбеливатель «хлорка» уже сильно щелочной – его показатель рН составляет около 12.
Насколько это важно для огородника? Дело в том, что разные системы живых организмов для нормального функционирования и возможности протекания или правильного результата той или иной реакции нуждаются в разных показателях рН – для человеческого организма этот показатель «свой» у крови, желудочного сока, поверхности кожи и т.п. Растения – тоже живые организмы
Если при поливе, посадке, удобрении растений баланс рН изменяется, меняется и нормальное течение всех процессов внутри этого организма (растения). Стабильный pH – чуть ли не основной фактор в их выращивании, позволяющий комфортно существовать всем системам, а главное – полноценно усваивать питательные элементы из окружающей среды
Растения – тоже живые организмы. Если при поливе, посадке, удобрении растений баланс рН изменяется, меняется и нормальное течение всех процессов внутри этого организма (растения). Стабильный pH – чуть ли не основной фактор в их выращивании, позволяющий комфортно существовать всем системам, а главное – полноценно усваивать питательные элементы из окружающей среды.
Диапазон pH 5,5-6,5 считается для выращивания растений идеальным – это важно, например, при культивации растений методом гидропоники. При более высоких значениях, к примеру, практически не будут усваиваться марганец (Mn), бор (B) и фосфор (P), а при более низких огородные культуры недополучат магний (Mg)
Как измеряют рН? Не будем сейчас о сложных лабораторных исследованиях. Для огородников давно придуманы компактные и простые в употреблении приборы для измерения активности ионов водорода – рН-метры (строго говоря, это вольтметры, но не будем углубляться в науку). Обычно они представляют собой коробочку с экраном и измерительным стержнем, который нужно просто воткнуть в рыхлую слегка влажную землю на нужную глубину и через минуту считать показания с электронного экрана. Для точности показаний измерения желательно проводить в нескольких точках и брать усредненные данные.
Для чего нужно определение рН почвы? Как мы уже упоминали, для оценки полноценности усвоения растениями важных макро- и микроэлементов, для выбора необходимых удобрений и для выяснения, нужно ли менять кислотность почвы на участке. Какие-то растения любят более кислые почвы, какие-то – более щелочные, это обязательно нужно учитывать и при необходимости самостоятельно корректировать рН грунта.
Кислотность почвы: определяем и регулируем
Если на вашем участке повышенная кислотность почвы, это может серьезно навредить растениям. Как понять, что пора принимать меры?
Еще один способ измерить уровень рН жидкости (воды для полива, раствора удобрений и т.п.) – использование так называемых чувствительных лакмусовых бумажек, к которым прилагаются цветные шкалы кислотности. Бумажку на секунду-другую опускают в измеряемый раствор, а затем сравнивают ее изменившийся цвет с эталонной шкалой.
Что происходит с кожей при изменении рН
Кислотная мантия на поверхности кожи защищает нас от проникновения загрязнений, микробов, токсинов и алергенов. Уровень рН определяет насколько хорошо работает защита.
При здоровом кислотном рН защита работает на ура.
Слишком кислотный рН (например, если вы неправильно применяете химические пилинги) делает кожу гиперчувствительной и склонной к раздражениям.
Щелочной рН обеспечивает благоприятные условия для «захватчиков». Он нарушает мантию и открывает ворота для множества кожных проблем — различных форм дерматитов, экземы, псориаза, акне и преждевременного старения.
В жирной коже избытки сала частично окисляются. Это приводит к смещению рН в сторону щелочи и создаёт благоприятные условия для размножения микробов, возникновения инфекций и развития акне.
Именно поэтому так важно поддерживать правильный баланс рН (4,7-5,7)
Главное о крови
Кровь представляет собой жидкую соединительную ткань, состоящую из двух фракций в определенном соотношении – плазмы и форменных элементов (эритроциты, лейкоциты, тромбоциты и другие).
Соотношения этих фракций постоянно меняются, как и постоянно обновляются клетки крови, которые отмирают, выводясь из организма выделительной системой, и уступают место новым.
Движение крови по сосудам управляется сердечными ритмами, не останавливается ни на секунду, так как именно она доставляет жизненно важный кислород и питательные вещества до всех органов и тканей.
Основных функций крови несколько:
- Дыхательная, обеспечивающая доставку кислорода от легких ко всем органам, и эвакуацию углекислого газа по обратному пути от клеток к легочным альвеолам,
- Питательная, организующая доставку питательных веществ (гормонов, ферментов, структурных и микроэлементов и т.д.) ко всем системам организма,
- Регуляторная, обеспечивающая сообщение гормонов между органами,
- Механическая, образующая тургорное напряжение органов за счет приливающей к ним крови,
- Выделительная, обеспечивающая транспортировку отработавших веществ к органам выделения – почкам и легким, для их дальнейшей эвакуации,
- Терморегулирующая, поддерживающая оптимальную для работы органов температуру тела,
- Защитная, обеспечивающая заслон клеток от чужеродных агентов,
Показатель pH крови формирует качество гомеостатической функции, регулирующей кислотно-щелочное равновесие и водно-электролитный баланс организма.
Что такое pH?
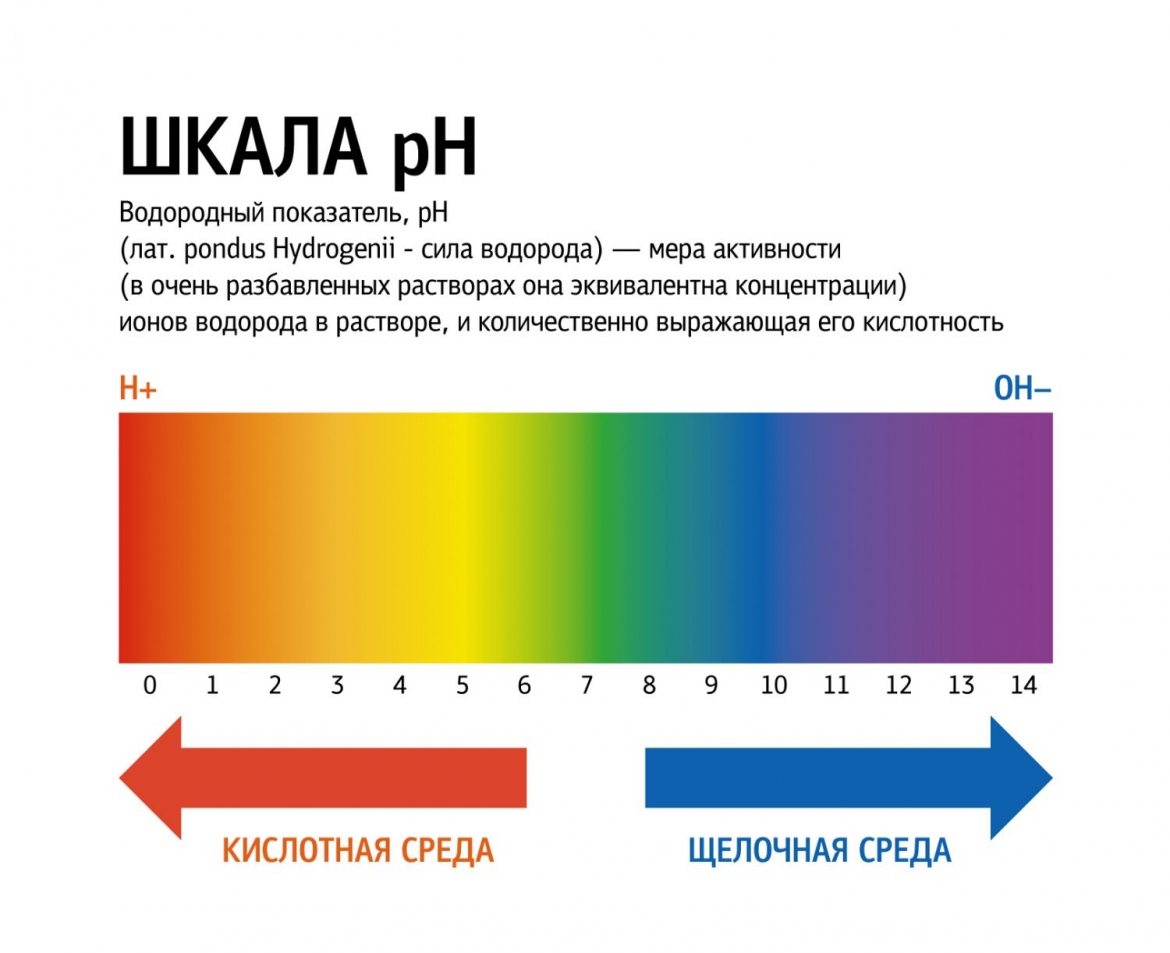
pH (произносится пэ аш), или водородный показатель, — характеристика водного раствора, описывающая меру его кислотности или щёлочности.
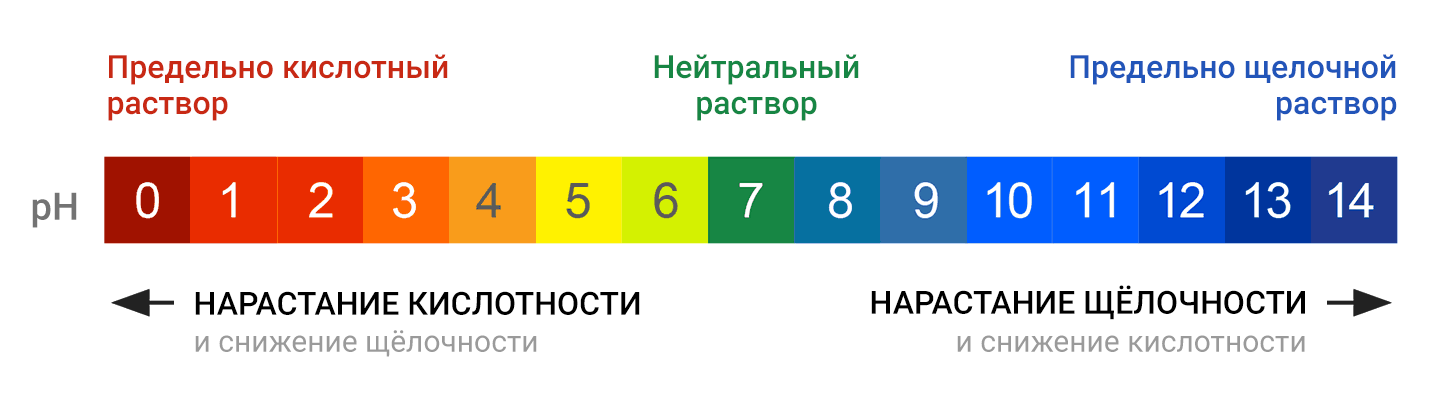
Значения на шкале pH располагаются от 0 до 14, с плавным переходом от предельно кислотного значения к нейтральному и далее, к предельно щелочному (или, как говорят химики, предельно осно́вному, от слова «основание»):
Значение рН напрямую связано с соотношением положительно заряженных и отрицательно заряженных ионов водорода в водном растворе:
Шкала рН является логарифмической. Это значит, что при изменении рН на одну единицу концентрация ионов изменяется в 10 раз. К примеру, раствор с рН 8 является в 10 раз более щелочным, чем раствор с рН 7. Раствор с рН 9 является в 100 раз более щелочным, чем раствор с рН 7, и т. д.
Кислотно-щелочной баланс нашей кожи
Поверхность кожи покрывает плёнка, состоящая из жира, пота и кислот. Ещё она называется мантией.
На поверхности кожи живут полезные бактерии. В результате их жизнедеятельности образуются различные кислоты. В основном — молочная, лимонная и уксусная. Именно поэтому плёнка называется кислотной мантией и её рН (рН поверхности кожи) — тоже кислотный.
рН кожи варьируется от 3 до 7. Например, pH здоровой кожи лица и головы — 4,7-5,7, pH ладоней — 6,2-6,5, pH подмышек — 5,8-6,6.
Конечно, вы помните волшебные цифры из рекламы — 5,5. Долгое время считалось, что средний и оптимальный pH нормальной здоровой кожи равен 5,5. В 2006 году International Journal of Cosmetic Science показало, что средний pH кожи ближе к 4,7.
рН сухой кожи — от 3 до 4,6; нормальной — от 4,7 до 5,7; жирной — от 5,8 до 7.
Для чего измерять и контролировать кислотность питательного раствора?
Правильный баланс питательных веществ в растворе и подходящая концентрация — не единственное, что нужно для обеспечения полноценного питания растений: необходимо также, чтобы питательные вещества находились в доступной форме — то есть, в таком химическом состоянии, в котором корни способны их усвоить.
Кислотность раствора (т. е. его pH) значимо влияет на доступность питательных веществ: в зависимости от меры кислотности, они становятся более или, наоборот, менее доступными для усвоения. Поэтому если вы желаете обеспечить вашим растениям наилучшие условия, ваша задача — подобрать и поддерживать такую кислотность раствора, при которой доступность всех питательных элементов будет оптимальной.
Уравнения, связывающие pH и pOH
Вывод значения pH
В чистой воде концентрации ионов водорода () и гидроксид-ионов () одинаковы и при 22 °C составляют по 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно · и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается (на самом деле увеличивается не концентрация собственно ионов — иначе как способность кислот «присоединять» ион водорода могла бы приводить к этому — а концентрация именно таких соединений с «присоединённым» к кислоте ионом водорода), а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > , говорят, что раствор является кислотным, а при > — осно́вным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
- pH=−lgH+{\displaystyle {\text{pH}}=-\lg \left}
pOH
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
как в любом водном растворе при 25 °C H+OH−=1,⋅10−14{\displaystyle =1{,}0\cdot 10^{-14}}, очевидно, что при этой температуре:
- pOH=14−pH{\displaystyle {\text{pOH}}=14-{\text{pH}}}
Анализ pH крови
При диагностике многих расстройств потребуется определение уровня кислотности крови. В этом случае врач должен узнать содержание ионов водорода и общую кислотность путем забора артериальной крови.
Артериальная кровь является более чистой, чем венозная, и соотношение в ней плазмы и клеточных структур более постоянно, поэтому исследование именно её, а не венозной, является более предпочтительным.
Анализ на уровень кислотности производится путем забора крови из капилляров пальца, то есть вне организма (инвитро). В дальнейшем её помещают в стеклянные pH-электроды и проводят измерения электрометрическим способом, подсчитывая ионы водорода и углекислого газа в единице объема крови.
На основании цифровых значений можно сделать следующие выводы:
- Если показатель равен 7,4, это говорит о слабощелочной реакции и о том, что кислотность в норме.
- Если уровень pH повышен (составляет больше 7,45) свидетельствует о том, что в организме накопились щелочные вещества (основания) и органы, ответственные за их эвакуацию, не справляются с этой задачей.
- Если pH обнаруживается ниже нижнего предела нормы, то это говорит о закислении организма, то есть кислоты вырабатывается или больше, чем нужно, или буферные системы не могут обезвреживать её излишки.
Как понизить?
 Как же снизить этот показатель?
Как же снизить этот показатель?
1. Добавить в воду природный кислый торф каштанового цвета:
- 5 грамм торфа заливается 1 литром дистиллированной воды.
- В течение суток необходимо измерять уровень рН: высокая кислотность указывает на то, что торф подходящий.
- Раствор небольшими частями выливается в аквариум.
- Периодически производятся замеры баланса рН.
2. Использовать препараты, продающиеся в специализированных магазинах и содержащие фосфорную кислоту. Побочный эффект: способствуют увеличению растительности, поэтому увлекаться ими не стоит.
3. Использовать средства, основными компонентами которых являются кора дуба или соцветия ольхи. Алгоритм использования и дозировка указаны в инструкции.
4. Использовать метод вымораживания.
- Вода наливается в таз.
- Емкость помещается в холод.
- Когда жидкость замерзнет наполовину, лет необходимо пробить.
- Незамерзшая вода сливается, а лед растапливается.
- Полученная вода добавляется в аквариум.
Видео о понижении ph в аквариуме:
Что влияет?
В норме колебания рН должны быть в пределах 0,2 – 0,8 в сутки. Уровень кислотности воды зависит от уровня СО2: чем выше концентрация углекислого газа, тем ниже водородный показатель.
На концентрацию химических соединений и элементов влияет, в первую очередь, аквариумная растительность. В процессе фотосинтеза днем она поглощает углекислый газ, что способствует увеличению уровня рН, а ночью, когда процесс фотосинтеза отсутствует, показатель снижается.
Почему повышается?
- Аэрация воды: увеличение концентрации кислорода в воде ведет к снижению концентрации углекислого газа.
- Выделения из аквариумных предметов декора (кораллы, окаменелости и т.п.) и субстрата: их структура содержит минералы, которые увеличивают рН.
- Обилие света: его количество напрямую влияет на скорость процесса фотосинтеза и, следовательно, на уровень рН.
Почему понижается?
- Искусственная подача в аквариум двуокиси углерода (CO2) для роста растений. Это соединение, попадая в воду, растворяется и образует углекислоту, увеличивает количество ионов водорода, что способствует понижению рН.
- Дыхание растений, рыб, бактерий способствует выделению в воду углекислого газа.
- Наличие коряг в емкости.
- Температура: вода, содержащаяся при повышенной температуре, способствует тому, что вода становится кислой.
- На снижения pH влияют процесс нитрификации, метанового брожения и окисления сульфидов.
Понятие о кислотности среды
Способом выражения концентрации ионов водорода в растворе является шкала рН («пэ-аш») – водородный показатель, выражающий кислотность среды. Он демонстрируют степень активности раствора за счёт концентрации в нём ионов H +. Шкала по модулю равна, а по знаку противоположна десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
pH = –lg
Так как логарифм концентрации иона водорода – это показатель молярной концентрации H +, рН равен экспоненте, умноженной на -1. Для воды 10-7 моль/л соответствует значению рН = 7. Данная нейтральная точка – баланс между H + и OH – по шкале рН. Это равновесие возникает в результате того, что диссоциация воды производит равные количества H + и OH –.
Обратите внимание, что, поскольку шкала рН логарифмическая, разница между соседними шкалами представляет собой 10-кратное изменение . Изменение уровня pH с 4 на 5 увеличит концентрацию ионов водорода в 10 раз.
В водных растворах величина рН обычно принимает значения от 0 до 14
Нейтральная среда характеризуется значением рН = 7, в щелочной среде рН больше 7, в кислой – меньше 7. Чем больше величина рН отличается от 7, тем более кислым или щелочным является раствор. Когда > говорят, что раствор является кислотным, а при > — основным.
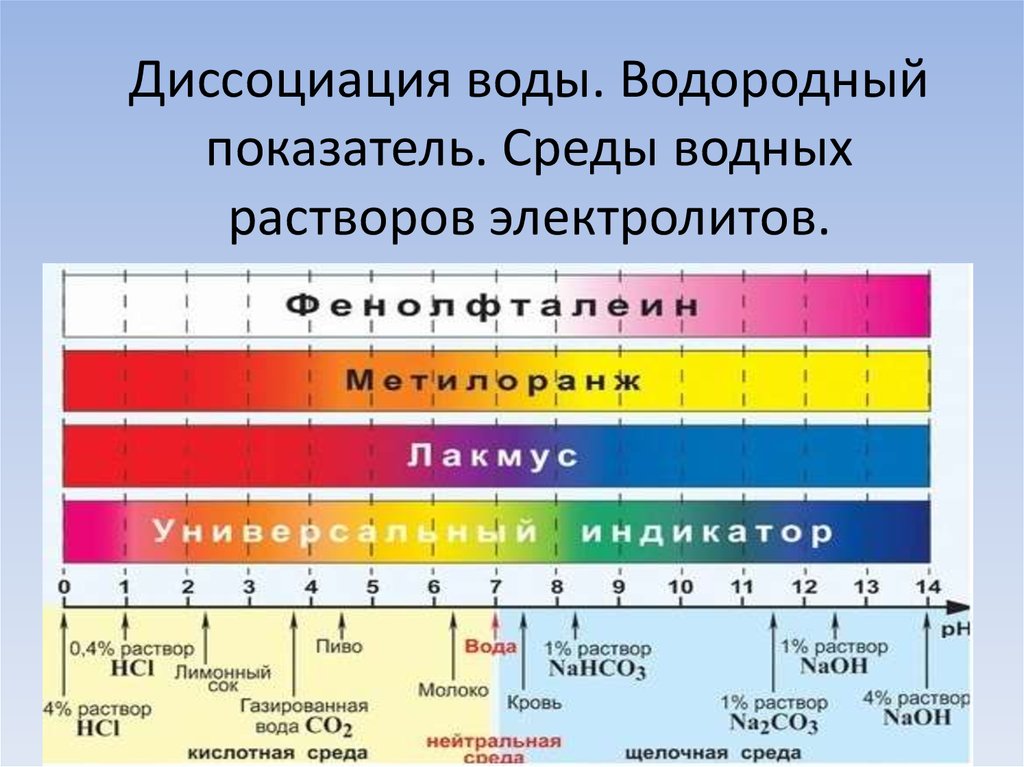
- Дождевая вода обычно имеет слабокислую реакцию среды (рН=6) за счёт растворения в ней углекислого газа.
- Дождь считается кислотным, если его рН<5.
- Желудочный сок — это сильнокислая среда (рН=1,7).
- рН крови (7,4).
- Слюны (6,9).
- Слез (7).

Разница между рКа и рН
Определение
рКа: рКа — отрицательное значение логарифмического числа Ка.
pH: pH — логарифмическая величина, обратная H+ концентрация.
Индикация кислотности
рКа: pKa указывает, является ли кислота сильной кислотой или слабой кислотой.
pH: pH показывает, является ли система кислотной или щелочной.
Подробности даны
рКа: рКа дает подробную информацию о диссоциации кислоты в водном растворе.
pH: pH дает подробную информацию о концентрации H+ ионы в системе.
Ценности
рКа: Если pKa кислоты высокое, это слабая кислота, а если pKa кислоты низкое, это сильная кислота.
pH: Если pH системы высокий, система является щелочной, но если pH низкий, эта система является кислой.
рКа: рКа зависит от концентрации кислоты, конъюгата основания и Н+.
pH: рН зависит от Н+ концентрация.
Заключение
Как pKa, так и pH являются очень важными параметрами в лабораторных условиях. Основное различие между pKa и pH заключается в том, что pKa указывает на диссоциацию кислоты, тогда как pH указывает на кислотность или щелочность системы.
pH шкала вещества
В
этом эксперименте вы сможете проверить
различные бытовые химикаты, используя
универсальный индикатор. Цель этого
проекта – познакомиться с понятием pH,
а также с химическими реакциями,
связанными с изменением цвета.
Ход эксперимента:
- Ознакомьтесь с инструкцией и таблицей цветов универсального индикатора. Все тестирования выполняйте в присутствии взрослого на кухне рядом с раковиной. В случае попадания любого вещества на кожу, смойте его немедленно.
- Соберите жидкую бытовую химию.
Найдите
на кухне:
- Уксус.
- Лимонный сок.
- Газированную воду.
- Нашатырный спирт.
- Средство для мытья посуды
Найдите
в ванной / аптечке:
- Отбеливатель.
-
Жидкие
стиральные порошки. -
Средство
для нейтрализации кислот.
Проверьте
другие химические вещества. Обязательно
спросите взрослого, безопасно ли
конкретное химическое вещество для
тестирования.
- Проверьте каждое из химических веществ. Следуйте инструкциям к вашему универсальному индикатору.
- Запишите цвет для каждого химического вещества.
- Какой pH показывает каждый цвет?
- Является ли химическое вещество кислотой или щелочью?
- Какова цель применения каждого тестируемого химического вещества?
- Как соотносится pH нейтральный, кислый или щелочной с целью применения вещества?
- Запишите полученные данные в таблице.
| Бытовая химия |
Цвет универсального индикатора |
pH | Кислота / щелочь? |
| Отбеливатель | Фиолетовый | 12 | Щелочь |
| Уксус | Красный | 2 | Кислота |
Вывод:
Какие
бывают кислые бытовые химикаты? Для
чего они используются? Какие бывают
щелочные бытовые химикаты? Для чего они
используются?
Поскольку
H + и OH очень реактивны, можно наблюдать
изменение цвета, когда определенные
химические вещества добавляются к
кислотам и щелочам. На этом строится
принцип работы универсальных индикаторов,
которые представляют собой смесь
химических веществ, реагирующих с ионами
H + и OH- и вызывающих изменение цвета.
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-осно́вного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-осно́вные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в осно́вной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы.
- Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в осно́вную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-осно́вное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Ацидоз
Легкая его форма обычно протекает бессимптомно и выявляется случайно при сопутствующих анализах крови.
При серьезной форме недуга проявляются следующие симптомы:
- Участившееся дыхание,
- Тошнота,
- Рвота,
- Быстрая утомляемость,
- Изжога.
Когда в организме высокий уровень кислотности, органы и ткани испытывают дефицит питания и кислорода, что ведет со временем к патологическим состояниям:
- Сбоям в работе сердечно-сосудистой системы
- Общей слабости,
- Нарушениям мочевыделительной системы,
- Опухолевым процессам,
- Болезненностям в мышцах и суставах,
- Ожирению,
- Развитию диабета,
- Снижению иммунитета.
Причинами устоявшегося ацидоза выступают:
- Сахарный диабет,
- Кислородное голодание,
- Испуг или шок, стрессовое состояние,
- Различные заболевания,
- Алкоголизм.
На заметку
• Помните, что измерение pH происходит не мгновенно. Для получения точных результатов дождитесь, когда значение на экране прибора стабилизируется.
• Измеряя растворы с разной кислотностью, между измерениями стряхивайте излишки жидкости с pH-метра.
• Помните, что стеклянная колба pH-метра — довольно хрупкая штука. Поэтому постарайтесь не ронять ваш pH-метр на пол и не ударять его о твёрдые поверхности (к примеру, об стенку контейнера).
• Чтобы продлить срок службы вашего pH-метра, измеряйте им только чистую воду и гидропонный раствор. Не используйте его для измерения каких-либо других жидкостей.
• По завершении измерений промойте электрод под струёй воды, налейте в защитный колпачок чистую воду и закрутите его на электроде.
…Продолжение тутВсе очерки раздела «Заметки балконного выращивателя»
Понравилась эта статья? Поделитесь ей в соцсетях: