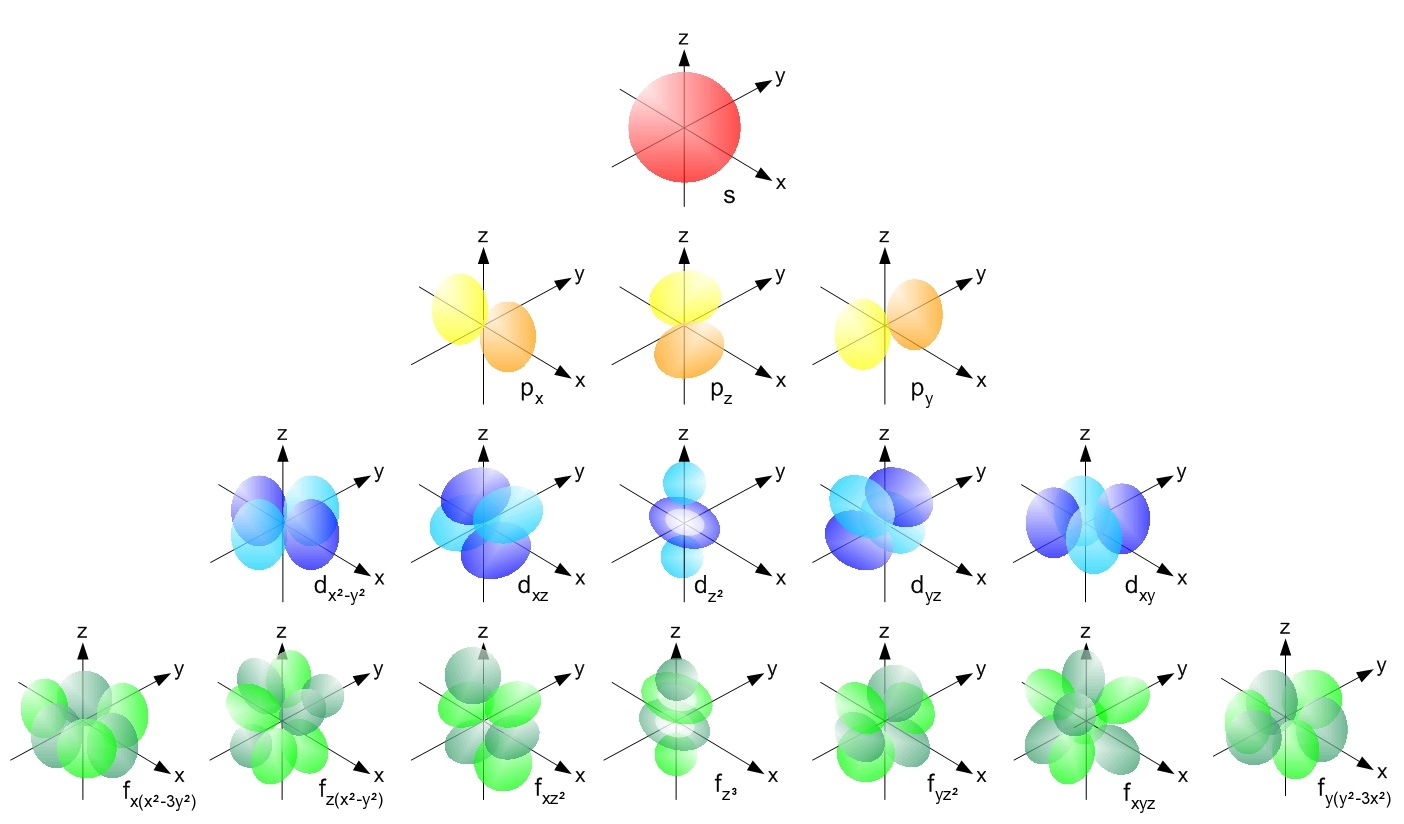
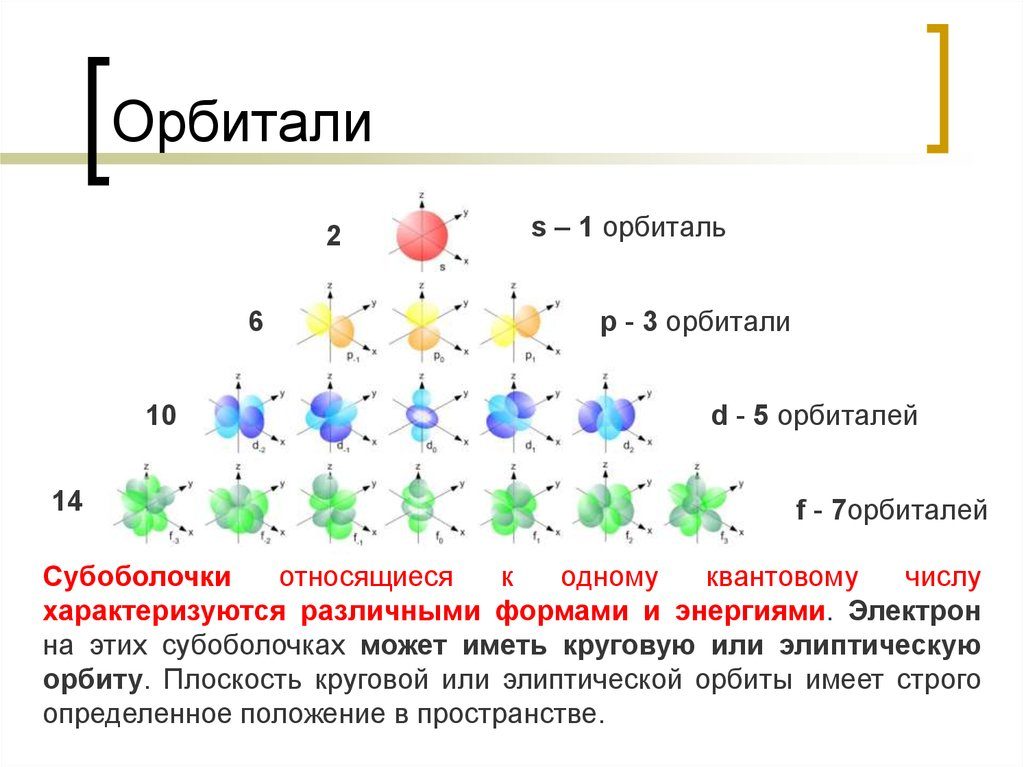
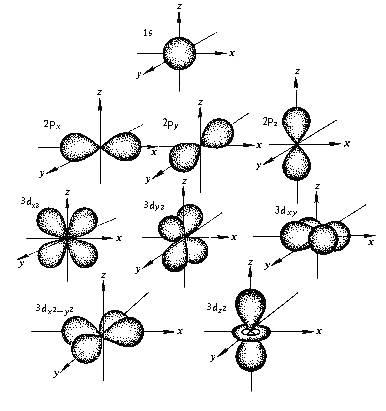
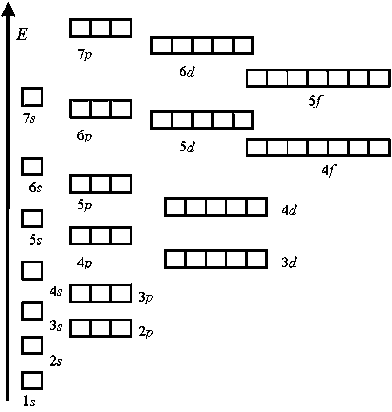
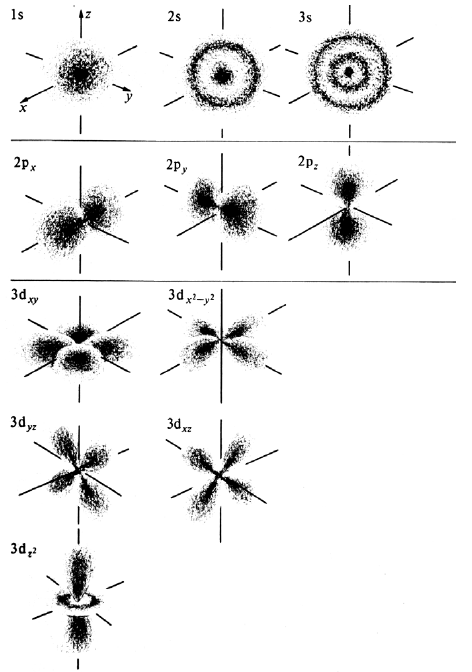
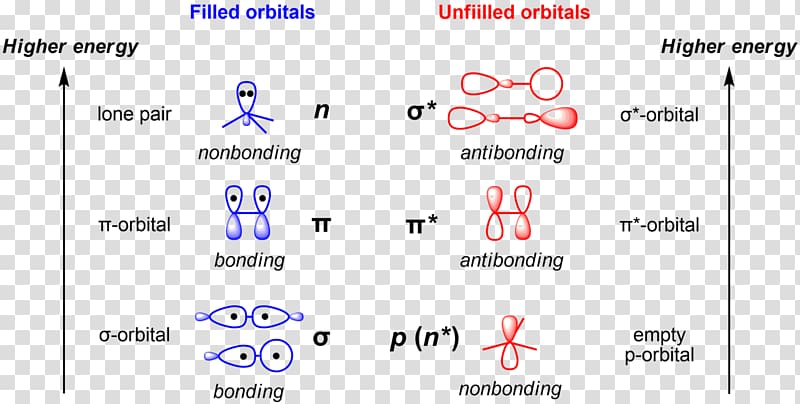
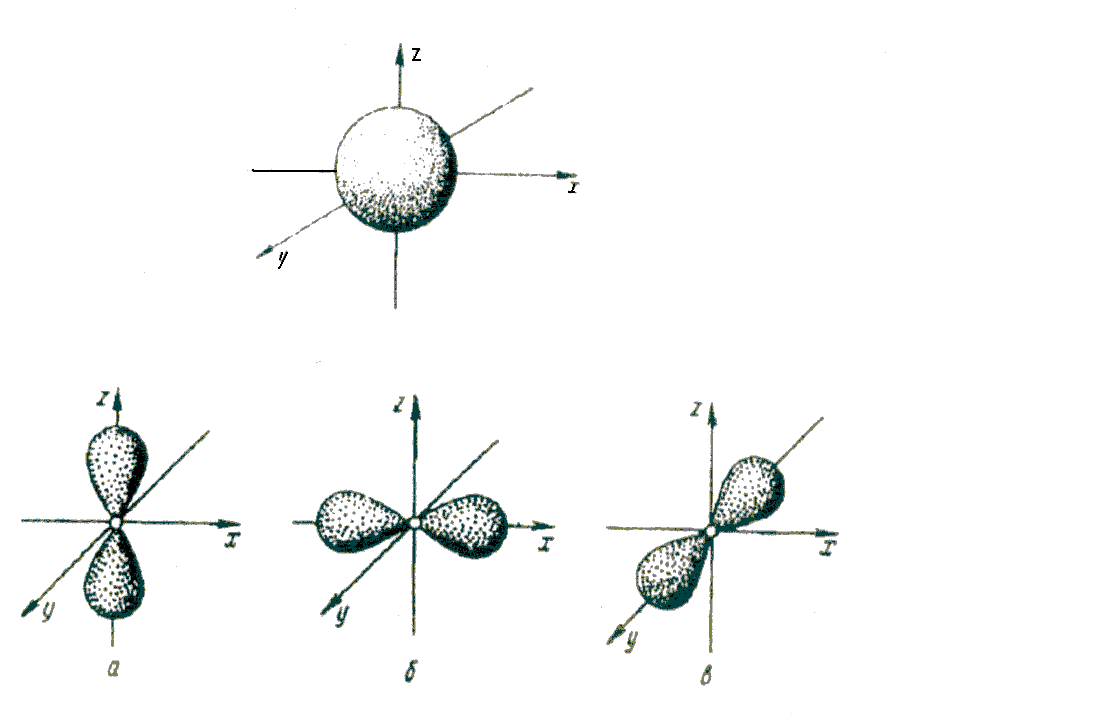Р-орбитали
Не все электроны населяют s-орбитали (на самом деле, очень немногие из них там находятся). На первом энергетическом уровне единственным доступным местом расположения для них является 1s, на втором добавляются 2s и 2p.
Орбитали этого типа скорее походят на 2 одинаковых воздушных шара, связаны друг с другом на ядре. На диаграмме показано поперечное сечение 3-мерной области пространства. Опять же, орбиталь показывает лишь область с 95-процентной вероятностью нахождения отдельного электрона.
Если представить себе горизонтальную плоскость, которая проходит через ядро таким образом, что одна частью орбиты будет находиться над плоскостью, а другая под ней, то существует нулевая вероятность нахождения электрона на этой плоскости. Так как же частица попадает из одной части в другую, если он никогда не сможет пройти через плоскость ядра? Это связано с ее волновой природой.
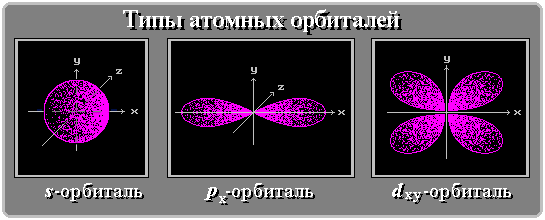
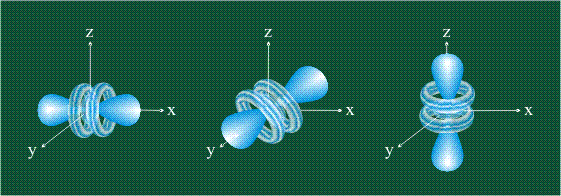
В отличие от s-, p-орбиталь имеет определенную направленность.
На любом энергетическом уровне можно иметь три абсолютно эквивалентные р-орбитали, расположенные под прямым углом друг к другу. Они произвольно обозначаются символами рх, ру и pz. Так принято для удобства – то, что подразумевается под направлениями X, Y или Z, постоянно изменяется, т. к. атом беспорядочно движется в пространстве.
Р-орбитали на втором энергетическом уровне называются 2рх, 2ру и 2pz. Есть подобные орбитали и на последующих – 3px, 3py, 3pz, 4px, 4py, 4pz и так далее.
Все уровни, за исключением первого, имеют р-орбитали. На более высоких «лепестки» вытянутее, с наиболее вероятным местом нахождения электрона на большем удалении от ядра.
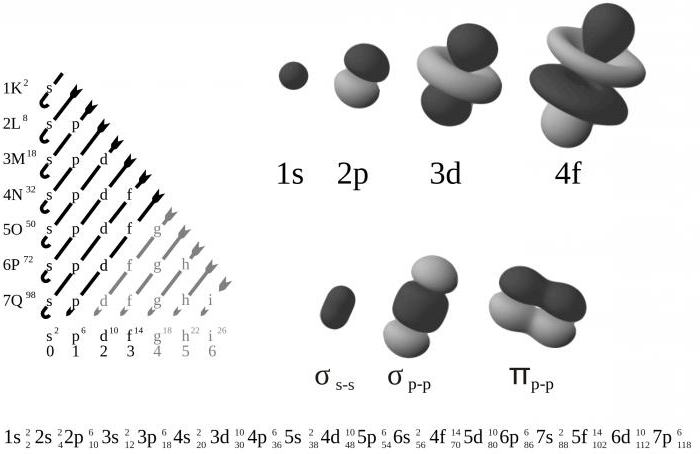
Атомные орбитали: принцип заполнения
Представляя себе переходы от одного атома к другому в периодической таблице химических элементов, можно установить электронную структуру следующего атома путем размещения дополнительной частицы в следующую доступную орбиталь.
Электроны, прежде чем заполнить более высокие энергетические уровни, занимают более низкие, расположенные ближе к ядру. Там, где есть выбор, они заполняют орбитали по отдельности.
Такой порядок заполнения известен под названием правила Хунда. Оно применяется только тогда, когда атомные орбитали обладают равными энергиями, а также помогает минимизировать отталкивание между электронами, что делает атом более стабильным.
Следует обратить внимание на то, что у s-орбитали энергия всегда немного меньше, чем у р на том же энергетическом уровне, поэтому первые всегда заполняются раньше последних. Что действительно странно, так это положение 3d-орбиталей
Они находятся на более высоком уровне, чем 4s, и поэтому 4s-орбитали заполняются первыми, а затем уже все 3d- и 4p-орбитали
Что действительно странно, так это положение 3d-орбиталей. Они находятся на более высоком уровне, чем 4s, и поэтому 4s-орбитали заполняются первыми, а затем уже все 3d- и 4p-орбитали.
Такая же путаница происходит и на более высоких уровнях с большим количеством переплетений между ними. Поэтому, например, атомные орбитали 4f не заполняются, пока не будут заняты все места на 6s.
Знание порядка заполнения имеет центральное значение для понимания того, как описывать электронные структуры.
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Михаил Левицкий
Квантовые числа и номенклатура орбиталей
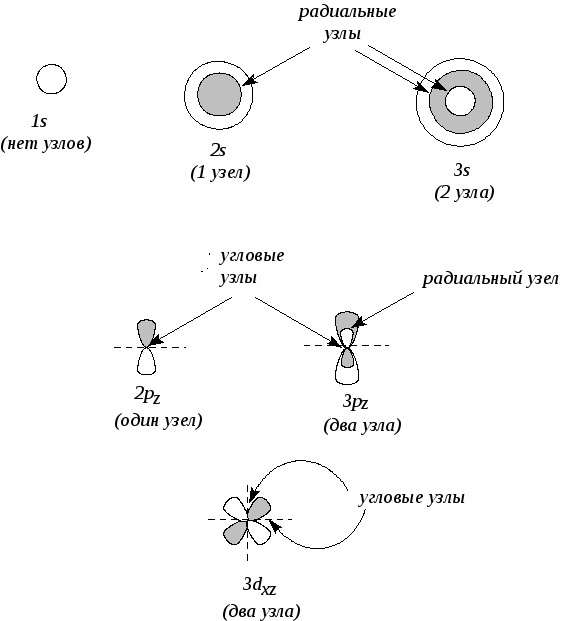
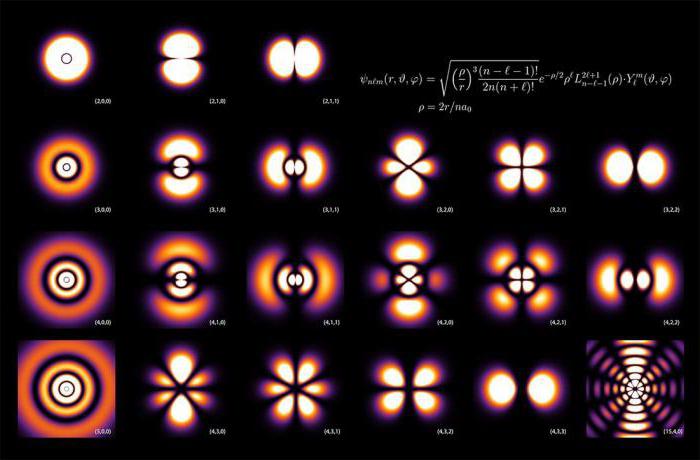
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
- E=−(12)me4n2ℏ2{\displaystyle E=-(1/2){\frac {me^{4}}{n^{2}{\hbar ^{2}}}}}
- Энергия для n соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1). Момент импульса при этом задаётся соотношением
- L=ℏl(l+1){\displaystyle L=\hbar {\sqrt {l(l+1)}}}
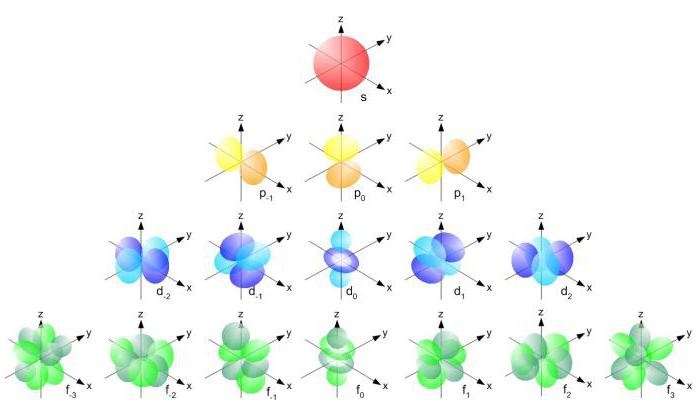
- Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
| Значение орбитального квантового числа | 1 | 2 | 3 | 4 | 5 | |
|---|---|---|---|---|---|---|
| Буквенное обозначение | s | p | d | f | g | h |
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах:
s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l):
- Mz=ℏml{\displaystyle M_{z}=\hbar m_{l}}
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу выше) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
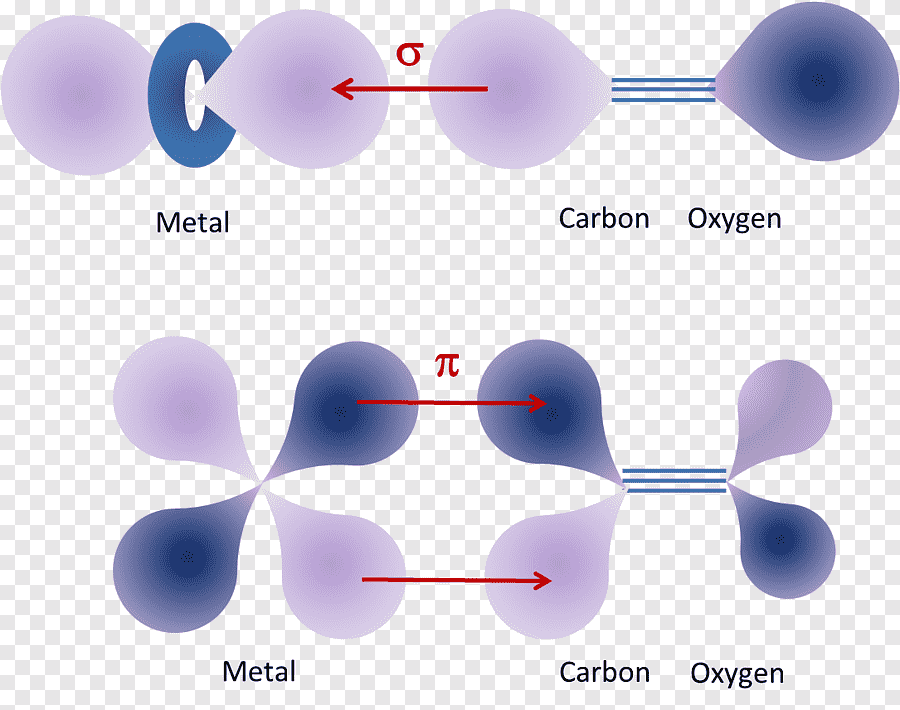
Участие орбиталей в образовании простых химических связей.
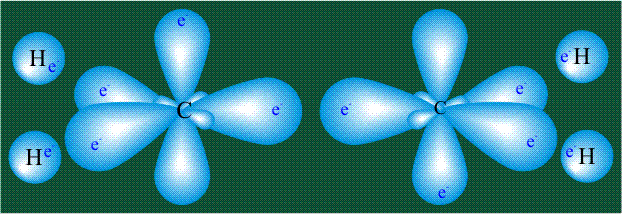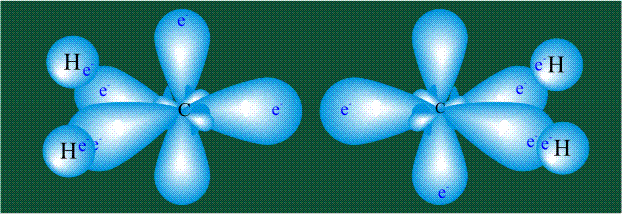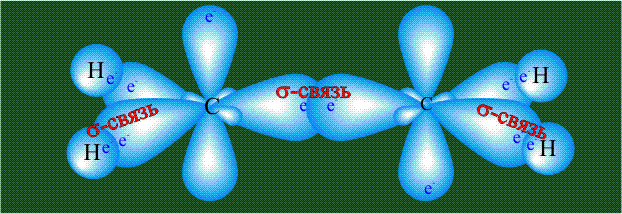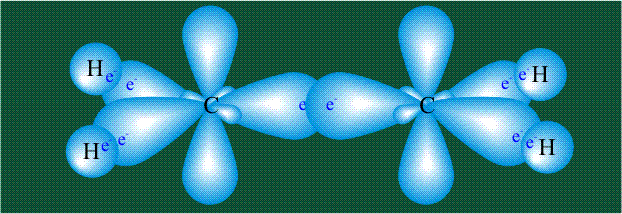
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
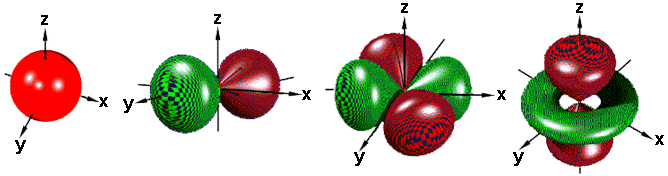
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
Гибридизация приводит лишь к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов(гибридных или обычных)приводит к образованию химической связи между ними. В данном случае (см. рисунок, помещенный ниже) максимальная электронная плотность располагается вдоль линии, связывающей два атома. Такую связь называют s-связью.

В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:

Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
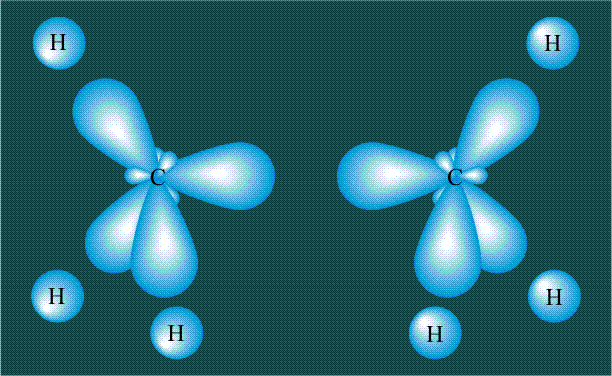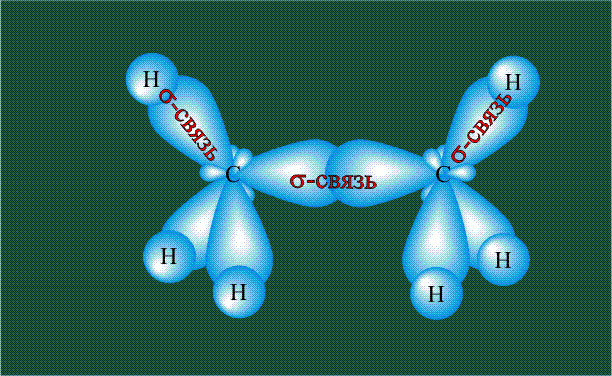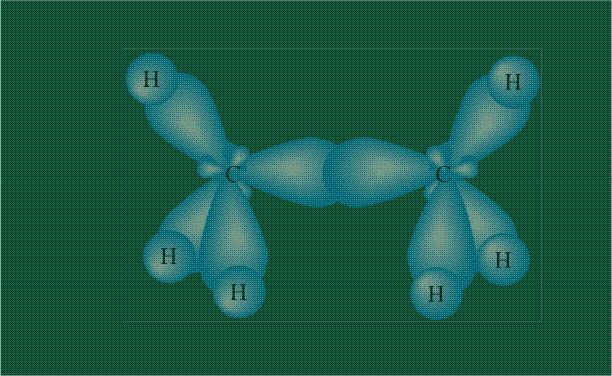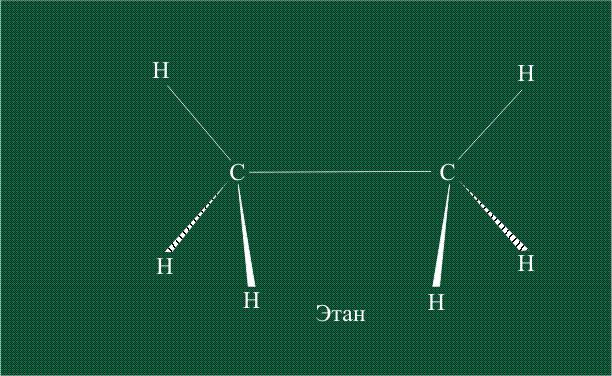
Геометрия молекулы этана напоминает метан, валентные углы 109°, что определяется пространственным расположением гибридных орбиталей углерода:

В словаре Словарь иностранных слов
ы, мн. орды, орд, ж.
1. В древности у тюркских кочевых народов: род государственного объединения (первонач. — стано-вище кочевых племен). Ордынский — относящийся к орде, ордам.
2. перен. Беспорядочное, неорганизованное скопище людей (обычно настроенных агрессивно или предпринимающих агрессивные действия). Целая о. хулиганов.
Орбитали высоких уровней.
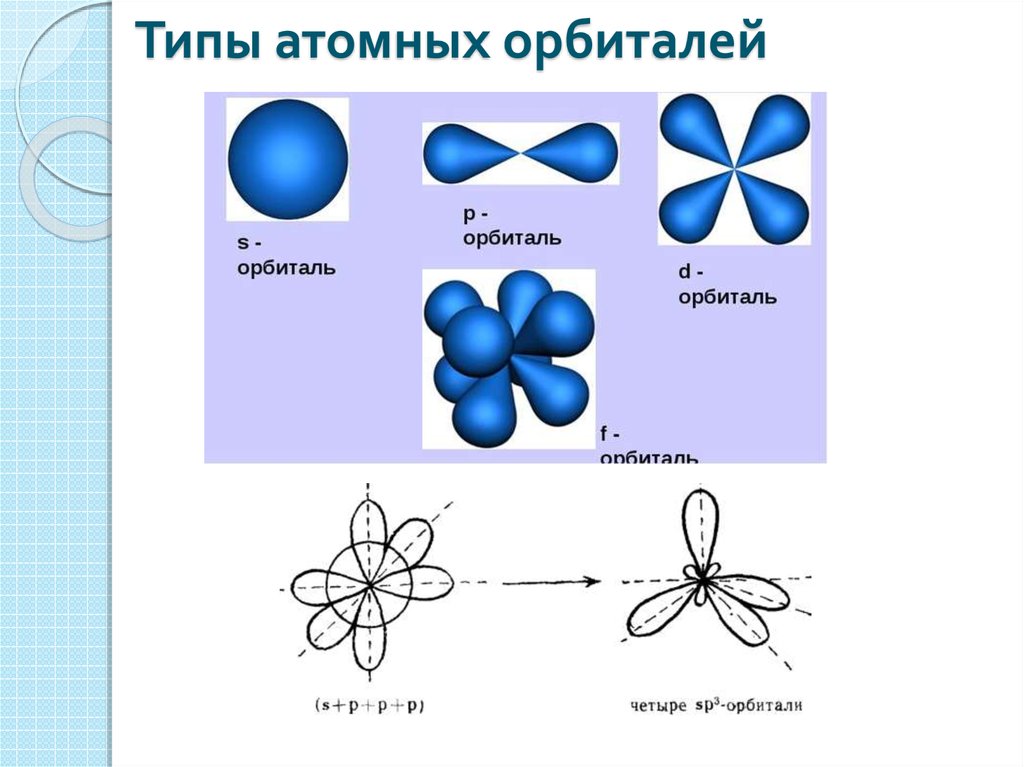
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:

d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Невозможность изображения орбит
Чтобы построить траекторию движения чего-то, нужно точно знать, где объект находится, и быть в состоянии установить, где он будет через мгновение. Для электрона это сделать невозможно.
Согласно принципу неопределенности Гейзенберга, нельзя точно знать, где частица находится в данный момент и где она окажется потом. (На самом деле принцип говорит о том, что невозможно определить одновременно и с абсолютной точностью ее момент и импульс).
Поэтому невозможно построить орбиту движения электрона вокруг ядра. Является ли это большой проблемой? Нет. Если что-то невозможно, это следует принять и найти способы обойти.

Геометрическое представление
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Форма и симметрия орбитали задаются орбитальными квантовыми числами l и m: s-орбитали являются сферически симметричными, p, d и f-орбитали имеют более сложную форму, определяемую угловыми частями волновой функции — угловыми функциями. Угловые функции Ylm (φ , θ) — собственные функции оператора квадрата углового момента L², зависящие от квантовых чисел l и m (см. Сферические функции), являются комплексными и описывают в сферических координатах (φ , θ) угловую зависимость вероятности нахождения электрона в центральном поле атома. Линейная комбинация этих функций определяет положение орбиталей относительно декартовых осей координат.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 | |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 2е | ±1{\displaystyle \pm 1} | ±1{\displaystyle \pm 1} | ±1{\displaystyle \pm 1} | ±2{\displaystyle \pm 2} | ±2{\displaystyle \pm 2} | |||
| Линейная комбинация | −{\displaystyle -} | −{\displaystyle -} | 1i2(Y11−Y1−1){\displaystyle {{1 \over {i{\sqrt {2}}}}(Y_{11}-Y_{1-1})}} | 12(Y11+Y1−1){\displaystyle {{1 \over {\sqrt {2}}}(Y_{11}+Y_{1-1})}} | −{\displaystyle -} | 12(Y21+Y2−1){\displaystyle {{1 \over {\sqrt {2}}}(Y_{21}+Y_{2-1})}} | 1i2(Y21−Y2−1){\displaystyle {{1 \over {i{\sqrt {2}}}}(Y_{21}-Y_{2-1})}} | 12(Y22+Y2−2){\displaystyle {{1 \over {\sqrt {2}}}(Y_{22}+Y_{2-2})}} | 1i2(Y22−Y2−2){\displaystyle {{1 \over {i{\sqrt {2}}}}(Y_{22}-Y_{2-2})}} |
| Обозначение | s{\displaystyle s} | pz{\displaystyle p_{z}} | py{\displaystyle p_{y}} | px{\displaystyle p_{x}} | dz2{\displaystyle d_{z^{2}}} | dxz{\displaystyle d_{xz}} | dyz{\displaystyle d_{yz}} | dx2−y2{\displaystyle d_{x^{2}-y^{2}}} | dxy{\displaystyle d_{xy}} |
Дополнительным фактором, иногда учитываемым в геометрическом представлении, является знак волновой функции (фаза). Этот фактор существеннен для орбиталей с орбитальным квантовым числом l, отличным от нуля, то есть не обладающих сферической симметрией: знак волновой функции их «лепестков», лежащих по разные стороны узловой плоскости, противоположен. Знак волновой функции учитывается в методе молекулярных орбиталей МО ЛКАО (молекулярные орбитали как линейная комбинация атомных орбиталей).
Сегодня науке известны математические уравнения, описывающие геометрические фигуры, представляющие орбитали (зависимости координаты электрона от времени). Это уравнения гармонических колебаний отражающие вращение частиц по всем доступным степеням свободы — орбитальное вращение, спин,… Гибридизация орбиталей представляется как интерференция колебаний.
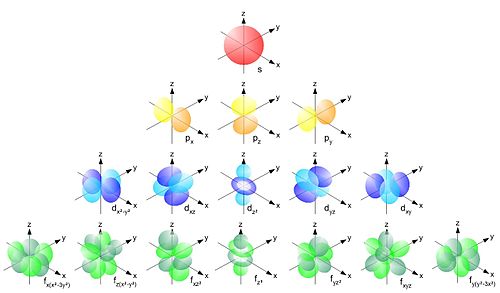
Форма и расположение в пространстве s-, p-, d— и f-орбиталей.
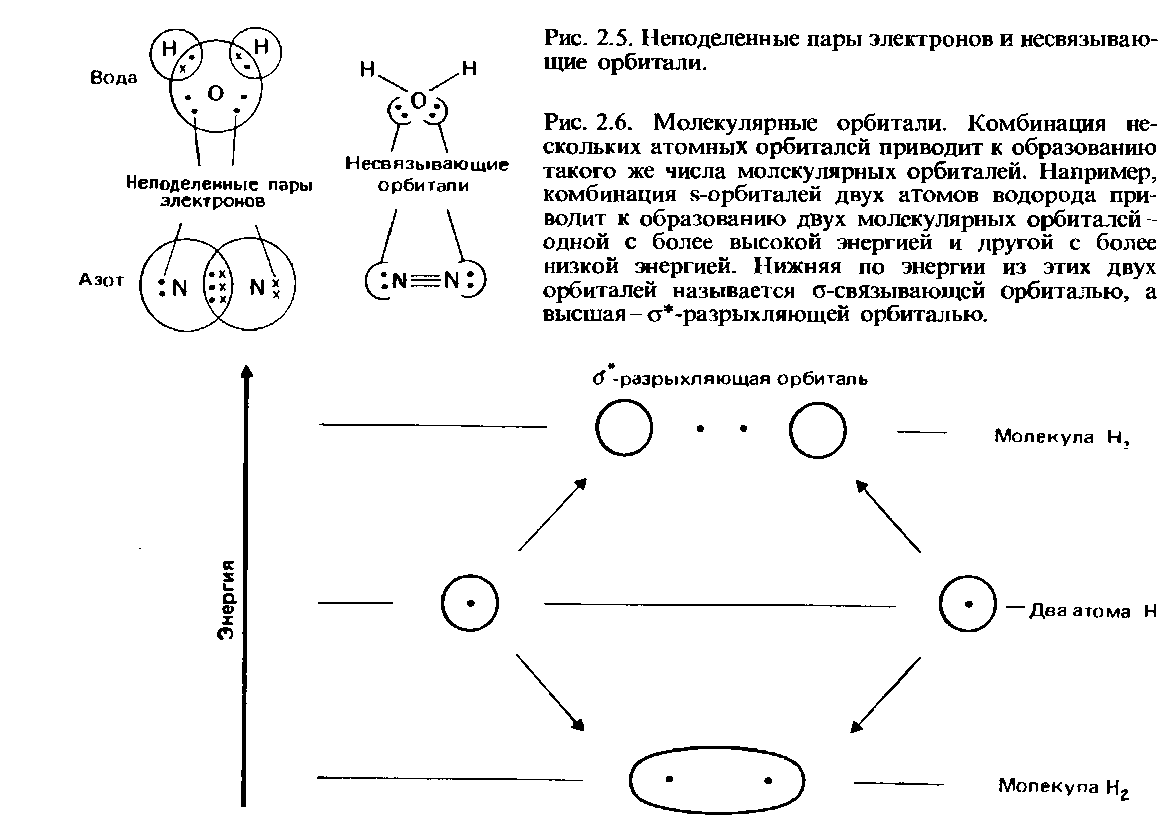
Обзор
Молекулярная орбиталь (МО) может использоваться для представления областей в молекуле, где , вероятно, будет обнаружен электрон, занимающий эту орбиталь. Молекулярные орбитали — это приближенные решения уравнения Шредингера для электронов в электрическом поле атомных ядер молекулы . Однако вычисление орбиталей непосредственно из этого уравнения — слишком сложная задача. Вместо этого они получены из комбинации атомных орбиталей, которые предсказывают местонахождение электрона в атоме. Молекулярная орбиталь может определять электронную конфигурацию молекулы: пространственное распределение и энергию одного (или одной пары) электронов. Чаще всего МО представляет собой линейную комбинацию атомных орбиталей (метод ЛКАО-МО), особенно при качественном или очень приближенном использовании. Они неоценимы, поскольку предоставляют простую модель связи в молекулах, понятную с помощью теории молекулярных орбиталей . Большинство современных методов вычислительной химии начинаются с расчета МО системы. Молекулярная орбиталь описывает поведение одного электрона в электрическом поле, создаваемом ядрами, и некоторое среднее распределение других электронов. В случае двух электронов, находящихся на одной орбитали, принцип Паули требует, чтобы у них был противоположный спин. Обязательно это приближение, и высокоточные описания молекулярной электронной волновой функции не имеют орбиталей (см. Взаимодействие конфигурации ).
Молекулярные орбитали, как правило, делокализованы по всей молекуле. Более того, если молекула имеет элементы симметрии, ее невырожденные молекулярные орбитали либо симметричны, либо антисимметричны по отношению к любой из этих симметрий. Другими словами, применение операции симметрии S (например, отражение, вращение или инверсия) к молекулярной орбитали ψ приводит к тому, что молекулярная орбиталь остается неизменной или меняет ее математический знак на противоположный : S ψ = ± ψ. В планарных молекулах, например, молекулярные орбитали либо симметричны ( сигма ), либо антисимметричны ( пи ) относительно отражения в плоскости молекулы. Если также рассматривать молекулы с вырожденными орбитальными энергиями, то справедливо более общее утверждение, что молекулярные орбитали образуют основы для неприводимых представлений группы симметрии молекулы . Свойства симметрии молекулярных орбиталей означают, что делокализация является неотъемлемой чертой теории молекулярных орбиталей и делает ее фундаментально отличной от теории валентных связей (и дополняя ее) , в которой связи рассматриваются как локализованные электронные пары с учетом резонанса для учета делокализации. .
В отличие от этих адаптированных к симметрии канонических молекулярных орбиталей, локализованные молекулярные орбитали могут быть сформированы путем применения определенных математических преобразований к каноническим орбиталям. Преимущество этого подхода заключается в том, что орбитали будут более точно соответствовать «связям» молекулы, как показано структурой Льюиса. Недостатком является то, что уровни энергии этих локализованных орбиталей больше не имеют физического смысла. (Обсуждение в остальной части этой статьи будет сосредоточено на канонических молекулярных орбиталей Для дальнейшего обсуждения локализованных молекулярных орбиталей, см. Естественная связь орбитальный и сигма-пи и эквивалентной орбитальные модели .)
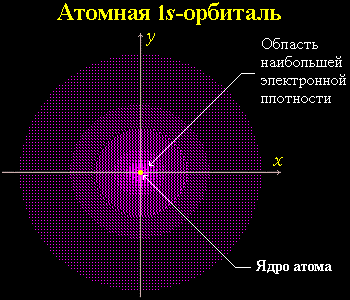
Электрон водорода – 1s-орбиталь
Предположим, имеется один атом водорода и в определенный момент времени графически запечатлевается положение одного электрона. Вскоре после этого, процедура повторяется, и наблюдатель обнаруживает, что частица находится в новом положении. Как она из первого места попала во второе, неизвестно.
Если продолжать действовать таким образом, то постепенно сформируется своего рода 3D-карта мест вероятного нахождения частицы.
В случае атома водорода электрон может находиться в любом месте в пределах сферического пространства, окружающего ядро. На диаграмме показано поперечное сечение этого сферического пространства.
95 % времени (или любой другой процент, так как стопроцентную уверенность могут обеспечить лишь размеры Вселенной) электрон будет находиться в пределах довольно легко определяемой области пространства, достаточно близкой к ядру. Такой участок называется орбиталью. Атомные орбитали – это области пространства, в которых существует электрон.
Что он там делает? Мы не знаем, не можем знать и поэтому просто игнорируем эту проблему! Мы можем сказать лишь, что если электрон находится на конкретной орбитали, то он будет обладать определенной энергией.
Каждая орбиталь имеет название.
Пространство, занимаемое электроном водорода, называется 1s-орбиталью. Единица здесь обозначает то, что частица находится на ближайшем к ядру энергетическом уровне. S говорит о форме орбиты. S-орбитали сферически симметричны относительно ядра – по крайней мере, как полый шар из довольно плотного материала с ядром в его центре.
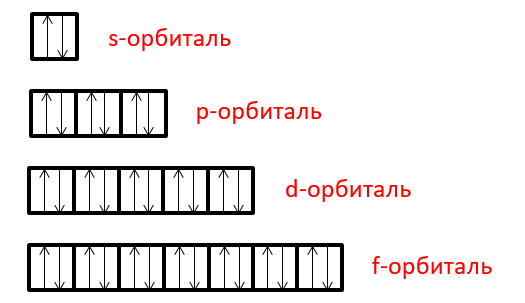
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Квантовые числа и номенклатура орбиталей
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
- E=−(12)me4n2ℏ2{\displaystyle E=-(1/2){\frac {me^{4}}{n^{2}{\hbar ^{2}}}}}
- Энергия для n соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1). Момент импульса при этом задаётся соотношением
- L=ℏl(l+1){\displaystyle L=\hbar {\sqrt {l(l+1)}}}
- Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
| Значение орбитального квантового числа | 1 | 2 | 3 | 4 | 5 | |
|---|---|---|---|---|---|---|
| Буквенное обозначение | s | p | d | f | g | h |
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах:
s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l):
- Mz=ℏml{\displaystyle M_{z}=\hbar m_{l}}
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу выше) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Участие орбиталей в образовании кратных химических связей.
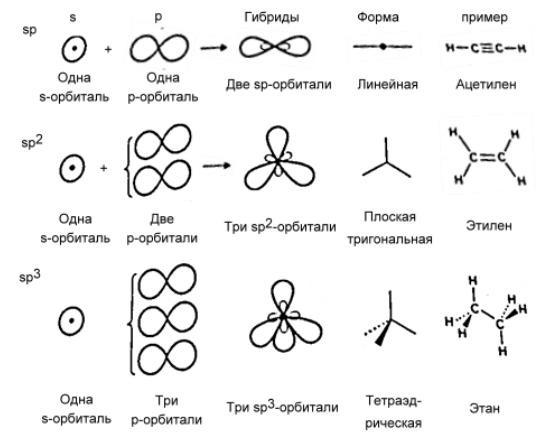
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z,в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Два атома углерода присоединяют четыре атома водорода, а также соединяются между собой, образуя s-связь С-С:
Две орбитали pz, не участвовавшие в гибридизации, взаимоперекрываются, их геометрия такова, что перекрывание происходит не по линии связи С-С, а выше и ниже ее. В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона (отмечены синим и красным цветом), участвующие в образовании этой связи. Таким образом, образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют p-связью:
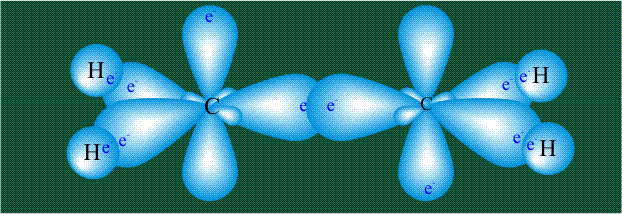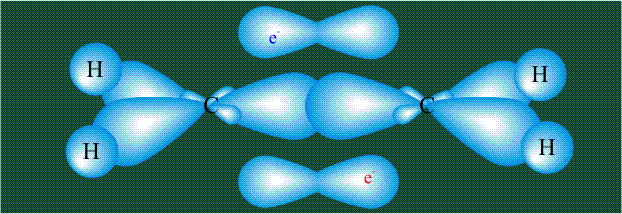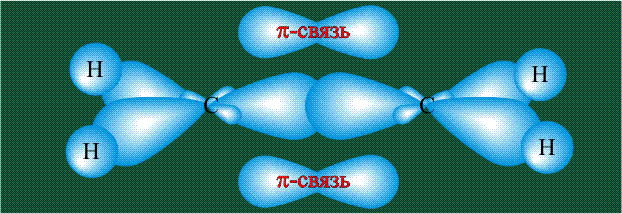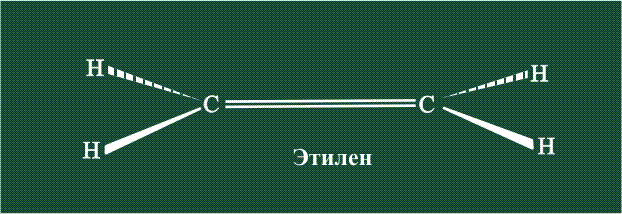
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
Взаимоперекрывание орбиталей-гибридов друг с другом и с орбиталями атомов водорода приводит к образованию s-связей С-С и С-Н, изображаемых с помощью простой валентной черты:

Две пары оставшихся орбиталей pyи pz взаимоперекрываются. На рисунке, приведенном ниже, цветными стрелками показано, что из чисто пространственных соображений наиболее вероятно перекрывание орбиталей с одинаковыми индексами х-х и у-у. В результате образуются две p-связи, окружающие простую s-связь С-С:

В итоге молекула ацетилена имеет палочкообразную форму:
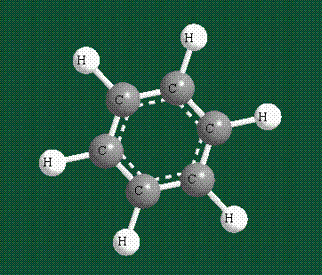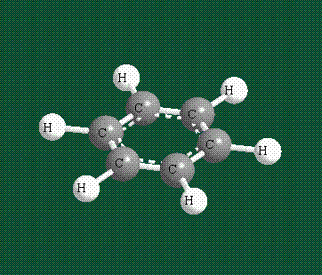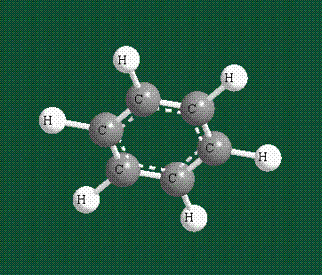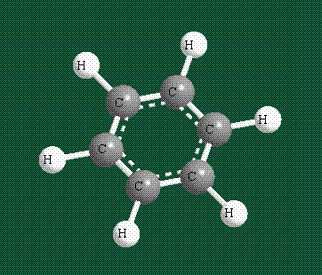
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s— и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
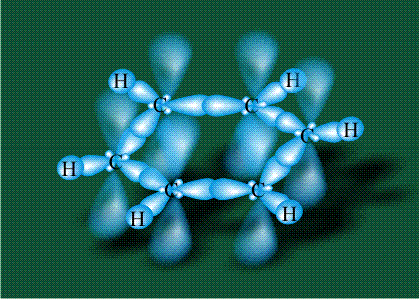
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
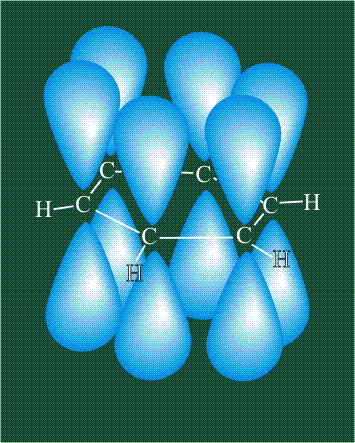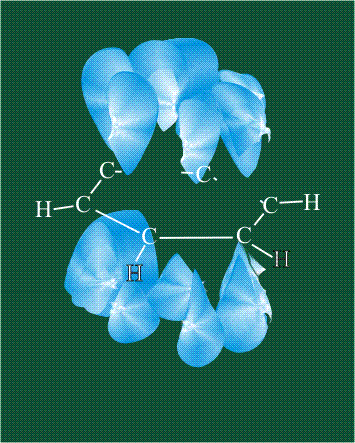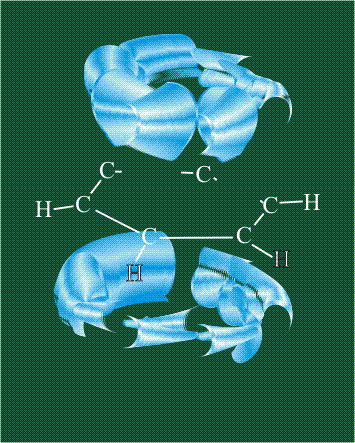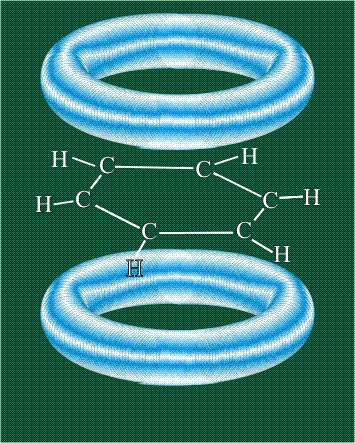
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
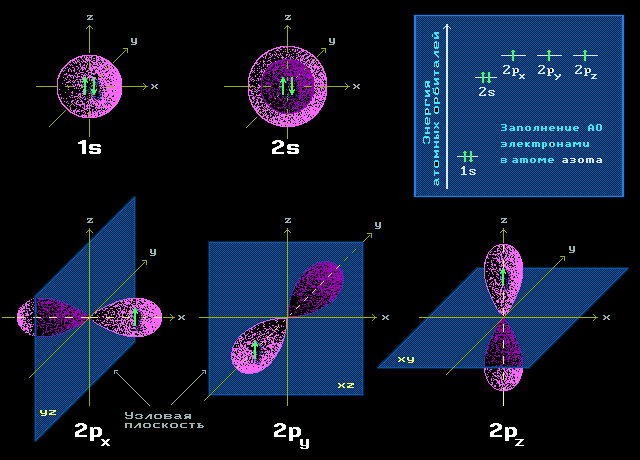
2s
Следующая орбиталь – 2s. Она похожа на 1s, за исключением того, что область наиболее вероятного нахождения электрона расположена дальше от ядра. Это орбиталь второго энергетического уровня.
Если присмотреться внимательно, то можно заметить, что ближе к ядру есть еще один регион несколько более высокой плотности электрона («плотность» является еще одним способом обозначения вероятности того, что эта частица присутствует в определенном месте).
2s-электроны (и 3s, 4s и т. д.) проводят часть своего времени намного ближе к центру атома, чем можно было бы ожидать. Результатом этого является небольшое снижение их энергии на s-орбиталях. Чем ближе электроны приближаются к ядру, тем меньше становится их энергия.
3s-, 4s-орбитали (и т. д.) располагаются все дальше от центра атома.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Формирование молекулярных орбиталей
Молекулярные орбитали возникают из разрешенных взаимодействий между атомными орбиталями , которые разрешены, если симметрии (определенные из теории групп ) атомных орбиталей совместимы друг с другом. Эффективность атомных орбитальных взаимодействий определяется из перекрытия (мера того, насколько хорошо две орбитали конструктивно взаимодействуют друг с другом) между двумя атомными орбиталями, что имеет значение, если атомные орбитали близки по энергии. Наконец, количество образованных молекулярных орбиталей должно быть равно количеству атомных орбиталей в атомах, которые объединяются, чтобы сформировать молекулу.
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Квантовые числа и номенклатура орбиталей
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l.
Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
- E=−(12)me4n2ℏ2{\displaystyle E=-(1/2){\frac {me^{4}}{n^{2}{\hbar ^{2}}}}}
- Энергия для n соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1). Момент импульса при этом задаётся соотношением
- L=ℏl(l+1){\displaystyle L=\hbar {\sqrt {l(l+1)}}}
- Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
| Значение орбитального квантового числа | 1 | 2 | 3 | 4 | 5 | |
|---|---|---|---|---|---|---|
| Буквенное обозначение | s | p | d | f | g | h |
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах:
s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l, включая 0 (ml = -l … 0 … l):
- Mz=ℏml{\displaystyle M_{z}=\hbar m_{l}}
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу выше) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Гибридизация.
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях: