Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твердый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удаленных мест.
Топливо
Водород используют в качестве ракетного топлива. Ввиду крайне узкого диапазона температур (менее 7 кельвинов), при котором водород остается жидкостью, на практике чаще используется смесь жидкой и твёрдой фаз (шугообразный водород).
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей, хотя здесь серьезную проблему представляет водородное охрупчивание сталей, не позволяющее напрямую переводить обычный ДВС на этот газ. Водород в ДВС меньше загрязняет окружающую среду локально (использование водорода в этом качестве затрудняет низкая эффективность его получения и сопряжённых дополнительных расходов на его сжатие, транспортировку), но так же, как и бензиновые/дизельные аналоги, потребляет и деградирует моторное масло и все остальные неэкологичные материалы, присущие двигателям внутреннего сгорания. В смысле экологии электромобили значительно лучше, перспективен также двигатель Стирлинга.[источник не указан 2116 дней]
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.
Как получить металлический водород?
На сегодняшний день единственным доступным способом получения металлического водорода является использование специальных алмазных наковален, где атомы водорода сжимаются и охлаждаются до тех пор, пока не изменят свое состояние. Почти 80 лет ученые пытаются превратить газообразный водород в металл — и вот у них получилось. Для этого они применили к нему давление, которое больше, чем в ядре Земли.
Публикации о подобных результатах уже появлялись раньше, однако еще ни одна группа ученых не смогла их подтвердить. Например, в 2011 сообщалось, о том, что ученые смогли «сжать» водород до нужного состояния с помощью давления выше 220 ГПа (гигапаскалей), что более чем в 2 миллиона раз больше атмосферного, которое составляет 100 кПа (килопаскалей). В 2017 году другая группа ученых заявляла о том, что им удалось достичь давления уже 495 ГПа. Кстати, тогда основную часть экспериментов они провести не успели. Единственный полученный образец металлического водорода был утерян после того, как одна из алмазных наковален рассыпалась в пыль во время попытки измерить давление. Что стало с образцом – непонятно. Может он затерялся среди алмазных частиц, может превратился обратно в газ. Почитать подробнее об этой неудаче можно здесь можно здесь.
Французские учены учли предыдущий опыт и ошибки своих коллег, а также свои предыдущие исследования и все-таки добились нужного результата. Удалось это благодаря двум открытиям. Во-первых, они изменили конструкцию алмазной наковальни, сделав вершины алмазных наконечников не плоскими, а тороидальными, с углублением в виде бублика. Такое изменение позволило увеличить максимальный предел давления с 400 Гпа до 600 ГПа.

Наконечник улучшенной алмазной наковальни. Диаметр кольцевых трещин составляет около 150 микрон (чуть больше толщины человеческого волоса)
Во-вторых, они создали новый тип специального инфракрасного спектрометра – инструмента, позволяющего проводить измерения образца водорода.
При эксперименте ученые начали сжимать в алмазной наковальне образец водорода и одновременно охлаждать. Когда давление достигло 425 ГПа, а температура стала -193 градусов по Цельсию, водород начал поглощать инфракрасное излучение спектрометра. Это стало свидетельством перехода водорода в другое, твердое состояние.
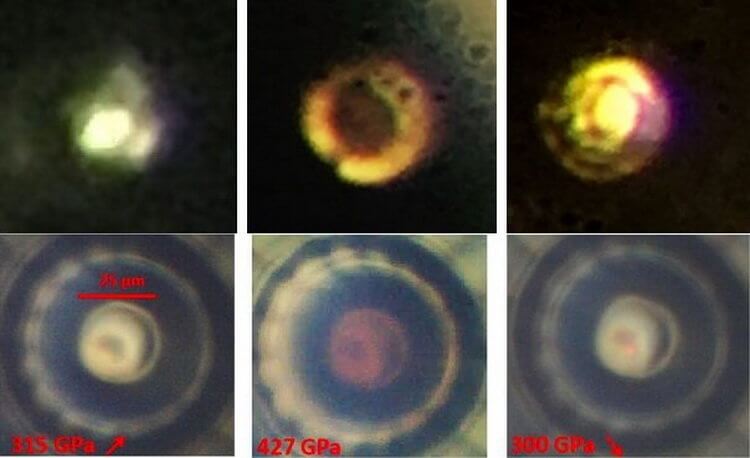
Изображение переходных фаз водорода при эксперименте 2017 года (сверху) и смена фаз при различных значениях давления – 315, 427 и 300 ГПа – при эксперименте французских ученых. Во втором случае видно, что образец водорода стал непрозрачным
Заявление французских ученых было воспринято с недоверием, в основной потому, что предыдущие утверждения об успешном создании металлического водорода оказывались ошибочными, не соответствовали действительности или просто были недоказуемыми.
Тем не менее, уже сейчас многие говорят, что группа французских физиков может получить Нобелевскую премию за свое открытие — самую престижную премию в науке.
Что думаете по этому поводу? Согласны, что это Нобелевка? Поделиться мнением можно в нашем Telegram-чате.
Участие водорода в термоядерной реакции
Изотопы водорода дейтерий и тритий являются источниками невероятно мощной энергии, высвобождающейся в процессе термоядерной реакции.

Фото 6. Термоядерный взрыв без водорода был бы невозможен
Такая реакция возможна при температуре не ниже 1060 °C и протекают очень быстро – в течение нескольких секунд.
На Солнце термоядерные реакции протекают медленно.
Задача ученых – понять, почему так происходит, чтобы использовать полученные знания для создания новых – практически неисчерпаемых – источников энергии.
Что такое водород (видео):
>
Свойства материала
Железо обычно встречаются в земной «ы коры в виде руды , как правило , оксид железа, таких как магнетит , гематит и т.д. Железо выплавляли из железной руды с помощью ряда химических процессов. Один из таких процессов, известный как водородный обжиг , чаще применяется к таким металлам, как вольфрам и молибден , но может использоваться для производства сплавов железа с водородом.
В узком диапазоне смесей водорода и железа, которые образуют гидрид железа при атмосферном давлении, может образовываться небольшое количество различных металлургических структур с различными свойствами. При комнатной температуре наиболее стабильной формой чистого железа является объемно-центрированная кубическая (ОЦК) структура, называемая альфа-железом или альфа-железом. Это довольно мягкий металл, который может растворять только очень небольшую концентрацию водорода, не более 2 частей на миллион при 25 ° C (77 ° F) и 3,6 частей на миллион при 912 ° C (1674 ° F). Включение водорода в альфа-железо называется ферритным гидридом железа. При температуре 910 ° C (1670 ° F) чистое железо превращается в гранецентрированную кубическую структуру (ГЦК), называемую гамма-железом или γ-железом. Включение водорода в гамма-железо называется аустенитным гидридом железа. Более открытая структура ГЦК аустенитного железа может растворять несколько больше водорода, вплоть до 9,0 ppm водорода при 1394 ° C (2541 ° F). При этой температуре железо превращается в другую структуру ОЦК, называемую дельта-железом или δ-железом. Он может растворять еще больше водорода, до 13 ppm водорода при 1538 ° C (2800 ° F), что отражает верхнее содержание водорода в гидриде железа. Когда водород выходит из раствора с железом, он превращается в элементарный водород ( H2).
Когда гидриды железа с более чем 2 ppm водорода охлаждаются, водород больше не входит в кристаллические структуры, что приводит к избытку водорода. Способ выхода водорода из кристаллических фаз заключается в его выпадении в осадок из раствора в виде элементарного водорода , оставляющего после себя окружающую фазу ОЦК-железа, называемую ферритом, с небольшой долей водорода в растворе. В перенасыщенном составе (более 2 частей на миллион водорода) водород будет выпадать в осадок в виде крупных включений элементарного водорода на границах зерен до тех пор, пока доля водорода в зернах не уменьшится до насыщенного состава (2 частей на миллион). Вышесказанное предполагает, что процесс охлаждения идет очень медленно, что дает водороду достаточно времени для миграции. По мере увеличения скорости охлаждения у водорода будет меньше времени на миграцию с образованием элементарного водорода на границах зерен; следовательно, элементарный водород более широко диспергирован и действует, предотвращая скольжение дефектов внутри этих зерен, что приводит к упрочнению гидрида железа. При очень высоких скоростях охлаждения, производимых закалкой, водород не успевает мигрировать, но блокируется в кристаллической структуре и образует мартенсный гидрид железа. Мартенсный гидрид железа — это сильно деформированная и напряженная, пересыщенная форма водорода и железа, чрезвычайно твердая, но хрупкая.
Термическая обработка
Существует множество способов термической обработки сплава с гидридом железа. Наиболее распространены отжиг , закалка и отпуск . Термическая обработка эффективна для композиций, превышающих насыщенную композицию, состоящую из 2 частей на миллион водорода, что способствует предотвращению водородной хрупкости . Ненасыщенный гидрид железа не подвергается термической обработке.
Отжиг — это процесс нагрева сплава железа с водородом до достаточно высокой температуры для снятия локальных внутренних напряжений. Он не способствует общему размягчению продукта, а лишь локально снимает напряжения и напряжения, заключенные внутри материала. Отжиг проходит в три фазы: восстановление , рекристаллизация и рост зерен . Температура, необходимая для отжига конкретного гидрида железа, зависит от типа отжига, который должен быть достигнут, и легирующих компонентов.
Закалка включает нагрев железо-водородного сплава для создания другой фазы, а затем закалку в воде или масле. Это быстрое охлаждение приводит к твердой, но хрупкой мартенситной структуре. Затем железо-водородный сплав подвергается отпуску, который является всего лишь специализированным типом отжига, для уменьшения хрупкости. В этом случае процесс отжига (отпуска) преобразует часть растворенного водорода в элементарный водород и, следовательно, снижает внутренние напряжения и дефекты. В результате получается более пластичный и устойчивый к разрушению сплав железа с водородом.
История исследований
В 1930-х годах британский ученый Джон Бернал предположил, что атомарный водород, состоящий из одного протона и одного электрона и представляющий собой полный аналог щелочных металлов, может оказаться стабильным при высоких давлениях. В 1935 году Юджин Вигнер и Xиллард Белл Хантингтон провели соответствующие расчёты. Гипотеза Бернала нашла подтверждение — согласно полученным расчётам, молекулярный водород переходит в атомарную металлическую фазу при давлении около 250 тыс. атмосфер (25 ГПа) со значительным увеличением плотности. В дальнейшем оценка давления, требуемого для фазового перехода, была повышена, но условия перехода всё же считаются потенциально достижимыми. Предсказание свойств металлического водорода ведётся теоретически. Попытки получения, начатые в 1970-х годах, привели к сообщениям о возможном получении металлического водорода в 1996, 2008 и 2011 году, пока, наконец, в 2017 году профессор Айзек Сильвера и его коллега Ранга Диас не добились получения стабильного образца при давлении 5 млн атмосфер, однако камера, где хранился образец, под давлением разрушилась, и образец был потерян.
Связь с другими областями физики
- Астрофизика
Считается, что большие количества металлического водорода присутствуют в ядрах планет-гигантов — Юпитера, Сатурна — и крупных экзопланет. Благодаря гравитационному сжатию под газовым слоем должно находиться ядро из металлического водорода.
Реакции водорода со сложными веществами
- при высокой температуре водород восстанавливает многие оксиды металлов:
ZnO+H2 = Zn+H2O
- метиловый спирт получают в результате реакции водорода с оксидом углерода (II):
2H2+CO → CH3OH
- в реакциях гидрогенизации водород реагирует с многими органическими веществами.
Более подробно уравнения химических реакций водорода и его соединений рассмотрены на странице «Водород и его соединения — уравнения химических реакций с участием водорода».
Применение водорода
- в атомной энергетике используются изотопы водорода — дейтерий и тритий;
- в химической промышленности водород используют для синтеза многих органических веществ, аммиака, хлороводорода;
- в пищевой промышленности водород применяют в производстве твердых жиров посредство гидрогенизации растительных масел;
- для сварки и резки металлов используют высокую температуру горения водорода в кислороде (2600°C);
- при получении некоторых металлов водород используют в качестве восстановителя (см. выше);
- поскольку водород является легким газом, его используют в воздухоплавании в качестве наполнителя воздушных шаров, аэростатов, дирижаблей;
- как топливо водород используют в смеси с СО.
В последнее время ученые уделяют достаточно много внимания поиску альтернативных источников возобновляемой энергии. Одним из перспективных направлений является «водородная» энергетика, в которой в качестве топлива используется водород, продуктом сгорания которого является обыкновенная вода.
Способы получения водорода
Промышленные способы получения водорода:
- конверсией метана (каталитическим восстановлением водяного пара) парами воды при высокой температуре (800°C) на никелевом катализаторе: CH4 + 2H2O = 4H2 + CO2;
- конверсией оксида углерода с водяным паром (t=500°C) на катализаторе Fe2O3: CO + H2O = CO2 + H2↑;
- термическим разложением метана: CH4 = C + 2H2↑;
- газификацией твердых топлив (t=1000°C): C + H2O = CO + H2↑;
- электролизом воды (очень дорогой способ при котором получается очень чистый водород): 2H2O → 2H2↑ + O2.
Лабораторные способы получения водорода:
- действием на металлы (чаще цинк) соляной или разбавленной серной кислотой: Zn + 2HCl = ZCl2 + H2; Zn + H2SO4 = ZnSO4 + H2↑;
- взаимодействием паров воды с раскаленными железными стружками: 4H2O + 3Fe = Fe3O4 + 4H2↑.
Химические свойства
Доля диссоциировавших молекул водорода при атмосферном давлении в зависимости от температуры
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
-
- H2→ 2H{\displaystyle {\mathsf {H_{2}\rightarrow {}\ 2H}}}− 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
-
- Ca+H2→ CaH2{\displaystyle {\mathsf {Ca+H_{2}\rightarrow {}\ CaH_{2}}}}
и с единственным неметаллом — фтором, образуя фтороводород:
-
- F2+H2→ 2HF{\displaystyle {\mathsf {F_{2}+H_{2}\rightarrow {}\ 2HF}}}
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
-
- O2+2H2→ 2H2O{\displaystyle {\mathsf {O_{2}+2H_{2}\rightarrow {}\ 2H_{2}O}}}
Записанное уравнение отражает восстановительные свойства водорода.
-
- N2+3H2→ 2NH3{\displaystyle {\mathsf {N_{2}+3H_{2}\rightarrow {}\ 2NH_{3}}}}
С галогенами образует галогеноводороды:
-
- H2+F2→ 2HF{\displaystyle {\mathsf {H_{2}+F_{2}\rightarrow {}\ 2HF}}}, реакция протекает со взрывом в темноте и при любой температуре,
-
- H2+Cl2→ 2HCl{\displaystyle {\mathsf {H_{2}+Cl_{2}\rightarrow {}\ 2HCl}}}, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
-
- C+2H2→ CH4{\displaystyle {\mathsf {C+2H_{2}\rightarrow {}\ CH_{4}}}}
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
-
- 2Na+H2→ 2NaH{\displaystyle {\mathsf {2Na+H_{2}\rightarrow {}\ 2NaH}}}
-
- Ca+H2→ CaH2{\displaystyle {\mathsf {Ca+H_{2}\rightarrow {}\ CaH_{2}}}}
-
- Mg+H2→ MgH2{\displaystyle {\mathsf {Mg+H_{2}\rightarrow {}\ MgH_{2}}}}
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
-
- CaH2+2H2O→ Ca(OH)2+2H2↑{\displaystyle {\mathsf {CaH_{2}+2H_{2}O\rightarrow {}\ Ca(OH)_{2}+2H_{2}\uparrow }}}
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
-
- CuO+H2→ Cu+H2O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow {}\ Cu+H_{2}O}}}
-
- Fe2O3+3H2→ 2Fe+3H2O{\displaystyle {\mathsf {Fe_{2}O_{3}+3H_{2}\rightarrow {}\ 2Fe+3H_{2}O}}}
-
- WO3+3H2→ W+3H2O{\displaystyle {\mathsf {WO_{3}+3H_{2}\rightarrow {}\ W+3H_{2}O}}}
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
R−CH=CH−R′+H2→R−CH2−CH2−R′{\displaystyle {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!R’+H_{2}}}\rightarrow {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}\!\!-\!\!R’}}}
Физические свойства

Эмиссионный спектр излучения атомов водорода на фоне сплошного спектра в видимой области

Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода.
В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением.
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород.
Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация параводорода в смеси в зависимости от температуры
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Распространённость
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.