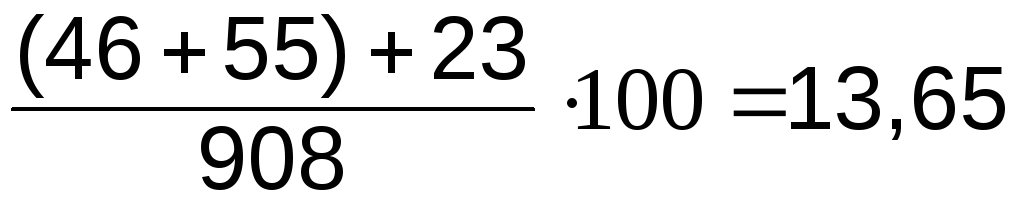Общие сведения
Схема митотического кроссинговера
Митотическая рекомбинация может происходить в любом локусе, однако её результат виден лишь тогда, когда особь гетерозиготна по этим локусам. В результате митотического кроссинговера при расхождении хромосом в половине случаев должны образовываться двойные пятна, так как в двух случаях из четырёх одна из пары хроматид будет нормальной, а другая — рекомбинантной.
Иными словами, фенотип дочерней клетки зависит от того, как разойдутся хромосомы по метафазной пластинке. Если две рекомбинантные хроматиды, содержащие различные аллели, встанут на пластинке друг против друга, то дочерняя клетка будет гетерозиготной и с нормальным фенотипом, несмотря на рекомбинацию (так как рекомбинантные участки как бы взаимно компенсируют друг друга). Если же против рекомбинантной хроматиды станет нормальная, то клетка будет гомозиготной по рекомбинантному локусу. Результатом этого будет появление двойного пятна, где у некоторых клеток будет проявляться гомозиготный рецессивный фенотип, а у других — гомозиготный доминантный (дикий) фенотип. Если такие дочерние клетки продолжат размножаться и делиться, двойные пятна будут расти, приводя к появлению новых фенотипов.
Митотическая рекомбинация происходит в течение интерфазы. Было высказано предположение, что рекомбинация происходит в течение G1-фазы, когда хромосома ещё не удвоена. В более недавнее время было предположено, что митотический кроссинговер происходит вследствие репарации путём гомологичной рекомбинации двунитевых повреждений ДНК, а сам процесс идёт в G1-фазе, однако этому противоречит то, что репарация путём гомологичной рекомбинации происходит в основном после репликации.
Частота кроссинговера и величина сцепления генов
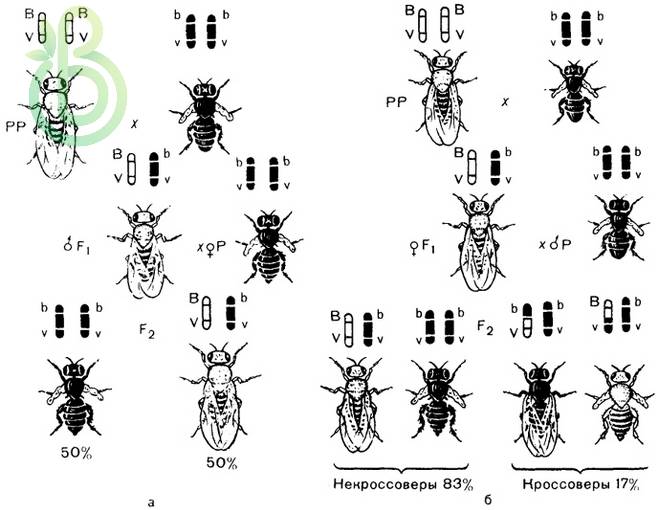
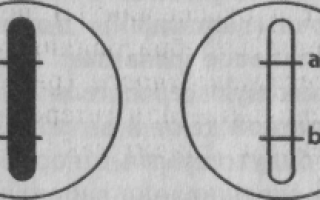
Схема наследования генов, расположенных в одной паре гомологичных хромосом: а — полное сцепление (кроссинговер отсутствует); б — неполное сцепление (кроссинговер имеет место).
В случае независимого наследования генов гетерозиготные по двум признакам особи вследствие анализирующего скрещивания в потомстве проявляли расщепление в соотношении 1:1:1:1.
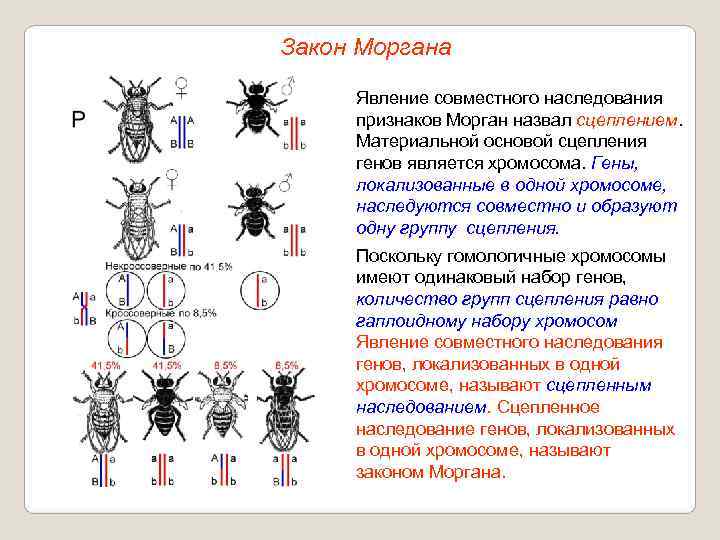
В опыте Моргана анализирующее скрещивание дало другие результаты. У дрозофилы гены, контролирующие окраску тела (серая – черная) и длину крыльев (длинные – короткие зачатки) локализованы в одной хромосоме. Серое тело и длинные крылья доминируют.
При скрещивании гомозиготной по рецессивным признакам самки с дигетерозиготным самцом происходит расщепление 1:1 по фенотипу.
В – серое тело, b – черное; V – длинные крылья, v – короткие:
Р: bv / / bv × BV / / bv
черное тело серое тело
короткие крылья длинные крылья
G: bv BV, bv
F: BV / / bv, bv / / bv
серое тело черное тело
длинные крылья короткие крылья
50 % 50 %
Гены, которые локализованы в одной хромосоме, передаются всегда вместе – такое сцепление называется полным. Дигетерозиготная особь в этом случае образует вместо четырех типов гамет лишь два.
У самца невозможен процесс конъюгации и кроссинговер, вследствие чего не образуются кроссоверные гаметы. Это можно объяснить отсутствием у самцов мушек дрозофил особого белкового комплекса, необходимого для обеспечения процесса конъюгации гомологичных хромосом.
При скрещивании дигетерозиготных самок дрозофил с гомозиготными по рецессивным генам самцами возникает расщепления в потомстве:
Р: BV / / bv × bv / / bv
серое тело черное тело
длинные крылья короткие крылья
G: BV, bv bvBv, bV
F: BV / / bv, bv / / bv Bv / / bv, bV / / bv
серое тело черное тело серое тело черное тело
длинные короткие короткие длинные
крылья крылья крылья крылья
41,5 % 41,5 % 8,5 % 8,5 %
У дигетерозиготной самки дрозофилы образуются четыре типа гамет, два из которых (BV, bv) – некроссоверные, а два других (Bv, bV) – кроссоверные, которые возникли вследствие кроссинговера.
В потомстве появились особи, которые отличаются по своим признакам от родительских форм (с серым телом, короткими крыльями и черным телом, длинными крыльями) – имеют рекомбинантные фенотипы.
Два или больше генов являются сцепленными неполностью, если потомки с новыми генными комбинациями (рекомбинанты) встречаются значительно меньше, чем родительские фенотипы.
Частота рекомбинаций (с) подсчитывается по формуле:
с = ((k + m) : n) × 100 % ,
где к, m – количество рекомбинантов,
n – общее количество потомков.
При скрещивании дигетерозиготной самки с серым телом и длинными крыльями с гомозиготным самцом с черным телом и короткими крыльями было получено в потомстве:
мушек с серым телом и длинными крыльями – 965;
мушек с черным телом и короткими крыльями – 944;
мушек с серым телом и короткими крыльями – 185;
мушек с черным телом и длинными крыльями – 206.
То есть можем подсчитать частоту рекомбинаций:
((965 + 944) : (965 + 944 + 185 + 206)) × 100 % = 17 % .
Частота рекомбинаций (частота скрещения хромосом) является косвенным отображением силы сцепления генов в хромосомах. Чем она больше, тем меньше сила сцепления генов в хромосоме и тем дальше гены локализованы один от другого. Тем больше возможность отрыва хромосом и больше возможность образования рекомбинантных особей. Частота кроссинговера может достичь 50 % , но не превышает этой величины. Это невозможно потому, что при очень больших расстояниях между генами возникает дополнительный обмен в других участках (двойной, тройной кроссинговер), часть кроссоверных форм может оставаться неучтенной, что в свою очередь приведет к общему уменьшению процента кроссинговера.
Если расстояние между хромосомами равно 50 % и больше – состояния признаков наследуются независимо.
Негомологичный кроссовер
Кроссоверы обычно происходят между гомологичными областями совпадающих хромосом , но сходство в последовательности и других факторах может привести к несовпадающим выравниваниям. Большая часть ДНК состоит из последовательностей пар оснований , повторяющихся очень большое количество раз. Эти повторяющиеся сегменты, часто называемые спутниками, довольно однородны среди видов. Во время репликации ДНК каждая цепь ДНК используется в качестве матрицы для создания новых цепей с использованием частично консервативного механизма; В результате правильного функционирования этого процесса образуются две идентичные парные хромосомы, часто называемые сестрами. События кроссовера сестринских хроматид, как известно, происходят со скоростью нескольких событий кроссовера на клетку на деление у эукариот. Большинство этих событий включают обмен равными объемами генетической информации, но могут происходить неравные обмены из-за несоответствия последовательностей. Они упоминаются под разными названиями, включая негомологичный кроссовер, неравный кроссовер и несбалансированную рекомбинацию, и приводят к вставке или удалению генетической информации в хромосоме. Хотя эти мутации редки по сравнению с случаями гомологичного кроссовера, они радикальны, затрагивая множество локусов одновременно. Они считаются основной движущей силой генерации дупликаций генов и являются основным источником мутаций в геноме .
Конкретные причины негомологичных кроссоверов неизвестны, но известно несколько влияющих факторов, увеличивающих вероятность неравного кроссовера. Одним из распространенных векторов, ведущих к несбалансированной рекомбинации, является репарация двухцепочечных разрывов (DSB). DSB часто восстанавливают с использованием гомологически направленной репарации, процесса, который включает в себя вторжение цепи-шаблона цепью DSB (см. Рисунок ниже). Соседние гомологичные области матричной цепи часто используются для репарации, что может привести к вставкам или делециям в геноме, если используется негомологичная, но комплементарная часть матричной цепи. Сходство последовательностей играет важную роль в кроссовере — события кроссовера с большей вероятностью происходят в длинных областях близкой идентичности гена. Это означает, что любой участок генома с длинными участками повторяющейся ДНК подвержен событиям кроссовера.
Наличие сменных элементов — еще один важный элемент негомологичного кроссовера. Повторяющиеся участки кода характеризуют сменные элементы; комплементарные, но негомологичные регионы повсеместно встречаются в транспозонах. Поскольку хромосомные области, состоящие из транспозонов, имеют большое количество идентичного повторяющегося кода в конденсированном пространстве, считается, что области транспозонов, подвергающиеся перекрестному событию, более склонны к ошибочному дополнительному совпадению; то есть участок хромосомы, содержащий множество идентичных последовательностей, если он подвергнется перекрестному событию, менее уверен в совпадении с идеально гомологичным участком дополнительного кода и более склонен к связыванию с участком кода на немного другая часть хромосомы. Это приводит к несбалансированной рекомбинации, поскольку генетическая информация может быть вставлена или удалена в новую хромосому, в зависимости от того, где произошла рекомбинация.
Хотя мотивирующие факторы, лежащие в основе неравной рекомбинации, остаются неясными, элементы физического механизма были выяснены. Белки репарации ошибочного спаривания (MMR), например, представляют собой хорошо известное регуляторное семейство белков, отвечающее за регулирование несовпадающих последовательностей ДНК во время репликации и регуляции ускользания. Оперативная цель MMR — восстановление родительского генотипа. В частности, один класс MMR, MutSβ, как известно, инициирует коррекцию несовпадений вставок-делеций длиной до 16 нуклеотидов. Мало что известно о процессе вырезания у эукариот, но при удалении E. coli происходит расщепление разрыва на 5 ‘или 3’ цепи, после чего ДНК-геликаза и ДНК-полимераза III связываются и образуют одноцепочечные белки, которые перевариваются. с помощью экзонуклеазы и прикрепляется к цепи с помощью лигазы . Множественные пути MMR вовлечены в поддержание стабильности сложного генома организма, и любая из многих возможных неисправностей в пути MMR приводит к ошибкам редактирования и исправления ДНК. Следовательно, хотя точно не известно, какие механизмы приводят к ошибкам негомологичного кроссовера, весьма вероятно, что задействован путь MMR.
Происхождение
Существуют две популярные и частично совпадающие теории, объясняющие происхождение кроссинговера, основанные на различных теориях происхождения мейоза . Первая теория основана на идее, что мейоз развился как другой метод репарации ДНК , и, таким образом, кроссинговер является новым способом замены возможно поврежденных участков ДНК. Вторая теория исходит из идеи, что мейоз возник в результате бактериальной трансформации с функцией распространения разнообразия. В 1931 году Барбара МакКлинток открыла триплоидное растение кукурузы. Она сделала ключевые выводы относительно кариотипа кукурузы, включая размер и форму хромосом. МакКлинток использовал профазную и метафазную стадии митоза для описания морфологии хромосом кукурузы, а позже продемонстрировал первую в истории цитологическую демонстрацию кроссинговера в мейозе. Работая со студенткой Харриет Крейтон, МакКлинток также внес значительный вклад в раннее понимание созависимости сцепленных генов.
Теория восстановления ДНК
Кроссинговер и репарация ДНК — очень похожие процессы, в которых используются многие из одних и тех же белковых комплексов. В своем отчете «Значение реакции генома на вызов» МакКлинток изучала кукурузу, чтобы показать, как геном кукурузы изменится сам, чтобы преодолеть угрозы ее выживанию. Она использовала 450 самоопыляемых растений, получивших от каждого родителя хромосому с разорванным концом. Она использовала модифицированные паттерны экспрессии генов на разных участках листьев ее растений кукурузы, чтобы показать, что в геноме прячутся мобильные элементы («контролирующие элементы»), а их подвижность позволяет им изменять действие генов в разных локусах. Эти элементы также могут реструктурировать геном, от нескольких нуклеотидов до целых сегментов хромосомы. Рекомбиназы и примазы закладывают основу нуклеотидов вдоль последовательности ДНК. Одним из таких специфических белковых комплексов, которые сохраняются между процессами, является RAD51 , хорошо консервативный белок рекомбиназы, который, как было показано, имеет решающее значение для репарации ДНК, а также для кроссинговера. Несколько других генов D. melanogaster также были связаны с обоими процессами, показывая, что мутанты по этим специфическим локусам не могут подвергаться репарации ДНК или кроссинговеру. К таким генам относятся mei-41, mei-9, hdm, spnA и brca2. Эта большая группа консервативных генов между процессами поддерживает теорию тесной эволюционной связи. Кроме того, было обнаружено, что репарация ДНК и кроссовер благоприятствуют сходным участкам хромосом. В эксперименте с использованием радиационного гибридного картирования на хромосоме 3B пшеницы ( Triticum aestivum L. ) кроссинговер и репарация ДНК происходили преимущественно в одних и тех же регионах. Более того, кроссинговер коррелирует с реакцией на стрессовые и вероятные повреждения ДНК.
Ссылки на бактериальную трансформацию
Процесс бактериальной трансформации также имеет много общего с хромосомным кроссовером, особенно в образовании выступов на сторонах разорванной цепи ДНК, что позволяет отжигать новую цепь. Сама бактериальная трансформация много раз была связана с репарацией ДНК. Вторая теория исходит из идеи, что мейоз возник в результате бактериальной трансформации с функцией распространения генетического разнообразия. . Таким образом, это свидетельство предполагает, что вопрос заключается в том, связан ли кроссинговер с репарацией ДНК или бактериальной трансформацией, поскольку эти два явления не исключают друг друга. Вероятно, что кроссинговер возник в результате бактериальной трансформации, которая, в свою очередь, возникла в результате репарации ДНК, что объясняет связи между всеми тремя процессами.
Химия

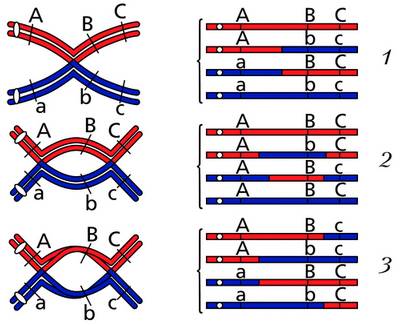
Современная модель мейотической рекомбинации, инициированной двухцепочечным разрывом или разрывом, с последующим спариванием с гомологичной хромосомой и инвазией цепи, чтобы инициировать процесс рекомбинационной репарации. Ремонт разрыва может привести к кроссоверу (CO) или непересечению (NCO) фланкирующих областей. Предполагается, что рекомбинация CO происходит в рамках модели двойного холлидейского соединения (DHJ), показанной справа выше. Считается, что рекомбинанты NCO возникают в основном в рамках модели отжига зависимых цепей от синтеза (SDSA), показанной слева выше. Большинство событий рекомбинации относятся к типу SDSA.
Мейотическая рекомбинация может быть инициирована двухцепочечными разрывами, которые вводятся в ДНК при воздействии повреждающих агентов ДНК или белка Spo11 . Затем одна или несколько экзонуклеаз переваривают 5′-концы, образованные двухцепочечными разрывами, с образованием 3′-концевых одноцепочечных ДНК (см. Диаграмму). Специфическая для мейоза рекомбиназа Dmc1 и общая рекомбиназа Rad51 покрывают одноцепочечную ДНК с образованием нуклеопротеиновых филаментов. Рекомбиназы катализируют вторжение противоположной хроматиды однонитевой ДНК с одного конца разрыва. Затем 3′-конец вторгающейся ДНК инициирует синтез ДНК, вызывая смещение комплементарной цепи, которая впоследствии отжигается с одноцепочечной ДНК, генерируемой на другом конце исходного двухцепочечного разрыва. Возникающая в результате структура представляет собой обмен поперечными цепями , также известный как соединение Холлидея . Контакт между двумя хроматидами, который вскоре подвергнется кроссинговеру, известен как хиазма . Соединение Холлидея представляет собой тетраэдрическую структуру, которую могут «тянуть» другие рекомбиназы, перемещая ее по четырехцепочечной структуре.
MSH4 и MSH5
Белки MSH4 и MSH5 образуют гетероолигомерную структуру ( гетеродимер ) у дрожжей и человека. В дрожжах Saccharomyces cerevisiae MSH4 и MSH5 действуют специфически, способствуя кроссоверам между гомологичными хромосомами во время мейоза . Комплекс MSH4 / MSH5 связывает и стабилизирует двойные соединения Холлидея и способствует их разделению в продукты кроссовера. (частично функциональный) мутант S. cerevisiae MSH4 показал 30% -ное снижение числа кроссоверов по всему геному и большое количество мейозов с необменными хромосомами. Тем не менее, этот мутант привел к паттернам жизнеспособности спор, предполагающим, что сегрегация необменных хромосом происходит эффективно. Таким образом, у S. cerevisiae собственно сегрегация, по-видимому, не полностью зависит от кроссоверов между гомологичными парами.
Хиазма
Кузнечик Melanoplus femur-rubrum подвергался воздействию острой дозы рентгеновских лучей на каждой отдельной стадии мейоза , и измерялась частота хиазм . Облучение в течение leptotene — стадий мейоза (то есть, до периода , в котором происходит кроссовер рекомбинация) было обнаружено увеличение частоты последующего хиазма. Точно так же у кузнечика Chorthippus brunneus воздействие рентгеновского излучения на стадии зиготена-ранняя пахитена вызывало значительное увеличение средней частоты клеточных хиазм. Частоту хиазм оценивали на более поздних стадиях мейоза. Эти результаты предполагают, что рентгеновские лучи вызывают повреждения ДНК, которые восстанавливаются перекрестным путем, ведущим к образованию хиазмы.
Преимущества и недостатки
Митотический кроссинговер наблюдали у D. melanogaster, у некоторых размножающихся бесполым путём грибов и в соматических клетках человека и мыши. В последнем случае митотический кроссинговер может приводить к появлению клеток, экспрессирующих рецессивные проонкогенные мутации, предрасполагая к развитию рака. С другой стороны, клетка может стать и гомозиготным мутантом по гену-супрессору опухолевого роста, что приведёт к тому же самому результату. Например, синдром Блума вызывается мутацией RecQ-хеликазы, которая играет роль в репликации и репарации ДНК. У мышей эта мутация ведёт к повышению частоты митотической рекомбинации, что в свою очередь повышает частоту развития опухолей.
В то же время митотический кроссинговер может иметь и положительный эффект для организма, у которого доминантные аллели в гомозиготном состоянии более функциональны, чем в гетерозиготном.
Для экспериментов с геномами модельных организмов, например, дрозофилы, митотический кроссинговер можно вызвать искусственно рентгеновским излучением и FLP-FRT-рекомбинацией.
Генетические карты хромосом
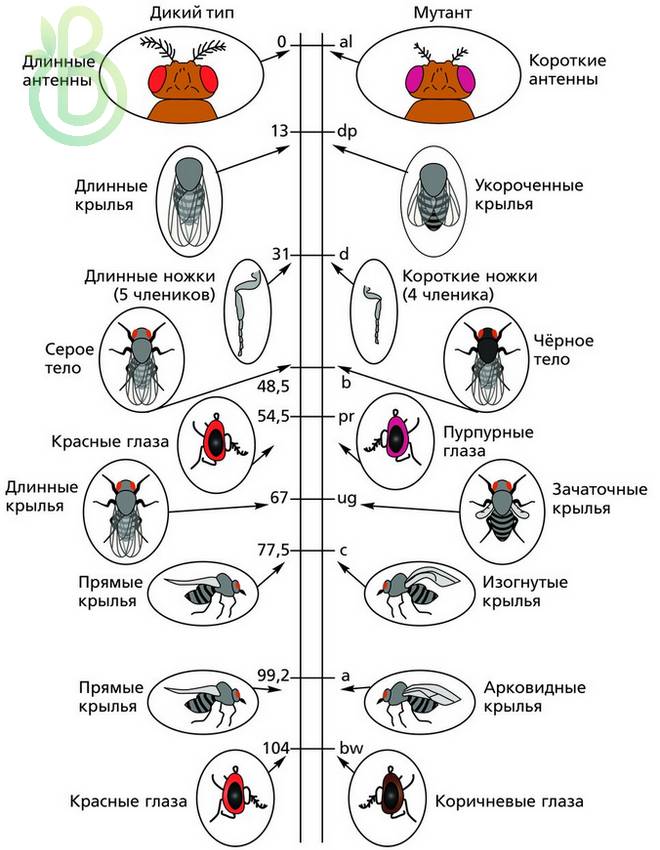
Генетические карты хромосом дрозофилы. Цифры указывают расстояние между генами и одним из концов хромосомы (в единицах перекреста)
Знание частоты рекомбинаций дает возможность составлять карты относительного расположения генов в хромосомах. На генетических картах гены расположены линейно один за другим на определенном расстоянии, которое определяется в процентах кроссинговера (частота рекомбинаций) или в морганидах (1 % кроссинговера равен одной морганиде). Чтобы построить генетическую карту растений или животных, проводят анализирующее скрещивание, где достаточно подсчитать процент особей, которые образовались вследствие кроссинговера. Необходимо также определить число групп сцепления и принадлежность генов к ним.
Например, частота рекомбинаций между генами равна: А и В – 8%, В и С – 6%. Этих данных недостаточно для составления карты, так как возможны варианты.
Необходимо знать расстояние между генами А и С.
Для человека невозможно применение метода скрещивания (гибридологического), поэтому его заменили методом анализа родословных.
Генетическая карта хромосом – это схема относительного размещения генов в одной хромосоме, которые принадлежат к одной группе сцепления.
Первые генетические карты были составлены для дрозофил, а потом и для других объектов.
Генетические карты составляют для каждой пары гомологичных хромосом. Каждая группа сцепления имеет свой порядковый номер (римскими цифрами) в зависимости от порядка открытия. Кроме номера в каждой группе сцепления указывается полное или сокращенное название генов, расстояние каждого гена в единицах кроссинговера от одного из концов хромосомы, место нахождения центромеры.
В 1930 году был разработан новый способ картирования хромосом, основанный на наличии в слюнных железах насекомых больших хромосом – политенных, имеющих хроматин в виде чередования темных и светлых дисков при окраске, которые видно даже при небольшом увеличении микроскопа. При выявлении дефектов в темных хроматиновых дисках сравнивали их с изменениями соответственно локализованных генов. Такие карты стали называть хромосомными (цитологическими). Генетические карты сравнивают с цитологическими. Цитологические карты хромосом определяют хромосому как физическое тело. Порядок генов в этих картах идентичен генетическим. Таким образом, генетические карты указывают на реальный порядок генов в хромосоме. Расстояние между генами на генетической карте приблизительно, так как нет соответствия возле центромеры – на генетической карте гены расположены плотнее, чем на хромосомной. Это связано со сниженной частотой кроссинговера возле центромеры. В других участках хромосомы наблюдается соответствие.
При картировании генов человека, кроме анализа родословных, используют другие методы. Одним из них является метод гибридизации соматических клеток грызунов и человека в культуре ткани. В гибридных клетках при размножении теряются одна или несколько хромосом изучаемого вида. После анализа большого количества клонов клеток отбирают 20-30, которые отличаются по набору хромосом. Если у всех клонов отсутствует хромосома и отсутствует изучаемый белок, а у других клонов есть белок и хромосома, делают вывод: синтез этого белка связан с этой хромосомой. Использование этого метода позволило за короткий срок составить генетические карты человека и животных.
Благодаря успехам в молекулярной генетике используют еще один метод картирования генов. ДНК гена выделяют с применением методов генной инженерии. Наносят раствор этих генов с меченной (радиоактивной или флуоресцентной) последовательностью ДНК на митотические хромосомы. Эти участки ДНК включаются в хромосомах на «свое» место, которое можно определить.
В 2003 году была выполнена программа «Геном человека» (запланированная ООН): расшифрован геном человека, изучены все 24 группы сцепления.
Для составления генетических карт прокариот используют другие методы, которые связаны с особенностями их строения. Прокариоты – гаплоидные организмы. Составление генетических карт прокариот строится на существовании особого процесса у бактерий – конъюгации.
Важность составления генетических карт заключается в использовании их в селекции растений, животных и микроорганизмов. Генетические карты человека могут быть полезными в развитии медицины и здравоохранения для диагностики, предотвращения и лечения трудных наследственных заболеваний
Примечания
- ↑ Hartel, Daniel L. and Maryellen Ruvolo. Genetics: Analysis of Genetics and Genomes. — Burlington : Jones & Bartlett, 2012.
- ↑ Tischfield, Jay A. (November 1997). «Loss of Heterozygosity, or: How I learned to Stop Worrying and Love Mitotic Recombination». American Journal of Human Genetics. 61 (5): 995—999.
- Stern, Curt (1936). «Somatic Crossing Over and Segregation in Drosophila Melanogaster». Genetics. 21 (6): 625—730.
- Инге-Вечтомов С.Г. Генетика с основами селекции: учебник для студентов высших учебных заведений / С. Г. Инге-Вечтомов. — СПб.: Изд-во Н-Л, 2010. — С. 193-194. — 720 с. — ISBN 978-5-94869-105-3.
- Esposito, Michael S (September 1978). «Evidence that Spontaneous Mitotic Recombination Occurs at the Two-Strand Stage». Proceedings of the National Academy of Sciences of the USA. 75 (9): 4436—4440.
- ↑
- Helleday, Thomas (2003). «Pathways for Mitotic Homologous Recombination in Mammalian Cells». Mutation Research. 532 (1–2): 103—115.
- Pâques, Frédéric; James E. Haber (1999). «Multiple Pathways of Recombination Induced by Double-Strand Breaks in Saccharomyces cerevisiae». Microbiology and Molecular Biology Reviews. 63 (2): 349—404.
- Luo, Guangbin; et al. (2000). «Cancer predisposition caused by elevated mitotic recombination in Bloom mice». Nature Genetics. 26: 424—429.
- Xu, T; GM Rubin (April 1993). «Analysis of genetic mosaics in developing and adult Drosophila tissues». Development. 117 (4): 1223–12237.