Основные параметры и превращения в процессе кристаллизации
Кристаллы обладают множеством характеристик, но, пожалуй, важнейшая из них — это распределение кристаллов по размерам, от которого в значительной степени зависит качество конечного продукта и эффективность процесса его получения. Размер и форма кристаллов непосредственно влияют на основные технологические этапы, следующие за кристаллизацией, — фильтрацию и сушку. Конечный размер кристаллов также определяет качество кристаллического продукта. Например, биологическая доступность и эффективность фармацевтических составов тем выше, чем мельче получаемые кристаллы, так как они лучше растворяются.
Парадоксальная горячая вода
Удивительный факт – горячая вода переходит в кристаллическое состояние быстрее, чем холодная – получил название «эффекта Мпембы» в честь танзанийского школьника, обнаружившего этот парадокс
Точнее, знали о нем еще в древности, однако, не найдя объяснения, натурфилософы и естествоиспытатели в конце концов перестали обращать внимание на загадочный феномен
В 1963 году Эрасто Мпемба был удивлен тем, что подогретая смесь для мороженого застывает быстрее, чем холодная. А в 1969 году интригующее явление получило подтверждение уже в физическом эксперименте (кстати, с участием самого Мпембы). Эффект объясняют целым комплексом причин:
- большее количество центров кристаллизации, таких как воздушные пузырьки;
- высокая теплоотдача горячей воды;
- высокий темп испарения, влекущего за собой уменьшение объема жидкости.
Изотермический способ и высаливание
Об этом тоже следует рассказать. Изотермический процесс кристаллизации характеризуется испарением воды из растворов при постоянной, не меняющейся температуре. Этот метод применим для веществ с содержанием солей, растворимость которых практически не зависит от нагревания.
Испарения удается добиться за счет доведения жидкости до интенсивного кипения и поддержания ее в таком состоянии. Это «традиционный» метод. Еще может использоваться медленное поверхностное испарение.
В некоторых случаях в жидкости вводят вещества, которые понижают их способность к растворению. Это называется высаливанием. Такими «помощниками» являются вещества, в которых содержится одинаковый с данной солью ион. Яркий пример: процесс кристаллизации хлорида натрия из раствора с высокой концентрацией, в который добавляют хлорид магния.
Следует оговориться, что механизм высаливания не всегда одинаков. Если в целях проведения данного процесса смешать два электролита, добавочный из которых будет с одноименным ионом, то в итоге получится добиться такой концентрации, что произведение растворимости вещества станет значительно выше. Что это значит? Говоря простыми словами – появится избыток вещества, и он выделится в твердую фазу.
Бывает и по-другому. Чтобы добиться высаливания, приходится и вовсе менять структуру раствора – способствовать образованию гидратных оболочек вокруг частиц вещества, которое необходимо кристаллизовать. Как это достигается? Посредством разрушения оболочек у уже растворенного вещества.
Важно усвоить: соли, которые образуют кристаллогидраты, высаливаются интенсивнее, чем те, которые образуются в безводной форме. Но некоторые «добавки» лишь усиливают растворимость
Это приводит к всаливанию.
Примеры
Кристаллизация – это в химии очень тщательно изучаемый процесс, который особенно интересен на практике.
В качестве примера можно рассмотреть процесс образования сахара. Суть процесса заключается в выделении сахарозы, содержащейся в сиропе. Последний, в свою очередь, содержит также другие вещества, которые не были удалены в процессе очистки сока, и вновь образовались по ходу сгущения.
Когда поднимается температура, кристаллизация начинается, и в ее процессе образуется межкристальный раствор, который называется утфель. Все лишние вещества будут скапливаться в нем. На самом деле, они серьезно затрудняют весь процесс, поскольку наличие различного рода примесей увеличивает вязкость раствора.
Еще один яркий пример кристаллизации в химии связан с образованием соли. Для того чтобы его увидеть воочию, даже не нужно проводить экспериментов – данный процесс существует в природе. В холодное время года прибой выбрасывает на берег тонны соли. Она не пропадает. Ее сгребают в огромные кучи, а потом, когда наступает жара и сухость, из нее испаряется кристаллизационная вода. Остается лишь мелкий порошок – соль, потребляемая промышленностью.
Пример с солью – самый простой. Даже в некоторых школах детям дают на дом задание в рамках урока химии: растворить в совсем небольшом количестве воды 1-2 ложки соли и оставить емкость где-нибудь. Для более интенсивной кристаллизации температуру можно увеличить – пододвинуть раствор к батарее, например. Через пару дней вода испарится. А вот солевые кристаллы останутся.
Из чего состоит кристаллизация??
Кристаллизация требует двух шагов, которые должны произойти, прежде чем может быть образование кристаллической сети: во-первых, должно быть достаточно накопления атомов или молекул на микроскопическом уровне, чтобы началось так называемое зародышеобразование.
Эта стадия кристаллизации может происходить только в переохлажденных жидкостях (т. Е. Охлажденных ниже точки замерзания, не делая их твердыми) или перенасыщенных растворах..
После начала зародышеобразования в системе ядра могут быть сформированы достаточно стабильными и достаточно большими, чтобы начать второй этап кристаллизации: рост кристаллов.
зарождение
На этом первом этапе определяется расположение частиц, которые будут образовывать кристаллы, и наблюдается влияние факторов окружающей среды на образовавшиеся кристаллы; например, время, необходимое для появления первого кристалла, называется временем зарождения.
Существует две стадии нуклеации: первичная и вторичная нуклеация. В первом случае новые ядра образуются, когда в середине нет других кристаллов или когда другие существующие кристаллы не влияют на их образование..
Первичное зародышеобразование может быть гомогенным, при котором нет влияния на часть твердых веществ, присутствующих в среде; или он может быть гетерогенным, когда твердые частицы внешних веществ вызывают увеличение скорости нуклеации, которое обычно не происходит.
При вторичном зародышеобразовании новые кристаллы образуются под воздействием других существующих кристаллов; это может произойти из-за сил резания, которые делают сегменты существующих кристаллов новыми кристаллами, которые также растут с собственной скоростью.
Этот тип зародышеобразования выгоден в системах с высокой энергией или в потоке, где вовлеченная жидкость вызывает столкновения между кристаллами.
Рост кристаллов
Это процесс, в котором кристалл увеличивает свой размер путем агрегации большего количества молекул или ионов в промежуточные положения своей кристаллической сети..
В отличие от жидкостей, кристаллы растут равномерно только тогда, когда молекулы или ионы входят в эти положения, хотя их форма будет зависеть от природы рассматриваемого соединения. Любое неправильное расположение этой структуры называется дефектом кристалла..
Рост кристалла зависит от ряда факторов, среди которых, среди прочего, поверхностное натяжение раствора, давление, температура, относительная скорость кристаллов в растворе и число Рейнольдса..
Самый простой способ обеспечить рост кристаллов до больших размеров и их высокую чистоту — это контролируемое и медленное охлаждение, которое предотвращает образование кристаллов за короткое время и попадание посторонних веществ внутрь. они.
Кроме того, важно отметить, что с маленькими кристаллами намного сложнее манипулировать, хранить и перемещать, и их фильтрация из раствора стоит дороже, чем более крупные. В подавляющем большинстве случаев самые крупные кристаллы будут наиболее желательными по этим и другим причинам.
Парадокс Мпембы
Его нельзя не отметить вниманием, рассказывая о кристаллизации воды. Такое явление, как парадокс Мпембы, интересно как минимум своей формулировкой
Звучит фраза так: «Горячая вода замерзает быстрее холодной». Интригует и озадачивает. Как такое возможно? Ведь вода перед переходом в стадию кристаллизации должна пройти «холодный» этап – остыть!
Противоречие первому началу термодинамики налицо. Но на то он и парадокс – логического объяснения нет, но на практике существует. Хотя с первым можно поспорить. Объяснения все-таки есть, и вот некоторые из них:
- Горячая вода начинает процесс испарения. Однако в холодном воздухе она превращается в лед и падает, образуя ледяную корку.
- Когда горячая вода испаряется из сосуда, ее объем уменьшается. Чем меньше жидкости – тем быстрее она кристаллизуется. Рюмка кипятка быстрее кристаллизуется, чем бутылка воды комнатной температуре.
- Снеговая подкладка в морозилке. Сосуд с кипятком ее плавит, устанавливая тепловой контакт со стенкой камеры. А вот под контейнером с холодной водой снег не тает.
- Кипяток охлаждается снизу. А холодная вода – сверху, что ухудшает конвекцию и теплоизлучение. На убыли тепла это тоже отражается.
- Расстояние между молекулами в горячей воде больше, чем в холодной. Это отражается на растягивании водородных связей. Следовательно, они запасают большую энергию. Она, в свою очередь, высвобождается в процессе охлаждения жидкости, и молекулы идут на сближение. Считается, что это меняет свойства кипятка, и потому замерзает он быстрее.
Есть еще несколько интересных попыток обосновать парадокс Мпембы, но однозначная причина по-прежнему неизвестна. Возможно, однажды ученые проведут основательное исследование, результат которого поможет окончательно разобраться в данном эффекте.
Особенности структуры жидкой воды и льда
Способность молекулы воды к формированию протонных связей проявляется и в жидком, и в твердом состоянии. Когда вода – жидкость, связи эти достаточно неустойчивы, легко разрушаются, но и постоянно образуются снова. Благодаря их наличию молекулы воды связаны между собой сильнее, чем частицы других жидкостей. Ассоциируясь, они формируют особые структуры – кластеры. По этой причине фазовые точки воды смещены в сторону более высоких температур, ведь для разрушения таких дополнительных ассоциатов тоже нужна энергия. Причем энергия довольно значительная: не будь водородных связей и кластеров, температура кристаллизации воды (а также ее плавления) составила бы –100 °C, а кипения +80 °C.
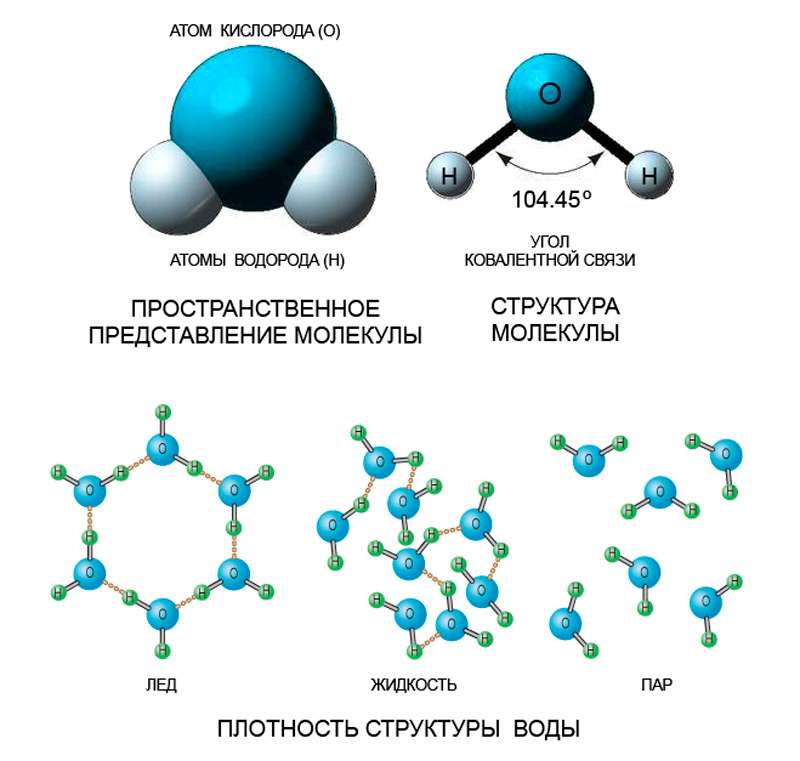
Строение кластеров идентично строению кристаллического льда. Связываясь каждая с четырьмя соседками, молекулы воды выстраивают ажурную кристаллическую структуру с основой в форме шестиугольника. В отличие от жидкой воды, где микрокристаллы – кластеры – непостоянны и подвижны из-за теплового движения молекул, при образовании льда они перестраиваются устойчивым и регулярным образом. Водородные связи фиксируют взаимное расположение узлов кристаллической решетки, и в результате расстояние между молекулами становится несколько больше, чем в жидкой фазе. Этим обстоятельством объясняется скачок плотности воды при ее кристаллизации – плотность падает с почти 1 г/см3 до примерно 0,92 г/см3.
Публикации по теме кристаллизации
Ознакомьтесь с подборкой статей по теме кристаллизации:
Классическая работа по нуклеации кристаллов из растворовJaroslav Nývlt, Kinetics of nucleation in solutions, Journal of Crystal Growth, Volumes 3–4, 1968.
Исследование механизмов выращивания кристаллов из раствораCrystal Growth Kinetics, Material Science and Engineering, Volume 65, Issue 1, July 1984.
Описание причин, по которым в системах «растворенное вещество — растворитель» вместо кристаллизации происходит образование новой жидкой фазыKiesow et al., Experimental investigation of oiling out during crystallization process, Journal of Crystal Growth, Volume 310, Issue 18, 2008.
Подробное исследование причин агломерации кристаллов в процессе кристаллизацииBrunsteiner et al., Toward a Molecular Understanding of Crystal Agglomeration, Crystal Growth & Design, 2005, 5 (1), pp 3–16.
Исследование механизмов распада агломератов в процессе кристаллизацииFasoli & Conti, Crystal breakage in a mixed suspension crystallizer, Volume 8, Issue 8, 1973, Pages 931–946.
Обзор алгоритмов разработки эффективных процессов кристаллизации в высокотехнологичных сегментах химической промышленностиPaul et al., Organic Crystallization Processes, Powder Technology, Volume 150, Issue 2, 2005.
Понятие о кристаллизации
Когда жидкость при охлаждении затвердевает, изменяется характер взаимодействия и расположения частиц вещества. Уменьшается кинетическая энергия беспорядочного теплового движения составляющих его частиц, и они начинают образовывать между собой устойчивые связи. Когда благодаря этим связям молекулы (или атомы) выстраиваются регулярным, упорядоченным образом, формируется кристаллическая структура твердого вещества.
Кристаллизация не охватывает одновременно весь объем охлаждаемой жидкости, а начинается с образования мелких кристалликов. Это так называемые центры кристаллизации. Они разрастаются послойно, ступенчато, путем присоединения все новых молекул или атомов вещества вдоль растущего слоя.
Искусственные методы
Для кристаллизации (см. также перекристаллизацию), чтобы произойти из решения она должна быть пересыщена. Это означает, что решение должно содержать больше предприятий раствора (молекулы или ионы) расторгнутый, чем оно содержало бы под равновесием (насыщаемое решение). Это может быть достигнуто различными методами, с (1) охлаждение решения, (2) добавление второго растворителя, чтобы уменьшить растворимость раствора (техника, известная как антирастворитель или утонувший), (3) химическая реакция и (4) изменение в pH факторе, являющемся наиболее распространенными методами, используемыми в промышленной практике. Другие методы, такие как растворяющее испарение, могут также использоваться.
сферической кристаллизации есть некоторые преимущества (текучесть и бионакопление) для формулировки фармацевтических наркотиков (см. касательно Вредного & al., 2001)
Кристаллическое производство
С существенной промышленной точки зрения:
- Макроскопическое кристаллическое производство: для удовлетворяют спрос как будто натуральных кристаллов с методами, которые «ускоряют шкалу времени» для крупного производства и/или совершенства.
- Ионическое кристаллическое производство;
- Ковалентное кристаллическое производство.
- Крошечные кристаллы размера:
- Порошок, песок и меньшие размеры: использование методов для порошка и управляемый (фрукты нанотехнологий) формы.
- Массовое производство: на химической промышленности, как производство соленого порошка.
- Типовое производство: маленькое производство крошечных кристаллов для существенной характеристики. Перекристаллизация, которой управляют, — важный метод, чтобы поставлять необычные кристаллы, которые необходимы, чтобы показать молекулярную структуру и ядерные силы в типичной молекуле кристалла. Много методов, как кристаллография рентгена и спектроскопия NMR, широко используются в химии и биохимии, чтобы определить структуры огромного разнообразия молекул, включая неорганические составы и биомакромолекулы.
- Производство тонкой пленки.
Очистка
Используемый, чтобы улучшиться (получение очень чистого вещества) и/или проверить их чистоту.
Кристаллизация отделяет продукт от жидкости feedstream, часто в чрезвычайно чистой форме, охлаждая feedstream или добавляя precipitants, которые понижают растворимость желаемого продукта так, чтобы это сформировало кристаллы.
Хорошо сформированные кристаллы, как ожидают, будут чисты, потому что каждая молекула или ион должны соответствовать отлично решетке, поскольку это оставляет решение. Примеси обычно не соответствовали бы также в решетке, и таким образом оставались бы в решении предпочтительно. Следовательно, молекулярное признание — принцип очистки в кристаллизации. Однако есть случаи, когда примеси соединяются в решетку, следовательно, уменьшая уровень чистоты заключительного кристаллического продукта. Кроме того, в некоторых случаях растворитель может соединиться в решетку, формирующую сольват. Кроме того, растворитель может быть ‘пойман в ловушку’ (в жидком состоянии) в пределах кристалла, сформированного, и это явление известно как «включение».
Типичное оборудование
Оборудование для главных производственных процессов для кристаллизации.
- Бак crystallizers. Кристаллизация бака — старый метод, все еще используемый в некоторых специализированных случаях. Влажным решениям, в кристаллизации бака, позволяют охладиться в открытых баках. После промежутка времени истощен ликер матери, и кристаллы удалены. Образованием ядра и размером кристаллов трудно управлять. Как правило, затраты на оплату труда очень высоки.
Вымораживание
Еще один процесс, который необходимо отметить вниманием, рассказывая о том, что такое кристаллизация. Вымораживанием называется выделение в твердом виде одного из компонентов газовой или жидкой смеси, которое достигается посредством охлаждения смеси
Причем достигается температура ниже той, при которой обычно начинается кристаллизация.
Основа данного процесса – низкая взаимная растворимость компонентов, которые нужно разделить. Пример: когда водные растворы вымораживают, то растворенные вещества в состав формирующихся в итоге кристаллов не входят.
Задействуется данный метод в особых случаях. Вымораживание эффективно, когда нужно разделить смеси, очистить вещества или концентрировать раствор.
Метод активно применяется в химической, микробиологической, фармакологической и пищевой промышленности. Но и в быту встречается масса примеров данного процесса. Речь идет про концентрирование вымораживанием с выделением льда. Оно направлено на сохранение аромата, цвета, а также лекарственных и вкусовых качеств термолабильных продуктов. К таковым относятся: травяные экстракты, соки, пиво, вино, ферментные растворы. А еще препараты, являющиеся биологически и лекарственно активными.
Нередко кристаллизация вещества посредством вымораживания сопровождается, впоследствии, сублимационной сушкой. Этот метод задействуется при производстве порошкообразных, предназначенных для растворения продуктов. Примеров полно – соки, чаи, кофе, супы, молоко, сливки, пюре, кисель, мороженое… всем знакомы эти порошки в пакетиках или банках, разведя которые в воде, удается получить готовый к употреблению продукт.
Кстати, еще вымораживание применяют для очистки сточных вод и обессоливания морских – чтобы получить чистую, без примесей. Даже воздух, иногда, разделяют. Криогенным способом, разумеется. Посредством вымораживания из него удается удалить пары диоксида углерода и воды.
Плавление и кристаллизация

Подробности Категория: Молекулярно-кинетическая теория 06.11.
2014 13:52 10986
Одно и то же вещество при определённых условиях может находиться в различных агрегатных состояниях — твёрдом, жидком или газообразном.
При переходе из одного состояния в другое состав молекул этого вещества не меняется. Изменяется только их расположение, характер теплового движения и силы межмолекулярного воздействия.
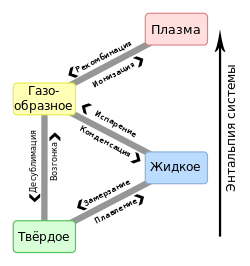
Из твёрдого состояния вещество переходит в жидкое, а из жидкого в газообразное. Такой переход называют фазовым переходом.
Плавление
При низких температурах все вещества замерзают и превращаются в твёрдые тела, атомы и молекулы в которых упакованы так плотно, что силы их взаимного притяжения позволяют им совершать только колебательные движения около положения равновесия. Поэтому при обычных условиях твёрдые тела сохраняют объём и форму.
Процесс перехода вещества из твёрдого состояния в жидкое называют плавлением. Это процесс происходит при повышении температуры.
Весной, когда пригревает солнышко, начинают таять снежные сугробы. Мельчайшие кристаллики льда, из которых состоит снег, превращаются в воду.
Но, несмотря на то, что воздух прогревается, и его температура становится выше нуля, температура тающего снега, и температура талой воды остаются равными 00С до тех пор, пока снег не растает совсем. Всё дело в том, что плавление происходит постепенно.
Вещество при плавлении поглощает тепло, которое получает извне, и некоторое время одновременно находится и в твёрдом, и в жидком состоянии. И его температура не меняется, пока всё оно не расплавится и не станет жидким.
Что происходит при нагревании твёрдого вещества? При повышении температуры скорость колебаний частиц внутри вещества увеличивается. Следовательно, увеличивается и его внутренняя энергия.
При определённой температуре, которую называют температурой плавления, кристаллическая решётка твёрдого тела начинает разрушаться. Молекулы получают большую свободу.
Чтобы твёрдое вещество начало плавиться, его необходимо нагреть до температуры плавления. Когда оно начинает получать тепло извне, некоторое время его температура будет расти прямо пропорционально времени нагревания.
Так будет до тех пор, пока оно не начнёт плавиться. Но как только его температура станет равной температуре плавления, она перестанет изменяться и будет постоянной, пока всё вещество не превратится в жидкость.
После этого температура жидкости снова начнёт повышаться.
Но если жидкость перестанет получать тепло, она начнёт остывать. И как только её температура снизится до значения, равного температуре плавления, начинается процесс кристаллизации.
Каждое вещество имеет свою температуру плавления. При нормальном давлении (760 мм рт.ст.) лёд начинает плавиться при 0оС. Самую высокую температуру плавления среди металлов имеет вольфрам — 3422 °C. Простое вещество углерод плавится при температуре 3500 — 4500 °C. А температура плавления спирта — минус 114оС.
Практический пример: значение скорости охлаждения для кристаллизации
В этом примере скорость охлаждения в конце процесса вызвала вторичное образование зародышей (зафиксировано зондом ParticleTrack с технологией FBRM), в результате чего образовалось множество мелких частиц. Это было обнаружено в режиме реального времени с помощью видеомикроскопа ParticleView с технологией PVM.
Увеличение скорости охлаждения раствора ведет к более быстрому пересыщению, в результате скорость образования зародышей кристаллов будет выше скорости их роста
Следовательно, чтобы получить нужное распределение кристаллов по размеру, чрезвычайно важно контролировать скорость охлаждения
Дисперсность кристаллов льда, например, влияет на вкус и консистенцию мороженого: так, кристаллы размером менее 50 мкм предпочтительнее кристаллов, которые больше 100 мкм. Она влияет и на технологические свойства распыляемых агрохимикатов: их частицы должны быть малы настолько, чтобы не засорять сопла при распылении, но при этом достаточно большими, чтобы их не уносило на соседние поля.
«Плавление и кристаллизация. Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления
Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
Кристаллизация растворов
Вода – замечательный растворитель. Вещества, растворенные в ней, сдвигают точку кристаллизации, как правило, в сторону понижения. Чем выше концентрация раствора, тем при более низкой температуре будет происходить замерзание. Ярким примером служит морская вода, в которой растворено много различных солей. Их концентрация в воде океанов составляет 35 промилле, и кристаллизуется такая вода при –1,9 °C. Соленость воды в разных морях сильно отличается, поэтому и точка замерзания бывает различной. Так, вода Балтики имеет соленость не более 8 промилле, и температура кристаллизации ее близка к 0 °C. Минерализованные грунтовые воды также замерзают при температурах ниже нуля. Следует иметь в виду, что речь всегда идет только о кристаллизации воды: морской лед практически всегда пресный, в крайнем случае слабосоленый.

Водные растворы различных спиртов тоже отличаются пониженной температурой замерзания, причем кристаллизация их протекает не скачкообразно, а с некоторым интервалом температур. Например, 40-процентный спирт начинает замерзать при -22,5 °C, а окончательно кристаллизуется при -29,5 °C.
А вот раствор такой щелочи, как едкий натр NaOH или каустик являет собой интересное исключение: ему свойственна повышенная температура кристаллизации.
Металлы
Они тоже кристаллизуются. Более того, все твердые металлы, которые мы видим и можем потрогать, являются результатом данного процесса. Превращения, происходящие параллельно, имеют огромное значение, поскольку они в значительной степени определяют свойства металлов.
Кристаллизация, как процесс, весьма интересна в данном случае. Пока вещество находится в жидком состоянии – атомы в нем непрерывно движутся. Естественно, все это время поддерживается соответствующая высокая температура. По мере ее понижения атомы сближаются, вследствие чего происходит их группирование в кристаллы. Так образуются «центры». То есть, первичные группы кристаллов. К ним, по мере замедления движения остальных атомов, присоединяются уже вторичные.
Поначалу кристаллы нарастают беспрепятственно. А те, которые уже образовались, не теряют правильности строения. Но потом кристаллы сталкиваются при дальнейшем движении. Вследствие их контакта форма портится. Однако внутри каждого кристалла строение по-прежнему остается правильным. Эти группы, кстати, именуются зернами. И образуются они не всегда. Все зависит от условий кристаллизации, при какой температуре она происходила (стабильной или нет), а также от природы самого металла.

О зернистости
Выше было многое сказано про удельную кристаллизацию, а также о различных методах, посредством которых осуществляется данный процесс. В продолжение темы металлов хотелось бы рассказать о пресловутой зернистости, причины возникновения которой описаны в предыдущем абзаце.
На самом деле, ее появление – признак плохой кристаллизации. Крупнозернистый металл является непрочным, практически не способен сопротивляться действительно высокому удару. В процессе ковке в нем появляются трещины. Также они образуются в зоне термического влияния. Чтобы уменьшить вероятность их образования, на производствах используют различные меры – модифицируют металл титановыми швами, например. Они способны предупредить рост зерна.
Для крупнозернистых металлов даже выдвигаются другие требования по предъявлению образцов. Их толщина должна быть как минимум 1,5 см. Только в таком случае удастся сравнить результаты механических и микромеханических испытаний.
Так что на производствах стремятся к получению металлов мелкозернистой структуры. Для этого создают особые условия – те, при которых возможна малая скорость роста кристаллов и максимальное число пресловутых центров, вокруг которых потом формируются их группы.
То, насколько крупными получатся зерна, зависит от количества частичек нерастворимых примесей. Обычно это сульфиды, нитриды и оксиды – они играют роль готовых центров кристаллизации.
Мелкозернистой структуры можно добиться посредством модифицирования – добавления в металлы посторонних веществ. Они делятся на два вида:
- Вещества, которые не растворяются в жидком металле. Играют роль дополнительных центров кристаллизации.
- Поверхностно-активные компоненты. В металлах растворяются. Впоследствии они оседают на поверхности растущих кристаллов и препятствуют их росту.
А качество полученного металла изучается посредством различных методов. Проводят термический, дилатометрический, магнитный анализ, структурные и физические исследования. Причем одним только способом выяснить информацию обо всех свойствах металла невозможно.

О скрытой теплоте
Особенности молекулярного строения воды весьма серьезно отражаются на ее свойствах. Это видно, в частности, по большой удельной теплоте кристаллизации воды. Она обусловлена именно наличием протонных связей, отличающим воду от прочих соединений, образующих молекулярные кристаллы. Установлено, что энергия водородной связи в воде составляет около 20 кДж на моль, то есть на 18 г. Значительная часть этих связей устанавливается «в массовом порядке» при замерзании воды – вот откуда берется такая большая отдача энергии.

Приведем несложный расчет. Пусть при кристаллизации воды выделилось 1650 кДж энергии. Это немало: эквивалентную энергию можно получить, например, при взрыве шести гранат-лимонок Ф-1. Подсчитаем массу подвергшейся кристаллизации воды. Формула, связывающая количество скрытой теплоты Q, массу m и удельную теплоту кристаллизации λ, очень проста: Q = – λ * m. Знак минуса означает просто, что тепло отдается физической системой. Подставляя известные величины, получим: m = 1650/330 = 5 (кг). Всего 5 литров нужно, чтобы целых 1650 кДж энергии выделилось при кристаллизации воды! Разумеется, энергия отдается не мгновенно – процесс длится в течение достаточно продолжительного времени, и теплота рассеивается.
Об этом свойстве воды прекрасно знают, например, многие птицы, и используют его, чтобы погреться возле замерзающей воды озер и рек, в таких местах температура воздуха на несколько градусов выше.
Термодинамический вид
Серия увеличения низкотемпературного СЭМ для снежного кристалла. Кристаллы захватываются, хранятся и покрываются платиной путем распыления при низких температурах для получения изображений.
Процесс кристаллизации, по-видимому, нарушает второй принцип термодинамики . В то время как большинство процессов, дающих более упорядоченные результаты, достигаются за счет применения тепла, кристаллы обычно образуются при более низких температурах, особенно при переохлаждении . Однако из-за выделения теплоты плавления во время кристаллизации энтропия Вселенной увеличивается, поэтому этот принцип остается неизменным.
Молекулы в чистом совершенном кристалле при нагревании внешним источником станут жидкими. Это происходит при четко определенной температуре (разной для каждого типа кристалла). Когда он разжижается, сложная архитектура кристалла разрушается. Плавление происходит потому, что увеличение энтропии ( S ) в системе за счет пространственной рандомизации молекул превышает потерю энтальпии ( H ) из-за нарушения сил упаковки кристалла:
- Т(Sжидкость-Sтвердый)>ЧАСжидкость-ЧАСтвердый,{\ displaystyle T (S _ {\ text {жидкость}} — S _ {\ text {solid}})> H _ {\ text {liquid}} — H _ {\ text {solid}},}
- граммжидкость<граммтвердый.{\ displaystyle G _ {\ text {liquid}} <G _ {\ text {solid}}.}
Что касается кристаллов, то из этого правила нет исключений. Точно так же, когда расплавленный кристалл охлаждается, молекулы возвращаются в свою кристаллическую форму, как только температура упадет выше точки поворота. Это связано с тем, что термическая рандомизация окружающей среды компенсирует потерю энтропии, которая возникает в результате переупорядочения молекул внутри системы. Такие жидкости, которые кристаллизуются при охлаждении, являются скорее исключением, чем правилом.
Природа процесса кристаллизации определяется как термодинамическими, так и кинетическими факторами, что может сделать его очень изменчивым и трудным для контроля. Такие факторы, как уровень примесей, режим смешивания, конструкция емкости и профиль охлаждения, могут иметь большое влияние на размер, количество и форму получаемых кристаллов.