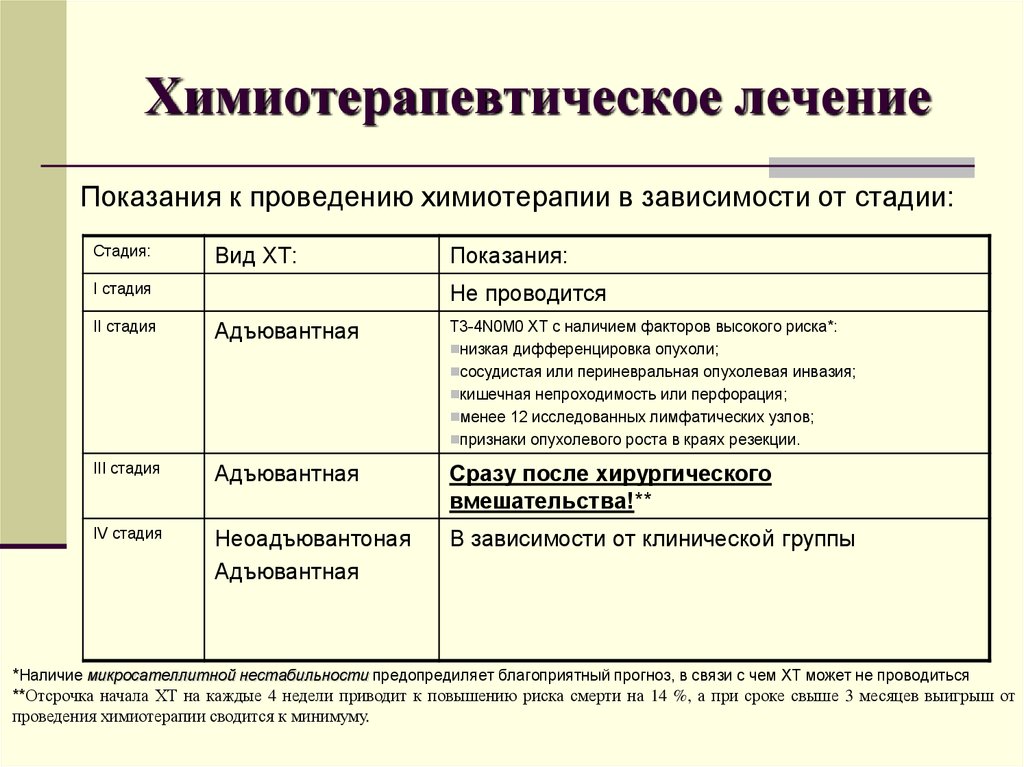
Методы иммунотерапии при лечении онкологии
Лечение рака иммунотерапиейпроисходит с помощью разнообразных методов. Они могут быть специфическими или неспецифическими.
Специфические
Специфическая иммунотерапия против рака основана на использовании вакцин, содержащих опухолевые антигены. Такая методика может быть очень эффективной. Ее рекомендуется проводить одновременно с неспецифической иммунотерапией (комбинированное лечение).
Специфическая иммунотерапия направлена на стимуляцию иммунной системы посредством введения опухоль-ассоциированных антигенов. Они вводятся в виде противоопухолевых вакцин. В их состав входят дендритные клетки, которые способствуют развитию противоопухолевых иммунных реакций в человеческом организме. Их применение восстанавливает и даже усиливает противоопухолевую устойчивость.
 Специфическая иммунотерапия рака основана на вакцинах
Специфическая иммунотерапия рака основана на вакцинах
Использование противоопухолевых вакцин в лечении рака легких 2-3 стадии повышает пятилетнюю выживаемость больных на 25%. А при раке яичников 3-4 стадии пятилетняя выживаемость повышается на 35%.
Неспецифические
Такие методы используются в основном для терапии инфекционных заболеваний, против возбудителей которых нет иммуноглобулинов. Это брюшной тиф, дизентерия и некоторые другие болезни.
При лечении рака используется редко. Их применение оправдано только на нулевой или первой стадии развития заболевания. Самым распространенным методом неспецифической иммунотерапии является переливание одногрупповой донорской крови – 100-200 мл в сутки. Но в этом случае существует риск инфицирования гепатитом, иммунодефицитом и некоторыми другими патологиями. Поэтому использовать такой метод рекомендуется только при наличии серьезных показаний.
Также к этой группе методов относится использование нативной плазмы крови, содержащей белки и иммуноглобулины. Такие вещества адсорбируют антигены, подавляют действие раковых клеток и препятствуют развитию онкологического заболевания.
Как проводится иммунотерапия аллергии
Иммунотерапия аллергеном может проводиться перорально или подкожно. Еще одно подразделение десенсибилизации зависит от продолжительности действия аллергенов. Предсезонная десенсибилизация применяется у людей с аллергией на сезонные аллергены, круглогодичная десенсибилизация – у людей с аллергией на аллергены, возникающей круглый год. Схема десенсибилизации к сезонным и многолетним аллергенам очень похожа, отличается только время начала терапии.
Аллергенная иммунотерапия в случае аллергии на аллергены, возникающей в течение года (например, на клещей домашней пыли), может быть начата в любое время, независимо от времени года. Терапия сезонных аллергенов может проводиться в предсезонной системе. Для пыльцы растений десенсибилизация начинается в осенне-зимний период и прекращается во время воздействия аллергенов, то есть в сезон пыльцы, или круглогодично — меньшие дозы аллергена вводятся в течение всего года.
Тип используемой иммунотерапии выбирается лечащим врачом на основании предыдущего собеседования и результатов анализов.
Лечение проходит в два этапа. Первый — врач вводит пациенту все более высокие дозы аллергена, пока не будет достигнут максимум. Затем пациент получает эту дозу во второй части лечения.
На практике это выглядит так:
- Первая фаза. В течение первых трех месяцев круглогодичной десенсибилизации вакцины вводятся с интервалом в 7–14 дней. Дозы вводимого аллергена постепенно увеличиваются до достижения максимального значения концентрации;
- Поддерживающая фаза. Постоянная поддерживающая доза аллергена вводится каждые 4-6 недель, а вся терапия длится от 3 до 5 лет в зависимости от чувствительности организма.
Схема предсезонной иммунотерапии немного отличается, в основном из-за более короткого времени десенсибилизации. В безаллергенный период пациенту вводят до десятка доз аллергена каждые 7-14 дней.
На успех десенсибилизации влияют внешняя среда и решения врача и пациента
Первое важное решение — это правильный выбор вакцины для пациента, т.е. какой тип аллергена и терапию выбрать
По этой причине необходимы диагностика и тщательное интервью с пациентом.
Из-за специфики десенсибилизации важно максимально устранить аллерген из окружающей среды. Независимо от используемой вакцины, десенсибилизацию лучше всего начинать при минимальном воздействии аллергенного фактора, то есть при:
- аллергии на пыльцу растений – в осенне-зимний период,
- круглогодичной аллергии – в момент наименьшей выраженности симптомов.
Только вакцины, принимаемые систематически и через определенные промежутки времени, гарантируют эффективность иммунотерапии, поэтому пациент обязан посещать кабинет аллерголога в среднем один раз в месяц. Тогда первые эффекты лечения будут видны через год терапии.

Прием аллерголога
К сожалению, иммунотерапия может быть неэффективной у людей, страдающих острой астмой и атопическим дерматитом.
Примерные сроки проявления осложнений
Сроки появления осложнений могут быть разными: как в ближайшее время после введения иммунного препарата, так и через несколько лет. Описаны случаи, когда осложнения возникали через пять лет после завершения терапии, поэтому необходимо всегда быть начеку. Как правило, более ранние осложнения – со стороны кожных покровов, более поздние – со стороны печени, и эндокринной системы.
Если пациент отмечает какие-либо непонятные неприятные изменения в своём состоянии: высыпания, расстройство стула, то не надо заниматься самолечением, а необходимо срочно обратиться к своему лечащему врачу-химиотерапевту. Он уже определит, нужно ли подключать дополнительно узких специалистов или назначит лечение, которое, как правило, будет успешным в плане коррекции возникших осложнений.
Многие осложнения могут представлять угрозу для жизни, например, очень выраженное расстройство стула способно привести к обезвоживанию, нарушению электролитного обмена и работы сердца. К лечащему врачу-онкологу необходимо обращаться на самых ранних этапах возникновения осложнений.
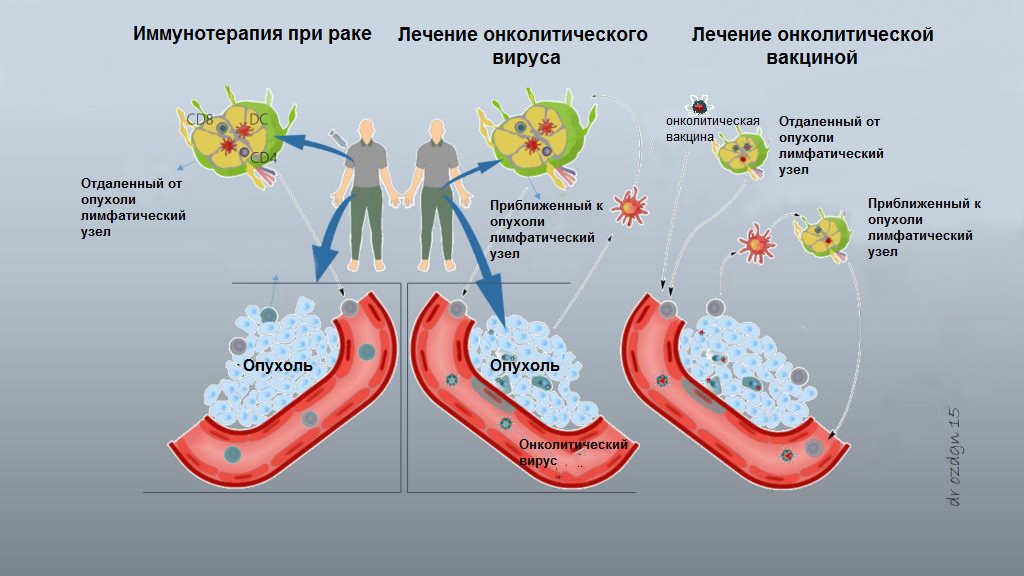
Вакцины против рака
Задачей вакцинации при онкологическом поражении является выработка у больного иммунного ответа на аномальные клеточные элементы, составляющие структуру определённой опухоли или похожей на неё по набору антигенов. Иммунотерапия, проводимая посредством противоопухолевых вакцин, вызывает в последнее время большой интерес среди учёных, т. к. позволяет создать в организме больного с помощью иммунизации препаратом с иммуногенными антигенами активный специфический иммунитет.
В настоящее время в онкологической практике используются 2 разновидности вакцин, помогающих бороться с онкологическими процессами:
- Клеточные, созданные на основе целых клеток. Среди них выделяют 2 типа – аутологичные и аллогенные. В первых содержатся собственные, предварительно инактивированные, клеточные элементы человека, а вторые являются донорскими, изготовленными из биоматериала другого пациента.
- Антигенные, содержащие не целые мутировавшие клетки, а только их фрагменты (белки, участки нуклеиновых кислот и т. д.). Они могут содержаться в однотипных или совершенно различных опухолях, поэтому показывают высокую эффективность при лечении онкоопухолей различной локализации.
Помимо вновь создаваемых средств для иммунизации человека от онкологии существуют и классические, давно зарекомендовавшие себя с положительной стороны, препараты. При некоторых типах онкологии, например, при раке шейки матки или нескольких разновидностях онкозболеваний печени, возникновение патологического процесса провоцируется вирусами, относящимися к группе онковирусов. В этом случае традиционно применяется иммунизация против этих патологических агентов, т. е. вводятся вакцины против вируса папилломы человека и гепатита В, способные предотвратить эти виды онкологии. Классической стала и вакцина БЦЖ для иммунотерапии рака мочевого пузыря, эффективно борющаяся с уротелиальными онкопоражениями.
Виды лечения
Так как иммунологические препараты могут по-разному воздействовать на иммунную систему организма, выделяют разные методики лечения:
- иммунокоррекция;
- иммуномоделирующая терапия;
- иммунореконструкция;
- аутосеротерапия;
- аутопиотерапия;
- заместительная иммунотерапия.
Для полного понимания принципа лечения рака иммунотерапией с каждым отдельным видом стоит ознакомиться более подробно.
Иммунокоррекция
Данный вид терапии направлен на восстановление правильной работы звеньев иммунной системы, которые не выполняют свои функции. В процессе проведения иммунокоррекции пациентам вводят препараты, которые усиливают защиту организма, например, в случае простуды, или же подавляют ее — при аутоиммунных заболеваниях или аллергиях.
Иммуномодулирующая терапия
Проводимая иммуномодулирующая терапия воздействует на все области иммунной системы, но принцип действия так же направлен либо на торможение, либо на активацию иммунитета. В первом случае пациентам назначаются иммунодепрессанты, а во втором иммуностимуляторы. Онкологические процессы при стимуляции естественной защиты организма могут не только затормаживаться, но и полностью останавливаться.

Иммунореконструкция
Назначение иммунореконструкции подразумевает пересадку стволовых клеток, что позволяет полностью восстановить и возобновить деятельность иммунитета. Стволовые клетки используются при лечении различных заболеваний и неоднократно доказывали свою эффективность, например, при лечении диабета, артроза, острого лейкоза, а также болезни Паркинсона и Альцгеймера. Уже длительное время клиники Израиля практикуют иммунореконструкцию и подтверждают высокую эффективность данной методики.
Аутосеротерапия
В случае проведения лечения этим методом иммунотерапии, пациентам делают инъекции крови, которая берется у них самих или же у доноров. Такую сыворотку изначально нагревают до 56 градусов, и при этой температуре выдерживают в течение получаса. Только после этого делают инъекцию пациенту. В зависимости от заболевания, курс терапии может длиться от 16 до 24 дней, при этом инъекции выполняются каждые два дня.
Аутопиотерапия
Этот вид иммунотерапии похож на аутосеротерапию, однако вместо сыворотки крови больным вводят их собственный гной. Это необходимо для того, чтобы организм начал самостоятельно вырабатывать антитела для борьбы с недугом. Инъекции выполняются на здоровых областях кожи, а курс лечения длится от одного до десяти дней.
Заместительная иммунотерапия
Иногда, при течении болезни в организме человека останавливается продуцирование белка иммуноглобулина, который подавляет развитие инфекции. Тогда его необходимо вводить с помощью инъекций. Этот вид иммунотерапии часто назначается пациентам с недугами, причиной которых стал иммунодефицит.
Иммунотерапия при различных видах рака
Этот метод зарекомендовал себя, как очень эффективный при различных видах рака. Он помогает при онкологии легких, яичников, молочных желез и других органов.
Рак легких
Рак легких – это самая распространенная разновидность рака. По смертности у мужчин он занимает первое место, а у женщин – третье.
При раке легких выделяется небольшое количество антигенов, на которые воздействуют иммунопрепараты. Тем не менее, иммунотерапия при раке легкихиспользуется, и достаточно успешно. Лучше всего такая терапия воздействует при немелкоклеточнойонкологии. А при мелкоклеточном раке и опухоли плевры результаты немного хуже.
При раке легкихмогут применяться такие виды иммунотерапии:
- применение моноклональных антител;
- использование ингибиторов веществ, которые подавляют иммунные реакции в организме;
- противоопухолевые вакцины;
- модификация иммунных клеток пациента на генном уровне – адаптивное перемещение Т-лимфоцитов.
В процессе лечения могут появиться некоторые трудности. Нередко у пациентов возникают побочные эффекты. Тем не менее, при новообразованиях в легких иммунотерапия широко применяется.
При раке груди
Иммунотерапия при раке молочной железы– это активно развивающееся направление в онкологии. Рак груди – это самое распространенное онкологическое заболевание у женщин, составляет 12% от всех случаев рака.
Онкологические новообразования в груди у женщин могут иметь различные молекулярно-генетические свойства. На некоторых клетках увеличивается выработка белка-рецептора HER-2. От этого раковые клетки начинают активно размножаться. HER-2позитивный рак наблюдается у каждой пятой пациентки.
Если после молекулярно-генетического анализа опухоли было обнаружено, что на ней есть белок HER-2, при раке молочной железы назначается иммунотерапия. Используемые препараты вводятся непосредственно в опухоль, поэтому эффект наступает быстрее, а здоровые ткани организма не повреждаются.
 Иммунотерапию часто использую при раке груди
Иммунотерапию часто использую при раке груди
Такие средства безопасные, поэтому их можно использовать в течение длительного времени и комбинировать с другими препаратами. Также у пациенток редко развивается резистентность, так как во время терапии могут применяться различные антигены.
Благодаря иммунотерапии опухоль при раке молочной железы (РМЖ) замедляет рост. Клетки перестают делиться, поэтому заболевание не прогрессирует. А со временем атипичные клетки начинают погибать. Поэтому пятилетняя выживаемость таких пациенток значительно повышается.
При других видах рака
Также иммунотерапия применяется и при других видах рака:
- При меланоме такой метод очень эффективен. Ведь заболевание быстро прогрессирует, появляются метастазы. А применение средств для повышения иммунитета хорошо помогает. Могут использоваться такие препараты: Кейтруда, Ервой, Опдиво и некоторые другие.
- Рак желудка. На 1-3 стадиях болезнь лечится хирургическим путем. А вот на 4 стадии, когда опухоль распространилась за пределы органа, и другие методы лечения не помогают, полезна иммунотерапия. Пациенту может быть назначен Трастузумаб, Рамуцирумаб или другое средство.
- Рак почек. В этом случае применяются препараты группы цитокинов или ингибиторов контрольных точек.
Таким образом, иммунотерапия эффективна при разных видах рака.
Механизм действия
Основной особенностью механизма действия препаратов, применяемых для И., является то, что они осуществляют свое действие через иммунокомпетентные клетки (или дополнительные факторы иммунитета — макрофаги, систему комплемента). Каждый препарат, применяемый для И., помимо главного направления действия (табл.), обладает и другими эффектами (напр., кортикостероиды, механизм действия которых на иммунную систему заключается в нарушении взаимодействия между лимфоцитами и макрофагами, обладают также противовоспалительным действием; иммуноглобулины, помимо своего основного заместительного эффекта, оказывают также стимулирующее действие на синтез антител и т. д.). Для характеристики всех средств, применяемых для И., главными являются два параметра: 1) направление действия — стимуляция, подавление или замещение иммунной системы; 2) точки приложения действия — Т- и В-лимфоциты.
Так, стимулирующая И. может усиливать скорость пролиферации и дифференцировки иммунокомпетентных клеток, причем этот эффект может быть как специфическим — вовлечение только клонов клеток, способных реагировать на данный антиген (туберкулин и др.), так и неспецифическим, когда в реакцию вовлекается значительная часть популяции иммунокомпетентных клеток. При этом некоторые препараты стимулируют преимущественно Т-лимфоциты (левомизол и др.), другие — B-лимфоциты (полиадинил: полиуридиновая к-та и др.). Подавляющая терапия может воздействовать как на отдельные клоны клеток (индукция толерантности, гипосенсибилизация), так и на целые популяции (иммунодепрессия). Иммунодепрессанты могут оказывать преимущественное действие на Т-лимфоциты (напр., АЛС) или на В-лимфоциты (напр., цитозин-арабинозид). Особым видом И. является пассивная И., когда реципиенту, нуждающемуся в соответствующем лечении, переносят готовые защитные факторы либо специфически сенсибилизированные к определенному антигену клетки или иммунную сыворотку, либо клетки, замещающие деятельность целой популяции (Т или В), или иммуноглобулины. Один из типов И.— адоптивная И.— с помощью продуктов клеток сенсибилизированных доноров или просто с помощью экстрактов иммунокомпетентных клеток клетки реципиента наделяются иммунными свойствами (так, напр., при введении «фактора переноса» — экстракта клеток, реагирующих на определенный антиген, — клетки реципиента, ранее не реагировавшие на этот антиген, восстанавливают свою реактивность).
Иммунотерапия рака желудка
Химиотерапия рака желудка переживает ренессанс, на сегодняшний день показано преимущество предоперационный ХТ в переводе ракового процесса из неоперабельного в подлежащий хирургическому лечению, а также несомненна роль цитостатиков в профилактике рецидива и метастазов после операции.
При генерализованном заболевании стандарты настаивают на использовании химиотерапии на первом и втором этапе. Пока единственное зарегистрированное при карциноме желудка иммуноонкологическое средство цирамза (рамуцирумаб) применяют после исчерпания эффекта двух последовательных комбинаций цитостатиков.
Цирамза тоже моноклональное антитело, оно воспрепятствует формированию новых сосудов в опухоли, для чего связывается с рецептором, отсекая доступ к нему ключевого медиатора ангиогенеза VEGF.
В клинических испытаниях цирамза увеличивала продолжительность жизни пациентов сравнительно с получавшей ХТ группой больных, поэтому комбинация цирамза вместе с паклитакселом включена в альтернативные схемы третьей линии лечения распространённой карциномы желудка.
Виды иммунотерапевтических препаратов
Специфические лечебные средства, используемые в биологической терапии, имеют разное действие – одни маркируют аномальные элементы, делая их мишенями для иммунной системы, другие выступают в роли киллеров, т. е. методично убивают помеченные клетки, а третьи предназначены для укрепления организма в целом. В настоящее время есть даже такие препараты иммунотерапии при раке, которые способны предотвратить его возникновение, например, риск развития онкопроцесса в шейке матки значительно снижается у представительниц прекрасного пола, привитых от вируса папилломы.
Все лекарственные средства, применяемые в биотерапии, относят к 3 группам:
- Противораковые вакцины специфического действия, предназначение которых заключается в уничтожении определённых аномальных клеток и онкогенных вирусов, способных проникнуть в организм.
- Неспецифические иммуностимуляторы. Данные средства способствуют активизации выработки бластов миелоидного ряда. Их предназначение не в борьбе против определённой опухоли, а в том, чтобы помочь иммунитету больного человека настроиться на борьбу со злокачественным процессом.
- Моноклональные антитела, группа белков, способных оказывать пагубное воздействие на конкретный тип опухолевой структуры.
Пробуждение силы. История Нобелевских открытий
Человеческий иммунитет — вообще-то настоящая армия безжалостных убийц, и после каждой «боевой операции» по обезвреживанию очередного противника их необходимо успокаивать и переводить из военного в мирное положение. Этот механизм снижает температуру до нормальных значений и прекращает воспаления, когда опасность миновала и заражение побеждено.
Нобелевская премия по физиологии и медицине в 2018 году была присуждена американцу Джеймсу Эллисону и японцу Тасуку Хондзё за их независимые открытия в одной и той же области: как именно происходит это переключение из агрессивного в спокойный режим.
Ни один из ученых поначалу не думал о лечении рака. Оба они хотели яснее понять работу иммунного ответа. К тому моменту было ясно, что и на поверхности Т-клеток, и на поверхности антиген-презентирующих клеток (APC) есть рецепторные молекулы, которые и действуют друг на друга, провоцируя или замедляя работу иммунитета. Был открыт TCR — T-клеточный рецептор, которым Т-клетки распознают «вражеские» белки, выставленные на APC. Нашли главный комплекс гистосовместимости MHC (major histocompatibility complex), с помощью которого АРС как раз и преподносят на опознание Т-клеткам кусочки чужеродных белков. Свою Нобелевку за открытие этого сценария получили в 1996 г. Питер Доэрти и Рольф Цинкернагель.
Ученые понимали, что рецепторы на поверхности Т-клеток работают совместно с ко-стимуляторами на поверхности APC. Белок CD28 с поверхности Т-клеток выделили еще в 1980 году, вскоре на поверхности APC нашли молекулу B7. В ходе экспериментов исследователи группы Эллисона перенесли ген B7 в раковые клетки, и те стали отторгаться здоровой тканью. Оказалось, B7 соединяется с CD28 на Т-клетке, и тем самым запускает ее работу: Т-клетка уничтожает клетку опухоли, на поверхности которой «торчит» белок B7.
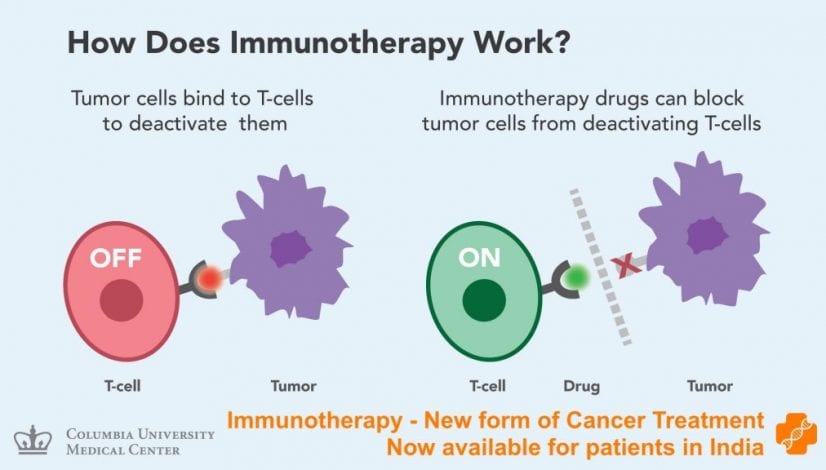
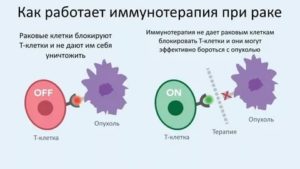
В 1987 году Эллисон обнаружил цитотоксический T-лимфоцитарный антиген-4 CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4) — и выяснил, что по структуре этот белок похож на давно известный CD28, и тоже способен связываться с B7 — однако при этом действует совершенно обратным образом: останавливает иммунную реакцию.

Действие CTLA-4
Сначала медики собирались использовать этот «тормоз», чтобы бороться с аутоиммунными заболеваниями (когда иммунитет начинает атаковать здоровые клетки организма). Но Эллисон придумал гениальную вещь: не давить на тормоз, а отключить его.
Он разработал антитело-ингибитор (выключатель), которое связывалось с CTLA-4 и не давало ему сомкнуться с B7, чтобы отключить иммунные реакции. Свободные молекулы B7 связывались с CD28, Т-клетка активировалась и снова была готова убивать. Когда он в 1995 году провел опыты на больных раком мышах, стало ясно, что от таких Т-лимфоцитов с отключенными тормозами не могут скрыться даже хитрые клетки раковой опухоли. В 2010 уже были проведены успешные исследования на безнадежных больных. У некоторых пациентов исчезла меланома вместе с метастазами — невероятный результат!

Действие ингибитора CTLA-4 — ипилимумаба
В то же время в Киото Тасуку Хондзё нашел на поверхности Т-клетки другую рецепторную молекулу: PD-1 (Рrogrammed cell Death protein-1, Белок Программируемой клеточной Смерти-1). В ходе экспериментов (снова на многострадальных мышках) японец выяснил, что отключение гена, кодирующего этот белок, провоцирует у мышей симптомы аутоимунного заболевания — то есть ингибирование PD-1 тоже отключало «тормоза» у Т-лимфоцитов и делало их агрессивными и активными.
Хондзё выяснил, что PD-1 переводит Т-клетку в «спящий режим», когда связывается с белком PD-L1/ PD-L2 на поверхности антиген-презентирующей клетки (APC). Ингибитор PD-1 размыкал эту связь и снова активировал Т-клетки. Действие этого «тормоза» было похоже на действие CTLA-4, но проходило другим маршрутом.

Действие ингибитора PD-L1 — ниволумаба
Обе открытые «тормозящие» молекулы, CTLA-4 и PD-1, назвали иммунными контрольными точками (checkpoints) — именно их количество и активность заставляют Т-клетки принимать решение: успокоиться или начать воевать.
Выяснилось, что блокаторы CTLA-4 активируют иммунитет в общем, все Т-клетки, а ингибитор PD-1 — более специфично действует именно на опухоли, т.к. многие раковые клетки несут на себе «второй кусочек паззла», молекулы PD-L1/ PD-L2. Из-за этого лечение ингибиторами PD-1 дает меньший риск осложнений.
Что такое иммунотерапия?
Для лучшего понимания методов и механизмов, с помощью которых иммунотерапия выполняет свои эффекты, необходимо знать некоторые из основных элементов иммунной системы.
Основными активными единицами в процессах иммунной системы являются лейкоциты, которые являются несколькими основными типами, а именно:
- B-лимфоциты: связанный с продуцированием антител против специфических антигенов
- Т-лимфоциты: клетки, которые находятся в непосредственном контакте с неопластическими клетками (посторонние клетки в целом) и сигналы другим активным активационным блокам иммунной системы (сигнализирующие о существовании существующей угрозы)
- NK-клетки: аббревиатура происходит от естественных клеток-киллеров или естественных киллерных клеток, которые участвуют в производстве конкретных веществ, предназначенных для связывания и последующего разрушения
Моноциты представляют собой тип белых кровяных клеток, которые проглатывают и переваривают посторонние частицы, а дендритные клетки служат формой представления и ознакомления с инородными клетками с иммунной системой.
Все эти клетки (и многие другие виды и подвиды) циркулируют в крови, обеспечивая надежную защиту от развития неожиданного вторжения патогенами.
Помимо защиты самих себя, эти клетки также участвуют в производстве различных веществ, участвующих в защите организма, наиболее важными из которых являются антитела и цитокины.
Специфические антитела отключают специфические антигены (посторонние вещества), а цитокины представляют собой белки, которые непосредственно атакуют чужеродные клетки или сигнализируют о необходимости усиления из других единиц, вовлеченных в иммунную систему.
Иммунотерапия использует различные компоненты иммунной системы, синтезированные в лаборатории (совершенно новый синтетический продукт или изменение существующего), выбирая их для выполнения определенных функций.
Методы иммунотерапии используют иммунную систему пациента (соответствующим образом модифицирует ее), изменяя ее, чтобы противостоять атакам неопластических клеток и других посторонних веществ, которые приводят к развитию болезни.
Биологическое лечение и, в частности, иммунотерапия направлено на:
- подавлять, останавливать или контролировать рост неопластических клеток
- превращение неопластических клеток в легко узнаваемые иммунной системой
- стимулирование активной системы в отношении истребления иностранных агентов
- прерывание процесса, ответственного за превращение нормальных здоровых клеток в неопластические клетки
- предотвращать распространение неопластических клеток в других органах и системах (состояние, которое клинически проявляется в развитии метастазов)
- увеличивая способность организма восстанавливать поврежденные клетки в результате других методов лечения (например, химиотерапию), тем самым снижая долгосрочные неблагоприятные эффекты из-за применяемых терапевтических методов.
Вакцины
Не разработана достаточно эффективная широкая спектральная (антивирусная) противоопухолевая вакцина, которая прошла все доклинические и клинические исследования, необходимые для ее утверждения и использования, но усилия специалистов в данной области направлены на синтез такого лекарственного средства.
В отличие от вакцин против инфекционных заболеваний, которые вводятся до заражения, и их основная цель состоит в том, чтобы предотвратить инфицирование (или передать инфекцию в мягкую форму в случае возможного заражения), вакцины, используемые в биологической терапии, направлены против определенных неопластических клеточных структур. Они применяются к существующему новообразованию в организме с основной целью подавления роста опухоли, снижением риска ее распространения и повышением эффективности других противоопухолевых терапий.
Создание вакцины, столь же эффективной против легочного, колоректального рака, рака молочной железы и т. д., значительно улучшит клиническое состояние большого числа пациентов с риском.
Известная вакцина БЦЖ, помимо профилактики туберкулеза, также находит применение в иммунотерапевтических методах. При его прямом использовании с катетером в мочевом пузыре вакцина является эффективным инструментом против карциномы in situ мочевого пузыря.