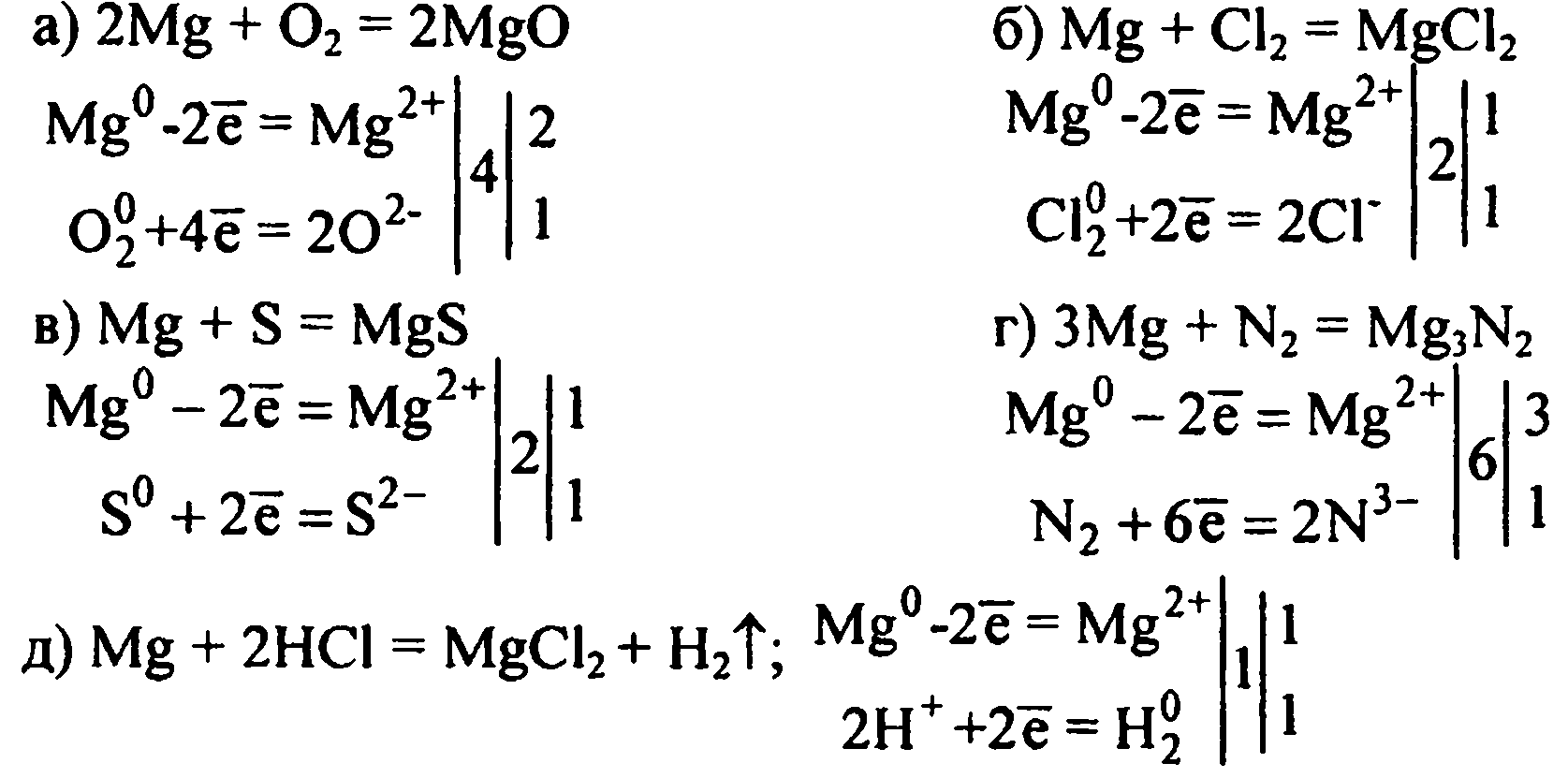Химические свойства:
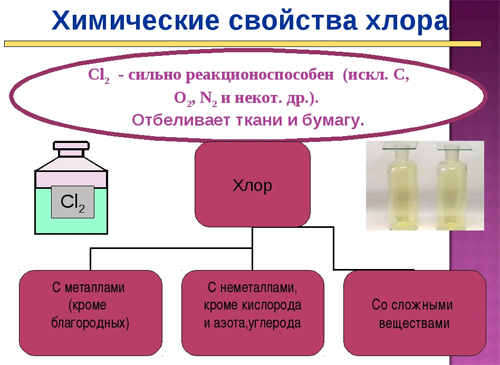
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы, металлами и неметаллами (кроме углерода, азота, кислорода и инертных газов). Хлор очень сильный окислитель, вытесняет менее активные неметаллы (бром, иод) из их соединений с водородом и металлами:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = I2 + 2NaCl
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли.
Cl2 + H2O HClO + HCl;
Хлор взаимодействует со многими органическими соединениями, вступая в реакции замещения или присоединения:
CH3-CH3 + xCl2 => C2H6-xClx + xHCl
CH2=CH2 + Cl2 => Cl-CH2-CH2-Cl
C6H6 + Cl2 => C6H6Cl + HCl
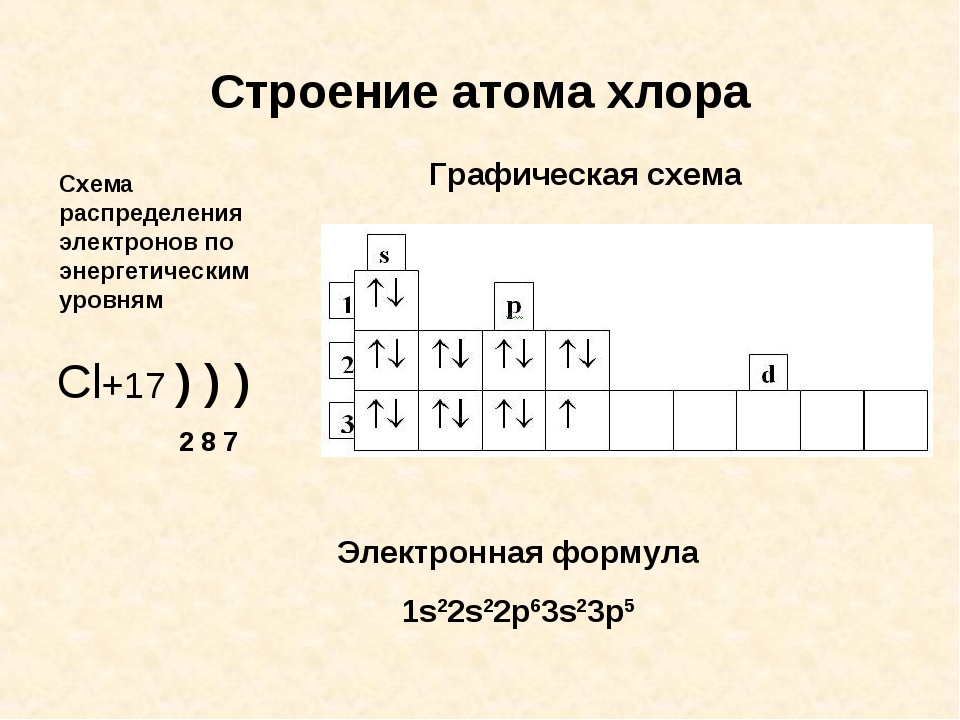
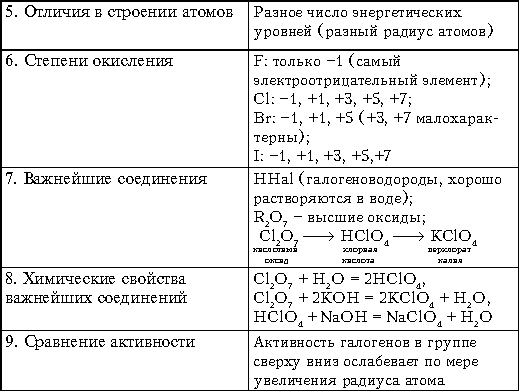
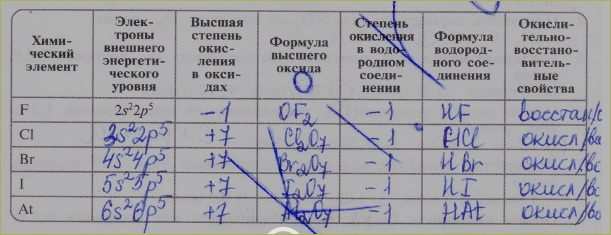
Хлор имеет семь степеней окисления: -1, 0, +1, +3, +4, +5, +7.
[править] Литература
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Горный энциклопедический словарь: в 3 т. / Под ред. В. С. Белецкого. — Донецк: Восточный издательский дом, 2001—2004.
- Ф. А. Деркач «Химия» Л., 1968.
| Общеядовитого действия | Циановодород (AC) • Хлорциан (CK) • Арсин (SA) • Фосфин (PH) • Угарный газ (CO) | ||||||
|---|---|---|---|---|---|---|---|
| Удушающего действия | Фосген (CG, Р-10 • Дифосген (DP) • Хлор (CL) | ||||||
| Кожно-нарывного действия | Иприт (HD) • Люизит (L, Р-43) • Метилдихлорарсин (MD) • Этилдихлорарсин (ED) • Фенилдихлорарсин (PD) • Сесквииприт (Q) • Азотистые иприты (Газ HN1, Газ HN2, Газ HN3) • Кислородный иприт (T) | ||||||
| Нервно-паралитического действия |
|
||||||
| Раздражающего действия (ирританты) |
|
||||||
| Психохимического действия (инкапаситанты) |
Хинуклидил-3-бензилат (BZ, Р-78) • Фенциклидин (SN) • ЛСД (K) • Апоморфин • EA 3167 | ||||||
| Болевого действия (алгогены) | 1-метокси-1,3,5-циклогептатриен (CH) | ||||||
| Метаболические яды (цитотоксиканты) |
1,2-дихлорэтан • Оксид этилена • Полихлордибензодиоксины (ПХДД) • Полихлордибензофураны (ПХДФ) |
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
|
Хлор в жизни организмов и растений
Хлор входит в состав практически всех живых организмов. Особенность состоит в том, что присутствует он не в чистом виде, а в виде соединений.
В организмах животных и человека ионы хлора поддерживают осмотическое равенство. Вызвано это тем, что они имеют наиболее подходящий радиус для проникновения в мембранные клетки. Наряду с ионами калия Cl регулирует водно-солевой баланс. В кишечнике ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы предусмотрены во многих клетках нашего организма. Посредством их происходит межклеточный обмен жидкостями и поддерживается pH клетки. Порядка 85 % от общего объема этого элемента в организме пребывает в межклеточном пространстве. Выводится из организма по мочеиспускательным каналам. Вырабатывается женским организмом в процессе кормления грудью.
На данном этапе развития тяжело однозначно сказать, какие именно заболевания провоцирует хлор и его соединения. Связано это с недостатком исследований в этой области.
Также ионы хлора присутствуют в клетках растений. Он активно принимает участие в энергетическом обмене. Без этого элемента невозможен процесс фотосинтеза. С его помощью корни активно впитывают необходимые вещества. Но большая концентрация хлора в растениях способна оказывать пагубное влияние (замедление процесса фотосинтеза, остановка развития и роста).

Однако существуют такие представители флоры, которые смогли «подружиться» или хотя бы ужиться с данным элементом. Характеристика неметалла (хлора) содержит такой пункт, как способность вещества окислять почвы. В процессе эволюции упомянутые выше растения, называемые галофитами, заняли пустые солончаки, которые пустовали из-за переизбытка этого элемента. Они впитывают ионы хлора, а после избавляются от них при помощи листопада.
[править] Распространение в природе
Хлор — достаточно распространенный элемент. В свободном состоянии в природе он не встречается, так как в химическом отношении хлор очень активен. Самым распространенным природным соединением хлора является хлорид натрия NaCl, огромные количества которого растворены в воде морей, океанов и некоторых озер. Во многих местах хлорид натрия в виде минерала галита (или каменной соли) образует мощные залежи. Богатые залежи очень чистой каменной соли расположены в районах Соль-Илецка на Южном Урале и Артёмовска на Донбассе.
Кроме того, очень распространенными соединениями хлора является хлорид калия KCl и хлорид магния MgCl2. Хлорид калия и хлорид натрия образуют минерал сильвинит KCl·NaCl, мощные месторождения которого расположены на Украине (города Калуш и Стебник), а хлорид калия и хлорид магния образуют минерал карналлит KCl·MgCl2·6H2O, большие залежи которого имеются на Урале.
Свойства хлора
Хлор представляет собой химически активный неметалл, принадлежащий группе галогенов. Входит в таблицу Менделеева под атомарным номером 17. При нормальных условиях представляет собой газ, имеющий удушливый запах и желто-зеленый оттенок. Он ядовит, тяжелее воздуха в 3 раза.
Свойства хлора заключаются в том, что из-за высокой химической активности, он вступает в реакцию почти со всеми элементами таблицы. Поэтому вещество практически не встречается в чистом виде. В природе его можно встретить лишь в составе минералов: сильвина, бишофита, галита, сильвина, карналитта и др. На воздействие щелочей и воды, реагирует переходом в хлорноватистую и соляную кислоту.
В 1772 г. вещество впервые было получено Джозефом Пристли в результате эксперимента. Однако не в чистом виде, а как соединение с водородом. А уже через 2 года было получено вещество в чистом виде. Для проведения эксперимента шведский химик Карл Вильгельм Шееле использовал диоксид марганца и хлороводород.
Однако из-за выраженного запаха вещество долго причисляли к одной из форм соляной кислоты. Химик Г. Дэви в 1811 году сумел доказать ошибочность этого суждения. В ходе эксперимента ему удалось разложить поваренную соль на два компонента: натрий и хлор. Он же предложил для нового вещества название – хлорин. Оно переводится с греческого как «зеленый», что намекает на природный цвет газа. А еще через год Ж. Гей-Люссак уменьшил его до «хлор».
История получения.
Хлор, вероятно, получали еще алхимики, но его открытие и первое исследование неразрывно связано с именем знаменитого шведского химика Карла Вильгельма Шееле. Шееле открыл пять химических элементов – барий и марганец (совместно с Юханом Ганом), молибден, вольфрам, хлор, а независимо от других химиков (хотя и позже) – еще три: кислород, водород и азот. Это достижение впоследствии не смог повторить ни один химик. При этом Шееле, уже избранный членом Шведской королевской академии наук, был простым аптекарем в Чёпинге, хотя мог занять более почетную и престижную должность. Сам Фридрих II Великий, прусский король, предлагал ему занять пост профессора химии Берлинского университета. Отказываясь от подобных заманчивых предложений, Шееле говорил: «Я не могу есть больше, чем мне нужно, а того, что я зарабатываю здесь в Чёпинге, мне хватает на пропитание».
Многочисленные соединения хлора были известны, конечно, задолго до Шееле. Этот элемент входит в состав многих солей, в том числе и самой известной – поваренной соли. В 1774 Шееле выделил хлор в свободном виде, нагревая черный минерал пиролюзит с концентрированной соляной кислотой: MnO2 + 4HCl Cl2 + MnCl2 + 2H2O.
Вначале химики рассматривали хлор не как элемент, а как химическое соединение неизвестного элемента мурия (от латинского muria – рассол) с кислородом. Считалось, что и соляная кислота (ее называли муриевой) содержит химически связанный кислород. Об этом «свидетельствовал», в частности, такой факт: при стоянии раствора хлора на свету из него выделялся кислород, а в растворе оставалась соляная кислота. Однако многочисленные попытки «оторвать» кислород от хлора ни к чему не привели. Так, никому не удалось получить углекислый газ, нагревая хлор с углем (который при высоких температурах «отнимает» кислород от многих содержащих его соединений). В результате подобных опытов, проведенных Гемфри Дэви, Жозеф Луи Гей-Люссаком и Луи Жаком Тенаром, стало ясно, что хлор не содержит кислорода и является простым веществом. К тому же выводу привели и опыты Гей-Люссака, который проанализировал количественное соотношение газов в реакции хлора с водородом.
В 1811 Дэви предложил для нового элемента название «хлорин» – от греч. «хлорос» – желто-зеленый. Именно такой цвет имеет хлор. Этот же корень – в слове «хлорофилл» (от греч. «хлорос» и «филлон» – лист). Спустя год Гей-Люссак «сократил» название до «хлора». Но до сих пор англичане (и американцы) называют этот элемент «хлорином» (chlorine), тогда как французы – хлором (chlore). Приняли сокращенное название и немцы – «законодатели» химии на протяжении почти всего 19 в. (по-немецки хлор – Chlor). В 1811 немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (от греческих «халс» – соль, и «геннао» – рождаю). Впоследствии этот термин закрепился не только за хлором, но и за всеми его аналогами по седьмой группе – фтором, бромом, иодом, астатом.
В 1826 шведский химик Йёнс Якоб Берцелиус, уточнив полученные им же ранее данные, определил для хлора атомную массу 35,41, которая отличается от современной лишь на 0,1%! Это поразительный результат, если учесть качество оборудования, с которым работал знаменитый химик. Основной инструмент для определения атомных масс – весы. Когда-то каждый экземпляр точных аналитических весов изготовлялся мастером вручную, и стоили хорошие весы очень дорого. Поэтому лишь немногие очень богатые химики могли похвастаться такими весами. Сам Берцелиус имел в молодые годы плохо оборудованную лабораторию с довольно грубыми весами, поэтому для получения надежных результатов он был вынужден повторять один и тот же анализ по 20–30 раз! В течение 10 лет Берцелиус опубликовал результаты анализа 2000 соединений, образованных 43 элементами, и труд, затраченный им на эту колоссальную работу, превосходит всякое воображение. Спустя почти столетие другой знаменитый химик, один из первых лауреатов Нобелевской премии по химии Вильгельм Оствальд, увидев в музее оборудование, с которым работал Берцелиус, сказал: «Мне стало совершенно ясно, как мало зависит от прибора и как много от человека, который перед ним сидит».
Применение хлора
Хлор – химический элемент, используемый для производства соляной кислоты, не только в желудке.
Соляную кислоту с помощью 17-го вещества получают и вне организма. Соединение пригождается при дублении и окрашивании кож, на производстве активированного угля, синтетических красителей и органических полупродуктов.

Без хлора не обойтись и в гальванопластике. В составе соляной кислоты элемент нужен при изготовлении различных клеев и гидролизного спирта.
Обеззараживающая характеристика элемента пригождается теперь не в госпиталях, а в обработке водопроводной воды.
Ее хлорирование применяется больше века. Появилась альтернатива – озонирование. Хлор воду обеззараживает, но может негативно влиять на организм. Ресурсоснабжающие организации волнует еще и то, что 17-е вещество разъедает трубы.
Следовательно, сети чаще требуют ремонта и замены. Это убытки. Однако, пока, озонирование – лишь перспектива, а не реалии сегодняшнего дня.
Метод затратнее хлорирования, а результаты обработки воды не столь впечатляющие. В металлургии активный хлор участвует в процессах получения ниобия, титана, тантала. Это редкие и ценные металлы, так что у 17-го элемента важная роль. Уважают вещество и аграрии. Они закупают хлорорганические соединения.
С их помощью борются с сорняками. Чтобы отравление хлором «не заработали» и культурные растения, они должны быть двудольными. Реагент пагубно действует лишь на однодольные побеги. Содержат хлор и инсектициды. Эти соединения направлены уже на вредителей-насекомых.
Инсектициды убивают их избирательно, оставляя нетронутыми растения и полезные микроорганизмы. Потребность человеческого организма – 800 миллиграммов в сутки. Получают их не только из соли.

Продукты содержащие хлор
Помогут морская рыба, а так же, яйца, стручковый горох, гречка и рис. Рыбу заменяют устрицами и морскими огурцами.
Ионы хлора из них поддерживают осмотическое равновесие систем организма и регулируют водно-соляной обмен. Орган, в котором сосредоточенна основная масса 17-го элемента – кожа. Хлор в ней должен постоянно обновляться, поскольку выводится с потом и мочой.
В них переходит почти столько же вещества, сколько потребляется. Поэтому, хлор должен присутствовать в рационе всегда.
История открытия:
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческого clwroz — «зелёный».
Хлор как яркий представитель неметаллов
Неметаллы – простые вещества, которые включают в себя газы и жидкости. В большинстве случаев они хуже проводят электрический ток, чем металлы, и имеют существенные различия в физико-механических характеристиках. При помощи высокого уровня ионизации способны образовывать ковалентные химические соединения. Ниже будет дана характеристика неметалла на примере хлора.
Как уже было сказано выше, этот химический элемент представляет собой газ. В нормальных условиях у него полностью отсутствуют свойства, сходные с таковыми у металлов. Без сторонней помощи не может взаимодействовать с кислородом, азотом, углеродом и др. Свои окислительные свойства проявляет в связях с простыми веществами и некоторыми сложными. Относится к галогенам, что ярко отражается на его химических особенностях. В соединениях с остальными представителями галогенов (бром, астат, йод), вытесняет их. В газообразном состоянии хлор (характеристика его — прямое тому подтверждение) хорошо растворяется. Является отличным дезинфектором. Убивает только живые организмы, что делает его незаменимым в сельском хозяйстве и медицине.
[править] Промышленное производство
В технике хлор получают электролизом водного раствора хлорида натрия NaCl. Хлорид натрия в водном растворе диссоциирует на ионы натрия и хлора:
- NaCl ⇌ Na+ + Cl−
Молекулы воды также частично диссоциируют:
- H2O ⇌ H+ + OH−
Таким образом, к катоду привлекаются катионы натрия и катионы водорода, а к аноду — анионы хлора и анионы гидроксила. Катионы водорода восстанавливаются легче, чем катионы натрия, а анионы хлора окисляются легче, чем анионы гидроксила. Поэтому на катоде выделяется водород, а аноде — хлор. Электродные реакции можно обозначить такими уравнениями:
- Катод: 2Н+ + 2е = Н2↑
- Анод: 2Cl− − 2е = Cl2↑
Катионы натрия и анионы гидроксила все время накапливаются в растворе и образуют гидроксид натрия NaOH. Он реагирует с хлором, частично растворяется в воде, образуя гипохлорит и хлорид натрия
NaOH + Cl2 → NaCl + NaOCl
Раствор NaClO используют как отбеливатель.
Хлор как отравляющий газ.
Получивший хлор Шееле отметил его очень неприятный резкий запах, затруднение дыхания и кашель. Как потом выяснили, человек чувствует запах хлора даже в том случае, если в одном литре воздуха содержится лишь 0,005 мг этого газа, и при этом он уже оказывает раздражающее действие на дыхательные пути, разрушая клетки слизистой оболочки дыхательных путей и легких. Концентрация 0,012 мг/л переносится с трудом; если же концентрация хлора превышает 0,1 мг/л, он становится опасным для жизни: дыхание учащается, становится судорожным, а затем – все более редким, и уже через 5–25 минут происходит остановка дыхания. Предельно допустимой в воздухе промышленных предприятий считается концентрация 0,001 мг/л, а в воздухе жилых районов – 0,00003 мг/л.
Петербургский академик Товий Егорович Ловиц, повторяя в 1790 опыт Шееле, случайно выпустил значительное количество хлора в воздух. Вдохнув его, он потерял сознание и упал, потом в течение восьми дней страдал от мучительной боли в груди. К счастью, он выздоровел. Чуть не умер, отравившись хлором, и знаменитый английский химик Дэви. Опыты даже с небольшим количеством хлора опасны, так как могут вызвать сильное поражение легких. Рассказывают, что немецкий химик Эгон Виберг одну из своих лекций о хлоре начал словами: «Хлор – ядовитый газ. Если я отравлюсь во время очередной демонстрации, вынесите меня, пожалуйста, на свежий воздух. Но лекцию при этом придется, к сожалению, прервать». Если же выпустить в воздух много хлора, он становится настоящим бедствием. Это испытали на себе во время Первой мировой войны англо-французские войска. Утром 22 апреля 1915 германское командование решило провести первую в истории войн газовую атаку: когда ветер подул в сторону противника, на небольшом шестикилометровом участке фронта в районе бельгийского городка Ипр были одновременно открыты вентили 5730 баллонов, каждый из которых содержал 30 кг жидкого хлора. В течение 5 минут образовалось огромное желто-зеленое облако, которое медленно уходило от немецких окопов в сторону союзников. Английские и французские солдаты оказались полностью беззащитными. Газ проникал через щели во все укрытия, от него не было спасения: ведь противогаз еще не был изобретен. В результате было отравлено 15 тысяч человек, из них 5 тысяч – насмерть. Через месяц, 31 мая немцы повторили газовую атаку на восточном фронте – против русских войск. Это произошло в Польше у города Болимова. На фронте 12 км из 12 тысяч баллонов было выпущено 264 тонны смеси хлора со значительно более ядовитым фосгеном (хлорангидридом угольной кислоты COCl2). Царское командование знало о том, что произошло при Ипре, и тем не менее русские солдаты не имели никаких средств защиты! В результате газовой атаки потери составили 9146 человек, из них только 108 – в результате ружейного и артиллерийского обстрела, остальные были отравлены. При этом почти сразу же погибло 1183 человека.
Вскоре химики указали, как спасаться от хлора: надо дышать через марлевую повязку, пропитанную раствором тиосульфата натрия (это вещество применяется в фотографии, его часто называют гипосульфитом). Хлор очень быстро реагирует с раствором тиосульфата, окисляя его:
Na2S2O3 + 4Cl2 + 5H2O 2H2SO4 + 2NaCl + 6HCl. Конечно, серная кислота тоже не безвредное вещество, но ее разбавленный водный раствор намного менее опасен, чем ядовитый хлор. Поэтому у тиосульфата в те годы появилось еще одно название – «антихлор», но первые тиосульфатные противогазы были мало эффективны.
В 1916 русский химик, будущий академик Николай Дмитриевич Зелинский изобрел действительно эффективный противогаз, в котором ядовитые вещества задерживали слоем активированного угля. Такой уголь с очень развитой поверхностью мог задержать значительно больше хлора, чем пропитанная гипосульфитом марля. К счастью, «хлорные атаки» остались лишь трагическим эпизодом в истории. После мировой войны у хлора остались только мирные профессии. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Изучение хлора
Будущим химикам должна быть известна характеристика хлора. По плану 9-классники могут даже ставить лабораторные опыты с этим веществом на основе базовых знаний по дисциплине. Естественно, преподаватель обязан провести инструктаж по технике безопасности.
Порядок работ следующий: необходимо взять колбу с хлором и насыпать в неё мелкую металлическую стружку. В полете стружка вспыхнет яркими светлыми искрами и одновременно образуется легкий белый дым SbCl3. При погружении в сосуд с хлором оловянной фольги она также самовоспламенится, а на дно колбы медленно опустятся огненные снежинки. Во время этой реакции образуется дымная жидкость – SnCl4. При помещении железной стружки в сосуде образуются красные «капли» и появится рыжий дым FeCl3.
Наряду с практическими работами повторяется теория. В частности, такой вопрос, как характеристика хлора по положению в периодической системе (описана в начале статьи).

В результате опытов выясняется, что элемент активно реагирует на органические соединения. Если поместить в банку с хлором вату, смоченную предварительно в скипидаре, то она мгновенно воспламенится, и из колбы резко повалит сажа. Эффектно тлеет желтоватым пламенем натрий, а на стенках химпосуды появляются кристаллы соли. Ученикам будет небезынтересно узнать, что, будучи ещё молодым химиком, Н. Н. Семенов (впоследствии лауреат Нобелевской премии), проведя такой опыт, собрал со стенок колбы соль и, посыпав ею хлеб, съел его. Химия оказалась права и не подвела ученого. В результате проведенного химиком опыта действительно получилась обычная поваренная соль!
Свойства хлора
Хлор – элемент газообразный. Цвет у него желто-зеленый. Название 17-го элемента с греческого так и переводиться. Однако, ткани и бумагу вещество отбеливает. Правда, для этого нужна хлорноватистая кислота – итог взаимодействия хлора с водой.
В 18-ом веке, когда 17-е вещество только открыли, говорили «хлорная вода», не зная о том, что имеют дело с кислотой.
В начале 19-го века ей начали ополаскивать свои руки медики. Такая практика была введена, к примеру, в одном из госпиталей Вены. Врачи, конечно, не хотели отбелить руки. Хлорная вода служила обеззараживающим средством. Способность 17-го элемента убивать болезнетворные бактерии заметили в конце 18-го столетия.
Раствор хлора – одно из примерно 200-от его соединений. В чистом виде элемент не встречается. Причина – высокая химическая активность. Вещество обязательно вступает во взаимодействие с «соседями». Однако, чистый хлор, все же, получен.

Первый удачный опыт проведен в 1774-ом году Карлом Шеелем. Это шведский химик. Он соединил соляную кислоту с пиролюзитом оксида марганца.
Понадобились предосторожности в работе с газом, ведь он токсичен. Если хлор попадает в легкие, то вызывает удушье и ожоги
Поэтому, в дыхательной системе, точнее в ее кровотоках, находят лишь соединения хлора. Общее содержание 17-го вещества в организме человека – 0,25% от массы.
Жидкий хлор – часть соляной кислоты, находящейся в желудке человека. 17-ый элемент в реагенте играет не только обеззараживающую роль, но и расщепляет пищу.
Получается, хлор, опасный в газообразном состоянии, приносит пользу в виде соединений, к примеру, той же поваренной соли.

Съесть ее, кстати, хочется, чтобы поддержать выработку соляной кислоты в желудке. Это подсознательная тяга организма. Не зря же животные в лесах, в частности, лоси, находят солончаки и лижут так называемую «белую смерть». Так смерть ли это?
Как видно, роль хлора весьма относительна. Он может быть благом, а может и ядом. В последнем амплуа элемент использовали немецкие войска.
Они распыляли желтоватый газ на врагов во время первой мировой войны. Это один из дебютных примеров использования химического оружия. Соединение калий-хлор вкупе с кислородом взрывоопасно, что тоже могло бы пригодиться на войне, но используется в другой сфере – пиротехнической.
Вещество – составная фейерверков, выступает не только в роли взрывчатки, но и красителя. Найти соединение хлора с кислородом и калием можно и на некоторых спичках. Впрочем, о применении 17-го элемента поговорим отдельно.
Важнейшие соединения:
Хлороводород HCl — бесцветный газ, на воздухе дымит вследствие образования с парами воды капелек тумана. Обладает резким запахом, сильно раздражает дыхательные пути. Содержится в вулканических газах и водах, в желудочном соке. Химические свойства зависят от того, в каком состоянии он находится (может быть в газообразном, жидком состоянии или в растворе). Раствор HCl называется соляной (хлороводородной) кислотой. Это сильная кислота, вытесняет более слабые кислоты из их солей. Соли — хлориды — твёрдые кристаллические вещества с высокими температурами плавления.
Ковалентные хлориды — соединения хлора с неметаллами, газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства, как правило легко гидролизующиеся водой с образованием соляной кислоты:
PCl5 + 4H2O = H3PO4 + 5HCl;
Оксид хлора(I) Cl2O., газ буровато-желтого цвета с резким запахом. Поражает дыхательные органы. Легко растворяется в воде, образуя хлорноватистую кислоту. Хлорноватистая кислота HClO. Существует только в растворах. Это слабая и неустойчивая кислота. Легко разлагается на соляную кислоту и кислород. Сильный окислитель. Образуется при растворении хлора в воде. Соли — гипохлориты, малоустойчивы (NaClO*H2O при 70 °C разлагается со взрывом), сильные окислители. Широко используется для отбеливания и дезинфекции хлорная известь, смешанная соль Ca(Cl)OClХлористая кислота HClO2, в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается. Кислота средней силы, соли — хлориты, как правило, бесцветны и хорошо растворимы в воде. В отличие от гипохлоритов, хлориты проявляют выраженные окислительные свойства только в кислой среде. Наибольшее применение (для отбелки тканей и бумажной массы) имеет хлорит натрия NaClO2.Оксид хлора(IV) ClO2, — зеленовато-желтый газ с неприятным (резким) запахом, …Хлорноватая кислота , HClO3 — в свободном виде нестабильна: диспропорционирует на ClO2 и HClO4. Соли — хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Это сильные окислители, в смеси с восстановителями взрывоопасны. Хлорат калия (бертолетова соль) — KClO3, использовалась для получения кислорода в лаборатории, но из-за высокой опасности её перестали применять. Растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.Хлорная кислота HClO4, в водных растворах хлорная кислота — самая устойчивая из всех кислородсодержащих кислот хлора. Безводная хлорная кислота, которую получают при помощи концентрированной серной кислоты из 72%-ной HСlO4 мало устойчива. Это самая сильная одноосновная кислота (в водном растворе). Соли — перхлораты, применяются как окислители (твердотопливные ракетные двигатели).
Нехватка хлора
Гипохлоремия – недостаточный уровень хлора в крови. Подобное состояние встречается редко, так как обычно возникает избыток. Ведь хлорид входит в состав поваренной соли. А она присутствует почти во всех продуктах и приготовленных блюдах.
Однако вызвать гипохлоремию могут следующие факторы:
- длительное голодание;
- гипергидроз;
- синдром Кушинга;
- использование слабительных и диуретиков;
- бессолевой рацион;
- заболевания почек;
- пищевое отравление, вызывающее рвоту и диарею;
- ожоги, затрагивающие большую площадь кожного покрова;
- сердечная недостаточность, перешедшая в хроническую стадию;
- искусственное вскармливание;
- болезнь Аддисона;
- язва желудка;
- травма черепа, затронувшая гипоталамус.
О нехватке хлора сигнализирует:
- судороги;
- выпадение волос;
- крошащиеся зубы;
- сонливость;
- отечность;
- отсутствие аппетита;
- повышенная температура тела;
- истощение;
- депрессия;
- варикоз;
- нарушение координации;
- сухость кожных покровов;
- тошнота;
- снижение артериального давления.
Хлор в природе.
Хлора в земное коре не очень много – всего 0,017%, причем в свободном состоянии он встречается лишь в небольших количествах в вулканических газах. В списке самых распространенных элементов хлор находится в конце второго десятка. Хлора меньше, чем даже ванадия и циркония (но больше, чем хрома, никеля, цинка, меди и азота). При этом хлор очень сильно распылен: небольшие количества этого элемента входят в состав множества различных минералов и горных пород. Очень высокая химическая активность хлора приводит к тому, что в природе он встречается, как правило, в виде соединений, в сочетании с натрием, калием, магнием, кальцием.
Хлор образует около ста минералов; главным образом это хлориды легких металлов – щелочных и щелочноземельных. Самый распространенный среди них – галит NaCl. Реже встречаются хлориды калия, кальция, магния. Из них наиболее распространены бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O, сильвин KCl, сильвинит NaCl·KCl, каинит KCl·MgSO4·3H2O, тахигидрит CaCl2·2MgCl2·12H2O. В виде таких соединений хлор содержится в соляных пластах, образовавшихся при высыхании древних морей. Особенно мощные залежи образует галит и калийные соли; их запасы оцениваются гигантским числом – более 10 триллионов тонн!
Очень много хлора содержится в морской воде – в среднем 1,9%. Происходит это потому, что хлор вымываемый из пород, нигде не может задержаться (почти все хлориды металлов растворимы) и выносится реками в моря и океаны. Но не следует думать, что попавший в морскую воду хлор уже не может вернуться на материки. В обратной миграции хлора большую роль играет ветер, уносящий соленую пыль с поверхности океанов, морей и соленых озер. Так хлор участвует в круговороте веществ. Но в засушливых и пустынных районах в результате интенсивного испарения воды концентрация хлора в грунтовых водах сильно повышается. Так образуются солончаки, особенно в низинах. Из различных источников ежегодно в мире добывают сотни миллионов тонн хлора.
Растворы хлоридов – обязательная составная часть живых организмов. Содержание хлора в теле человека 0,25%, в плазме крови – 0,35%. В теле взрослого человека содержится более 200 г хлорида натрия, из которых 45 г растворено в крови. В продуктах питания и природной воде часто недостаточно хлора для нормального развития человека, поэтому с древних времен люди подсаливают пищу. Вводят хлор и в подкормку животных. Растения же, в отличие от животных, никогда не испытывают дефицита хлора.

Биологическая роль и токсичность:
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Ионы хлора жизненно необходимы растениям, участвуя в энергетическом обмене у растений, активируя окислительное фосфорилирование.
Хлор в виде простого вещества ядовит, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую Мировую войну.
Короткова Ю., Швецова И.
ХФ ТюмГУ, 571 группа.
[править] Физические свойства
Хлор — тяжелый газ желтовато-зеленого цвета с резким, удушливым запахом, неметалл. При вдыхании очень раздражает слизистую оболочку и вызывает острый кашель, а в больших количествах — даже смерть.
Под давлением около 6 атмосфер хлор уже при обычной температуре сжижается в желтую тяжелую жидкость, которая под нормальным давлением кипит при −34 °С, а при −102,4 °С замерзает в желтоватую кристаллическую массу. Сжиженный хлор хранят и транспортируют в стальных баллонах.
В воде хлор растворяется хорошо. В одном объеме воды при обычной температуре растворяется более двух объемов хлора. Раствор хлора в воде называют хлорной водой.
Добыча хлора
Методы 18-го века в 21-ом не актуальны. Вместо использованного когда-то Карлом Шееле оксида марганца и соляной кислоты применяют обычные соль и воду. Натрий хлор растворяют и подвергают действию электрического тока.
Не нужно ни специального оборудования, ни тары, ни повышенных температур. Современный метод прост и дешев. Сколько хлора произвести диктует спрос. Так, в 1970-е миру требовались 20 000 000 тонн в год.
Тогда, в производстве основных неорганических продуктов 17-ый элемент занял 5-е место. Позиция осталась прежней, но объем потребления вырос. На 2015-ый год — около 28 000 000 тонн. Это и хлор для бассейна, и хлористый винил, и пестициды, и растворители, и хлор в таблетках.
Последние растворяют в воде и используют, как моющее и обеззараживающее средство.

Половину хлора производят в Соединенных Штатах. Это обосновано потребностью в 17-ом веществе самой Америки.
В год внутренняя промышленность потребляет около 12 000 000 тонн реагента. Весома роль на рынке и у Великобритании. Производят, в основном, соединения 17-го элемента, к примеру, кислоты хлора.
Если говорить не об искусственном получении хлора и его производстве, а о добычи в природе, то она сводится к выработке каменной соли. Получается, месторождения 17-го вещества разрабатывали еще 3000-4000 лет назад. Тогда, добывать соль начали на землях современной Ливии.
Общее количество хлора в земных недрах – всего 0,017%. Получается, при активной добыче есть возможность истощения ресурсов. Так что, в далекой перспективе стоимость 17-го элемента может возрасти. А какова она на данный момент?
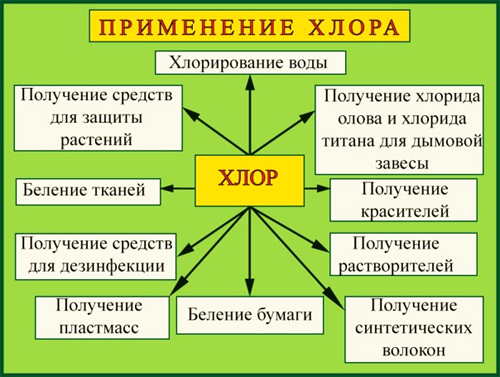
Применение:
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: — В производстве поливинилхлорида, пластикатов, синтетического каучука;
— Для отбеливания ткани и бумаги;
— Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений;
— Для обеззараживания воды — «хлорирования»;
— В пищевой промышленности зарегистрирован в качестве пищевой добавки E925;
— В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений;
— В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.