Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.




Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.

Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Атомы
Внутренние энергетические уровни
В формулах для энергии электронов на различных уровнях, данных ниже в атоме, установлен нулевой пункт для энергии, когда рассматриваемый электрон полностью оставил атом, т.е. когда основное квантовое число электрона. Когда электрон связан с атомом в любой более близкой ценности, энергия электрона ниже и считается отрицательной.
Орбитальный государственный энергетический уровень: атом/ион с ядром + один электрон
Предположите, что есть один электрон в данном атомном орбитальном в подобном водороду атоме (ион). Энергия его государства, главным образом, определена электростатическим взаимодействием (отрицательного) электрона с (положительным) ядром. Энергетическими уровнями электрона вокруг ядра дают:
(как правило, между 1 эВ и 10 эВ),
где постоянный Rydberg, атомное число, основное квантовое число, константа Планка, и скорость света. Для подобных водороду атомов (ионы) только, уровни Rydberg зависят только от основного квантового числа.
Это уравнение получено из объединения формулы Rydberg для любого подобного водороду элемента (показанный ниже) с предположением, что основное квантовое число выше = в формуле Rydberg и (основное квантовое число энергетического уровня электрон спускается с, испуская фотон). Формула Rydberg была получена из эмпирических спектроскопических данных об эмиссии.
Эквивалентная формула может быть полученным квантом механически от независимого от времени уравнения Шредингера с кинетическим энергетическим оператором гамильтониана, использующим волновую функцию в качестве eigenfunction, чтобы получить энергетические уровни как собственные значения, но постоянный Rydberg был бы заменен другими фундаментальными константами физики.
Если есть больше чем один электрон вокруг атома, электронные электронные взаимодействия поднимают энергетический уровень. Этими взаимодействиями часто пренебрегают, если пространственное наложение электронных волновых функций низкое.
Для мультиэлектронных атомов взаимодействия между электронами заставляют предыдущее уравнение больше не быть точным, как заявлено просто с как атомное число. Простое (хотя не полный) способ понять это как эффект ограждения, где внешние электроны видят эффективное ядро уменьшенного обвинения, так как внутренние электроны связаны плотно с ядром и частично отменяют его обвинение. Это приводит к приблизительному исправлению, где заменен с эффективным ядерным обвинением, символизируемым, поскольку это зависит сильно от основного квантового числа.
В таких случаях, орбитальные типы (определенный азимутальным квантовым числом), а также их уровни в рамках влияния молекулы и поэтому также затрагивают различные атомные электронные энергетические уровни
Принцип Aufbau заполнения атома с электронами для электронной конфигурации принимает эти отличающиеся энергетические уровни во внимание. Для заполнения атома с электронами в стандартном состоянии самые низкие энергетические уровни заполнены первый и совместимый с принципом исключения Паули, принципом Aufbau и правлением Хунда
Разделение микроструктуры
Микроструктура является результатом релятивистских кинетических энергетических исправлений, сцепление орбиты вращения (электродинамическое взаимодействие между вращением и движением электрона и электрическим полем ядра) и Дарвинский термин (свяжитесь со взаимодействием термина электронов раковины в ядре). Они затрагивают уровни типичным порядком величины 10 эВ.
Гипермикроструктура
Эта еще более прекрасная структура происходит из-за взаимодействия вращения вращения электронного ядра, приводящего к типичному изменению в энергетических уровнях типичным порядком величины 10 эВ.
Энергетические уровни из-за внешних областей
Эффект Зеемана
Есть энергия взаимодействия, связанная с магнитным дипольным моментом, являясь результатом электронного орбитального углового момента, данный
с
Дополнительно принимая во внимание магнитный импульс, являющийся результатом электронного вращения. Из-за релятивистских эффектов (уравнение Дирака), есть магнитный импульс, являясь результатом электронного вращения
Из-за релятивистских эффектов (уравнение Дирака), есть магнитный импульс, являясь результатом электронного вращения
:,
с g-фактором электронного вращения (приблизительно 2), закончившись в полный магнитный момент,
Энергия взаимодействия поэтому становится
Устройство мироздания: фундамент для законов энергии
Законы, по которым работает энергия, очень логичны. Они вытекают из фундаментальных основ нашего мира. Эти основы с древнейших времен описывались различными мистическими учениями. Лишь совсем недавно, с развитием квантовой механики, они обрели и научное подтверждение. Итак, краеугольные камни Мироздания — это:
- Глубинное единство мира. Мир един, поскольку в его основе лежит . Существование изначальной квантовой реальности подтверждается многочисленными квантовыми экспериментами. Эта реальность и есть Абсолют — мистическое начало, творящее Мироздание.
- Информация как истинная основа мира. Наша реальность возникает из Абсолютной реальности за счет постоянного обмена информацией между объектом и окружающим миром. Такой обмен информацией происходит при взаимодействии. Именно так описывает возникновение реальности .
- Энергия как инструмент для «материализации» информации. Мир представляет собой . Именно энергия обеспечивает возможность взаимодействия и информационного обмена. Тем самым она позволяет «заякорить» информацию, превратить ее в материальный объект.
- Многоуровневость Мироздания. В процессе декогеренции происходит несколько стадий выделения полностью обособленного, «физического» объекта из изначальной квантовой реальности. Поэтому между Абсолютом и «физическим» миром Эти миры есть такая же объективно существующая часть Мироздания, как и наш «физический» мир.
А теперь разберем «энергетические» законы Вселенной, и следствия из этих законов. Эти следствия напрямую влияют лично на тебя и на твою жизнь!
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е =+11Na+ 1s22s22p63s
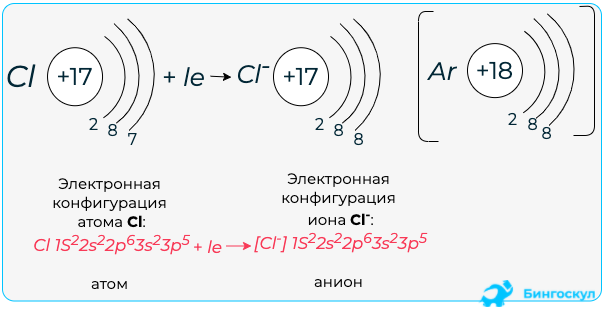
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора обраузется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома
Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s 2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s 2p
7. Электронная формула фтора:

8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s 2p 3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s 2p 3s 3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s 2p 3s 3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s 2p 3s 3p
13. Электронная формула хлора:

14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s 2p 3s 3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s 2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s 2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s
Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня
Как определить состояние биополя
По соотношению разных факторов влияния выделяют людей с сильной и слабой энергетикой, которые в разном соотношении обладают позитивными и негативными потоками. Увидеть ауру и определить ее силу можно по цвету. Но есть также и более явные признаки, заметные без специальной подготовки.
Признаки слабой энергетики
Низкий уровень энергии присущ людям, находящимся в стрессовой ситуации. Их выдает быстрая утомляемость и апатия. Строя барьеры из страхов, сомнений и неуверенности, они не могут стабильно заниматься любой деятельностью и постепенно угасают в плане эмоций и жизненных интересов.

Постоянные страхи и бессонница — один из главных признаков слабой энергетики
Организм со слабой энергетикой тяжело восполняет утраченные силы из-за так называемых дыр в биополе. В некоторых случаях индивиды, имея проблемы в энергообмене, используют более простой способ — подпитываются от людей с сильной энергетикой. Заменяя естественные процессы энергетическим вампиризмом, человек становится менее привлекательным для других, с ним тяжело поддерживать любые отношения.
Выделяют 8 основных признаков слабой энергетики и пробоев в ауре.
- Слабое здоровье и сильная подверженность любым заболеваниям.
- Вялость, быстрая утомляемость, нестабильное эмоциональное состояние.
- Нерешительность и неуверенность в любых действиях.
- Наличие фобий, страхов, бессонницы.
- Отсутствие заинтересованности в происходящем вокруг, нежелание находиться в эпицентре жизни.
- Отсутствие интереса в развитии себя.
- Высокая ранимость, плаксивость.
- Нехватка энергии на любые действия.
Человек с такой энергетикой испытывает истощение после спорта, секса, принятия алкоголя и даже длительного приема пищи. Таким людям необходимо больше времени для отдыха и восстановления общего потенциала.

Вялость и сонливость тоже могут быть признаком истощения резервов биополя
В большинстве своем — это пожилые или принёсшие серьёзное заболевание люди, а также те, что подвержены стрессу или депрессии.
Признаки сильной энергетики
Обладая сильной энергией, человек излучает положительные эмоции. Как нельзя лучше характеризует таких людей фраза — жизнь бьет ключом. Подзарядиться, впитать заряд положительной энергии можно, даже просто побыв рядом с таким человеком. Это харизматичные, притягательные люди, обладающие лидерскими качествами. Таким доверяют, прислушиваются к ним и хотят поддержать их замыслы.
Сильная энергетика — это совокупность физически здорового организма и ясности, стабильности сознания. Главное — осознавать, что даже сильный дух нуждается в отдыхе и перерывах, чтобы избежать перегрузок и истощения организма.

Люди с сильной энергетикой жизнерадостны
Сильная энергетика характеризуется 8 главными признаками.
- Богатырское здоровье, способное устоять перед болезнью.
- Быстрый уровень восстановления сил.
- Постоянный положительный эмоциональный заряд, бодрость.
- Жизнерадостность.
- Стабильная, благотворная работоспособность.
- Решительность, целеустремленность.
- Наполненность и разносторонность интересов.
- Здоровый сон.
Это самодостаточные, уверенные личности, чувствующие себя в любой ситуации естественно, не обращающие внимания на мнение окружения.
Внешне характерными признаками часто являются: темный или просто насыщенный цвет волос, глубокие, будто сияющие глаза, выразительные густые брови.
Положительное и отрицательное

В конце девятнадцатого века ученые вплотную подошли к изучению мельчайших частиц вещества. Например, было понятно: атом содержит как положительно, так и отрицательно заряженные составляющие. Но структура атома была неизвестна: расположение, взаимодействие, соотношение веса его элементов оставались загадкой.
Резерфорд поставил опыт по рассеянию альфа-частиц тонкой золотой фольгой. Он выяснил, что в центре атомов находятся тяжелые положительные элементы, а по краям расположены очень легкие отрицательные. Значит, носителями разных зарядов являются не похожие друг на друга частицы. Это объясняло заряд атомов: к ним можно было добавить элемент или удалить его. Равновесие, которое поддерживало нейтральность всей системы, нарушалось, и атом приобретал заряд.
Молекулы
Химические связи между атомами в молекуле образуются, потому что они делают ситуацию более стабильной для задействованных атомов, что обычно означает, что суммарный уровень энергии для задействованных атомов в молекуле ниже, чем если бы атомы не были так связаны. Когда отдельные атомы приближаются друг к другу для ковалентной связи , их орбитали влияют на энергетические уровни друг друга, образуя связывающие и разрыхляющие молекулярные орбитали . Уровень энергии связывающих орбиталей ниже, а уровень энергии разрыхляющих орбиталей выше. Чтобы связь в молекуле была стабильной, ковалентные связывающие электроны занимают связывающую орбиталь с более низкой энергией, что может обозначаться такими символами, как σ или π, в зависимости от ситуации. Соответствующие антисвязывающие орбитали можно обозначить, добавив звездочку, чтобы получить σ * или π * орбитали. Не-связывающая орбиталь в молекуле является орбитальным с электронами внешних оболочек , которые не участвуют в образовании связи и его уровень энергии является таким же , как у атома составляющего. Такие орбитали можно обозначить как n орбиталей. Электроны на n-орбитали обычно представляют собой неподеленные пары . В многоатомных молекулах также задействованы различные колебательные и вращательные уровни энергии.
Грубо говоря, состояние молекулярной энергии, т.е. собственного состояния из молекулярного гамильтониана , является суммой электронных, колебательных, вращательных, ядерных и поступательных компонентов, таким образом, что:
- Eзнак равноEелеcтропяc+Evябратяопал+Eротатяопал+Eптыcлеар+Eтрапsлатяопал{\ displaystyle E = E _ {\ rm {electronic}} + E _ {\ rm {вибрационные}} + E _ {\ rm {вращательные}} + E _ {\ rm {ядерные}} + E _ {\ rm {трансляционные}} \ ,}
где Е электронный является собственным значением из электронного молекулярного гамильтониана (значение на поверхности потенциальной энергии ) в равновесной геометрии молекулы .
Уровни молекулярной энергии обозначены символами молекулярных терминов . Удельная энергия этих компонентов зависит от конкретного энергетического состояния и вещества.
Диаграммы уровней энергии
Существуют различные типы диаграмм уровней энергии для связей между атомами в молекуле.
- Примеры
- Молекулярных орбиталей схемы , диаграммы Яблонски и ФФК диаграммы.
От чего зависит энергетический уровень
Энергетический уровень человека напрямую зависит от работы его энергетических потоков и их взаимодействия друг с другом. Внешнее воздействие и влияние потоков постоянно изменяют энергию организма. По этой причине она достаточно непрочная и подвержена частым изменениям. Энергия возрастает, когда вы раскачиваете свой потенциал, достигаете поставленных целей, радуетесь и наслаждаетесь жизнью. Увлеченные люди, уверенные и постоянно улучшающие себя способны преодолеть катаклизмы, любые бедствия и спастись в экстренной ситуации.
Развитие себя не требует специальных знаний. Занятия любым видом танца или йогой, посещение курсов языка или творческих уроков, а также медитации помогут быть в балансе с собой. Различные физические нагрузки не менее важны для организма, поэтому не пренебрегайте спортивными занятиями. Обязательно занимайтесь подходящим для вас видом спорта.
Если человек пренебрегает здоровым образом жизни или злоупотребляет вредными привычками, этим он снижает резервы своего биополя, не дает свободно перемещаться энергетическим потокам. Застои энергии могут стать причинами болезней и проблемам с эмоциональным самочувствием.
Одним из факторов, влияющих на энергетический уровень организма, является взаимодействие с энергетическими вампирами. Они подпитываются энергией человека. Их разделяют на две группы.
- Солнце-вампиры — провокаторы ссор и разногласий, подстрекатели, создающие негативную атмосферу.
- Лунно-вампиры — нытики, что, сетуя на жизнь и жалуясь, зеркально передают негативную энергию, забирая положительную в противовес.

Энергетические вампиры питаются разными видами эмоций
Валентные электроны
Ранее мы говорили, что атом является нейтрально заряженной частицей, поскольку количество электронов и протонов в нем одинаково. Однако, электроны, находящиеся на самых дальних орбиталях, слабо притягиваются положительными протонами, находящимися в ядре атома. Поэтому, атомы элементов способны отдавать и присоединять электроны.
|
Электроны, расположенные на внешнем незавершенном энергетическом уровне, называются валентными электронами. Подробнее см. Валентность. |
НАДО ЗНАТЬ! К валентным относятся внешние электроны, плюс те предвнешние электроны, энергия которых больше, чем у внешних.
См. далее: Масса атомов и молекул, атомная единица массы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).

Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?

Что такое энергетика человека
Любая материя имеет свою энергию — знания об этом передавались с древних времен. Сегодня существует целая наука — биоэнергетика, которая изучает процессы передачи тонких материй и методы влияния на них. Энергетикой наполнено любое тело как живое, так и неживое. Тела и предметы излучают и получают энергетические потоки. Благодаря этой циркуляции происходит постоянный обмен энергией между организмами, окружающей средой и предметами в ней.
В процессе этого обмена человек обретает бодрость и полноту духа или наоборот угнетенность, истощение, подавленность. Энергетика человека — это самочувствие, эмоциональный настрой, успешность и здоровое состояние организма.
Наше тело пронизано тонкой структурой энергии, в которой происходит циркуляция потоков, имеющих определенные оттенки. Главными потоками, поступающими извне в организм человека, являются:
- поток ядра земли, именуемый восходящим. Он поступает через стопы, проходит вдоль позвоночника к центру энергетической системы организма — теменной области;
- поток из космоса — нисходящий. Он проникает в энергетический центр на темени и движется до пальцев рук и ног.
В итоге земная и космическая энергия, взаимодействуя с телом человека, создают биополе человека — оболочку вокруг него, или ауру.

Через биополе человек взаимодействует с космической энергией
Для полноценной работы потоки обязаны свободно циркулировать по телу — от этого зависит работа организма. Иначе происходит сбой, образуя проблемы с самочувствием, настроением и здоровьем:
- недостаточное количество земной энергии поражает кровеносную систему и нарушает работу сердца;
- отсутствие в полном объеме космической энергии плохо отражается в первую очередь на позвоночном столбе и суставах.
Электронная формула атома
Все на диаграммах уровней энергии довольно понятно и наглядно, но громоздко. Используя электронную конфигурацию, диаграмму можно выразить одной короткой строкой.
Рассмотрим атом углерода, который имеет два энергетических уровня, на которых расположено всего 6 электронов (2 — на внутреннем, и 4 — на внешнем):
Ниже на рисунках представлены примеры электронных формул атомов углерода и натрия (модель электронной оболочки) и их графическое изображение:
 Рис. Электронная формула углерода.
Рис. Электронная формула углерода.
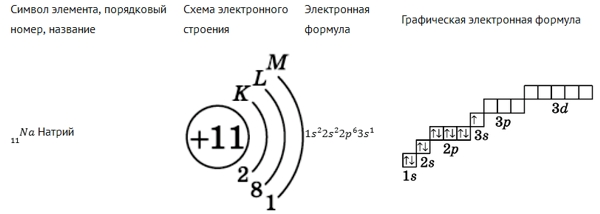 Рис. Электронная формула натрия.
Рис. Электронная формула натрия.
В электронной конфигурации указывается название орбитали энергетического уровня в верхнем индексе которой находится количество электронов, расположенных на этой орбитали.
| Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т. е., количеству электронов в атоме. |
Электронная оболочка атома формируется согласно следующих принципов:
-
принцип минимума энергии — в первую очередь заполняются орбитали с наименьшей энергией (ближайшие к атомному ядру):
1s; 2s; 2p; 3s; 3p; 4s (3d); 4p; 5s (4d); 5p; 6s (4f) (5d); 6p; 7s; - принцип Паули — на одной атомной орбитали могут находиться не более 2 электронов с противоположными спинами (спаренные электроны);
- правило Хунда — атомные орбитали заполняются таким образом, чтобы сумма их спинов была максимальной.
Например, электронная формула для хлора имеет следующий вид: 1s22s22p63s23p5.
Порядковый номер хлора в таблице — 17. Это значит, что атом хлора содержит 17 протонов и 17 электронов. Т.е., нам на диаграмме надо (согласно правилам) расположить 17 электронов.
Как уже было сказано выше, схематически электрон отображается в виде стрелочки. Если на орбитали находятся два электрона, то они отображаются в виде двух разнонаправленных стрелок (электроны с разными спинами).
- Сначала заполняем самый низкий энергетический уровень: 1s-орбиталь. На ней размещается 2 электрона.
- Следующие 2 электрона занимают 2s-орбиталь.
- Следующий энергетический уровень: 2p-орбиталь — 6 электронов.
- Следующие 2 электрона — 3s-орбиталь.
- Оставшиеся 5 электронов располагаются на 3p-орбитали, образуя две спиновые пары (у последнего электрона пары нет).
Таким образом, диаграмма уровней энергии для хлора будет выглядеть следующим образом:
Внимательный читатель, скорее всего, обратил внимание, что порядок заполнения электронных энергетических подуровней в атомах несколько нарушен, например, сначала заполняется подуровень 4s, а только затем 3d. Данное нарушение обясняется правилом Клечковского, которое гласит, что электроны заполняют атомные уровни (подуровни) в порядке возрастания суммы (n + l), в случае, если суммы главного и орбитального квантовых чисел равны, заполнение происходит в порядке увеличения n (см
).
- Для подуровня 4s: n+l = 4+0 = 4;
- Для подуровня 3d; n+l = 3+2 = 5.
Подуровни 3d, 4p, 5s имеют равные суммы n+l=5, поэтому заполнение идет в порядке возрастания главного квантового числа: 3d→4p→5s.
Правило Клечковского имеет ряд исключений, когда близкие друг к другу подуровни незначительно отличаются энергией, в таком случае электрон стремится занять подуровень с меньшей энергией, пусть он даже будет «вышележащим», при этом «нижележащий» уровень остается незаполненным. Например 5d1 заполняется раньше, чем 4f.
Классификация химических элементов по строению их атомов:
- s-элементы (14): электроны заполняют s-подуровень внешнего уровня — водород, гелий + первые 2 элемента каждого периода;
- p-элементы (30): электроны заполняют p-подуровень внешнего уровня — последние 6 элементов каждого периода;
- d-элементы (32): электроны заполняют d-подуровень второго снаружи уровня — элементы вставных декад больших периодов, которые находятся между s- и p-элементами;
- f-элементы (28): электроны заполняют f-подуровень третьего снаружи уровня — лантаноиды и актиноиды.
Подробнее см. Таблицу электронных конфигураций атомов химических элементов по периодам.

Кристаллические материалы
Было обнаружено, что кристаллические твердые тела имеют энергетические зоны вместо или в дополнение к энергетическим уровням. Электроны могут принимать любую энергию в незаполненной зоне. Поначалу это кажется исключением из требований к уровням энергии. Однако, как показано в теории зон, энергетические зоны на самом деле состоят из множества дискретных уровней энергии, которые расположены слишком близко друг к другу, чтобы их можно было разрешить. Внутри полосы количество уровней порядка количества атомов в кристалле, поэтому, хотя электроны на самом деле ограничены этими энергиями, они, по-видимому, могут принимать континуум значений. Важными энергетическими уровнями в кристалле являются верх валентной зоны , дно зоны проводимости , уровень Ферми , вакуумный уровень и энергетические уровни любых дефектных состояний в кристалле.
Свет и атом

Количество энергии, необходимой для перехода, зависит от расстояния между энергетическими уровнями атома. Чем они дальше друг от друга, тем больше выделяемый или поглощаемый квант.
Как известно, свет – это и есть квант электромагнитного поля. Таким образом, когда электрон в атоме переходит с более высокого на более низкий уровень, он творит свет. При этом действует и обратный закон: когда электромагнитная волна падает на предмет, она возбуждает его электроны, и они переходят на более высокую орбиталь.
Кроме того, энергетические уровни атома индивидуальны для каждого вида химического элемента. Узор расстояний между орбиталями различается для водорода и золота, вольфрама и меди, брома и серы. Поэтому анализ спектров испускания любого объекта (в том числе и звезды) однозначно определяет, какие вещества и в каком количестве в нем присутствуют.
Применяется этот метод невероятно широко. Спектральный анализ используется:
- в криминалистике;
- в контроле качества еды и воды;
- в производстве товаров;
- в создании новых материалов;
- в усовершенствовании технологий;
- в научных экспериментах;
- в исследовании звезд.
Этот перечень лишь примерно показывает, насколько полезным оказалось открытие электронных уровней в атоме. Электронные уровни – самые грубые, самые большие. Существуют более мелкие колебательные, и еще более тонкие вращательные уровни. Но они актуальны только для сложных соединений – молекул и твердых тел.
Надо сказать, что структура ядра до сих пор не исследована до конца. Например, нет ответа на вопрос о том, почему определенному количеству протонов соответствует именно такое число нейтронов. Ученые предполагают, что атомное ядро тоже содержит некий аналог электронных уровней. Однако до сих пор это не доказано.














































