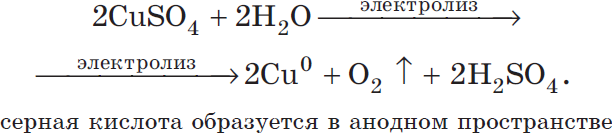Содержание
Что такое электролиз?
Чтобы ответить на данный вопрос, следует сначала обратиться к терминологии и уяснить некоторые основные физико-химические понятия.
- Постоянный ток — это направленный поток электронов, исходящий от любого источника электричества.
- Электролит — вещество, раствор которого способен проводить электрический ток.
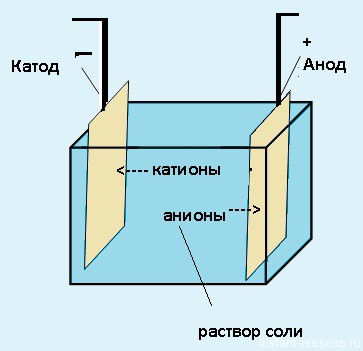
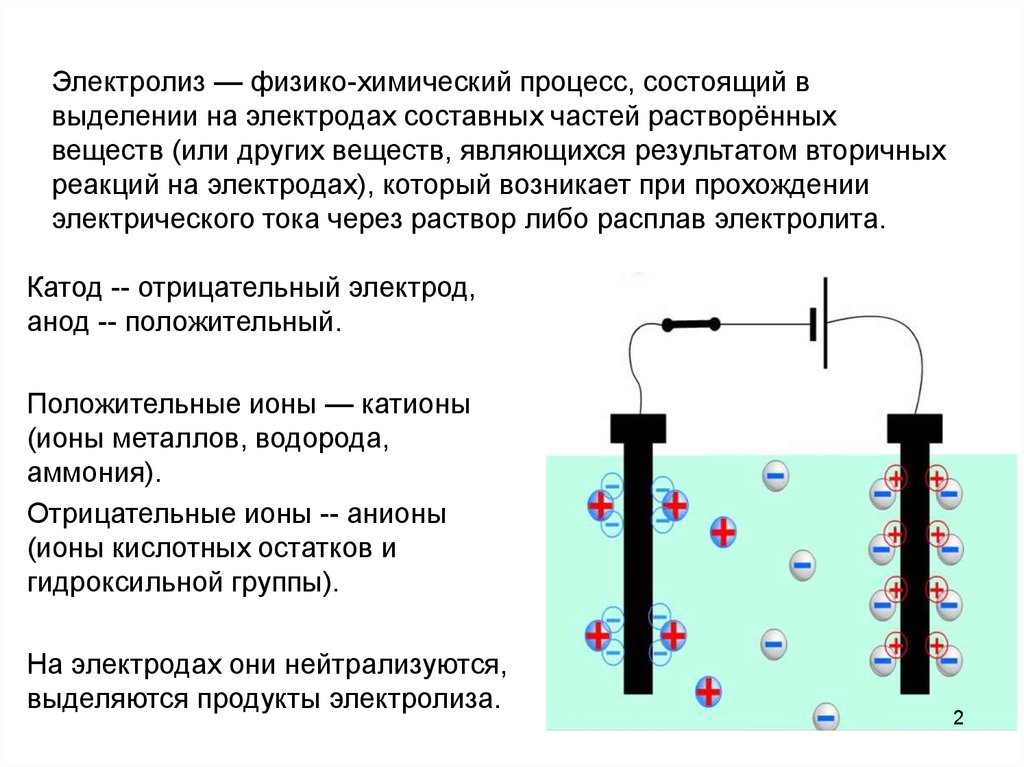
- Электроды — пластинки из определенных материалов, соединенные между собой, которые пропускают электричество через себя (анод и катод).
- Окислительно-восстановительная реакция — это процесс, при котором происходит изменение степеней окисления участников. То есть одни ионы окисляются и повышают значение степени окисления, другие, напротив, восстанавливаются, понижая ее.
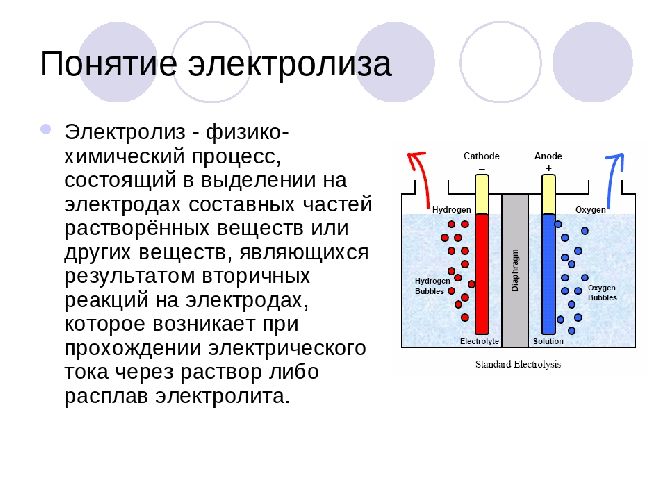
Уяснив все эти термины, можно ответить на вопрос о том, что такое электролиз. Это окислительно-восстановительный процесс, заключающийся в пропускании постоянного тока через раствор электролита и завершающийся выделением разных продуктов на электродах.
Простейшая установка, которую можно назвать электролизером, включает в себя всего несколько компонентов:
- два стакана с электролитом;
- источник тока;
- два электрода, соединенных между собой.
В промышленности использует гораздо более сложные автоматизированные конструкции, позволяющие получать большие массы продуктов — электролизные ванны.
Процесс электролиза достаточно сложный, подчиняется нескольким теоретическим законам и протекает по установленным порядкам и правилам. Чтобы правильно предсказать его исход, необходимо четко усвоить все закономерности и возможные варианты прохождения.

Промышленное использование
Процесс Холла-Эру для производства алюминия
- Электрометаллургии из алюминия , лития , натрия , калия , магния , кальция , а в некоторых случаях меди .
- Производство хлора и гидроксида натрия , называемое хлорно-щелочным процессом .
- Производство хлората натрия и хлората калия .
- Производство перфторированных органических соединений, таких как трифторуксусная кислота, методом электрофторирования .
- из рафинированной меди .
- Производство топлива, такого как кислород (для космических кораблей и атомных подводных лодок ), а также водорода .
- и чистка старых монет и других металлических предметов.
Производственные процессы
В производстве электролиз можно использовать для:
- Гальваника , при которой на материал подложки наносится тонкая пленка металла. Гальваника используется во многих отраслях промышленности как в функциональных, так и в декоративных целях, например в кузовах автомобилей и никелевых монетах.
- Электрохимическая обработка (ЭХМ), при которой электролитический катод используется в качестве инструмента для удаления материала путем анодного окисления с заготовки. ECM часто используется как метод удаления заусенцев или травления металлических поверхностей, таких как инструменты или ножи, с несмываемой меткой или логотипом.
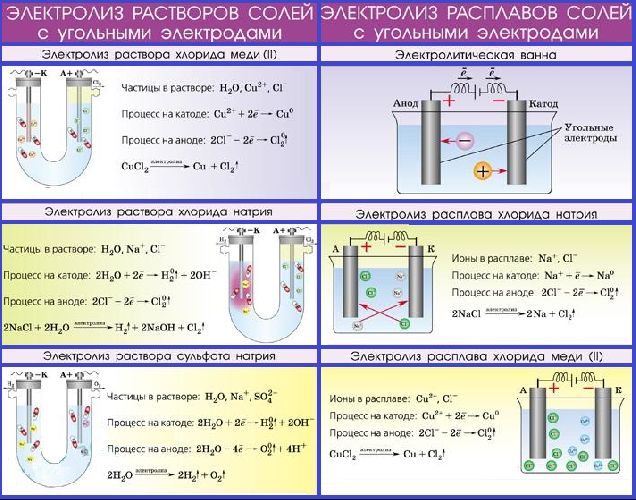
Электролиз расплавов
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает
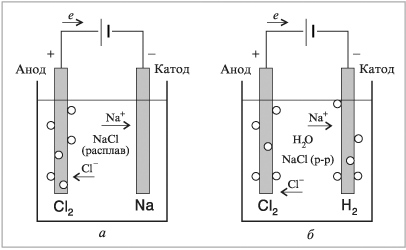
Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
В этом случае на катоде происходит восстановление катионов Na:
Na+ + ē → Na0.
Анод вызывает окисление анионов Cl:
2Cl– – 2ē → Cl20.
Общее уравнение гальванолиза расплава NaCl будет иметь вид:
2Na+Cl– → 2Na0 + Cl20.
 Схема электролиза расплава NaCl
Схема электролиза расплава NaCl
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
Устройство и принцип работы
Самая простейшая электролизная установка состоит из нескольких «ячеек», каждая из которых включает в себя:
- 2 пластинчатых электрода – катод (отрицательный) и анод (положительный);
- Резиновую прокладку, располагающуюся по периметру двух смежных разноименных электродов.
Крайние ячейки оснащаются специальными патрубками, через которые отводятся выделяющиеся газы.
 Несколько соединенных между собой «ячеек» электролизной установки
Несколько соединенных между собой «ячеек» электролизной установки
Электролизер может содержать от 1 до 30-40 и более таких «ячеек», одноименные пластины которых подключены последовательно.
Важно! При использовании источников питания с переменным током дополнительно применяют выпрямители, самым простейшим из которых является диодный мост. Работает такая установка следующим образом:
Работает такая установка следующим образом:
- В пространство между электродами заливают дистиллированную воду с растворенной в ней щелочью или обычной пищевой содой;
- От источника питания на электроды всех ячеек установки подается напряжение номиналом 1,8-2,0 В;
- В результате протекания процесса электролиза к отрицательно заряженному катоду притягиваются анионы (положительно заряженные ионы) растворенного в воде вещества, в результате чего на нем образуется тонкая пленка натрия;
- На положительно заряженном аноде происходит разрушение молекул воды, при этом из каждой образуется 2 атома водорода и 1 атом кислорода;
- Выделяющийся гремучий газ по отводным патрубкам попадает в предназначенную для него емкость.
Интенсивность процесса электролиза зависит от величины напряжения и силы тока – при малых значениях данных характеристик процесс протекать не будет. Если источник питания будет подавать ток со слишком большими значениями вольт-амперной характеристики, заливаемый в электролизер раствор будет сильно нагреваться и выкипать.
Первый закон Фарадея
Основная статья: Законы электролиза Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t},если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=MNa{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=μzeNAIΔt{\displaystyle m={\frac {\mu }{zeN_{A}}}I\Delta t}
- m=μzFIΔt{\displaystyle m={\frac {\mu }{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=μFz{\displaystyle k={\frac {\mu }{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
| Соль активного металла и бескислородной кислоты | Соль активного металла и кислородсодержащей кислоты | Гидроксид: активный металл и гидроксид-ион |
|---|---|---|
|
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): Na++e−=Na{\textstyle {\ce {Na+ + e- = Na^0}}} A(+): Cl−−e−⟶Cl⟶Cl2{\displaystyle {\ce {Cl- — e- -> Cl^0 -> Cl2}}} |
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}}
K(-): 2Na++2e−=2Na{\displaystyle {\ce {2Na+ + 2e- = 2Na^0}}} A(+): 2SO42−−4e−=2SO3+O2{\displaystyle {\ce {2SO4^2- — 4e- = 2SO3 + O2}}} |
NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}}
K(-): Na++e−=Na{\displaystyle {\ce {Na+ + e- = Na^0}}} A(+): 4OH−−4e−=2H2O+O2{\displaystyle {\ce {4OH- — 4e- = 2H2O + O2}}} |
Активные металлы
| Соль активного металла и бескислородной кислоты | Соль активного металла и кислородсодержащего кислотного остатка | Гидроксид: активный металл и гидроксид-ион |
|---|---|---|
|
NaCl⟷Na++Cl−{\displaystyle {\ce {NaCl <-> Na+ + Cl-}}}
K(-): 2H2O+2e−=H2+2OH−{\displaystyle {\ce {2H2O + 2e- = H2 + 2OH-}}} A(+): 2Cl−−2e−=Cl2{\displaystyle {\ce {2Cl- — 2e- = Cl2}}} |
Na2SO4⟷2Na++SO42−{\displaystyle {\ce {Na2SO4 <-> 2Na+ + SO4^2-}}} | NaOH⟷Na++OH−{\displaystyle {\ce {NaOH <-> Na+ + OH-}}} |
Менее активные металлы и неактивные металлы
| Соль менее активного металла и бескислородной кислоты | Соль менее активного металла и кислородсодержащей кислоты | Гидроксид |
|---|---|---|
|
ZnCl2⟷Zn2++2Cl−{\displaystyle {\ce {ZnCl2 <-> Zn^2+ + 2Cl-}}}
K(-): Zn2++2e−=Zn{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}} A(+): 2Cl−−2e−=2Cl{\displaystyle {\ce {2Cl- — 2e- = 2Cl^0}}} |
ZnSO4⟷Zn2++SO42−{\displaystyle {\ce {ZnSO4 <-> Zn^2+ + SO4^2-}}}
K(-): Zn2++2e−=Zn{\displaystyle {\ce {Zn^2+ + 2e- = Zn^0}}} Вывод: 2ZnSO4+2H2O⟶2Zn+2H2SO4+O2{\displaystyle {\ce {2ZnSO4 + 2H2O -> 2Zn + 2H2SO4 + O2}}} |
Невозможно: гидроксиды неактивных металлов нерастворимы в воде |
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl2
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na + Cl2
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O2 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na + O2+ 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O2
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al + 3О2
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C + О2 = C+4O2-2
Проект «Электролиз воды»
Энергия накапливается в молекулярных связях. Когда эти связи
распадаются, высвобожденную энергию можно использовать для работы. Распад
молекул воды на водород и кислород позволяет высвободить огромное количество
энергии, которую можно преобразовать в электричество для дома или автомобиля.
Чтобы разрушить эти связи, требуется определённое количество энергии.
Атомы молекул воды должны стать достаточно активными, чтобы разъединиться. В
домашних условиях мы можем обеспечить эту энергию за счёт батарейки. В каждой
батарейке есть два полюса или два конца: положительный и отрицательный. Вода
соединяет полюса, благодаря чему энергия может перемещаться между ними. Когда
электричество проходит через воду, оно её расщепляет. Сама по себе она не
является хорошим проводником электричества, поэтому во время данного
эксперимента будет проведен электролиз водных растворов
солей.
Электролит – это часть раствора, которая может быть разрушена
вследствие электролиза (от лат. electrolysis). Electro относится к энергии и
электричеству, а –lysis означает «расщепление» или «распад». Электролиты важны
не только для батареек, но также для нашего организма. Ведь, если быть точными,
он состоит не из воды, как принято считать, а, по большей части, содержит
именно электролит.
Цель – определить, какой электролит лучше всего проводит электричество
во время электролиза воды.
Что
нам понадобится:
- дистиллированная вода;
- проточная вода (из-под крана);
- 2 кнопки серебристого цвета;
- батарейка 9 вольт;
- маленький прозрачный пластиковый контейнер (хорошо подойдёт одноразовая ёмкость);
- 2 пробирки;
- секундомер;
- пищевая сода;
- соль поваренная;
- лимон;
- средство для мытья посуды.
Ход
эксперимента:
- Вставьте кнопки во дно пластикового контейнера снизу, чтобы острые кончики были направлены вверх. Разместите их на таком расстоянии, на котором расположены два полюса девятивольтной батарейки. Будьте осторожны, не уколитесь кнопками!
- Поместите пластиковый контейнер на батарейке, чтобы кнопки соприкасались с полюсами. Если ёмкость слишком большая, используйте дополнительные предметы, чтобы её закрепить (подойдут книги, блок стикеров и т.д.).
- Медленно заполните контейнер дистиллированной водой. Если конструкция накренится в сторону, у вас есть возможность всё вовремя исправить, прежде чем вы сможете продолжить. Будет ли дистиллированная вода проводить электричество сама по себе? Попробуйте!
- Добавьте щепотку пищевой соды.
- Возьмите две пробирки. Подержите их над кнопками, чтобы собрать газ, который будет накапливаться во время проведения эксперимента. Запишите свои наблюдения. Что происходит? Собралось ли в одной пробирке больше газа, чем в другой? Как вы думаете, какой газ образовался?
- Вылейте этот раствор. Продолжите ту же процедуру, используя другие комбинации:
- дистиллированная вода с лимонным соком;
- дистиллированная вода и поваренная соль;
- дистиллированная вода и средство для мытья посуды;
- дистиллированная вода (без добавок);
- проточная вода.
Даёт ли проточная
вода какой-то эффект? Если да, то почему?
Вывод:
Дистиллированная вода не проводит электрический ток, а проточная
способна проводить лишь небольшое количество. Раствор с пищевой содой
обеспечивает хорошее количество электролитов, но с поваренной солью подходит
лучше всего. Почему? Пищевая сода, известная в химии
как гидрокарбонат натрия (NaHCO3) не является электролитом сама по
себе. Помните – необходим раствор! Растворяясь, сода проводит электрический ток
между полюсами батарейки. Во время проведения эксперимента с раствором соды в
воде выделяются водород (H2), кислород (O2) и углекислый
газ (CO2).
Столовая соль или хлорид натрия (NaCl) – это ещё одна хорошая добавка
для формирования электролитов. В воде соль обычно расщепляется на ионы Na+ и
Cl-. Как результат, выделяются водород, кислород, а также газообразный хлор (Cl2),
однако его лучше не вдыхать!
Лимонный сок – неплохой электролит, поскольку он содержит кислоту.
Кислота растворяется в воде, и ток переносится через ионы. Дистиллированная
вода без добавок не способна переносить ток. Однако проточная вода зачастую
становится хорошим проводником благодаря содержащимся в ней минералам и
примесям. Не беспокойтесь! Они не вредные!
Во время электролиза растворов с
использованием разных ингредиентов выделялось разное количество газов. Это
связано с тем, что растворы переносят разное количество тока. Количество
произведённого газа прямо пропорционально количеству тока, который проведён
через систему.
Из Википедии — свободной энциклопедии
Использование процесса
Электролиз растворов используется в разных отраслях современной промышленности. В химической отрасли с помощью данного процесса получают хлор, щелочи, перхлораты, хлораты, персульфаты, органические вещества, перманганат калия, надсерную кислоту, фтор, кислород, водород, иные ценные продукты.
В цветной металлургии электролиз расплавов применяют для извлечения чистого металла из руд. Металлы, которые нельзя выделять из-за высокого отрицательного потенциала из водных растворов, в цветной металлургии получают электролизом расплавов. Среди металлов, которые получают путем электролиза так называемых расплавленных сред, отметим магний, алюминий, уран, бериллий, цирконий.
Электролиз используют в машиностроении, электронной промышленности, радиотехнике, полиграфии, чтобы наносить тонкие металлические покрытия на изделия, защищая их от коррозии, увеличивая износостойкость, повышая жаропрочность.

Теоретическая часть
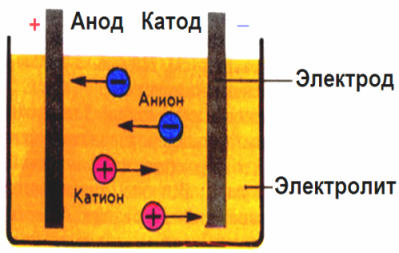
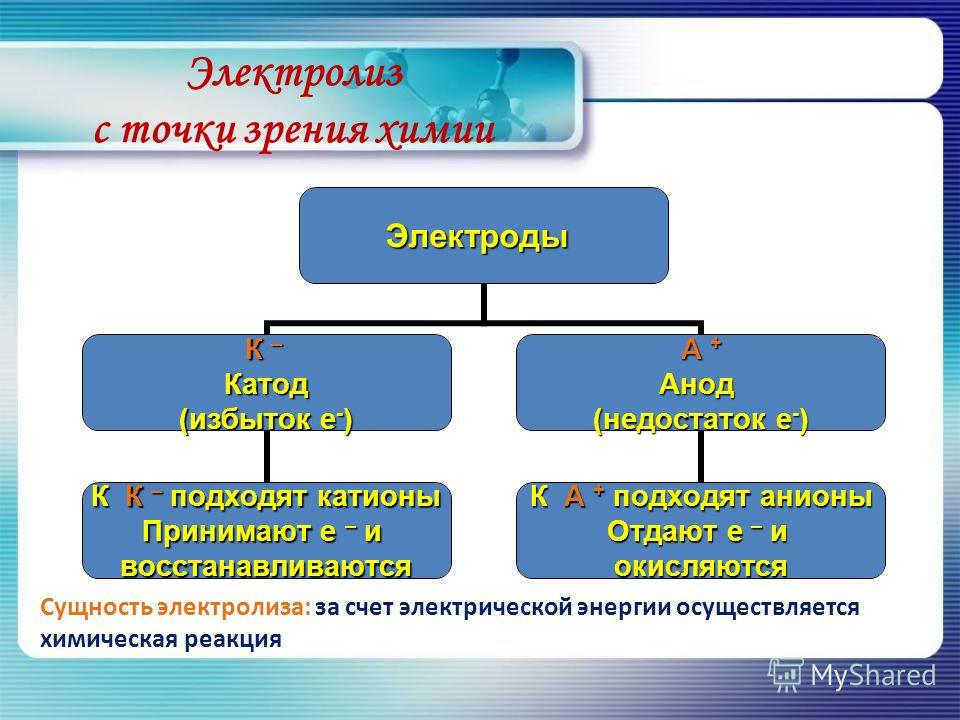
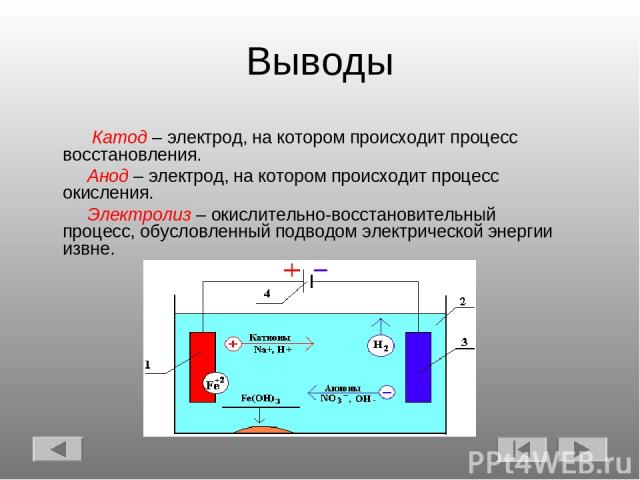
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
 Электролиз расплавов оснований.
Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к
элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока
Электролиз растворов На катоде могут протекать следующие реакции восстановления.
 Электролиз расплавов оснований.
Электролиз расплавов оснований.
 Как работает электролиз.
Как работает электролиз.
Электролиз расплавов
С точки зрения химии рассматриваемый процесс имеет свое уравнение. При помощи него можно изобразить всю схему на бумаге и предугадать результат
Самое главное, на что следует обращать внимание, — наличие или отсутствие водной среды и тип анода (растворимый или нет)
Если необходимо получение следующих продуктов: щелочных и щелочноземельных металлов, щелочей, алюминия, бериллия, газы из кислородсодержащих анионов, тогда не может идти речь об электролизе раствора электролита. Только расплав, потому что иначе требуемых соединений не получится. Именно поэтому часто в промышленности синтезируют перечисленные вещества, используя их безводные сухие соли и гидроксиды.
В целом уравнение электролиза расплава выглядит достаточно просто и стандартно. Например, если рассмотреть и записать его для йодида калия, то вид будет следующий:
KI = K+ + I-
Катод (К) «-«: К+ + 1е = К
Анод (А) «+»: 2I- — 2e = I2
Итог процесса: KI = K + I2.
Точно так же будет записываться электролиз любого металла, независимо от значения его электродного потенциала.
Особенности электролиза в растворах
Важно учитывать тот факт, что, помимо ионов электролита, есть также в растворе и продукты диссоциации воды: катионы водорода и анионы гидроксильной группы. Именно поэтому у катода возможна разрядка и катиона электролита, и протона водорода
У анода осуществляется разрядка гидроксильных ионов и анионов электролита.
Также молекулы воды вполне могут подвергаться электрохимическому восстановлению или окислению.
При тщательном рассмотрении катодных процессов, которые протекают в ходе электролиза водного раствора, важно учитывать величину потенциала восстановления протонов водорода. Он зависит от концентрации катионов водорода, имеющего значение -0, 41 В
Если в растворе электролита присутствует металл, у которого электродный потенциал имеет более положительное значение, следовательно, у катода в рамках электролиза будет наблюдаться его восстановление. Это утверждение относится к тем металлам, которые в электрохимическом ряду напряжений Бекетова располагаются вблизи водорода. При более отрицательном значении электродного потенциала, чем у катионов водорода, металл не будет восстанавливаться на катоде. В таких случаях на данном электроде скапливается водород.
При значении потенциала металла, сходном с показателем -0,41 В, допустимо одновременное образование на катоде как водорода, так и чистого металла .
На характер катодного процесса в случае электролиза раствора соли (щелочи) влияет расположение металла в ряду электрохимических напряжений металлов Бекетова.
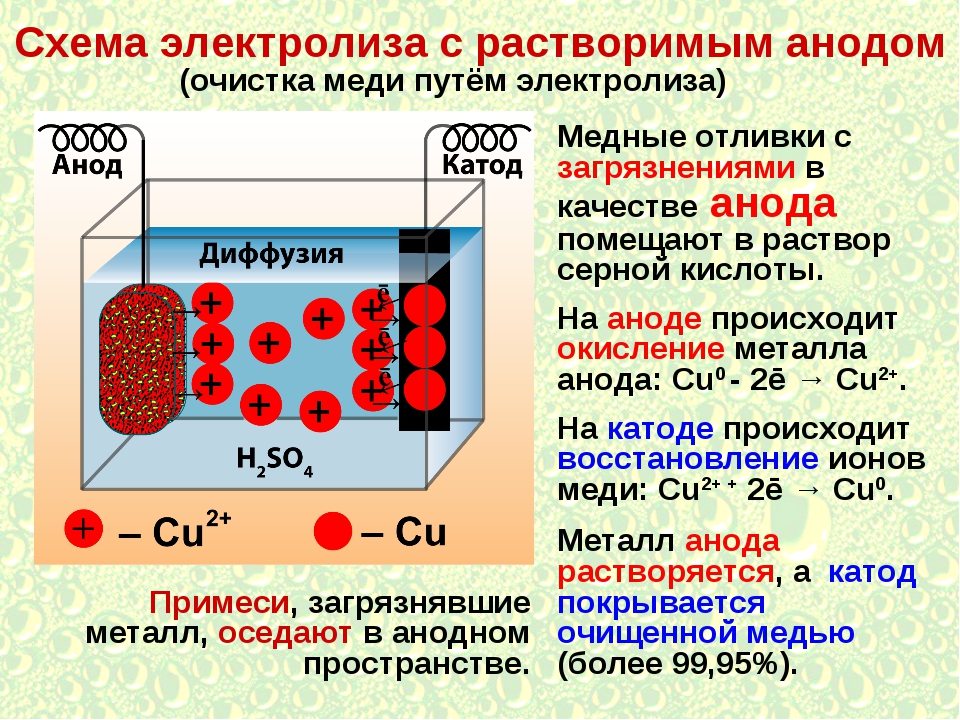
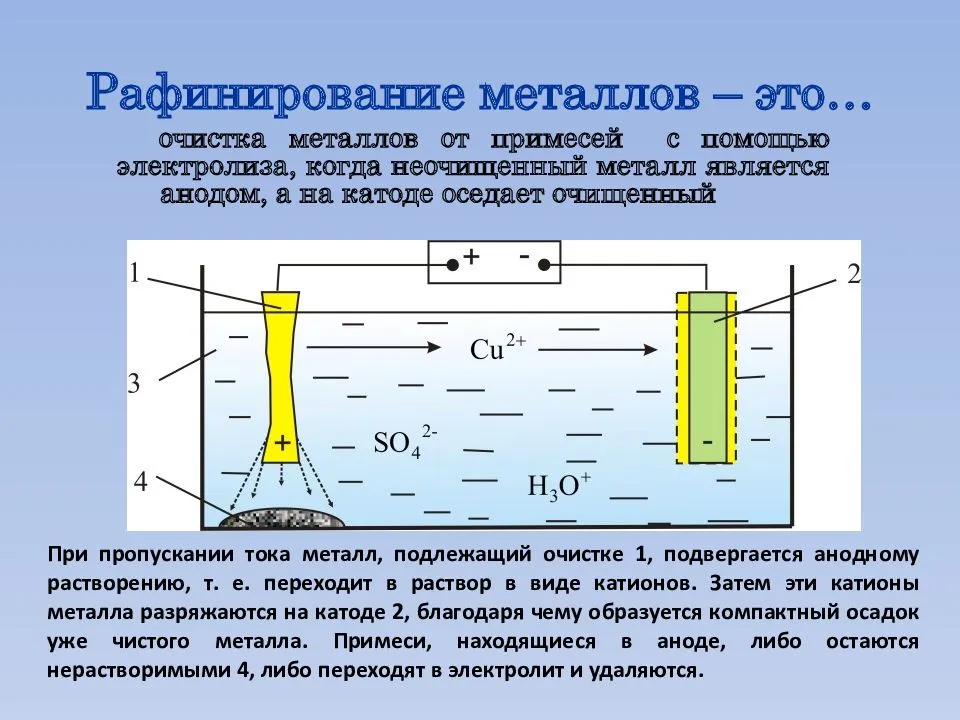
При анализе процессов, протекающих на аноде, необходимо учитывать тот факт, что возможно окисление материала анода. Именно поэтому в электрохимии выделят инертный анод, а также электрод, состоящий их активного анода.
Инертным является тот анод, у которого в рамках протекающего электролиза материал не подвергается окислению. Активным считают анод, способный окисляться в ходе электролиза.
Для инертных анодов выбирают платину, уголь, графит. Именно этот вариант рассматривается в школьном курсе химии.
Конкурирующие полуреакции при электролизе раствора
При использовании ячейки, содержащей инертные платиновые электроды, электролиз водных растворов некоторых солей приводит к восстановлению катионов (например, осаждению металлов, например, солями цинка) и окислению анионов (например, выделению брома с бромидами). Однако с солями некоторых металлов (например, натрия) водород выделяется на катоде, а для солей, содержащих некоторые анионы (например, сульфат SO 4 2- ), кислород выделяется на аноде. В обоих случаях это происходит из-за того, что вода восстанавливается с образованием водорода или окисляется с образованием кислорода. В принципе, напряжение, необходимое для электролиза раствора соли, может быть получено из стандартного потенциала электрода для реакций на аноде и катоде. Стандартный потенциал электрода напрямую связан со свободной энергией Гиббса , ΔG, для реакций на каждом электроде и относится к электроду без протекания тока. Ниже представлена выдержка из таблицы стандартных электродных потенциалов .
| Половина реакции | E ° (В) | Ref. |
|---|---|---|
| Na + + е — ⇌ Na ( ы ) | −2,71 | |
| Zn 2+ + 2 е — ⇌ Zn ( ы ) | -0,7618 | |
| 2H + + 2 e — ⇌ H 2 ( г ) | ≡ 0 | |
| Br 2 ( водн. ) + 2 e — ⇌ 2Br — | +1.0873 | |
| O 2 ( г ) + 4H + + 4 e — ⇌ 2H 2 O | +1,23 | |
| Cl 2 ( г ) + 2 e — ⇌ 2Cl — | +1,36 | |
| S2О2- 8+ 2 e — ⇌ 2 SO2- 4 | +2,07 |
С точки зрения электролиза эту таблицу следует интерпретировать следующим образом:
- При перемещении вниз по таблице E ° становится более положительным, а количество видов слева будет уменьшаться с большей вероятностью : например, ионы цинка с большей вероятностью будут восстановлены до металлического цинка, чем ионы натрия будут восстановлены до металлического натрия.
- При перемещении вверх по таблице E ° становится более отрицательным, и частицы справа с большей вероятностью будут окисляться : например, металлический натрий с большей вероятностью окисляется до ионов натрия, чем металлический цинк, который окисляется до ионов цинка.
Используя уравнение Нернста потенциал электрода можно рассчитать по концентрации ионов определенной температуры, и число электронов , участвующих. Для чистой воды ( pH 7):
- потенциал электрода для восстановления с образованием водорода составляет -0,41 В
- потенциал электрода для окисления с образованием кислорода +0,82 В.
Сопоставимые цифры, рассчитанные аналогичным образом для 1M бромида цинка , ZnBr 2 , составляют -0,76 В для восстановления до металлического Zn и +1,10 В для окисления с образованием брома. Вывод из этих фигур состоит в том, что водород должен образовываться на катоде, а кислород на аноде в результате электролиза воды, что противоречит экспериментальным наблюдениям, согласно которым металлический цинк осаждается и образуется бром. Объяснение состоит в том, что эти рассчитанные потенциалы указывают только на термодинамически предпочтительную реакцию
На практике необходимо принимать во внимание многие другие факторы, такие как кинетика некоторых стадий реакции. Эти факторы вместе означают, что для восстановления и окисления воды требуется более высокий потенциал, чем прогнозировалось, и это называется перенапряжениями
Экспериментально известно, что перенапряжения зависят от конструкции ячейки и природы электродов.
Для электролиза нейтрального (pH 7) раствора хлорида натрия восстановление иона натрия термодинамически очень затруднено, и вода восстанавливается с выделением водорода, оставляя ионы гидроксида в растворе. На аноде наблюдается скорее окисление хлора, чем окисление воды, поскольку перенапряжение для окисления хлорида до хлора ниже, чем перенапряжение для окисления воды до кислорода . В гидроксид — ионы и растворенного газа хлора реагируют далее с образованием хлорноватистой кислоты . Водные растворы, полученные в результате этого процесса, называются электролизованной водой и используются как дезинфицирующее и чистящее средство.
Особенности электролиза растворов
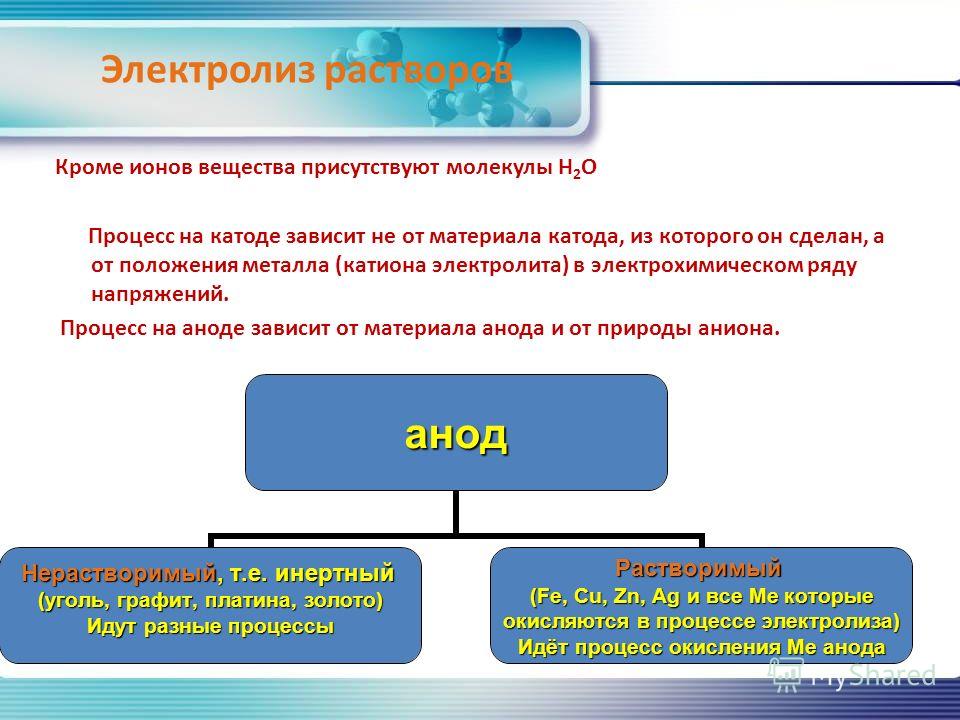
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
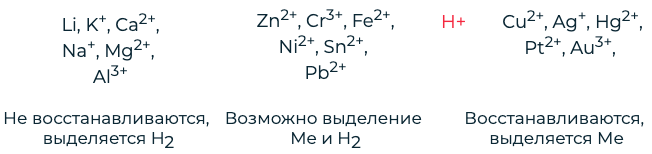
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б)На не растворимом аноде (графит, платина) обычно окисляются анионы S-, J-, Br-, Cl-, OH- и молекулы H2O:
- 2J- => J2 + 2e;
- 4OH- => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
KI → K+ + I-
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
Анод: 2I-— 2e- → I20
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl-
- Катод: Cu2+ + 2e- → Cu
- Анод: Cu — 2e- → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
KNO3 → K+ + NO3-
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Молекулы воды окисляются на аноде и выделяется кислород.
Анод: 2H2O — 4e- → O2 + 4H+
В результате получаем общее уравнение электролиза:
2H2O → 2H2 + O2
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Ba(OH)2 → Ba2+ + 2OH-
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
Катод: 2H2O + 2e- → H2 + 2OH-
На аноде откладываются молекулы кислорода.
Анод: 4OH- — 4e- → O2 + 4H+
Получаем суммарное уравнение электролиза:
2H2O → 2H2 + O2
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3—
- Катод: 2H+ + 2e- → H2
- Анод: 2H2O — 4e- → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
2H2O → 2H2 + O2
Некоторые теоретические понятия
Электролитом называют вещество, которое проводит ток. Электроды бывают двух видов. Катод представляет собой заряженный отрицательно электрод, на нем происходит реакция восстановления.
Анодом называют положительно заряженный электрод, где осуществляется восстановление.