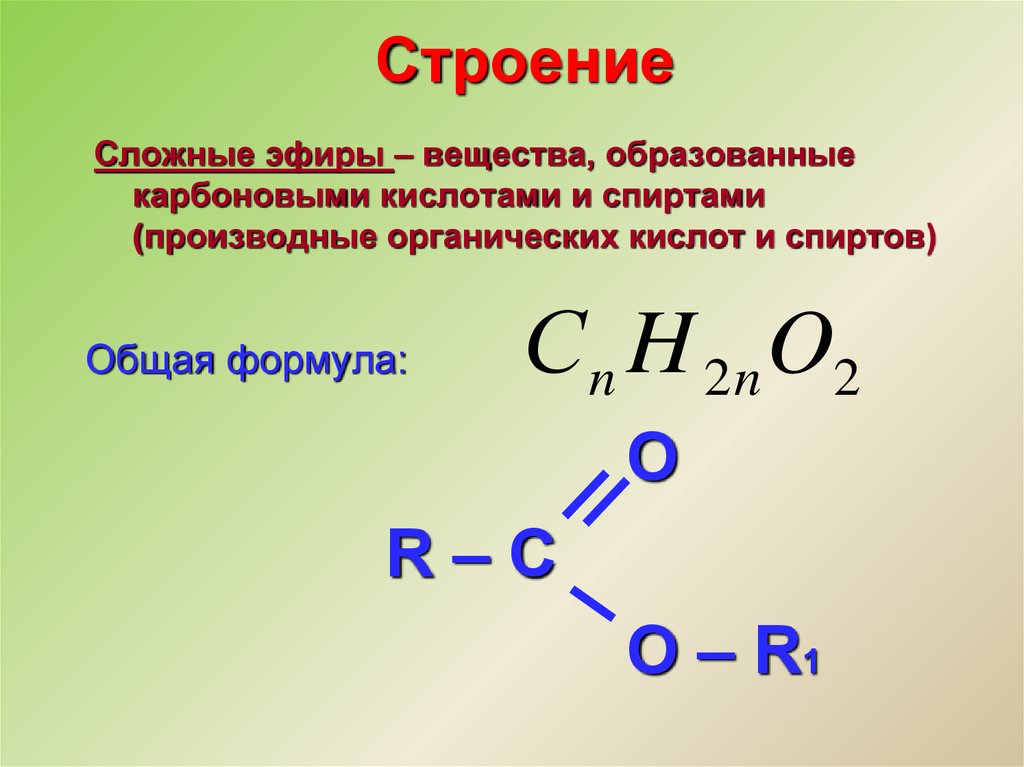
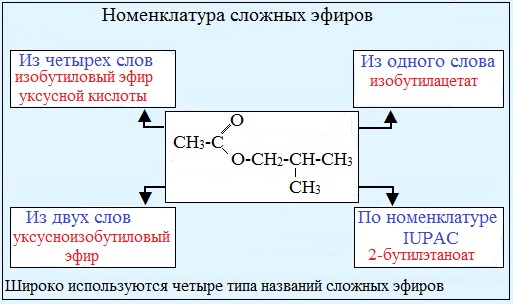
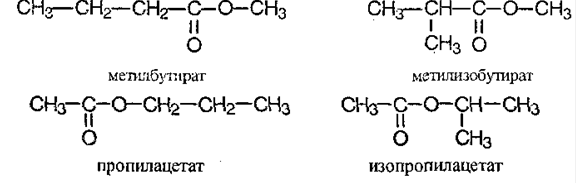
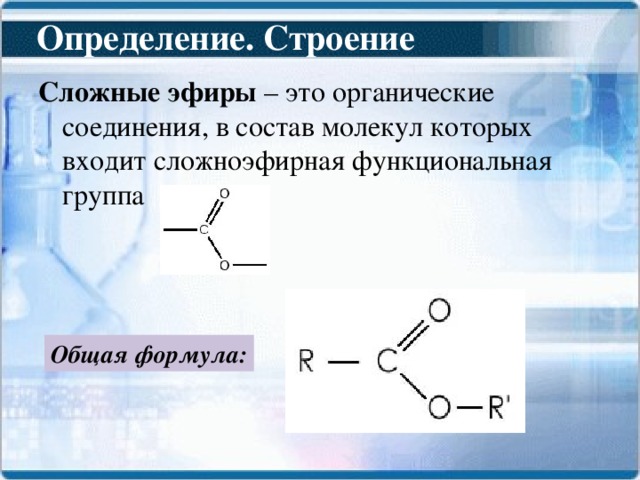
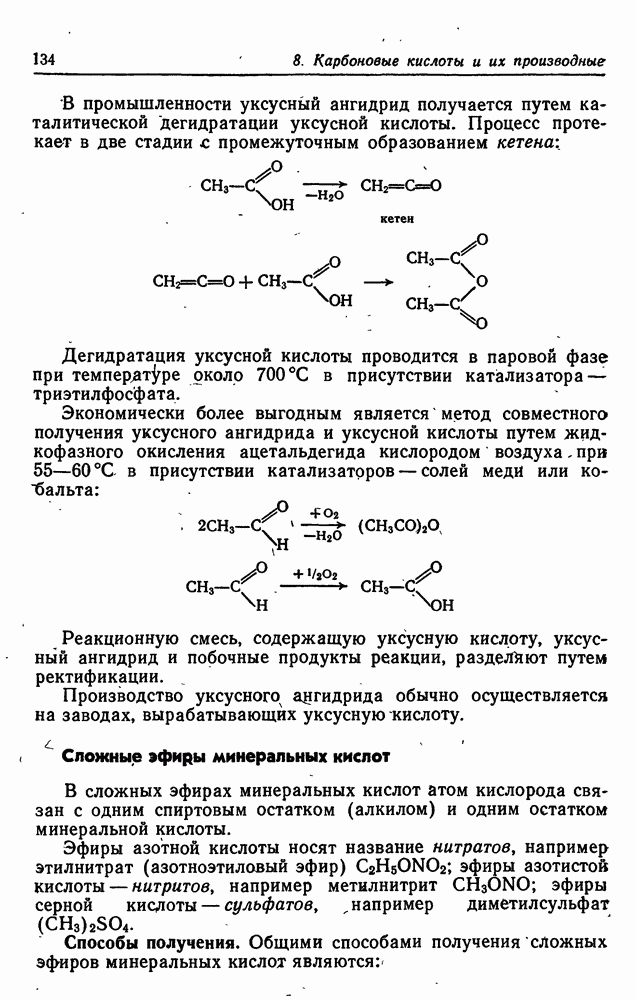
Классификация и состав сложных эфиров.
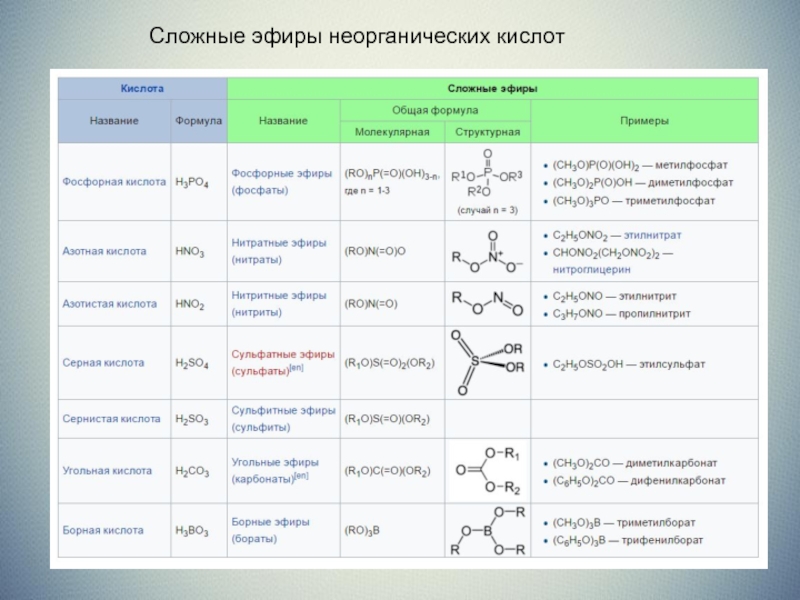
Среди изученных и широко применяемых сложных эфиров большинство представляют соединения, полученные на основе карбоновых кислот. Сложные эфиры на основе минеральных (неорганических) кислот не столь разнообразны, т.к. класс минеральных кислот менее многочисленен, чем карбоновых (многообразие соединений – один из отличительных признаков органической химии).
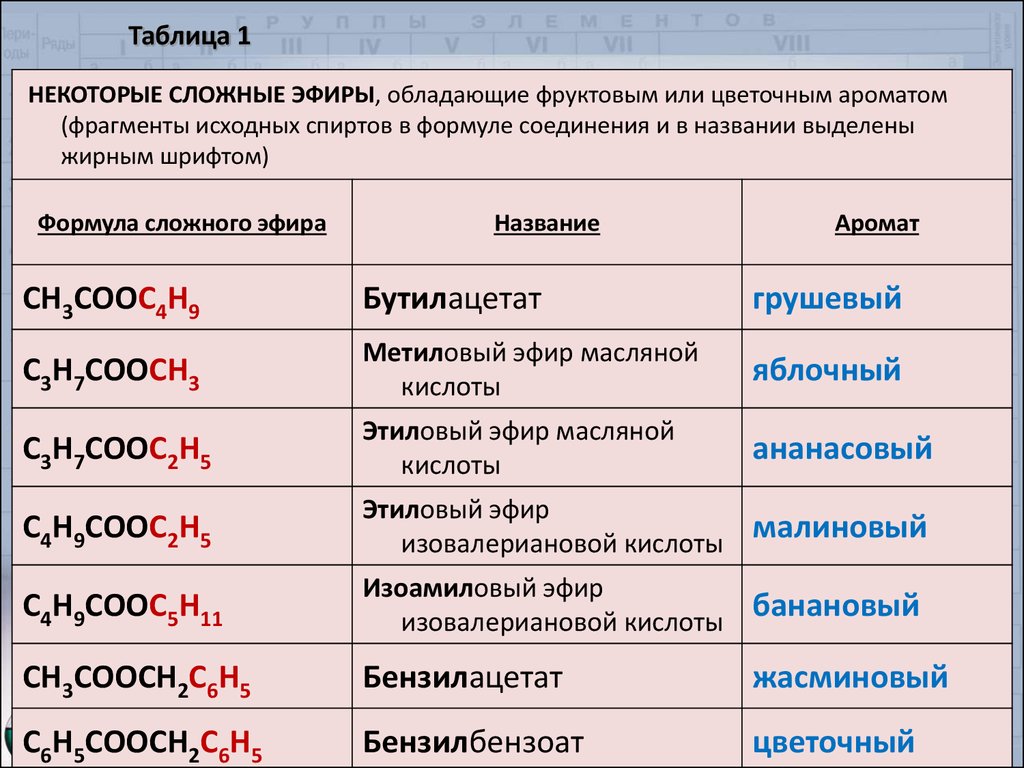
Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов (табл. 1), некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
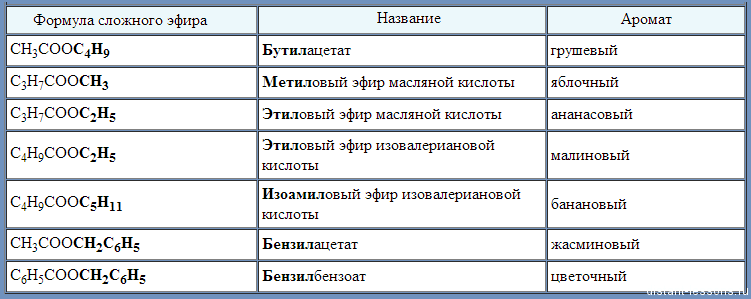
| Табл. 1. НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом) | ||
| Формула сложного эфира | Название | Аромат |
| СН3СООС4Н9 | Бутилацетат | грушевый |
| С3Н7СООСН3 | Метиловый эфир масляной кислоты | яблочный |
| С3Н7СООС2Н5 | Этиловый эфир масляной кислоты | ананасовый |
| С4Н9СООС2Н5 | Этиловый эфир изовалериановой кислоты | малиновый |
| С4Н9СООС5Н11 | Изоамиловый эфир изовалериановой кислоты | банановый |
| СН3СООСН2С6Н5 | Бензилацетат | жасминовый |
| С6Н5СООСН2С6Н5 | Бензилбензоат | цветочный |
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками, они, как правило, не обладают запахом. Пчелиный воск содержит смесь различных сложных эфиров, один из компонентов воска, который удалось выделить и определить его состав, представляет собой мирициловый эфир пальмитиновой кислоты С15Н31СООС31Н63. Китайский воск (продукт выделения кошенили – насекомых Восточной Азии) содержит цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Кроме того, воски содержат и свободные карбоновые кислоты и спирты, включающие большие органические группы. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.
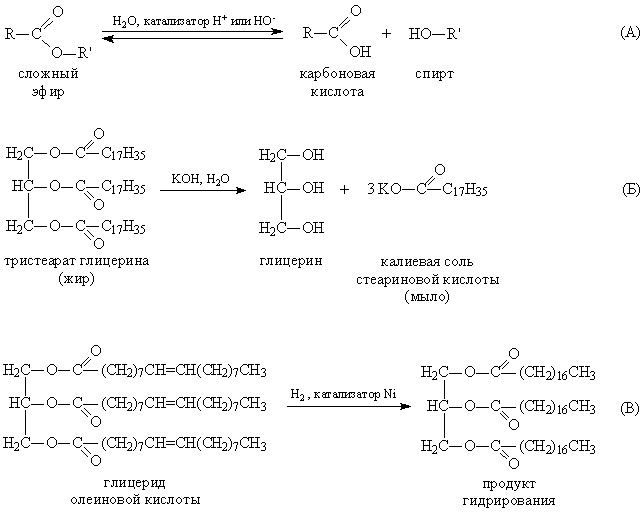
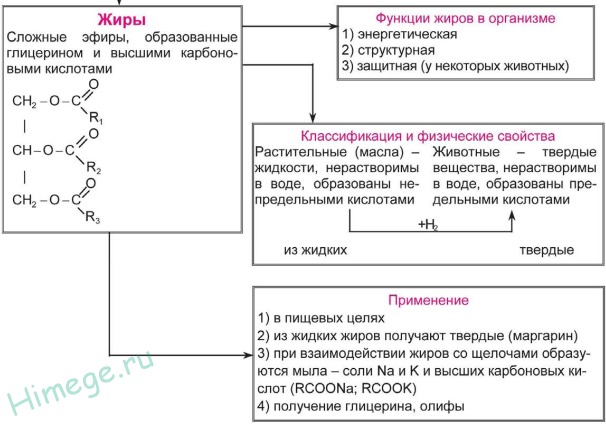
Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, образованные из трехатомного спирта глицерина НОСН2–СН(ОН)–СН2ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода. Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости. Животные жиры, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты (рис. 3А,Б). Растительные масла содержат глицериды кислот с несколько меньшей длиной углеродной цепи: лауриновой С11Н23СООН и миристиновой С13Н27СООН. (как и стеариновая и пальмитиновая – это насыщенные кислоты). Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются невысыхающими. В отличие от них, льняное масло содержит глицерид ненасыщенной линолевой кислоты (рис. 3В). При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях. На основе льняного масла изготавливают натуральную олифу.
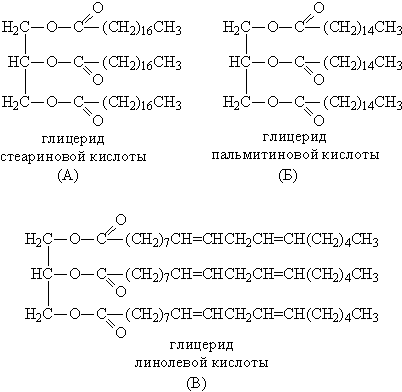
Рис. 3. ГЛИЦЕРИДЫ СТЕАРИНОВОЙ И ПАЛЬМИТИНОВОЙ КИСЛОТЫ (А И Б) – компоненты животного жира. Глицерид линолевой кислоты (В) – компонент льняного масла.
Сложные эфиры минеральных кислот (алкилсульфаты, алкилбораты, содержащие фрагменты низших спиртов С1–8) – маслянистые жидкости, эфиры высших спиртов (начиная с С9) – твердые соединения.
Простые эфиры
Реакция простых эфиров с галогеноводородами:
Большинство простых эфиров могут разлагаться под воздействием бромоводородной кислоти (HBr) с образованием алкилбромидов или при взаимодействии с иодоводородной кислотой (HI) с получениемалкилиодидов.
СН3—О—СН3 + НI = СН3—ОН + СН3I
СН3—ОН + НI = СН3I + Н2О
Образование оксониевых соединений:
Серная, иодная и др. сильные кислоты при взаимодействии с простыми эфирами, образуют оксониевые соединения – продукты соединения высшего порядка.
СН3—О—СН3 + HCl = (CH3)2О ∙ HCl
Взаимодействие простых эфиров с металлическим натрием:
При нагревании с основными металлами, например, металлическим натрием, простые эфиры расщепляются на алкоголяты и алкилнатрий.
СН3—О—СН3 + 2Na = СН3—ОNa + СН3—Na
Автоокисление простых эфиров:
В присутствии кислорода, простые эфиры медленно автоокисляются с образованием гидроперекиси идиалкил пероксида. Автоокисление является спонтанным окислением соединения в воздухе.
С2Н5—О—С2Н5 + О2 = СН3—СН(ООН)—О—С2Н5
Разница между эфиром и эфиром

И Эстер, и Эфир являются типами функциональных классов в классификации органических химических соединений. Классификация химических соединений облегчает анализ их свойств внутри группы в целом. И сложные и простые эфиры являются типами функциональных классов химических соединений, которые широко производятся, используются и имеют промышленную ценность.
Разница между эфиром и эфиром заключается в их химической структуре. главное отличие между Эстер и Эфир является то, что сложноэфирная группа нуждается в двух атомах углерода и двух атомах кислорода для завершения своей характерной структуры. Для ее сложноэфирной группы требуется только один атом кислорода и два атома углерода.
Что такое Эстер
Как уже упоминалось выше, сложноэфирная группа нуждается в двух атомах кислорода и двух атомах углерода для завершения своей структуры. Кислород (A) будет дважды связан с углеродом (A), а кислород (B) будет отдельно связан с углеродом (A) и углеродом (B). то есть R (O) -OR ’; R и R ‘представляют собой алкильные группы.
Сложные эфиры производятся как производные карбоновых кислот. Что происходит в реакции, так это то, что «Н» в группе «ОН» карбоновой кислоты замещается алкильной (R) группой. Эта стадия делает сложные эфиры менее реакционноспособными по сравнению с карбоновыми кислотами.
Однако сложноэфирные группы сохраняют значительный уровень реакционной способности благодаря своей «карбонильной группе». Карбонил относится к группе, в которой атом кислорода имеет двойную связь с атомом углерода. Благодаря этой карбонильной группе сложные эфиры легко поляризуются.
Сложные эфиры являются более полярными по сравнению с простыми эфирами, однако менее полярными по сравнению с карбоновыми кислотами. Кроме того, сложные эфиры способны образовывать Н-связи с внешними источниками Н, но не могут образовывать Н-связи друг с другом.
Концепция образования сложных эфиров также может быть распространена на неорганические соединения (например, трифенилфосфат, который является сложным фосфатным эфиром). Кроме того, сложные эфиры могут быть получены путем алкоголиза ацилхлоридов и ангидридов кислот.
Процесс этерификации является обратимой реакцией, и сложные эфиры подвергаются различным реакциям, включая гидролиз. Эфирная группа часто используется в качестве защитной группы для карбоновых кислот в химических реакциях.
Что такое эфир
Как уже упоминалось выше, эфирная группа имеет один атом кислорода и два атома углерода, Атом кислорода будет одинаково связан с обоими атомами углерода. то есть R-O-R ’.
Простые эфиры можно рассматривать как производные спиртов, где «Н» в группе «ОН» заменяется алкильной (R) группой. Это делает эфиры менее реактивными. Кроме того, поскольку он не обладает карбонильной группой, его реакционная способность даже меньше, чем у сложных эфиров.
Однако из-за присутствия атома кислорода с одинокими парами он способен образовывать Н-связи с внешними атомами Н.
В отличие от сложных эфиров, простые эфиры имеют много тривиальных названий. Однако, согласно номенклатуре IUPAC, они обычно обозначаются как «алкоксиалканы». Метоксиэтан является примером для этого.
Это объясняет, что атом кислорода связан с метильной группой и этильной группой.
Если обе алкильные группы с обеих сторон атома кислорода одинаковы, это называется «симметричным эфиром», а с другой стороны, если группы не похожи, их называют «несимметричными эфирами».
Определение – по структуре
эфир представляет собой группу, в которой один атом кислорода имеет двойную связь с атомом углерода, который однозначно связан с другим атомом кислорода, который снова однократно связан с другим атомом углерода.
эфир группа представляет собой группу, в которой атом кислорода одинарно связан с двумя атомами углерода (алкильными группами)
Эфиры имеют карбонильную группу и, следовательно, легко поляризуются.
Эфиры не имеют карбонильной группы.
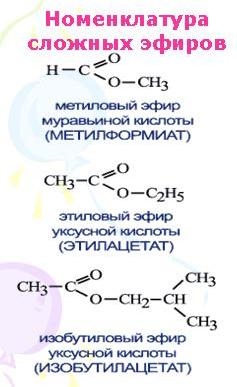
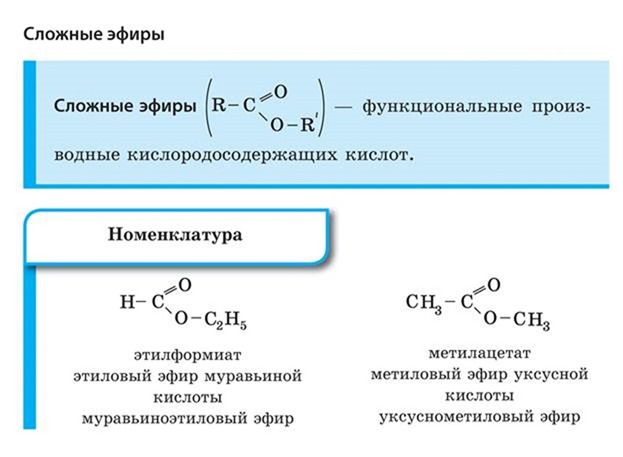
Номенклатура
Эфиры заканчиваться суффиксом «-ate» в соответствии с правилами IUPAC для обозначения химических соединений.
Эфиры называются «алкоксиалканы».
Эфиры получены из карбоновых кислот.
Эфиры получены из спиртов.
симметричность
Это невозможно для сложные эфиры иметь симметричную структуру благодаря наличию карбонильной группы.
Если обе алкильные группы на любой стороне атома кислорода в эфир группы похожи, структура симметрична.
Изображение предоставлено:
«Эстер-генерал» Сакурамбо – Предположительно собственная работа (предположительно – основываясь на заявлении об авторском праве). (Public Domain) через
Применение сложных эфиров.
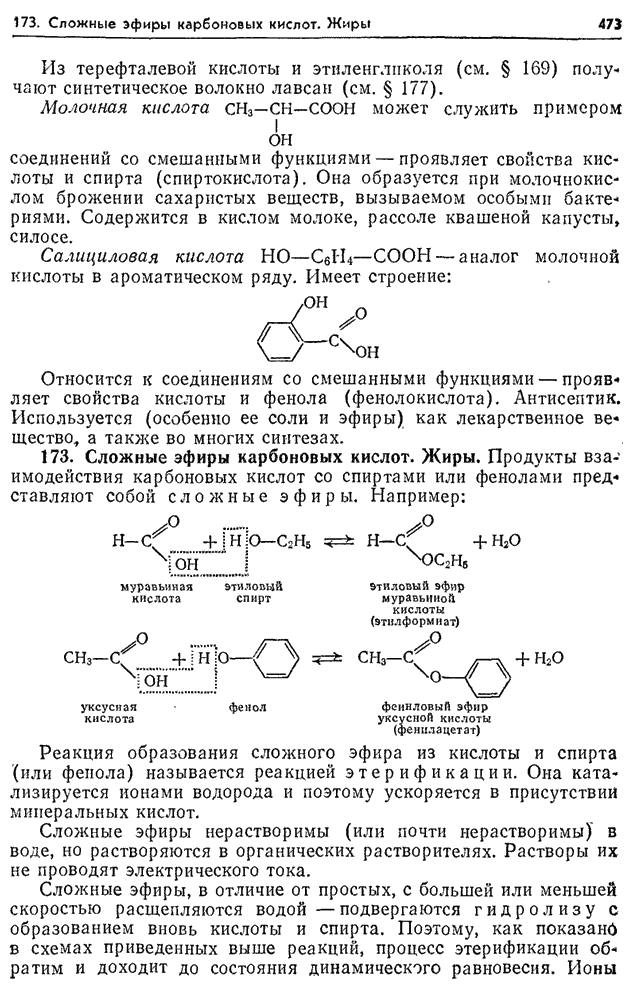
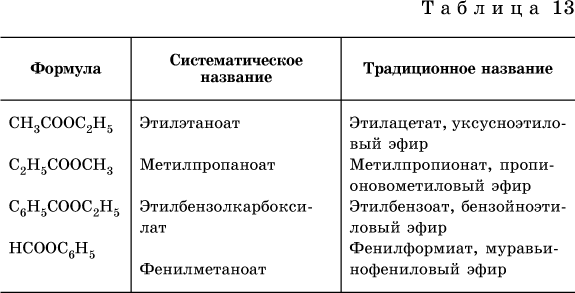
Этилформиат НСООС2Н5 и этилацетат Н3СООС2Н5 используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).
Сложные эфиры на основе низших спиртов и кислот (табл. 1) используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
Жиры вместе с углеводами и белками составляют набор необходимых для питания пищевых продуктов, они входят в состав всех растительных и животных клеток, кроме того, накапливаясь в организме, играют роль энергетического запаса. Из-за низкой теплопроводности жировой слой хорошо предохраняет животных (в особенности, морских – китов или моржей) от переохлаждения.
Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина (рис. 4), используемого в косметической промышленности и как компонент различных смазок.
Нитроглицерин (рис. 4) – известный лекарственный препарат и взрывчатое вещество, основа динамита.
На основе растительных масел изготавливают олифы (рис. 3), составляющие основу масляных красок.
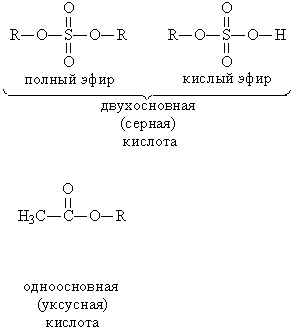
Эфиры серной кислоты (рис. 2) используют в органическом синтезе как алкилирующие (вводящие в соединение алкильную группу) реагенты, а эфиры фосфорной кислоты (рис. 5) – как инсектициды, а также добавки к смазочным маслам.
Михаил Левицкий
Физические свойства этеров и эстеров
Простые эфиры — малорастворимые в воде, легкокипящие жидкости, легко воспламеняются. При комнатной температуре, простые эфиры — приятно пахнущие бесцветные жидкости.
Сложные эфиры, имеющие малую молекулярную массу — легко испаряющиеся бесцветные жидкости, приятно пахнут, часто фруктами или цветами. С возрастанием карбоновой цепи ацилгруппы и спиртового остатков, их свойства становятся другими. Такие эфиры твердые вещества. Их точка плавления зависит от длинны углеродных радикалов и структуры молекулы.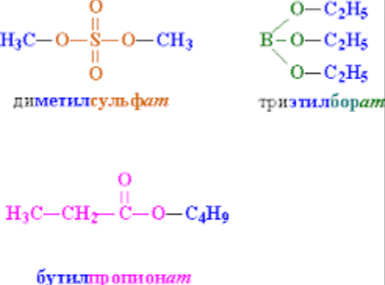
Список эфирных ароматизаторов
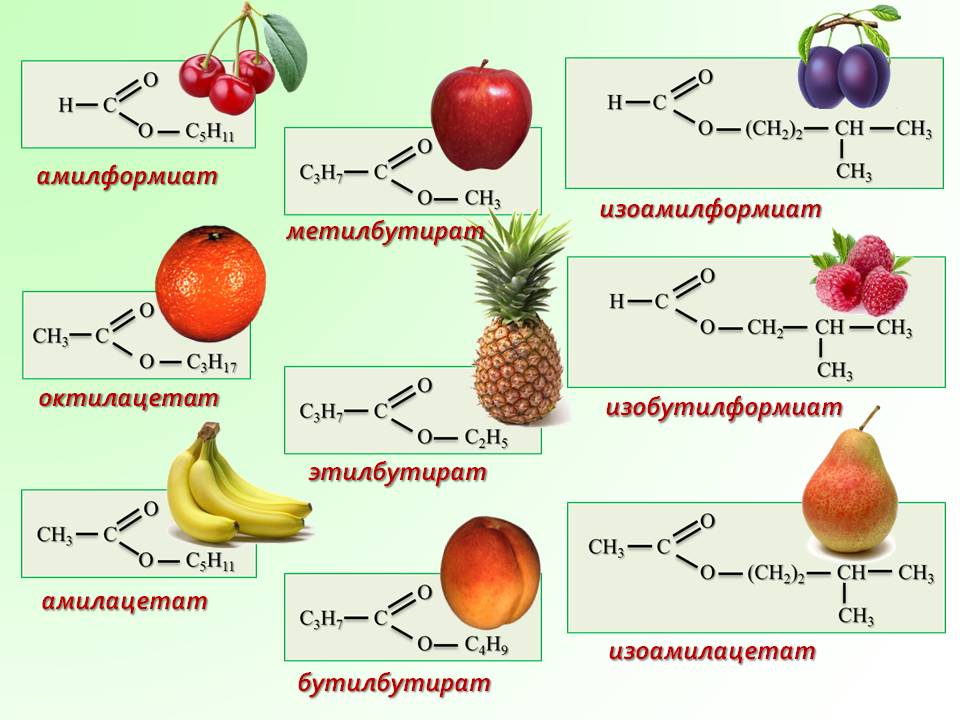
Многие сложные эфиры имеют характерный фруктовый запах, и многие из них естественным образом содержатся в эфирных маслах растений. Это также привело к их обычному использованию в искусственных ароматизаторах и ароматизаторах, имитирующих эти запахи.
| Имя Эстер | Структура | Запах или появление |
|---|---|---|
| Аллил гексаноат | ананас | |
| Бензилацетат | груша , клубника , жасмин | |
| Борнилацетат | сосна | |
| Бутил ацетат | яблоко , мед | |
| Бутилбутират | ананас | |
| Бутилпропаноат | грушевые капли | |
| Ацетат этила | жидкость для снятия лака , модельная краска , авиамодельный клей | |
| Этилбензоат | сладкий , грушевый , фруктовый , лекарственный, вишневый , виноградный | |
| Этилбутират | банан , ананас , клубника | |
| Этил гексаноат | ананас , восково-зеленый банан | |
| Этилциннамат | корица | |
| Этилформиат | лимон , ром , клубника | |
| Этил гептаноат | абрикос , вишня , виноград , малина | |
| Этил изовалерат | яблоко | |
| Этил лактат | сливочное масло , сливки | |
| Этилнонаноат | виноград | |
| Этил пентаноат | яблоко | |
| Геранил ацетат | герань | |
| Геранил бутират | вишня | |
| Геранил пентаноат | яблоко | |
| Изобутилацетат | вишня , малина , клубника | |
| Изобутилформиат | малина | |
| Изоамилацетат | груша , банан (ароматизатор в грушевых каплях ) | |
| Изопропилацетат | фруктовый | |
| Линалилацетат | лаванда , шалфей | |
| Линалил бутират | персик | |
| Линалил формиат | яблоко , персик | |
| Метилацетат | клей | |
| Метилантранилат | виноград , жасмин | |
| Метилбензоат | фруктовый, иланг-иланг , фейхоа | |
| Метилбутират (метилбутаноат) | ананас , яблоко , клубника | |
| Метил циннамат | клубника | |
|
Метилпентаноат ( метилвалерат ) |
цветочный | |
| Метил фенилацетат | мед | |
| Метилсалицилат ( масло грушанки ) | Современное корневое пиво , грушанка , мази Гермолен и Ралгекс (Великобритания) | |
| Нонил каприлат | оранжевый | |
| Октилацетат | фруктово- апельсиновый | |
| Октилбутират | пастернак | |
| Амилацетат (пентилацетат) | яблоко , банан | |
| Пентилбутират (амилбутират) | абрикос , груша , ананас | |
| Пентил гексаноат (амиловый капроат) | яблоко , ананас | |
|
Пентилпентаноат ( амилвалерат ) |
яблоко | |
| Пропилацетат | груша | |
| Пропил гексаноат | ежевика , ананас , сыр , вино | |
| Пропил изобутират | ром | |
| Терпенилбутират | вишня |
Простые эфиры
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные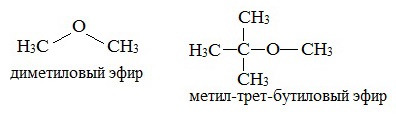
непредельные
ароматические
циклические 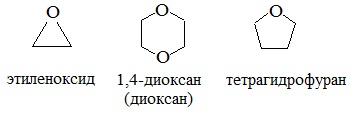
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
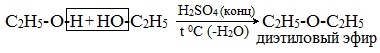
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана: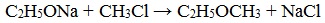
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):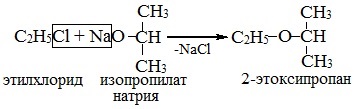
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид)  диоксан
диоксан
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Рубрики: Эфиры Теги: Эфиры
Реакции
Сложные эфиры реагируют с нуклеофилами у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов (аминов, алкоксидов, источников гидридов, литийорганических соединений и т. Д.). Связи С – Н, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород в сложных эфирах является слабоосновным, в меньшей степени, чем карбонильный кислород в амидах из-за резонансной передачи электронной пары из азота в амидах, но образует аддукты .
Гидролиз и омыление
Этерификация — обратимая реакция. Сложные эфиры подвергаются гидролизу в кислотных и основных условиях. В кислых условиях реакция является обратной реакцией этерификации Фишера . В основных условиях гидроксид действует как нуклеофил, а алкоксид — уходящая группа. Эта реакция — омыление — лежит в основе мыловарения.
Алкоксидная группа также может быть замещена более сильными нуклеофилами, такими как аммиак или первичные или вторичные амины, с образованием амидов : (реакция аммонолиза)
-
- RCO 2 R ‘+ NH 2 R ″ → RCONHR ″ + R′OH
Эта реакция обычно необратима. Вместо аминов можно использовать гидразины и гидроксиламин. Сложные эфиры могут быть превращены в изоцианаты через промежуточные гидроксамовые кислоты в перегруппировке Лоссена .
Источники углеродных нуклеофилов, например реактивы Гриньяра и литийорганические соединения, легко присоединяются к карбонилу.
Сокращение
По сравнению с кетонами и альдегидами сложные эфиры . Введение каталитического гидрирования в начале 20-го века было прорывом; сложные эфиры жирных кислот гидрируются до жирных спиртов .
-
- RCO 2 R ‘+ 2 H 2 → RCH 2 OH + R’OH
Типичный катализатор — хромит меди . До разработки каталитического гидрирования сложные эфиры восстанавливали в больших масштабах с использованием восстановления Буво-Блана . В этом методе, который в значительной степени устарел, используется натрий в присутствии источников протонов.
Литийалюминийгидрид используется для восстановления сложных эфиров до двух первичных спиртов, особенно для тонкого химического синтеза . Соответствующий реагент борогидрид натрия медленен в этой реакции. DIBAH восстанавливает сложные эфиры до альдегидов.
Прямое восстановление с получением соответствующего эфира затруднено, поскольку промежуточный полуацеталь имеет тенденцию к разложению с образованием спирта и альдегида (который быстро восстанавливается с образованием второго спирта). Реакция может быть осуществлена с использованием триэтилсилана с различными кислотами Льюиса.
Конденсация Клайзена и родственные реакции
Что касается альдегидов , атомы водорода на углероде, примыкающем («α к») к карбоксильной группе в сложных эфирах, являются достаточно кислыми, чтобы подвергаться депротонированию, что, в свою очередь, приводит к множеству полезных реакций. Для депротонирования требуются относительно сильные основания, такие как алкоксиды . Депротонирование дает нуклеофильный енолят , который может далее реагировать, например, конденсация Клайзена и ее внутримолекулярный эквивалент, конденсация Дикмана . Это превращение используют в синтезе сложного эфира малоновой кислоты , где сложный диэфир малоновой кислоты реагирует с электрофилом (например, алкилгалогенидом ) и впоследствии декарбоксилируется. Другой вариант — алкилирование Фратера-Зеебаха .
Другие реакции
- Фениловые эфиры реагируют с гидроксиарилкетонами в перегруппировке Фриса .
- Определенные сложные эфиры функционализированы α-гидроксильной группой в перегруппировке Чана .
- Сложные эфиры с β-атомами водорода могут быть превращены в алкены при пиролизе сложных эфиров .
- Прямое преобразование сложных эфиров в нитрилы .
Защита групп
Как класс, сложные эфиры служат защитными группами для карбоновых кислот . Защита карбоновой кислоты полезна при синтезе пептидов, чтобы предотвратить самореакцию бифункциональных аминокислот . Метиловые и этиловые эфиры обычно доступны для многих аминокислот; т — бутиловый эфир имеет тенденцию быть более дорогими. Однако сложные трет- бутиловые эфиры особенно полезны, потому что в сильно кислых условиях сложные трет- бутиловые эфиры подвергаются элиминированию с образованием карбоновой кислоты и изобутилена , что упрощает обработку.
11.3. Химические свойства сложных эфиров
1.
Реакция гидролиза, или омыления. Так,
как реакция этерификации является
обратимой, поэтому в присутствии кислот
протекает обратная реакция гидролиза:
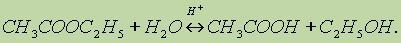
Реакция гидролиза
катализируется и щелочами; в этом случае
гидролиз необратим, так как получающаяся
кислота со щелочью образует соль:

2. Реакция
присоединения. Сложные эфиры, имеющие
в своем составе непредельную кислоту
или спирт, способны к реакциям
присоединения.
3.
Реакция восстановления. Восстановление
сложных эфиров водородом приводит к
образованию двух спиртов:

4. Реакция образования
амидов. Под действием аммиака сложные
эфиры превращаются в амиды кислот и
спирты:
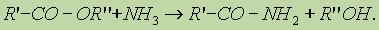
Интересные сведения о полярных совах
Данная группа хищников отличается тем, что они выходят на охоту не только ночью и вечером, но и солнечным днем. Зачастую это случается в послеобеденные часы, когда сова особенно голодна. Перед тем как начать охоту, птица залетает на высокий холм или гору, откуда и ведет наблюдение в течение некоторого времени. Так как полярная сова – птица, охотящаяся относительно на небольших участках земли, то в течение целого дня ее можно не выпускать из виду. Безусловно, зачастую даже самые опытные знатоки сов не могут подобраться на расстояние выстрела к этой птице. Большинство особей крайне боязливы, даже несмотря на то, что на прямую угрозу они натыкаются очень редко, что обусловлено плохой заселенностью их мест обитания. Возможно, такая реакция говорит о хорошо развитом инстинкте самосохранения. Нельзя не отметить, что полярная сова – птица, которая способна дать отпор таким дневным хищникам, как ястреб или беркут. На крупных особей они нападают редко, а вот на гнездо с маленькими совятами очень часто заглядываются.
12.1. Номенклатура и изомерия
Жиры
– образованы трехатомным спиртом
глицерином и высшими жирными кислотами.
Жиры входят в
состав растительных и животных организмов
и служат одним из источников энергии
живых организмов, которая выделяется
при окислении жиров.
Общая формула
жиров:
где
R’, R», R»‘ – углеродные радикалы.
Жиры
бывают “простыми” и “смешанными”. В
состав простых жиров входят остатки
одинаковых кислот (т. е. R’ = R» = R'»),
в состав смешанных – различных.
В жирах наиболее
часто встречаются следующие жирные
кислоты:
Алкановые кислоты
1.
Масляная кислотата СН3
– (CH2)2
– СООН
2.
Капроновая кислотата СН3
– (CH2)4
– СООН
3.
Пальмитиновая кислотата СН3
– (CH2)14
– СООН
4.
Стеариновая кислотата СН3
– (CH2)16
– СООН
Алкеновые кислоты
5.
Олеиновая кислотата С17Н33СООН
СН3–
(СН2)7–СН
= СН– (СН2)7–СООН
Алкадиеновые
кислоты
6.
Линолевая кислотата С17Н31СООН
СН3–
(СН2)4–СН
= СН–СН2–СН
= СН–СООН
Алкатриеновые
кислоты
7.
Линоленовая кислотата С17Н29СООН
СН3–СН2–СН
= CH–CH2–CH
== CH-CH2–CH
= СН–(СН2)4–СООН
Получение
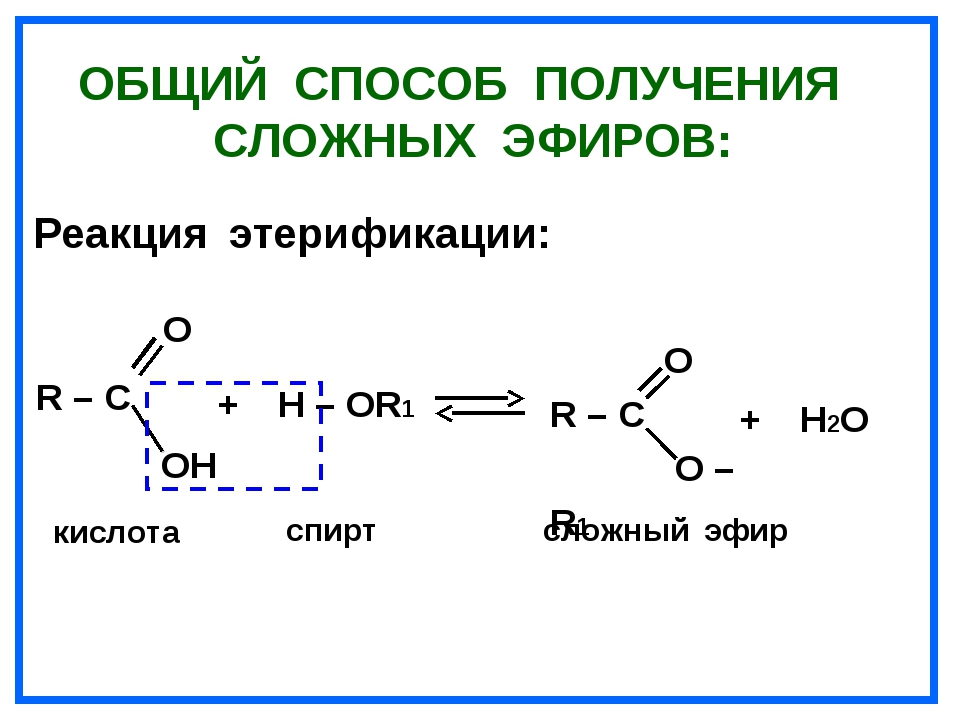
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
- ангидридов со спиртами:
(CH3CO)2O + 2C2H5OH → 2CH3COOC2H5 + H2O; - солей карбоновых кислот с галогенуглеводородами:
CH3(CH2)10COONa + CH3Cl → CH3(CH2)10COOCH3 + NaCl; - карбоновых кислот к алкенам:
CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.