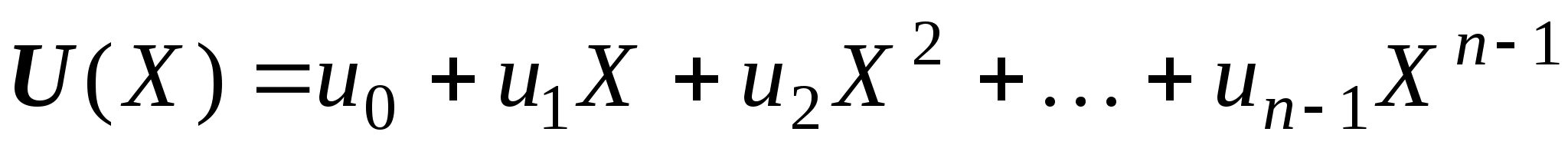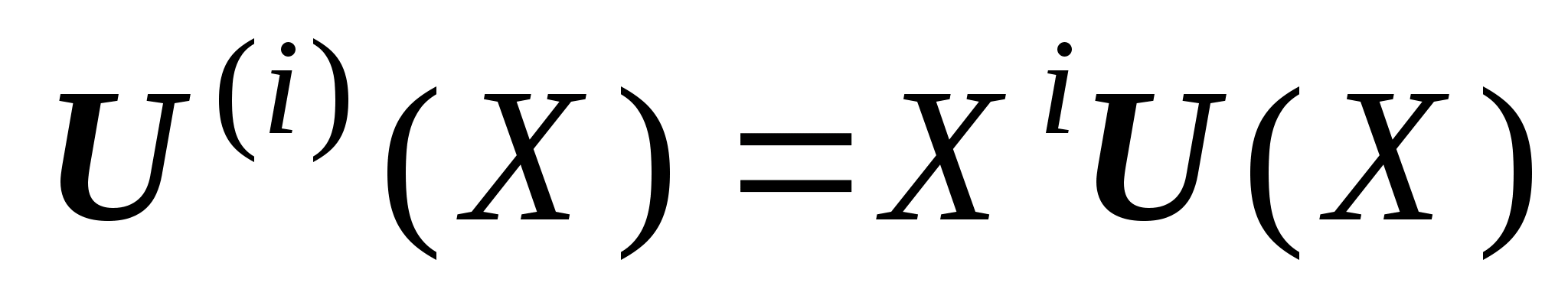Нуклеофильное замещение
В органической (и неорганической) химии нуклеофильное замещение является фундаментальным классом реакций, в которых нуклеофил избирательно связывается или атакует положительный или частично положительный заряд на атоме или группе атомов. При этом он заменяет более слабый нуклеофил, который затем становится уходящей группой ; Оставшийся положительный или частично положительный атом становится электрофилом . Вся молекулярная структура, частью которой являются электрофил и уходящая группа, обычно называется субстратом.
Наиболее общая форма реакции может быть дана как где R-LG указывает субстрат.
- Nuc + R-LG → R-Nuc + LG
Пара электронов ( ) от нуклеофила (NUC 🙂 атака субстрат (R-LG) формирование новой ковалентной связи Nuc-R-LG. Прежнее состояние заряда восстанавливается, когда уходящая группа (LG) уходит с электронной парой. Основным продуктом в этом случае является R-Nuc. В таких реакциях нуклеофил обычно электрически нейтрален или заряжен отрицательно, тогда как субстрат обычно нейтрален или заряжен положительно.
Примером нуклеофильного замещения является гидролиз алкилбромида , R-Br, в основных условиях, где атакующий нуклеофил представляет собой основание ОН -, а уходящей группой является Br — .
- R-Br + OH — → R-OH + Br —
Реакции нуклеофильного замещения являются обычным явлением в органической химии, и их можно в широком смысле классифицировать как происходящие на атоме углерода насыщенного алифатического соединения или (реже) на ароматическом или другом ненасыщенном углеродном центре.
Механизмы
Нуклеофильные замены на алифатических углеродных центрах могут происходить по двум различным механизмам: мономолекулярному нуклеофильному замещению ( S N 1 ) и бимолекулярному нуклеофильному замещению ( S N 2 ).
Механизм S N 1 состоит из двух ступеней. На первом этапе уходящая группа уходит, образуя карбокатион C + . На втором этапе нуклеофильный реагент (Nuc 🙂 присоединяется к карбокатиону и образует ковалентную сигма-связь. Если субстрат имеет хиральный углерод, этот механизм может привести либо к инверсии стереохимии, либо к сохранению конфигурации. Обычно оба варианта происходят без предпочтений. Результат — рацемизация .
Механизм S N 2 имеет всего один шаг. Атака реагента и изгнание уходящей группы происходят одновременно. Этот механизм всегда приводит к инверсии конфигурации. Если субстрат, который подвергается нуклеофильной атаке, является хиральным, реакция, следовательно, приведет к инверсии его стереохимии , называемой инверсией Вальдена .
Атака S N 2 может происходить, если обратный путь атаки стерически не затруднен заместителями на субстрате. Следовательно, этот механизм обычно имеет место на беспрепятственном первичном углеродном центре. Если имеется стерическое скопление на субстрате рядом с уходящей группой, например, в третичном углеродном центре, замещение будет включать механизм S N 1, а не S N 2; S N 1 также будет более вероятным в этом случае, потому что может быть образован достаточно стабильный карбокатион-интермедиат.
Когда субстрат представляет собой ароматическое соединение, тип реакции представляет собой нуклеофильное ароматическое замещение , которое протекает с различными механизмами. Производные карбоновых кислот реагируют с нуклеофилами путем нуклеофильного ацильного замещения . Такой тип реакции может быть полезен при получении соединений.
Ядерные реакции.
Ядерные реакции можно отнести к химическим лишь весьма условно, поскольку в них элемент превращается в изотоп того же элемента или другой элемент. Иногда какая-то часть вещества в ядерной реакции исчезает, и этот процесс сопровождается высвобождением огромного количества энергии; такие процессы происходят при взрыве атомной бомбы или в ядерном реакторе. Обычно в уравнениях ядерных реакций фигурируют нейтроны (), протоны (), электроны (), a-частицы (), g-лучи () и позитроны (). Верхний левый индекс обозначает массу частицы, а нижний левый – ее заряд. Приведем уравнения типичных ядерных реакций:
Суммы верхних индексов в левой и правой частях уравнения должны быть одинаковыми; то же самое относится к нижним индексам. Может показаться, что масса вещества в ходе ядерных реакций (17)–(19) не изменяется. В действительности же вследствие взаимодействия элементарных частиц в ядре и изменения их массы покоя у продуктов масса может оказаться чуть меньше, чем у исходных веществ. Именно с исчезновением этого незначительного количества вещества, которое превращается в энергию согласно уравнению Эйнштейна Е = mc2, и связана разрушительная сила ядерного взрыва. Протекающая при этом реакция описывается уравнением (19). В уравнении (17) (криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
Реакции одинарного замещения
В результате реакций одинарного замещения, более активный элемент замещает в соединении менее активный:
Zn(т) + CuSO4 (р-р) → ZnSO4 (р-р) + Cu(т)
Цинк в растворе сульфата меди вытесняет менее активную медь, в результате чего образуется раствор сульфата цинка.
Степень активности металлов по возрастанию активности:
- Au
- Ag
- Cu
- Pb
- Sn
- Ni
- Fe
- Cr
- Al
- Наиболее активными являются щелочные и щелочноземельные металлы
Ионное уравнение вышеприведенной реакции будет иметь вид:
Zn(т) + Cu2+ + SO42- → Zn2+ + SO42- + Cu(т)
Ионная связь CuSO4 при растворении в воде распадается на катион меди (заряд 2+) и анион сульфата (заряд 2-). В результате реакции замещения образуется катион цинка ( который имеет такой же заряд, как и катион меди: 2-)
Обратите внимание, что анион сульфата присутствует в обеих частях уравнения, т.е., по всем правилам математики его можно сократить. В итоге получится ионно-молекулярное уравнение:
Zn(т) + Cu2+ → Zn2+ + Cu(т)
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.
Мономолекулярные и бимолекулярные реакции
Нуклеофильное замещение бывает мономолекулярным (SN1)
По такому механизму протекает гидролиз важного продукта органического синтеза — третичного бутилхлорида. Первая стадия проходит медленно, она связана с постепенной диссоциацией на катион карбония и хлорид-анион
Второй этап идет быстрее, протекает реакция иона карбония с водой. Уравнение реакции замещения галогена в алкане на оксигруппу и получение первичного спирта: (CH3)3C—Cl → (CH3)3C+ + Cl-; (CH3)3C+ + H2O → (CH3)3C—OH + H+. Для одностадийного гидролиза первичных и вторичных алкилгалогенидов характерно одновременное разрушение связи углерода с галогеном и образование пары С—ОН. Это механизм нуклеофильного бимолекулярного замещения (SN2).
Замещение гомолитическое (радикальное, SR)
При радикальном механизме разрыва ковалентных связей электронная пара, общая для разных элементов, пропорционально распределяется между «осколками» молекулы. Образуются свободные радикалы. Это неустойчивые частицы, стабилизация которых происходит в результате последующих превращений. Например, при получении этана из метана возникают свободные радикалы, участвующие в реакции замещения: СН4 СН3• + •Н; СН3• + •СН3 → С2Н5; Н• + •Н → Н2. Гомолитический разрыв связи по приведенному механизму замещения характерен для алканов, реакция носит цепной характер. В метане атомы Н можно последовательно заменять на хлор. Аналогично идет реакция с бромом, но йод неспособен напрямую замещать водород в алканах, фтор слишком энергично с ними реагирует.

Реакции соединения
В реакциях соединения хотя бы два элемента образуют один продукт:
2Na(т) + Cl2 (г) → 2NaCl(т) — образование поваренной соли.
Следует обратить внимание на существенный нюанс реакций соединения: в зависимости от условий протекания реакции или пропорций реагентов, вступающих в реакцию, — ее результатом могут быть разные продукты. Например, при нормальных условиях сгорания каменного угля получается углекислый газ:C(т) + O2 (г) → CO2 (г). Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ:2C(т) + O2 (г) → 2CO(г)
Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ:2C(т) + O2 (г) → 2CO(г)
Виды реакций
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO4→ FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения A + B = AB Пример:S + O2→ SO2 Из нескольких простых или сложных веществ образуется одно сложное |
химические реакции разложения AB = A + B Пример:2HN3→ H2 + 3N2 Из сложного вещества образуется несколько простых или сложных веществ |
химические реакции замещения A + BC =AC + B Пример:Fe + CuSO4→ Cu + FeSO4 Атом простого вещества замещает один из атомов сложного |
химические реакции ионного обмена AB+CD = AD+CB Пример:H2SO4 + 2NaCl→ Na2SO4 + 2HCl Сложные вещества обмениваются своими составными частями |
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Электрофилы и нуклеофилы
Частицы, которые испытывают нехватку электронов и могут их принять, получили название «электрофилы». К ним относятся атомы углерода, соединенные с галогенами в галогеналканах. Нуклеофилы обладают повышенной электронной плотностью, они «жертвуют» пару электронов при создании ковалентной связи. В реакциях замещения богатые отрицательными зарядами нуклеофилы подвергаются атаке электрофилов, испытывающих нехватку электронов. Это явление связано с перемещением атома или другой частицы — уходящей группы. Другая разновидность реакций замещения — атака электрофила нуклеофилом. Подчас трудно разграничить два процесса, отнести замещение к тому или другому типу, поскольку сложно точно указать, какая из молекул — субстрат, а какая — реагент. Обычно в таких случаях учитываются следующие факторы:
- природа уходящей группы;
- реакционная способность нуклеофила;
- природа растворителя;
- структура алкильной части.
Типы реакционноспособных частиц
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону (гомолитический тип разрыва). В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:
Такие частицы называются свободными радикалами.
Свободные радикалы — атомы или группы атомов, имеющие неспаренные электроны.
Свободнорадикальные реакции — это реакции, которые протекают под действием и при участии свободных радикалов.
В курсе неорганической химии это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Реакции этого типа отличаются высокой скоростью, выделением большого количества тепла.
Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается с незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
Разрыв ковалентной связи приводит к образованию положительно и отрицательно заряженных частиц (гетеролитический разрыв); так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у другого атома получается незаполненная орбиталь:
Рассмотрим электролитическую диссоциацию кислот:
Можно легко догадаться, что частица, имеющая неподеленную электронную пару R:—, т. е. отрицательно заряженный ион, будет притягиваться к положительно заряженным атомам или к атомам, на которых существует по крайней мере частичный или эффективный положительный заряд.
Частицы с неподеленными электронными парами называют нуклеофильными агентами (nucleus — «ядро», положительно заряженная часть атома), т. е. «друзьями» ядра, положительного заряда.
Нуклеофилы (Nu) — анионы или молекулы, имеющие неподеленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: Сl— (хлорид-ион), ОН— (гидроксид-анион), СН3O— (метоксид-анион), СН3СОО— (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы — катионы или молекулы, имеющие незаполненную электронную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Электрофилом с незаполненной орбиталью является не любая частица. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону.
Из этого можно сделать вывод, что несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Реакции двойного замещения
В реакциях двойного замещения происходит замещение уже двух электронов. Такие реакции еще называют реакциями обмена. Такие реакции проходят в растворе с образованием:
- нерастворимого твердого вещества (реакции осаждения);
- воды (реакции нейтрализации).
Реакции осаждения
При смешивании раствора нитрата серебра (соль) с раствором хлорида натрия образуется хлорид серебра:
Молекулярное уравнение: KCl(р-р) + AgNO3 (p-p) → AgCl(т) + KNO3 (p-p)
Ионное уравнение: K+ + Cl- + Ag+ + NO3— → AgCl(т) + K+ + NO3—
Молекулярно-ионное уравнение:
Cl- + Ag+ → AgCl(т)
Если соединение растворимое, оно будет находиться в растворе в ионном виде. Если соединение нерастворимое, оно будет осаждаться, образовывая твердое вещество.
Растворимые ионные соединения:
|
Нерастворимые ионные соединения:
|
Реакции нейтрализации
Это реакции взаимодействия кислот и оснований, в результате которых образуются молекулы воды.
Например, реакция смешивания раствора серной кислоты и раствора гидроксида натрия (щелока):
Молекулярное уравнение:
H2SO4 (p-p) + 2NaOH(p-p) → Na2SO4 (p-p) + 2H2O(ж)
Ионное уравнение:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O(ж)
Молекулярно-ионное уравнение:2H+ + 2OH- → 2H2O(ж) или H+ + OH- → H2O(ж)
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
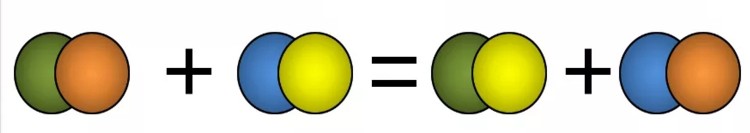
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
CH3-CH2-Cl + KOH = CH3-CH2-OH + KCl
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Предыдущая
ХимияГибридизация атомных орбиталей — типы и примеры
Следующая
ХимияАзотная кислота — строение, характеристика и основные свойства
Разнообразие химических явлений. Реакции замещения
Химические изменения, связанные с превращениями веществ, отличаются целым рядом особенностей. Разными могут быть конечные результаты, тепловые эффекты; одни процессы идут до конца, в других наступает химическое равновесие. Изменение веществ часто сопровождается повышением или понижением степени окисления
При классификации химических явлений по их конечному результату обращают внимание на качественные и количественные отличия реагентов от продуктов. По этим признакам можно выделить 7 типов химических превращений, в том числе замещение, идущее по схеме: А—В + С А—С + В
Упрощенная запись целого класса химических явлений дает представление о том, что среди исходных веществ есть так называемая «атакующая» частица, замещающая в реагенте атом, ион, функциональную группу. Реакция замещения характерна для предельных и ароматических углеводородов.
Реакции замещения могут происходить в виде двойного обмена: А—В + С—Е А—С + В—Е. Один из подвидов — вытеснение, например, меди железом из раствора медного купороса: CuSO4 + Fe = FeSO4 + Cu. В качестве «атакующей» частицы могут выступать атомы, ионы или функциональные группы

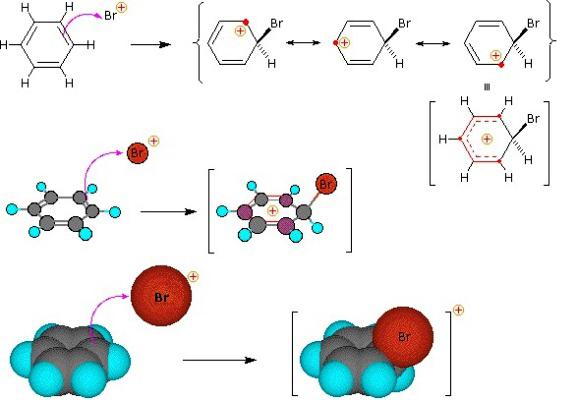
Реакции электрофильного замещения
В реакциях электрофильного замещения атакующей частицей является электрофил, то есть положительно заряженная частица или частица с дефицитом электронов. Уходящая частица носит название электрофуг.
Реакции электрофильного замещения более характерны для ароматических систем.
Общий вид реакций электрофильного замещения:
R−X+Y+→R−Y+X+{\displaystyle {\mathsf {R\!\!-\!\!X+Y^{+}}}\rightarrow {\mathsf {R\!\!-\!\!Y+X^{+}}}}
Реакции электрофильного замещения обозначаются «SE».
Для ароматических систем существует только один (основной) механизм электрофильного замещения SEAr, который включает в себя образование промежуточного положительно заряженного интермедиата, у которого на второй стадии отщепляется уходящая группа.
У алифатических соединений встречаются как механизмы SE1, так и SE2, аналогичные механизмам SN1 и SN2.
Пример реакции электрофильного замещения:

Наиболее распространенные электрофильные группы:
H+,RCO+,R+,RN2+,R2NH+,NO2+,Li+,Cl+,Br+,I+.{\displaystyle {\mathsf {H^{+},RCO^{+},R^{+},RN_{2}^{+},R_{2}NH^{+},NO_{2}^{+},Li^{+},Cl^{+},Br^{+},I^{+}.}}}
Реакции замещения

- Введение
- 1 Реакции нуклеофильного замещения
- 2 Реакции электрофильного замещения
- 3 Реакции радикального замещения
Примечания
Реакции замещения (англ.
substitution reaction) — химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы.
Реакции замещения обозначают английской буквой «S».
Общий вид реакций замещения:
Обычно, один из реагентов, в котором происходит замещение («R-X»), называют субстратом, а другой («Y-Z») — атакующим реагентом. Группа «X» называется уходящей, а группа «Y» — вступающей.
Примером реакции замещения может служить фотолитическое хлорирование метана:
В зависимости от способа расщепления связи, реакции замещения делятся на гомолитические (радикальные) и гетеролитические. Последние, в свою очередь, из-за типа атакующего реагента относят к нуклеофильным или электрофильным реакциям.
В органической химии реакции замещения имеют важнейшее значение. Детальное изучение типового механизма реакции позволяет не просто предсказать ее результат для конкретных реагентов, но и получить представление о выборе оптимальных температурных условий её протекания, подборе растворителя или возможного катализатора.
1. Реакции нуклеофильного замещения
В реакциях нуклеофильного замещения атакующей частицей является нуклеофил, то есть отрицательно заряженная частица или частица со свободной электронной парой. Уходящая группа носит название нуклеофуг.
Реакции нуклеофильного замещения более характерны для алифатических систем.
Общий вид реакций нуклеофильного замещения:
Реакции нуклеофильного замещения обозначаются «SN». Обычно, разделяют реакции алифатического (SN) и ароматического (SNAr) нуклеофильного замещения.
Наиболее распространено два типа механизмов реакций нуклеофильного замещения:
- SN1 — мономолекулярное нуклеофильное замещение: двухстадийный процесс — на первой (медленной) стадии образуется промежуточный карбкатион, который на второй (быстрой) стадии реагирует с нуклеофилом.
- SN2 — бимолекулярное нуклеофильное замещение: одностадийный процесс без образования интермедиата.
Примером реакции нуклеофильного замещения может служить гидролиз алкилгалогенидов:
Наиболее распространенные нуклеофильные группы:
2. Реакции электрофильного замещения
В реакция электрофильного замещения атакующей частицей является электрофил, то есть положительно заряженная частица или частица с дефицитом электронов. Уходящая частица носит название электрофуг.
Реакции электрофильного замещения более характерны для ароматических систем.
Общий вид реакций электрофильного замещения:
Реакции электрофильного замещения обозначаются «SE».
Для ароматических систем существует только один (основной) механизм электрофильного замещения SEAr, который включает в себя образование промежуточного положительно заряженного интермедиата, у которого на второй стадии отщепляется уходящая группа.
У алифатических соединений встречаются как механизмы SE1, так и SE2, аналогичные механизмам SN1 и SN2.
Пример реакции электрофильного замещения:
Наиболее распространенные электрофильные группы:
3. Реакции радикального замещения
В реакция радикального замещения атакующей частицей являются свободные радикалы.
Общий вид реакций радикального замещения:
Реакции радикального замещения обозначаются «SR».
Примером реакции радикального замещения может служить приведенная выше реакция хлорирования метана.
Примечания
- Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- XuMuK.ru — ЗАМЕЩЕНИЯ РЕАКЦИИ — Химическая энциклопедия — www.xumuk.ru/encyklopedia/1559.
html
- ↑ 12Mарч Дж. Органическая химия, пер. с англ., т. 2, — M.: Мир, 1988
-
Нуклеофильные и электрофильные реагенты — www.cultinfo.ru/fulltext/1/001/008/082/767.
htm — статья из Большой советской энциклопедии (3-е издание)
скачатьДанный реферат составлен на основе статьи из русской Википедии. Синхронизация выполнена 14.07.
11 11:09:59Похожие рефераты: Схема замещения, Эффект замещения, Реакции электрофильного замещения, Реакции радикального замещения, Реакции нуклеофильного замещения, Реакция, Реакция Соммле, Реакция КижнераВольфа.
Категории: Химические реакции, Реакции замещения, Реакции в органической химии.
Текст доступен по лицензии Creative Commons Attribution-ShareA.
Замещенные соединения
Замещенные соединения — это химические соединения, в которых один или несколько атомов водорода в структуре ядра были заменены функциональной группой, такой как алкил , гидрокси или галоген , или более крупными группами заместителей .
Например, бензол представляет собой простое ароматическое кольцо . Бензолы, подвергшиеся замещению, представляют собой гетерогенную группу химических веществ с широким спектром применения и свойств:
| Примеры замещенных бензольных соединений | ||
| соединение | общая формула | общая структура |
| Бензол | С 6 Н 6 | |
| Толуол | C 6 H 5 -CH 3 | |
| о-ксилол | С 6 Н 4 (-СН 3 ) 2 | |
| Мезитилен | С 6 Н 3 (-СН 3 ) 3 | |
| Фенол | С 6 Н 5 -ОН |
Примеры реакций замещения из органической химии
Для алканов особенно характерна реакция замещения. Примеры электрофильных и нуклеофильных превращений можно привести для циклоалканов и аренов. Подобные реакции в молекулах органических веществ идут при обычных условиях, но чаще — при нагревании и в присутствии катализаторов. К распространенным и хорошо изученным процессам относится электрофильное замещение в ароматическом ядре. Важнейшие реакции этого типа:
- Нитрование бензола азотной кислотой в присутствии H2SO4 — идет по схеме: C6H6 → C6H5—NO2.
- Каталитическое галогенирование бензола, в частности хлорирование, по уравнению: C6H6 + Cl2 → C6H5Cl + HCl.
- Ароматическое сульфирование бензола протекает с «дымящей» серной кислотой, образуются бензолсульфокислоты.
- Алкилирование — замена атома водорода из состава бензольного кольца на алкил.
- Ацилирование — образование кетонов.
- Формилирование — замена водорода на группу СНО и образование альдегидов.
К реакциям замещения относится реакция в алканах и циклоалканах, в которой галогены атакуют доступную связь С—Н. Получение производных может быть связано с замещением одного, двух или всех атомов водорода в предельных углеводородах и циклопарафинах. Многие из галогеноалканов с небольшой молекулярной массой находят применение в производстве более сложных веществ, относящихся к разным классам. Успехи, достигнутые в изучении механизмов реакций замещения, дали мощный толчок для развития синтезов на основе алканов, циклопарафинов, аренов и галогенопроизводных углеводородов.
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.