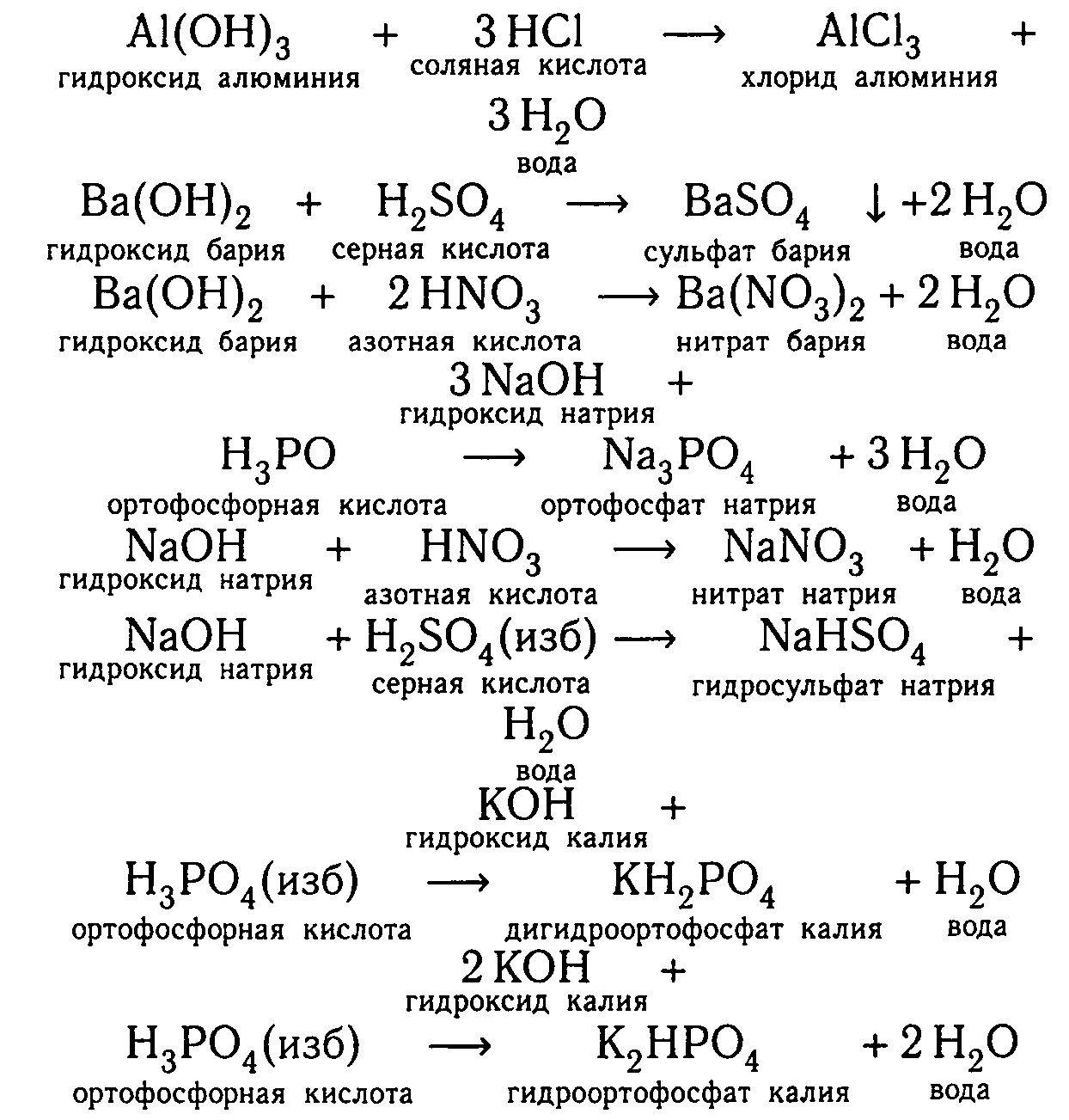
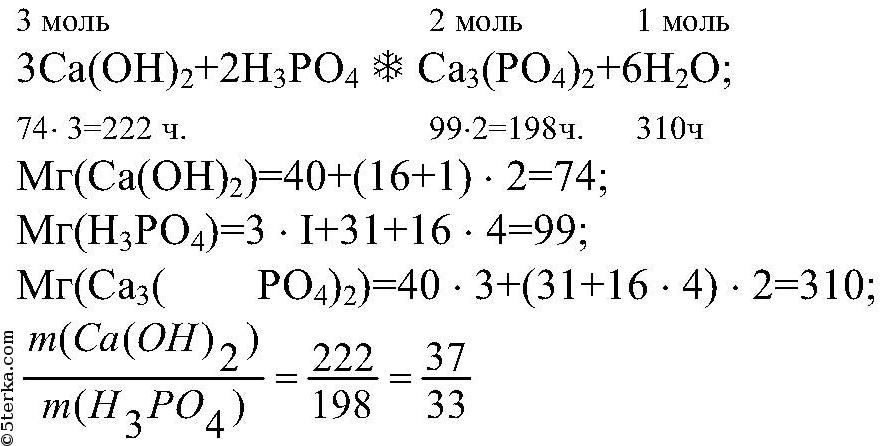Виды и формулы
Простейшим примером обмена является погружение лакмусовой бумажки в емкость с раствором соляной кислоты и гидроксидом натрия. Бумажка приобретет фиолетовый оттенок, что свидетельствует о нейтральной реакции. Если появится красный цвет, значит, в процессе взаимодействия образовалась кислая среда, а если синий, то щелочная. Два активных соединения при смешивании превратились в воду, которая испарится при нагреве, и соль. Различают два типа реакций:

- необратимые, протекающие в одну сторону, при которых не происходит распад соли на составляющие компоненты;
- обратимые — образующиеся соединения могут распадаться на исходные вещества, а затем снова взаимодействовать.
Необратимые процессы протекают при соединении сильных кислот с сильными основаниями (можно написать уравнением H2SO 4 + 2KOH → K2SO4 + 2H2O, HNO 3 + KOH → KNO3 + H2O). Обратимые возможны при взаимодействии слабых кислот и оснований (отображаются формулой Fe (OH)3 + H3PO4 FePO4 + 3H2O).
В ходе реакции между серной, соляной и другими кислотами с основаниями выделяется определенное количество тепла. Оно расходуется на подогревание как самого раствора, так и стенок сосуда, в котором он содержится. Количество выделяемого тепла рассчитывается при помощи так называемой постоянной колориметра. Тепловой эффект, которым сопровождается реакция, ускоряет ее процесс.
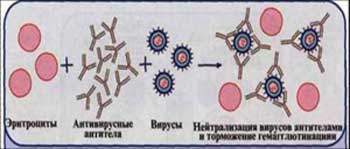
14.Методы индикации и идентификации вирусов.Реакция гемагглютинации вирусов (рга) и реакция торможения торможения гемагглютинации,сущность практическое применение.
-
-
Методы
индикации и идентификации вирусов в
клеточных культурах
-
При заражении вирусами
клеточных культур можно получать
различные видимые проявления действия
вируса:
Цитопатическое
действие вируса на культуру клеток
(ЦПД) – возникновение
в ней видимых морфологических
дегенеративных изменений (литическая
инфекция);
Приобретение заражённой
культурой клеток способности
к гемадсорбции
– к адсорбции эритроцитов на поверхности
клеточного слоя;
Образование в заражённой
клеточной культуре под плотным слоем
специального агарового покрытия
характерных бляшек,
являющихся «негативными
колониями» вирусов;
Подавление процессов
метаболизма в заражённой вирусом
культуре клеток,
выявляемое с помощью
так называемой цветной
пробы.
Окончательная идентификация
выделенного вируса проводится с помощью
реакции нейтрализации с диагностическими
вируснейтрализующими сыворотками.
Определяют их родовую
и видовую принадлежность.
Реакция
нейтрализации — реакция торможения
гемагглютинации (РТГА).
РТГА
применяется:-для
серотипирования вирусов;-для
серодиагностики инфекций..
РТГА.Цель:
серотипирование
вируса гриппа А
Компоненты:1.
Исследуемый материал
— аллантоисная жидкость куриного
эмбриона,2.
Диагностические
противогриппозные типоспецифиче-ские
сыворотки,3.
5 % взвесь куриных
эритроцитов.4.
Физиологический
раствор.
Реакция
ставится на стекле капельным способом.
На стекло наносят по
1 капле
диагностических сывороток и исследуемого
материала,
перемешивают,
затем добавляют 1
каплю взвеси эритроцитов.
При положительной
реакции наблюдается гомогенное
покраснение,
а при отрицательной
выпадение хлопьев красного цвета
(гемагглютинация).
реакция
торможения гемагглютинации (РТГА)
В
основе РГА лежит способность эритроцитов
склеиваться при адсорбции на них
определенных антигенов.
В
качестве исследуемого материала при
гемагглютинации используют аллантоисную,
амниотическую
жидкость.
РГА
не является серологической,
поскольку
происходит без участия иммунной сыворотки
и используется для выбора рабочего
разведения антигена для постановки
РТГА или наличия антигена (вируса)
в
исследуемом материале (например,
при
гриппе).
В
реакции используются эритроциты
животных,
птиц,
человека
I
(0) группы
крови.
Для
постановки ориентировочной РГА на
предметное стекло наносят каплю 5%
взвеси
эритроцитов и каплю испытуемого
материала,
тщательно
смешивают.
При
положительном результате через 1-2
минуты
макроскопически наблюдают появление
хлопьевидной агглютинации эритроцитов.
Для
постановки РГА в развернутом ряду в
лунках полистероловых планшетов готовят
двукратно возрастающие разведения
исследуемого материала на физиологическом
растворе в объёме 0,5
мл.
Во
все пробирки вносят по 0,5
мл
0,25
— 1% взвеси
эритроцитов.
Результаты
учитывают после полного оседания
эритроцитов в контроле (эритроциты
+
физиологический
раствор).
Реакцию
учитывают по характеру осадка эритроцитов.
В
положительных случаях степень агглютинации
отмечают плюсами.
Резко
очерченный осадок эритроцитов,
неотличимый
от контроля показывает отсутствие
агглютинации.
При
положительном результате РГА исследование
продолжают,
определяя
тип выделенного вируса с помощью реакции
торможения гемагглютинации
типоспецифическими сыворотками.
Приложения
Методы химического титрования используются для анализа кислот или оснований с целью определения неизвестной концентрации . Можно использовать либо pH-метр, либо pH-индикатор, который показывает точку нейтрализации по отчетливому изменению цвета. Простые стехиометрические расчеты с известным объемом неизвестного и известным объемом и молярностью добавленного химического вещества дают молярность неизвестного.
При очистке сточных вод часто применяются методы химической нейтрализации, чтобы уменьшить ущерб, который сточные воды могут нанести при попадании в окружающую среду. Для контроля рН, популярные химикаты включают карбонат кальция , оксид кальция , гидроксид магния и бикарбонат натрия . Выбор подходящего химического вещества для нейтрализации зависит от конкретного применения.
Есть много применений реакций нейтрализации, которые представляют собой кислотно-щелочные реакции. Очень часто используются антацидные таблетки. Они предназначены для нейтрализации избытка кислоты в желудке ( HCl ), которая может вызывать дискомфорт в желудке или нижних отделах пищевода. Это также можно исправить путем приема внутрь бикарбоната натрия (NaHCO 3 ).
В химическом синтезе наноматериалов теплота реакции нейтрализации может быть использована для облегчения химического восстановления прекурсоров металлов.
Также в пищеварительном тракте используются реакции нейтрализации, когда пища перемещается из желудка в кишечник. Для всасывания питательных веществ через стенку кишечника необходима щелочная среда, поэтому поджелудочная железа вырабатывает антацидный бикарбонат, вызывающий это преобразование.
Другое распространенное использование, хотя, возможно, не так широко известно, — это удобрения и контроль pH почвы . Гашеную известь (гидроксид кальция) или известняк (карбонат кальция) можно обрабатывать в почве, слишком кислой для роста растений. Удобрения, улучшающие рост растений, получают путем нейтрализации серной кислоты (H 2 SO 4 ) или азотной кислоты (HNO 3 ) газообразным аммиаком (NH 3 ) с получением сульфата аммония или нитрата аммония . Это соли, используемые в удобрении.
В промышленности побочный продукт сжигания угля, диоксид серы , может объединяться с водяным паром в воздухе с образованием серной кислоты, которая выпадает в виде кислотных дождей. Чтобы предотвратить выброс диоксида серы, устройство, известное как скруббер, собирает газ из дымовых труб. Это устройство сначала вдувает карбонат кальция в камеру сгорания, где он разлагается на оксид кальция (известь) и диоксид углерода. Эта известь затем вступает в реакцию с образовавшимся диоксидом серы, образуя сульфит кальция. Затем в смесь вводят известковую суспензию для получения суспензии, которая удаляет сульфит кальция и любой оставшийся непрореагировавший диоксид серы.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.

Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
Решение:
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
4,00 г / 40,0 г/моль = 0,100 моля NaOH
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
0,100 моля NaOH / 0,500 л раствора = 0,200 моль/л, или 0,2 М NaOH
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH— ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Решение:
- 10,0 г / 98,1 г/моль = 0,102 моля серной кислоты
- 0,102 моля / 0,750 л = 0,136 М раствор серной кислоты
Поскольку каждый моль серной кислоты высвобождает 2 эквивалента ионов H+, полученный раствор серной кислоты имеет нормальность, равную 2·0,136=0,272 н., т.е. представляет собой 0,272 н. раствора H2SO4.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Химический эквивалент кислоты — количество кислоты, которое при нейтрализации основания высвобождает 1 моль ионов H+.
Химический эквивалент основания — количество основания, которое при нейтрализации основания высвобождает 1 моль ионов OH—.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H+ (или OH—)
Для кислот, способных высвобождать 1 ион H+ на молекулу, как, например, HCl или HNO3, химический эквивалент представляет собой то же самое количество вещества, что и моль, а 1 грамм-эквивалент — то же самое, что и молекулярная масса. Однако поскольку H2SO4 способна высвобождать два иона H+ на молекулу, 1 молю H2SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты H3PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и NH3, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:

Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Решение:
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO3 и Ba(OH)2:
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
100,0 г / 85,67 г/экв = 1,167 экв Ba(OH)2
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
1,167 экв × 63,01 г/экв = 73,53 г HNO3
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции:
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
Число моль Ba(OH)2, вступающего в реакцию, равно:
100,0 г / 171,3 г/моль = 0,5838 моля Ba(OH)2
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
0,5838 моля × 2 = 1,167 моля HNO3
А в граммах это составит:
1,167 моля × 63,01 г/моль = 73,53 г HNO3
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
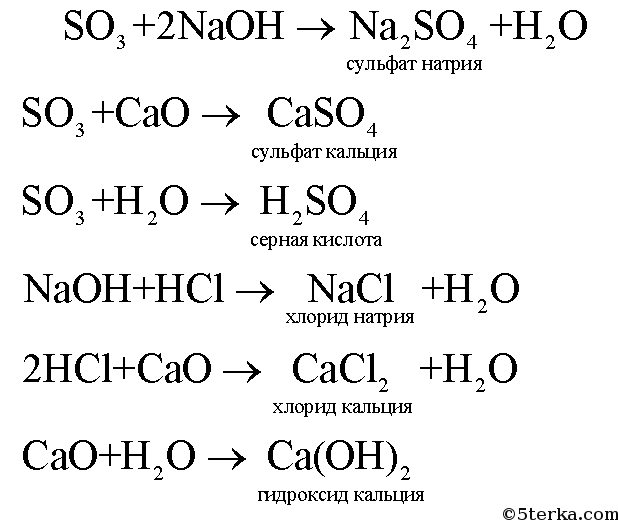
Химические свойства оксидов, определение, свойства, получение, номенклатура.
Оксиды
–соединения
элемента с кислородом, имеющим степень
окисления –
2. общая формула оксидов ЭmOn, где
m – число атомов элемента, а n – число
атомов кислорода.
Классификация
оксидов
Оксиды,
не образующие кислот, оснований и солей
при обычных условиях, называются
несолеобразующими.К
ним относят такие соединения, как
N2O,
NO, SiO, CO. Однако, последний при нагревании
с твердым NaOH образует соль формиат
натрия (HCOONa), что позволяет считать этот
оксид солеобразующим.
Солеобразующие
оксидыподразделяются
на кислотные, основные и амфотерные
(обладающие двойными свойствами).
Основные
оксиды —
это оксиды, которые взаимодействуют с
кислотами с образованием соли и воды и
которым соответствуют основания.
Они образованы только металлами.
Например:
Na2O; CaO; Fe2O3; CuO; Cu2O и т. д.
Кислотные
оксиды—
это оксиды, которые взаимодействуют с
основаниями с образованием соли и воды
и которым соответствуют кислоты.
Они образованы в основном неметаллами
и некоторыми металлами в своих
высших степенях окисления.
Например:
SO2; SO3; CO2; P2O5; SiO2; NO2; N2O5; и Mn2O7;
CrO3.
Амфотерные
оксиды —
это оксиды, которые взаимодействуют
как с кислотами так и с щелочами с
образованием соли и воды, т.е. проявляют
своиства основных и кислотных оксидов.
Например:
ZnO; AI2O3; BeO; Cr2O3.
ZnO
→ Zn(OH)2 → H2ZnO2; AI2O3 → AI(OH)3
→H3AIO3;
BeO
→ Be(OH)2 → H2BeO2; Cr2O3 →
Cr(OH)3 →H3CrO3.
Номенклатура
оксидов
Если элемент,
образующий оксид, имеет единственную
валентность, то ее в названии оксида
можно не указывать: Na2O
– оксид натрия. Если же элемент образует
несколько оксидов, то это необходимо:
Mn2O7
– оксид марганца (VII). По систематической
номенклатуре, требующей полного отражения
состава соединения, оксиды называют
так: CrO – хром оксид, Cr2O3 –
дихром триоксид.
Химические
свойства оксидов.
|
Основные |
Амфотерные |
Кислотные |
|
Основные-реагируют |
Амфотерные 2.Реагируют |
Кислотные-реагируют 2.Со 3.С 4.С |
Получение
оксидов.
|
Окисление |
простых |
2Mg |
|
сложных |
2H2S+3O2=2H2O+2SO2 |
|
|
Разложение |
нагреванием |
СaCO3=CaO+CO2 |
|
нагреванием |
Cu |
|
|
нагреванием |
H2SO3=H2O+SO2 |
|
|
нагреванием |
4CrO3=Cr2O3+3O2 |
|
|
Окисление |
4FeO+O2=2Fe2O3 |
|
|
Вытеснение |
Na2CO3+SiO2=Na2SiO3+CO2 |
Используют
для краски
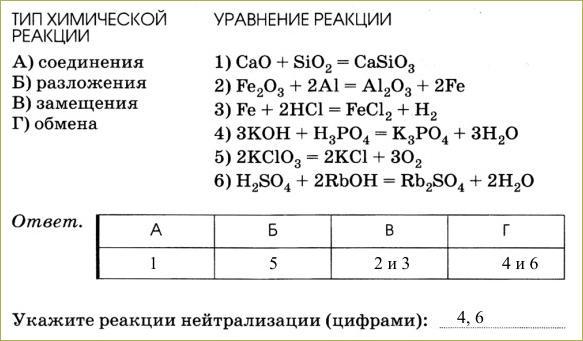
Обратимые реакции
Обратимость происходит в результате смещения вправо в системе равновесия. Обратимость реакции можно увидеть при использовании в качестве исходных веществ, например, или синильной кислоты, а также аммиака.
Слабая кислота и сильное основание:HCN+KOH=KCN+H2O;
В ионном виде:HCN+OH(-)=CN(-)+H2O.
Слабое основание и сильная кислота:HCl+NH3-H2O=Nh4Cl+H2O;
В ионном виде:H(+)+NH3-H2O=NH4(+)+H2O.
Слабая соль и слабое основание:CH3COOH+NH3-H2O=CH3COONH4+H2O;
В ионном виде:CH3COOH+NH3-H2O=CH3COO(-)+NH4(+)+H2O.
Существующее в неорганической химии понятие “реакция нейтрализации” подразумевает химический процесс, в котором взаимодействуют вещества с кислотными и основными свойствами, в результате чего происходит потеря участниками реакции и тех и других характерных химических свойств. Реакция нейтрализации в микробиологии имеет то же глобальное значение, продукты ее теряют свои биологические свойства. Но, разумеется, это совершенно иной процесс с другими участниками и итогами. И биологическое свойство, о котором идет речь и которое прежде всего интересует врачей и ученых, — это способность микроорганизма вызывать заболевание или гибель восприимчивого животного.
Области применения
Чаще всего этот метод исследования используется для идентификации вирусов, то есть диагностики вирусных заразных болезней. Причем тест может быть направлен как на выявление самого возбудителя, так и антител к нему.
В бактериологии эту методику обычно применяют для выявления антител к ферментам бактерий, таких как антистрептолизины, антистафилолизины, антистрептокиназы.
Каким образом проводится этот тест
Реакция нейтрализации основана на способности антител — особых иммунных белков крови — нейтрализовать антигены — чужеродные агенты, попадающие в организм. Если необходимо обнаружение возбудителя и его идентификация, тогда смешивают стандартную иммунную сыворотку, содержащую антитела, с биологическим материалом. Полученная смесь выдерживается в термостате нужное время и вводится в живую восприимчивую систему.
Таковыми являются лабораторные животные (крысы, мыши), куриные эмбрионы, культуры клеток. При отсутствии биологического действия (болезни или смерти животного) можно сделать вывод о том, что это именно тот вирус, стандартную сыворотку к которому использовали. Так как, как уже было сказано, признаком того, что реакция прошла, является потеря вирусом биосвойств (способности вызывать смерть животного) вследствие взаимодействия антител сыворотки и антигенов вируса. При определении токсических веществ алгоритм действий тот же, но есть варианты.
Если исследуют какой-либо субстрат, содержащий токсин, тогда его смешивают со стандартной сывороткой. В случае изучения последней применяют контрольное токсическое вещество. Чтобы пошла реакция нейтрализации, эта смесь также инкубируется заданное время и вводится восприимчивой системе. Техника оценки результата точно такая же.
В медицинской и ветеринарной практике используемая как диагностический тест реакция нейтрализации вирусов проводится в так называемой методике парных сывороток.
Это способ подтверждения диагноза какого-либо вирусного заболевания. Для его проведения у больного человека или животного берут дважды — в начале заболевания и через 14-21 дней после этого.
Если после проведения теста обнаруживается увеличение количества антител к вирусу в 4 и более раза, то диагноз можно считать подтвержденным.
Реакция — нейтрализация
Реакции нейтрализации ( РН) основаны на способности специфических антител иммунных сывороток погашать болезнетворное действие вирусов, риккетсий, бактерий и других инфекционных агентов или их продуктов, а также ингибировать физиологические реакции живых систем.
Реакция нейтрализации протекает очень быстро, и при дальнейшем смешивании вся масса сточных вод приобретает одинаковое значение рН в течение нескольких минут.
Реакция нейтрализации не сопровождается внешним эффектом, поэтому определять эквивалентную точку приходится с помощью индикаторов. Но они меняют окраску не строго в эквивалентной точке, а с некоторым отклонением. В связи с этим даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный же выбор индикатора искажает результаты анализа. Наиболее часто применяют из индикаторов метиловый оранжевый, метиловый красный, лакмус и фенолфталеин.
Реакция нейтрализации — реакция между кислотами и основаниями, ведущая к образованию солей.
Реакция нейтрализации сопровождается выделением большого количества тепла, что нежелательно в данном случае. Дело в том, что под влиянием высокой температуры поваренная соль, имеющаяся в соде в качестве примеси, разлагается с выделением хлора.
|
Нейтрализационный аппарат ИТН. |
Реакция нейтрализации сопровождается выделением тепла. Количество выделяющегося тепла реакции находится в зависимнсти от концентрация применяемой в производстве азотной кислоты. Чем выше концентрация кислоты, тем больше выделяется тепла.
Реакции нейтрализации были исследованы разными методами. Было найдено, что для потенциометрического титрования в безводном тионилхлориде удобно использовать молибденовый электрод , однако механизм электродной реакции не был установлен.
|
Соединения фосфороксихлорида с хлоридами. |
Реакции нейтрализации могут проводиться также с помощью цветных индикаторов: они показывают обратимое изменение цвета в зависимости от активности ионов хлора в растворе, которая может быть измерена также при помощи обратимого хлоридного электрода.
Реакции нейтрализации не сопровождаются каким-либо внешним эффектом, поэтому момент эквивалентности взаимодействующих растворов или конец титрования фиксируется подходящим индикатором, прибавляемым в небольшом количестве к титруемому раствору.
Реакция нейтрализации протекает между основаниями и кислотами. Сущность этой реакции заключается в том, что за счет гидроксильных групп оснований и водорода кислот образуется нейтральное вещество — вода.
Реакция нейтрализации широко используется в химической промышленности для получения различных солей.
Реакция нейтрализации идет согласно следующему уравнению: NaOH НС1 NaCl ЬШ.
Реакция нейтрализации не сопровождается какими-либо внешними изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибегать к помощи индикаторов. Таких индикаторов известно много, причем оказывается далеко не безразличным, какой из них выбрать. Надо сказать, что индикаторы обычно изменяют свою окраску не строго в точке эквивалентности, а с некоторыми отклонениями от нее. В соответствии с этим, если индикатор выбран правильно, проистекающая отсюда погрешность ( называемая индикаторной ошибкой титрования) мала и не скажется на результатах титрования. Но при неправильном выборе индикатора она может достигнуть значительной величины и совершенно исказить результаты анализа. Кроме того, в таких случаях и самая перемена окраски индикатора происходит не скачком, от одной капли титрующего раствора, а постепенно, так что неизвестно, когда следует закончить титрование.
Применение метода
Реакции нейтрализации лежат в основе титриметрического анализа. Титрированием называется количественный анализ концентрации веществ. Он пользуется популярностью в разных сферах, например, в медицине при обследовании на уровень кислотности желудочного сока, а также в фармакологии. Кроме того, реакция позволяет определить уровень карбонатной жесткости:
- воды;
- квашеных и молочных продуктов;
- безалкогольных напитков.

Принцип нейтрализации активно используется в вирусологии, биологических науках
Она имеет важное значение, а интерес для врачей и ученых представляет возможность лишать вещества их первоначальных свойств

Процесс представляет собой серологический тест, который проводится в лабораторной диагностике. Суть его заключается в способности антител иммунной сыворотки замедлять или полностью подавлять активность патогенных бактерий и токсических веществ, которые они выделяют в процессе жизнедеятельности. Метод позволяет верно идентифицировать вирусы, вызывающие заразные заболевания. Первоначально лабораторные исследования проводятся на крысах и мышах, куриных эмбрионах и клетках культур.
дальнейшее чтение
Нейтрализация рассматривается в большинстве учебников по общей химии. Подробные описания можно найти в учебниках по аналитической химии, таких как
Скуг, Д.А.; Запад, DM; Холлер, JF; Крауч, SR (2004). Основы аналитической химии (8-е изд.). Томсон Брукс / Коул. ISBN 0-03-035523-0. Главы 14, 15 и 16
Приложения
- Штумм, В .; Морган, Дж. Дж. (1996). . Нью-Йорк: Вили. ISBN 0-471-05196-9.
- Snoeyink, VL; Дженкинс, Д. (1980). Водная химия: химические равновесия и скорости в природных водах . Нью-Йорк: Вили. ISBN 0-471-51185-4.
- Миллеро, FJ (2006). Химическая океанография (3-е изд.). Лондон: Тейлор и Фрэнсис. ISBN 0-8493-2280-4.
- Меткалф и Эдди. Очистка, очистка и повторное использование сточных вод . 4-е изд. Нью-Йорк: Макгроу-Хилл, 2003. 526-532.