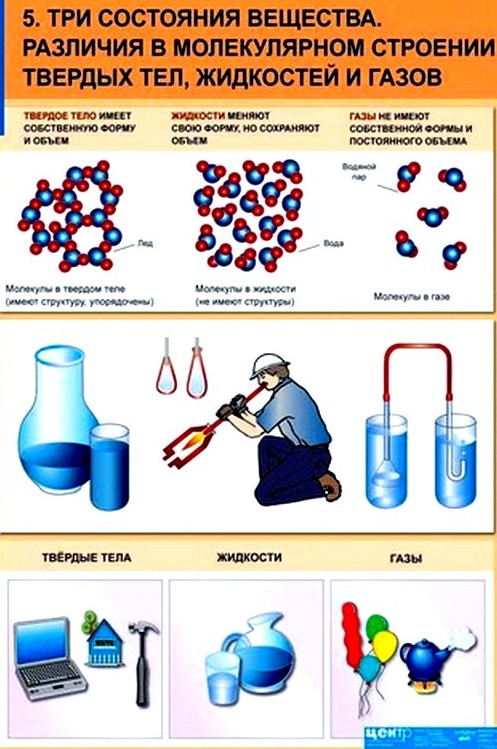
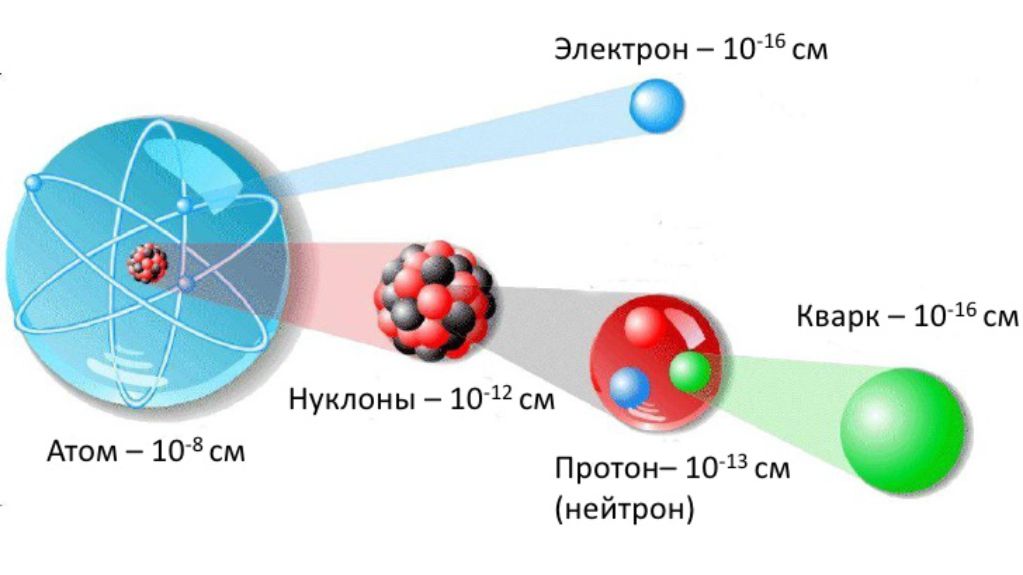
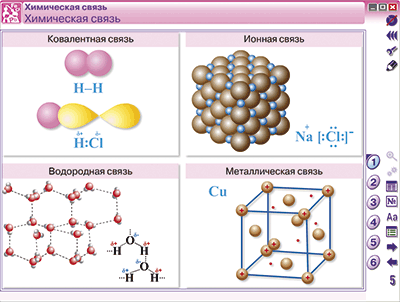
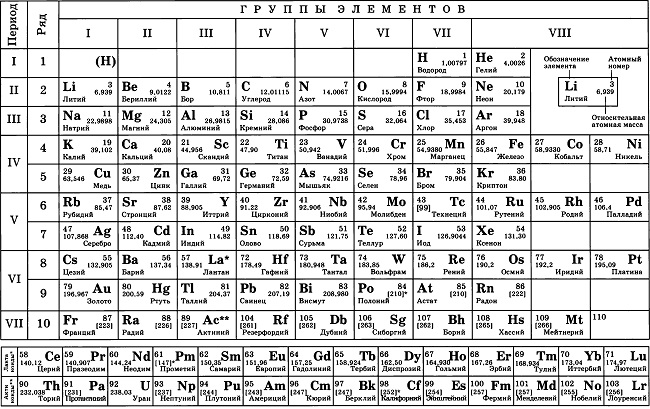
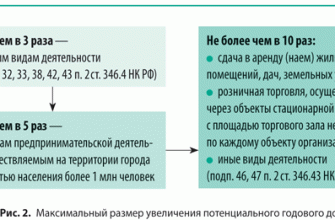
Определение кристаллической решетки
В совокупности различные типы кристаллических решеток веществ представляют собой сетки с различной пространственной ориентацией, в узлах которых располагаются ионы, молекулы или атомы. Это стабильное геометрическое пространственное положение и называется кристаллической решеткой вещества. Расстояние между узлами одной кристаллической ячейки называется периодом идентичности. Пространственные углы, под которыми расположены узлы ячейки, называются параметрами. По способу построения связей кристаллические решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными. Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:

Если, кроме узлов, частицы вещества расположены и в середине пространственных диагоналей, то такое построение частиц в веществе имеет название объемно-центрированной кристаллической решетки. На рисунке этот тип показан наглядно.
Если кроме узлов в вершинах решетки имеется узел и в месте, где пересекаются воображаемые диагонали параллелепипеда, то перед вами — гранецентрированный тип решетки.

Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водродные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристалалах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества, образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Атомные кристаллические решетки
Этот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Как определить тип кристаллической решетки.

P.S. Есть кое-что в школьной программе и программе ЕГЭ по этой теме то, с чем мы не совсем согласны. А именно: обобщение, о том, что любая связь металл-неметалл – это ионная связь. Это допущение, намеренно сделано, видимо, для упрощения программы. Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al2O3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Металлический тип

катионыЭлектроны, которые находятся в межузловом
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
| Виды | Вещества | Свойства |
| Атомная | Алмаз, графит, кремний, бор | Твёрдые, тугоплавкие, не растворяются в воде |
| Молекулярная | Йод, сера, белый фосфор, органические вещества | Нетвёрдые, легко плавятся, летучие |
| Ионная | Соли, оксиды и гидроксиды тяжёлых металлов | Твёрдые, хрупкие, легкоплавкие, электропроводны |
| Металлическая | Металлы и сплавы | Блестящие, ковкие, тепло- и электропроводны. |
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.

Смотреть галерею
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Дефекты в кристаллах
В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные.
Атомы совершают колебательные движения возле узлов решетки, и с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией, значительно большей средней энергии, и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замещенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки. Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстраплоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой, или линейной, дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Шириной дислокации считают расстояние от центра дефекта до места решетки без искажения. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокаций упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокаций характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов, а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами (рис. 2, г). На границе раздела атомы кристалла расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов. При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.

Рис. 2. Дефекты в кристаллах: а – вакансия, б – внедрённый атом, в – краевая линейная дислокация, г – неправильное расположение атомов на границе зерен 1 и 2
Молекулярные кристаллические решетки
В узлах молекулярной кристаллической решетки находятся молекулы, связанные между собой силами Ван-дер-Ваальса. Такие решетки образуют водород, хлор, азот, оксид углерода (IV) и многие органические соедини. Вследствие небольшой энергии взаимодействия частиц молекулярные кристаллы плавятся при низких температурах и легко растворяются в различных жидкостях (табл. 10).
Молекулы, имеющие разветвленное строение, образуетболее компактную кристаллическую структуру. Силы Взаимодействия между ними оказываются при этом гораздо выше, чем для не разветвленных молекул. Поэтому соединения с близкой молекулярной массой, но неодинаковым строением имеют различные температуры плавления (сравним, например, «-гептан и 2, 2, 3-триметилбутанв таблице 10).
Взаимодействие между молекулами усиливается также с усложнением строения их электронных оболочек и увеличением полярности. Температуры плавления полярных веществ существенно выше температур плавления неполярных соединений. От полярности молекул сильно зависит растворимость молекулярных кристаллов. Большое значение при этом играет соотношение между размерами полярной и неполярной части молекул. Например, уксусная кислота Н3С—СООН смешивается с водой в любых отношениях, в то время как растворимость стеариновой кислоты составляет при 25°С всего лишь 0,03 г на 100 г Н2О.
Для соединений, молекулы которых имеют полярные группы О—Н, N—Н, S—Н, структура кристаллов определяется в основном энергией водородных связей и характером их расположения в пространстве. Наличием большого числа водородных связей
объясняется, в частности, своеобразная структура льда.
Поскольку каждая молекула воды имеет два атома водорода и две не поделенные пары электронов, она может образовать четыре водородные связи:
В изолированной молекуле воды расстояние между ядрами атомов водорода и кислорода составляет примерно 0, 096 нм, а угол между направлениями связей О — Н равен 105°. В твердом и жидком состояниях параметры молекул Н2О незначительно изменяются. В кристаллической решетке льда вследствие образования водородных связей угол НОН приближается к тетраэдрическому (109,5°), а расстояние между ядрами атомов водорода и кислорода увеличивается до 0,099 нм.
Кристаллы льда принадлежат к гексагональной системе. Каждая молекула воды связана водородными связями с четырьмя другими молекулами. Вследствие относительно большой длины этих связей упаковка молекул Н2О оказывается очень неплотной, в структуре льда на каждые 46 молекул воды приходится шесть пустот диаметром 0,59 нм и две пустоты диаметром 0,52 нм.
За счет включения в полости кристалла молекул хлора, аргона, ксенона и некоторых других газов возникают так называемые клатратные соединения или соединения включения. Их образование с последующим разрушением применяется для разделения углеводородов и некоторых других веществ. Клатраты используют также как удобную форму хранения газов.
Если внедряющиеся молекулы газа сравнительно невелики (Аr, Хе, СН4, СO2), то они занимают все восемь пустот. Образующиеся при этом клатраты имеют состав X•5,75Н2О (8:46= 1:5,75). Более крупные частицы занимает только шесть пустот. Предельное отношение числа внедренных молекул к числу молекул воды составляет в этом случае 6:46=1:7,67. Например, при охлаждении Хлорной воды выпадают кристаллы гидрата хлора, имеющие состав Сl2•8Н2O.
При атмосферном давлении лед плавится при 0°С. С точки зрения молекулярно-кинетической теории плавление льда происходит при такой температуре, когда энергия теплового движения молекул оказывается достаточной для разрыва большинства водородных связей. Тетраэдрическая структура льда разрушается, и вода переходит в жидкое состояние. В жидкой воде существует подвижное равновесие: действие водородных связей воссоздает в каждый момент времени в каждом элементе объема тетраэдрическую структуру льда, а тепловое движение молекул эту структуру разрушает.
Плавление льда сопровождается поглощением тепловой энергии в количестве 6,01 кдж/моль.Большая часть ее расходуется на разрыв водородных связей.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Определение

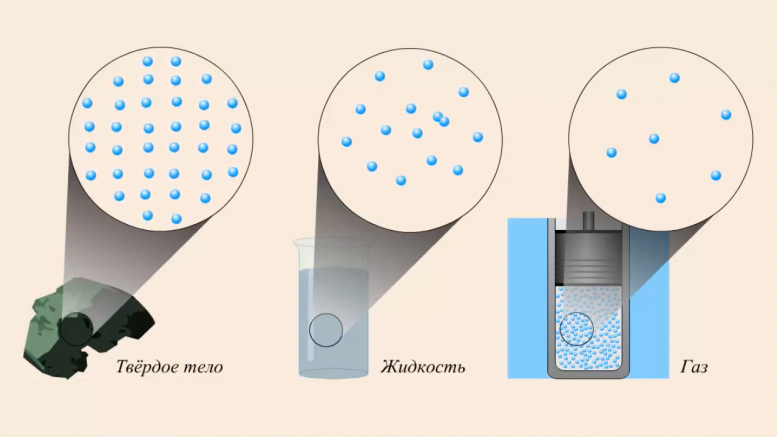
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Щелочные металлы
Атомная кристаллическая решетка.
В узлах атомной кристаллической решетки, в отличие от молекулярной, располагаются отдельные атомы. Получается, что удерживают решетку ковалентные связи (ведь именно они связывают нейтральные атомы).
Классический пример – эталон прочности твердости – алмаз (по химической природе – это простое вещество углерод). Связи: ковалентные неполярные, так как решетку образуют только атомы углерода.
А вот, например, в кристалле кварца (химическая формула которого SiO2) есть атомы Si и O. Поэтому связи ковалентные полярные.
Физические свойства веществ с атомной кристаллической решеткой:
- прочность, твердость
- высокие температуры плавления (тугоплавкость)
- нелетучие вещества
- нерастворимы (ни в воде, ни в других растворителях)
Все эти свойства обусловлены прочностью ковалентных связей.
Веществ в атомной кристаллической решеткой немного. Особой закономерности нет, поэтому их нужно просто запомнить:
- Аллотропные модификации углерода (C): алмаз, графит.
- Бор (B), кремний (Si), германий (Ge).
- Только две аллотропные модификации фосфора имеют атомную кристаллическую решетку: красный фосфор и черный фосфор. (у белого фосфора – молекулярная кристаллическая решетка).
- SiC – карборунд (карбид кремния).
- BN – нитрид бора.
- Кремнезем, горный хрусталь, кварц, речной песок – все эти вещества имеют состав SiO2.
- Корунд, рубин, сапфир – у этих веществ состав Al2O3.
Наверняка возникает вопрос: С – это и алмаз, и графит. Но они же совершенно разные: графит непрозрачный, пачкает, проводит электрический ток, а алмаз прозрачный, не пачкает и ток не проводит. Отличаются они структурой.
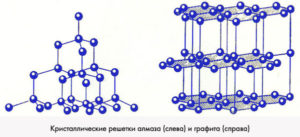
И то, и то – атомная решетка, но разная. Поэтому и свойства разные.
Что такое медь? Свойства, история и происхождение меди
История меди
Добрый день, уважаемый читатель, в данной статье хочу рассказать о меди и её свойствах. Что такое медь? Ответ на этот вопрос знают почти все. Она имеет обозначение Cu (произносится купрум) в таблице В. И. Менделеева находится под атомным номером 29. Медь – химический элемент, представляет собой металл. Название меди Cuprum является латинским и происходит от названия острова Кипр.
Данный металл широко применяется человеком уже долгие годы. Имеются достоверные факты о том, что индейцы, жившие в Эквадоре уже в XV веке умели добывать и использовать медь. Из неё они изготовляли монеты в виде топориков.

Данная монета очень продолжительное время являлась единственным денежным знаком, который существовал на побережье Южной Америки. Эта монета даже использовалась в торговле с инками. На острове Кипр, в III веке до нашей эры уже были открыты медные рудники. Известен интересный факт, что древние алхимики называли медь — венера (Venus).

Происхождение меди
Медь в природе встречается либо в самородках, либо в соединениях. Особое значение в промышленности имеют халькозин, борнит и медный колчедан. Однако и такие популярные в ювелирном деле поделочные самоцветы, как лазурит и малахит практически на сто процентов состоят из меди.
Медь имеет золотисто – розовую окраску. На воздухе этот металл очень быстро окисляется и покрывается оксидной плёнкой, которая называется патина. Именно из-за патины медь приобретает желтовато – красный цвет. Этот металл входит в состав очень многих сплавов, которые широко используются в промышленности.
Распространённые сплавы меди
Самым известным сплавом является дюралюминий, который состоит из сплава меди и алюминия. Медь в дюралюминии играет главную роль. Мельхиор также содержит медь в соединении с никелем, бронза – соединение олова и меди, латунь – сплав меди с цинком.
Медь обладает довольно высокой тепло и электропроводностью. По сравнению с другими металлами, она занимает второе место после серебра по электропроводности. В ювелирном производстве часто используют сплавы золота с медью. Медь в данном сплаве нужна для увеличения прочности ювелирных украшений к деформациям и истиранию.

В давние времена был известен сплав меди с оловом и цинком, который назывался пушечный металл. Как вы уже, наверно, догадались, что из данного сплава изготавливали пушечные ядра, но с развитием новых технологий, пушки перестали использовать и выпускать, однако данный сплав по сей день используется в производстве оружейных гильз.

Медь имеет бактерицидные свойства и поэтому она широко применяется в медицине, которые очень часто применяются в медицине. Данный факт доказан научными экспериментами и исследованиями. Особенно хорошо медь противостоит золотистому стафилококку. Этот микроб вызывает большое количество гнойных заболеваний кожи.
Токсичность меди
В тоже время известны факты того, что медь бывает очень токсичной. На планете Земля существует озеро Беркли Пит, оно находится в США в штате Монтана. Так вот это озеро считается самым токсичным в мире. Причиной тому является медный рудник, на месте которого образовалось озеро.

Вода в озере очень токсична, в ней почти нет живых организмов, а глубина озера составляет более 0,5 километра. Сильную токсичность воды доказывает один пример, который произошёл однажды на озере. Стая диких гусей, состоявшая из 35 взрослых особей, опустилась на водную гладь озера, а через 2,5 часа все птицы были найдены погибшими.

Однако, совсем недавно, на дне озера были обнаружены совсем новые микроорганизмы и водоросли, которые не встречались ранее в природе. В результате мутаций, данные жители хорошо себя чувствуют в токсичной воде озера.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.Кристаллическое строение сплавов сложнее, чем металлов.

Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.