Камеры и портативные устройства
Существуют различные способы воздействия атомарного кислорода на поверхность. Чаще всего используются вакуумные камеры. По размеру они варьируются от коробки для обуви до установки 1,2 х 1,8 х 0,9 м. С помощью микроволнового или радиочастотного излучения молекулы O2 разбиваются до состояния атомарного кислорода. В камеру помещают образец полимера, уровень эрозии которого свидетельствует о концентрации действующего вещества внутри установки.
Другим способом нанесения вещества является портативное устройство, позволяющее направить узкий поток окислителя на конкретную цель. Возможно создание батареи таких потоков, способных покрыть большую площадь обрабатываемой поверхности.
По мере проведения дальнейших исследований все большее число отраслей промышленности проявляет заинтересованность в использовании атомарного кислорода. НАСА организовало множество партнерских, совместных и дочерних предприятий, которые в большинстве случаев стали успешными в различных коммерческих областях.
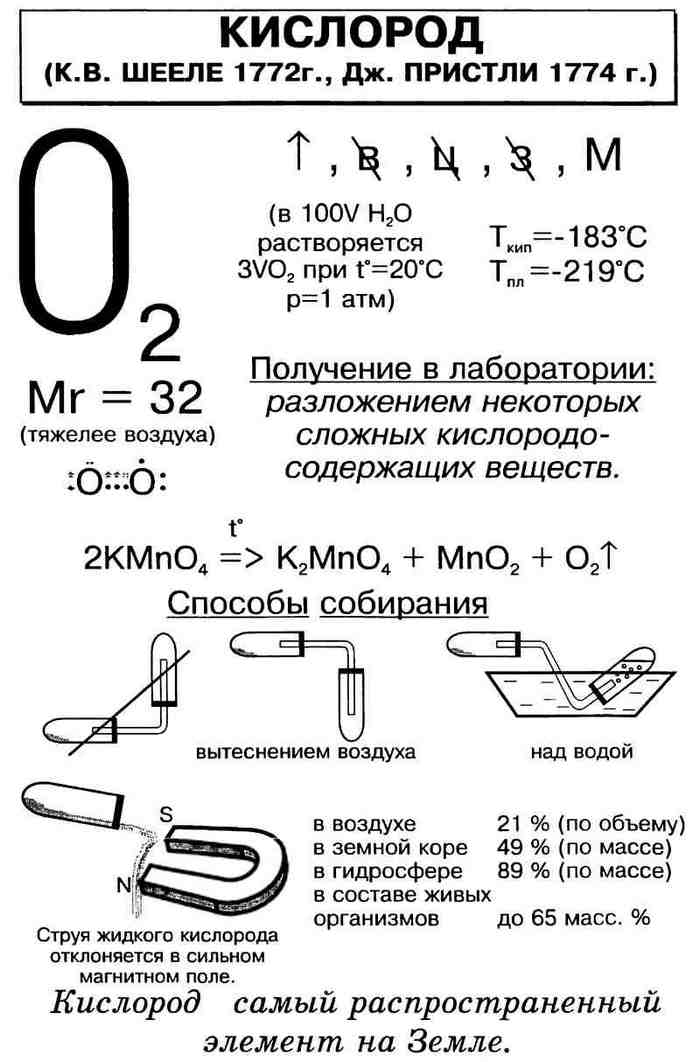
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
-
- 2HgO →ot 2Hg+O2↑{\displaystyle {\mathsf {2HgO\ {\xrightarrow {^{o}t}}\ 2Hg+O_{2}\uparrow }}}
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Использование в промышленности
Металлургия является крупнейшим потребителем чистого кислорода для производства высокоуглеродистой стали: избавиться от двуокиси углерода и других примесей неметаллов так быстрее и легче, чем при использовании воздуха.
Очистка сточных вод кислородом перспективна для более эффективной обработки жидких стоков, чем в других химических процессах. Все большее значение приобретает сжигание отходов в закрытых системах, использующих чистый O2.
Так называемый ракетный окислитель является жидким кислородом. Чистый О2 спользуется на подводных лодках и в водолазных колоколах.
В химической промышленности кислород заменил обычный воздух при производстве таких веществ, как ацетилен, окись этилена и метанол. Медицинские применения включают использование газа в кислородных камерах, ингаляторах и детских инкубаторах. Обогащенный кислородом газообразный анестетик обеспечивает поддержку жизни во время общей анестезии. Без этого химического элемента не смог бы существовать ряд отраслей промышленности, использующих плавильные печи. Вот что такое кислород.

Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространенная степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li+O2→2Li2O{\displaystyle {\mathsf {4Li+O_{2}\rightarrow 2Li_{2}O}}}
- 2Sr+O2→2SrO{\displaystyle {\mathsf {2Sr+O_{2}\rightarrow 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO+O2→2NO2↑{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}\uparrow }}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6+15O2→12CO2+6H2O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O}}}
- CH3CH2OH+3O2→2CO2+3H2O{\displaystyle {\mathsf {CH_{3}CH_{2}OH+3O_{2}\rightarrow 2CO_{2}+3H_{2}O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH+O2→CH3COOH+H2O{\displaystyle {\mathsf {CH_{3}CH_{2}OH+O_{2}\rightarrow CH_{3}COOH+H_{2}O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 2Na+O2→Na2O2{\displaystyle {\mathsf {2Na+O_{2}\rightarrow Na_{2}O_{2}}}}
Некоторые оксиды поглощают кислород:
- 2BaO+O2→2BaO2{\displaystyle {\mathsf {2BaO+O_{2}\rightarrow 2BaO_{2}}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- H2+O2→H2O2{\displaystyle {\mathsf {H_{2}+O_{2}\rightarrow H_{2}O_{2}}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Na2O2+O2→2NaO2{\displaystyle {\mathsf {Na_{2}O_{2}+O_{2}\rightarrow 2NaO_{2}}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- K+O2→KO2{\displaystyle {\mathsf {K+O_{2}\rightarrow KO_{2}}}}
Неорганические озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- 3KOH+3O3→2KO3+KOH∗H2O+2O2↑{\displaystyle {\mathsf {3KOH+3O_{3}\rightarrow 2KO_{3}+KOH*H_{2}O+2O_{2}\uparrow }}}
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
- PtF6+O2→O2PtF6{\displaystyle {\mathsf {PtF_{6}+O_{2}\rightarrow O_{2}PtF_{6}}}}
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щелочи:
- 2F2+2NaOH→2NaF+H2O+OF2↑{\displaystyle {\mathsf {2F_{2}+2NaOH\rightarrow 2NaF+H_{2}O+OF_{2}\uparrow }}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- F2+O2→O2F2{\displaystyle {\mathsf {F_{2}+O_{2}\rightarrow O_{2}F_{2}}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
[править] Факты о кислороде
- Кислород воздуха, от которого зависит жизнь человека, впервые появился в атмосфере Земли благодаря деятельности фотосинтезирующих бактерий.
- Большинство живых организмов зависит от кислорода. Обладая высокой химической активностью, он способен окислять («забирать» электроны) у многих химических веществ. Эти реакции происходят с выделением энергии необходимой для поддержания всех жизненных процессов организма. Процесс окисления органических веществ кислородом происходит в митохондриях живых клеток и называется клеточным дыханием.
- Лавуазье открыл, что вода — соединение водорода и кислорода. До этого вода считалась простым веществом.
- Озон, (молекулы которого содержат 3 атома кислорода) составляет 0,00006 % воздуха. Он образуется при диссоциации (распаде) двухатомных молекул кислорода под действием ультрафиолетовых лучей солнечного спектра.
- Ученые NASA нашли в экзосфере (верхнем слое атмосферы) спутника Сатурна Дионы кислород. Данное открытие, по словам исследователей, подтверждает теорию о том, что в атмосфере большинства спутников газовых гигантов Юпитера и Сатурна содержится кислород. Одновременно профессор Лондонского университета Эндрю Коатс заявил, что на Дионе не обнаружено признаков наличия воды, а следовательно, она непригодна для жизни. Однако, отметил ученый, на других спутниках удалось обнаружить наличие льда и воды, а это значит, что там могут быть обнаружены формы жизни.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
-
- 2KMnO4→K2MnO4+MnO2+O2↑{\displaystyle {\mathsf {2KMnO_{4}\rightarrow K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow }}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
-
- 2H2O2 →MnO2 2H2O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\ {\xrightarrow {MnO_{2}}}\ 2H_{2}O+O_{2}\uparrow }}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
-
- 2KClO3→2KCl+3O2↑{\displaystyle {\mathsf {2KClO_{3}\rightarrow 2KCl+3O_{2}\uparrow }}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
-
- 2HgO→100oC 2Hg+O2↑{\displaystyle {\mathsf {2HgO{\xrightarrow {100^{o}C}}\ 2Hg+O_{2}\uparrow }}}
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
-
- 2H2O→e− 2H2+O2↑{\displaystyle {\mathsf {2H_{2}O{\xrightarrow {e-}}\ 2H_{2}+O_{2}\uparrow }}}
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
-
- 2Na2O2+2CO2→2Na2CO3+O2↑{\displaystyle {\mathsf {2Na_{2}O_{2}+2CO_{2}\rightarrow 2Na_{2}CO_{3}+O_{2}\uparrow }}}
Для соблюдения баланса объемов поглощенного углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Распространенность
Что такое кислород? Составляя 46% массы земной коры, он является самым распространенным ее элементом. Количество кислорода в атмосфере составляет 21% по объему, а по весу в морской воде его 89%.
В породах элемент сочетается с металлами и неметаллами в виде оксидов, которые являются кислотными (например, серы, углерода, алюминия и фосфора) или основными (соли кальция, магния и железа), и в качестве солеобразных соединений, которые можно рассматривать как образованные из кислотных и основных оксидов, таких как сульфаты, карбонаты, силикаты, алюминаты и фосфаты. Хотя они и многочисленные, но эти твердые вещества не могут служить источниками кислорода, так как разрыв связи элемента с атомами металла слишком энергозатратен.
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Можно ли сжижить кислород
Помогать всему подряд отлично гореть — не единственное достоинство кислорода. Его еще можно, как оказалось, довести до сжиженного состояния при условии, что он будет доведен до очень низкого температурного уровня.
Для этого автор решает создать некое подобие термоса из двух емкостей, между которыми лежит прослойка монтажной пены. Из медной трубки он делает змеевик и помещает его внутрь, затем закрывает крышку. В итоге получается подобие холодильника Либиха. В емкость наливается жидкий азот. Как только трубка охлаждается, газ начинает проходить по ней и преобразовываться в конденсат. Это и есть кислород в жидком виде.
Жидкий кислород очень хорошо притягивается магнитом
Воздух + магнит
Теперь посмотрим на реакцию кислорода с магнитом, это очень интересно. Автор ролика взял очень мощный магнит и попробовал проверить, какая будет реакция, если приблизить его к жидкому кислороду. Что такое кислород по своей сути? Это парамагнетик и если его вылить на магнит, то его поведение будет равносильно парамагнитной жидкости. А если приблизить магнит к струе кислорода, она начинает буквально липнуть к нему, причем с большой силой. А это значит, что кислород в жидком виде очень хорошо притягивается магнитом. Удивительное вещество — кислород. Сколько интересных экспериментов с ним можно провести
Но конечно, не без внимания взрослых и с соблюдением всех мер предосторожности
Скажите уже — есть смысл покупать пульсоксиметр или нет?
Это сложный вопрос. В рекомендациях медицинских обществ нет совета покупать пульсоксиметры всем. Однако некоторым пациентам, у которых есть сердечная недостаточность или хронические заболевания легких и которые используют дома кислород, врачи рекомендуют иметь пульсоксиметр дома. Это необходимо для того, чтобы человек определил, нужно ли ему дышать кислородом, и вообще контролировал свое состояние.
Некоторые врачи, тем не менее, рекомендуют пульсоксиметры людям и без таких показаний. Аргументы в этом случае следующие:
Чтобы не паниковать лишний раз. Ощущение «заложенности» в грудной клетке и одышка совсем не обязательно связаны с тяжелым поражением легких. В ряде случаев температура, кашель, волнение могут приводить к тем же ощущениям. Если показатели пульсоксиметрии 94–96%, можно не волноваться: скорее всего, срочной госпитализации не требуется. Чтобы контролировать изменения своего состояния. При ОРВИ, которая течет как обычно, с помощью пульсоксиметра можно достаточно рано заметить ухудшение состояния и сообщить об этом врачу. Речь идет о постоянной сатурации ниже 92–93% в бодрствующем состоянии (во сне она и в норме может быть ниже). Чтобы помочь врачу. Если вы расскажете врачу о своих жалобах, сообщите температуру, пульс и насыщение крови кислородом, ему легче будет определить дальнейшую тактику лечения, даже при дистанционной консультации. Аргументы против очевидны: постоянные измерения у кого-то могут усиливать тревогу, а случайные низкие показатели — тем более
В любом случае важно понимать, что общее состояние должно оцениваться комплексно, а не только по показаниям прибора
Если вы захотите купить пульсоксиметр, лучше обсудить это с врачом.
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Компонент ракетного топлива
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горения.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Комментарии
Bulge-Concealing BreastplateBinds when equippedChest Leatherbreastplate wut?
Комментарий от TheMaelstorm
Just to make it clear, this is also a world drop, not just from lockboxes. (Not sure if lockbox already means world drop). Just got it on my rogue from one of the skeletal constructors in fleshwerks.To comment below: I said i got it from a construct, it also dropped from a mob in nexus normal earlier today. Neither are «rare» spawns.
Нахождение в природе
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих архей 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. При этом около 60 % кислорода, производимого лесами и зелёными растениями, расходуется на процессы гниения и разложения в самих лесах и растительных зонах.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Примечания
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ Кнунянц И. Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387-389. — 671 с. — 100 000 экз.
- Я. А. Угай. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — С. 432-435. — 527 с.
- Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. — San Francisco: Pearson – Benjamin Cummings, 2005. — С. 522–23. — ISBN 0-8053-7171-0.
- Freeman, Scott. Biological Science, 2nd. — Upper Saddle River, NJ: Pearson – Prentice Hall, 2005. — P. 214, 586. — ISBN Biological Science, 2nd.
- ↑
- Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28-33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4.
- Вредные химические вещества: Неорганические соединения элементов V-VIII групп. Справочник. — Л., 1989. — С. 150-170
Укрощение силы
Проведя сотни тестов, которые были частью разработки покрытия, устойчивого к атомарному кислороду, группа ученых из Гленновского исследовательского центра приобрела опыт в понимании того, как действует это химическое вещество. Эксперты увидели другие возможности применения агрессивного элемента.
По словам Бэнкса, группе стало известно об изменении химии поверхности, об эрозии органических материалов. Свойства атомарного кислорода таковы, что он способен удалить любую органику, углеводород, который не так просто реагирует с обычными химическими веществами.
Исследователи обнаружили множество способов его использования. Они узнали, что атомарный кислород превращает поверхности силиконов в стекло, что может быть полезно при создании компонентов с герметичным уплотнением без их прилипания друг к другу. Данный процесс разрабатывался для герметизации Международной космической станции. Кроме того, ученые обнаружили, что атомарный кислород может восстанавливать и сохранять поврежденные произведения искусства, улучшать материалы конструкций летательных аппаратов, а также приносить пользу людям, так как может быть использован во множестве биомедицинских применений.
O2
Двухатомная молекула кислорода образована двойной связью двух атомов кислорода. По этой причине молекулярный кислород при нормальных условиях является устойчивым соединением.
Энергия диссоциации молекулы кислорода примерно в 2 раза ниже, чем в молекуле азота (см. ), поэтому кислород по сравнению с азотом обладает более высокой реакционной способностью (но, гораздо меньшей по сравнению, например, с фтором).
Реакционная способность кислорода увеличивается по мере нагревания. Кислород реагирует со всеми элементами за исключением инертных газов. По причине своей высокой электроотрицательности (см. ) в химических соединениях (за исключением фтора) кислород выступает в роли окислителя со степенью -2 (только фтор окисляет кислород с образованием дифторида кислорода OF2).
Свойства газа кислорода:
- газ без цвета, запаха и вкуса;
- в жидком или твердом виде кислород имеет голубую окраску;
- умеренно растворим в воде: массовая доля кислорода при 20°C составляет 0,004%.
Кислородная мезотерапия
Кислородная терапия для лица и тела решает множество проблем кожи и ее возрастных изменений.
Метод помогает избавиться от:
- Растяжек, отеков, купероза.
- Шрамов, рубцов, угревой сыпи, сухости кожи.
- Пигментных пятен, мимических морщин, акне.
Также устраняются или уменьшаются темные круги под глазами, обвисший подбородок.
При помощи кислорода проводят восстановление эпидермиса после травмирующих процедур (пилинг, фотоомоложение и пр.).
Аппарат для кислородной терапии, используемой в косметологических целях, имеет несколько насадок для воздействия на разные участки кожи. Лечение проводится наружно с применением чистого О2. Перед началом процедуры кожу подготавливают – очищают, наносят специальные средства, усиливающие терапевтический эффект. Для достижения результата необходимо пройти не менее 10 процедур.
[править] Применение
Кислород воздуха имеет чрезвычайно важное значение для процессов горения. Сжигая различные виды топлива, получают тепло, которое используют для удовлетворения самых различных потребностей, в том числе для преобразования его в механическую и электрическую энергию
При участии кислорода воздуха сгорает топливо на теплоэлектростанциях, топливо в двигателях автомобилей, выжигают металлические руды на заводах цветной металлургии.
Сварка и резка металлов
Чистый кислород с ацетиленом широко используют для так называемой автогенной сварки стальных труб и других металлических конструкций и их резки. Для этого служит специальная горелка, который состоит из двух металлических трубок, вставленных друг в друга. В пространство между трубками пропускают ацетилен и зажигают, а затем по внутренней трубке пропускают кислород. Оба газа, подаются из баллонов под давлением. Температура в кислородно-ацетиленовом пламени — до 2000 ° C, при такой температуре плавится большинство металлов.
В медицине
Кислород — биогенный химический элемент, обеспечивающий дыхание большинства живых организмов на Земле. Физиологическое действие кислорода разностороннее, решающее значение в его лечебном эффекте имеет способность возмещать дефицит кислорода в тканях организма при гипоксии (недостаточного снабжения тканей кислородом или нарушения его усвоения).
Ингаляцией (вдыханием) кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией (нехваткой кислорода): при заболеваниях органов дыхания (пневмония, отек легких и т. д.), сердечно-сосудистой системы (сердечная недостаточность, коронарная недостаточность, резкое падение артериального давления и т. п.), отравлениях угарным газом, синильной кислотой, удушающими веществами (хлор, фосген и др.), а также при других заболеваниях с нарушением функции дыхания и окислительных процессов.
В анестезиологической практике кислород широко применяется в смеси с ингаляционными наркотическими анальгетиками. Чистым кислородом и смесью его с углекислотой пользуются при ослаблении дыхания в послеоперационном периоде, при интоксикациях и т. д.
Широко пользуются кислородом для так называемой гипербарической оксигенации — применения кислорода под повышенным давлением. Установлена высокая эффективность этого метода в хирургии, интенсивной терапии тяжелых заболеваний, особенно в кардиологии, реаниматологии, неврологии и других областях медицины.
Применяют также энтеральную оксигенотерапию (введение кислорода в кишечник или желудок) путем введения в желудок кислородной пены, применяемой в виде так называемого кислородного коктейля. Используется для общего улучшения обменных процессов в комплексной терапии сердечно-сосудистых заболеваний, нарушений обмена веществ и других патологических состояний, связанных с кислородной недостаточностью организма.
Чистым кислородом пользуются для дыхания также летчики при высоких полетах, водолазы, на подводных лодках и т. п.
Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания.