Поваренная соль (хлорид натрия): NaCl
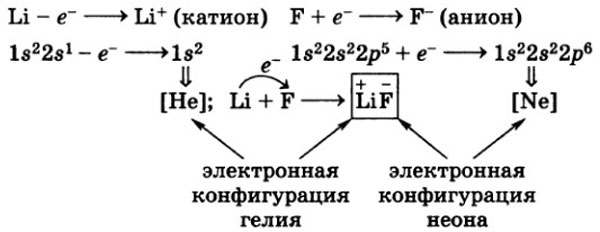
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
В результате перемещения электрона образуются ионы: катион натрия (Na+) и анион хлора (Cl-). Поскольку противоположные заряды притягиваются, то образуется устойчивое соединение NaCl (хлорид натрия) — поваренная соль.
В результате взаимного притяжения противоположно заряженных ионов, образуется ионная связь — устойчивое химическое соединение.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
| Ионная связь — химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Следует понимать, что понятие ионной связи довольно относительно, строго говоря к «чистым» ионным соединениям можно отнести только те вещества, у которых разность в электроотрицателности атомов, которые образуют ионную связь, равна или более 3. По этой причине в природе существует всего с десяток чисто ионных соединений — это фториды щелочных и щелочно-земельных металлов (например, LiF; относительная электроотрицательность Li=1; F=4).
Чтобы не «обижать» ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. ).
Ионизация
Основная статья: Ионизация
Атомы и молекулы могут превращаться в положительно заряженные ионы в результате потери одного или нескольких электронов. Отрыв электрона от атома или молекулы требует затраты энергии, называемой энергией ионизации.
Положительно заряженные ионы также образуются при присоединении протона (положительно заряженного ядра атома водорода). Примером является молекулярный ион водорода, ион аммония, ониевые соединения.
Отрицательно заряженные ионы образуются в результате присоединения электрона к атому или молекуле. Присоединение электрона сопровождается выделением энергии.
Положительный ион водорода (H+ или протон, p) получается при ионизации атома водорода. Энергия ионизации в данном процессе имеет значение 13,595 эВ.
Для атома гелия энергия ионизации составляет 24,581 эВ и 54,403 эВ и соответствует отрыву первого и второго электронов. Получаемый ион гелия (He2+) в физике имеет название альфа-частица. Выброс альфа-частиц наблюдается при радиоактивном распаде некоторых атомных ядер, например 88Ra226.
Энергия отрыва первого электрона атома имеет явно выраженный периодический характер зависимости от порядкового номера элемента.
В связи с низкими значениями энергии ионизации щелочных металлов, их атомы легко теряют свои внешние электроны под действием света. Отрыв электрона производится в данном случае за счёт энергии поглощаемых металлом квантов света.
Натрий: Na
На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен: либо отдать этот электрон, либо принять семь новых. Исходя из вышесказанного, натрий будет отдавать электрон. При этом у него «исчезает» 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион — катион.
Электронная конфигурация катиона натрия: Na+ 1s22s22p6
Особо внимательные читатели справедливо скажут, что такая же электронная конфигурация и у неона (Ne). Так что же, натрий превратился в неон? Вовсе нет — не забывайте о протонах! Их по-прежнему; у натрия — 11; у неона — 10. Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).
Подведем итог:
- атом натрия и его катион отличаются одним электроном;
- катион натрия имеет меньший размер, поскольку он теряет внешний энергетический уровень.
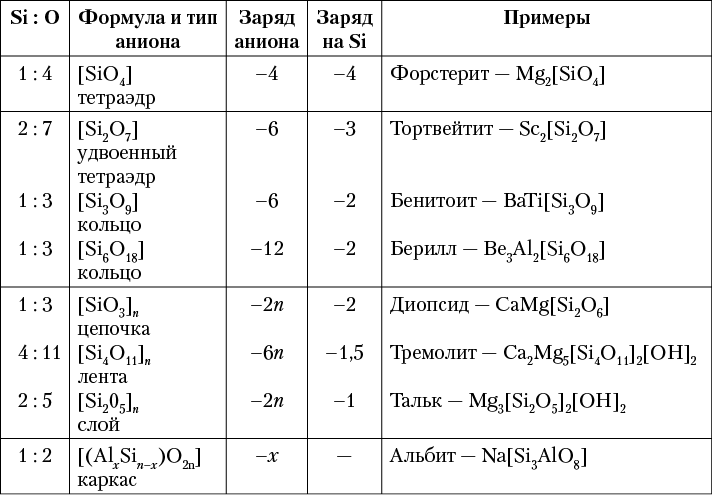
Кислотный остаток
Анион в сложном неорганическом соединении называется (но не всегда, например это неверно для воды или оксидов металлов) кислотным остатком. Анионы, например, можно выделить в формулах неорганических кислот и солей (Na2SO4, HNO3); в них они пишутся на втором месте (после катиона). Для почти всех кислотных остатков существует соответствующая кислота: например, SO42– — «остаток» серной кислоты, Cl– — соляной кислоты. Многие кислоты существуют только в растворах, например, угольная кислота, но её соли (карбонаты) известны. Некоторые кислоты (формулы которых можно искусственно выписать) не существуют (даже в растворах), но формально им приписываются соли, которые существуют и устойчивы. Например, это так для фосфид-иона (P3–), который дает соли (фосфиды), не имеющие существующей кислоты. Такие ионы не называются кислотными остатками. Таким образом, не всякий анион является кислотным остатком. А именно, к ним не относится ион кислорода в оксидах, гидроксильный ион в воде, или ионы в солях не имеющие реально существующей прототипной кислоты. В последнем случае отнесение соединения к классу солей является традицией. Также традицией обусловлено не отнесение воды к классу кислот. То есть строго логически непротиворечивое определение кислоты, кислотного остатка и соли затруднительно.
Неорганические кислоты и соответствующие им кислотные остатки
| Кислота | Название кислоты | Кислотный остаток | Название солей |
|---|---|---|---|
| H3BO3 | ортоборная | BO33- | ортоборат |
| H2CO3 | угольная | CO32- | карбонат |
| H2SiO3 | метакремниевая | SiO32- | метасиликат |
| H4SiO4 | ортокремниевая | SiO44- | ортосиликат |
| HN3 | азотистоводородная | N3— | азид |
| HNO2 | азотистая | NO2— | нитрит |
| HNO3 | азотная | NO3— | нитрат |
| HPO3 | метафосфорная | PO3— | метафосфат |
| H3PO4 | ортофосфорная | PO43- | ортофосфат |
| H3PO2 | фосфорноватистая | PO23- | гипофосфит |
| H3PO3 | фосфористая | PO33- | фосфит |
| HAsO3 | метамышьяковая | AsO3— | метаарсенат |
| H3AsO4 | ортомышьяковая | AsO43- | ортоарсенат |
| H2S | сероводородная | S2- | сульфид |
| H2SO3 | сернистая | SO32- | сульфит |
| H2SO4 | серная | SO42- | сульфат |
| H2Se | селеноводородная | Se2- | селенид |
| H2SeO3 | селенистая | SeO32- | селенит |
| H2SeO4 | селеновая | SeO42- | селенат |
| H2Te | теллуроводородная | Te2- | теллурид |
| H2TeO3 | теллуристая | TeO32- | теллурит |
| HF | плавиковая | F- | фторид |
| HCl | соляная | Cl- | хлорид |
| HClO | хлорноватистая | ClO- | гипохлорит |
| HClO2 | хлористая | ClO2— | хлорит |
| HClO3 | хлорноватая | ClO3— | хлорат |
| HClO4 | хлорная | ClO4— | перхлорат |
| HBr | бромоводородная | Br- | бромид |
| HBrO | бромноватистая | BrO- | гипобромит |
| HBrO2 | бромистая | BrO2— | бромит |
| HBrO3 | бромноватая | BrO3— | бромат |
| HBrO4 | бромная | BrO4— | пербромат |
| HI | иодоводородная | I- | иодид |
| HIO | иодноватистая | IO- | гипоиодит |
| HIO2 | иодистая | IO2— | иодит |
| HIO3 | иодноватая | IO3— | иодат |
| HIO4 | иодная | IO4— | периодат |
Приставка «орто» может опускаться, однако это нежелательно
Таблица анионов
| F- | фторид | P 2 O 7 -4 | пирофосфат |
|---|---|---|---|
| Cl | хлорид | (№ 2 ) — | нитрит |
| бром | бромид | (№ 3 ) — | нитрат |
| I- | йодид | S-2 | сульфид |
| (ClO) — | гипохлорит | (SO4) -2 | сульфат |
| (CLO 2 ) — | хлорит | (SO 3 ) -2 | сульфит |
| (CLO 3 ) — | хлорат | (S 2 O 3 ) -2 | тиосульфат |
| (CLO 4 ) — | перхлорат | (S 4 O 6 ) -2 | персульфат |
| (BrO) — | гипобромит | (MnO 4 ) — | перманганат |
| (BrO3) — | бромат | (MnO 4 ) -2 | манганат |
| (IO) — | гипоиодит | (SiO3) -2 | метасиликат |
| (IO 3 ) — | йодат | (SiO 4 ) -4 | ортосиликат |
| (IO 4 ) — | периодатное | (CrO 4 ) -2 | хромат |
| (CN) — | цианид | (CrO 7 ) -2 | дихромат |
| (CNO) — | цианат | (AsO3) -3 | арсенит |
| (ЦНС) — | тиоцианат | (AsO 4 ) -3 | мышьяковокислый |
| (C 2 H 3 O 2 ) — | ацетат | (SbO3) -3 | Antimônito |
| (СО 3) -2 | карбонат | (SbO 4 ) -3 | антимонат |
| (С2-4) -2 | оксалат | (BO 3 ) -3 | борат |
| [Fe (CN) 6 ] -3 | гексационоферрата | (SnO 3 ) -2 | станнат |
| [Fe (CN) 6 ] -4 | железистосинеродистый | (SnO 2 ) -2 | станнин |
| (PO 3 ) — | метафосфат | (AlO 2 ) — | алюминат |
| (H 2 PO 2 ) — | гипофосфит | (PbO 2 ) -2 | Plumbito |
| (HPO 3 ) -2 | фосфит | (ZnO 2 ) -2 | zincato |
| (ПО 4 ) -3 | ортофосфат |
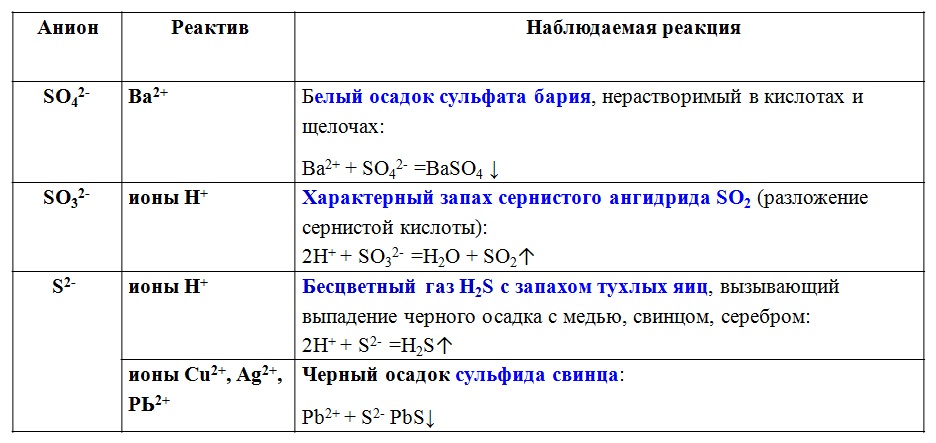
Таблица аналитическая классификация анионов

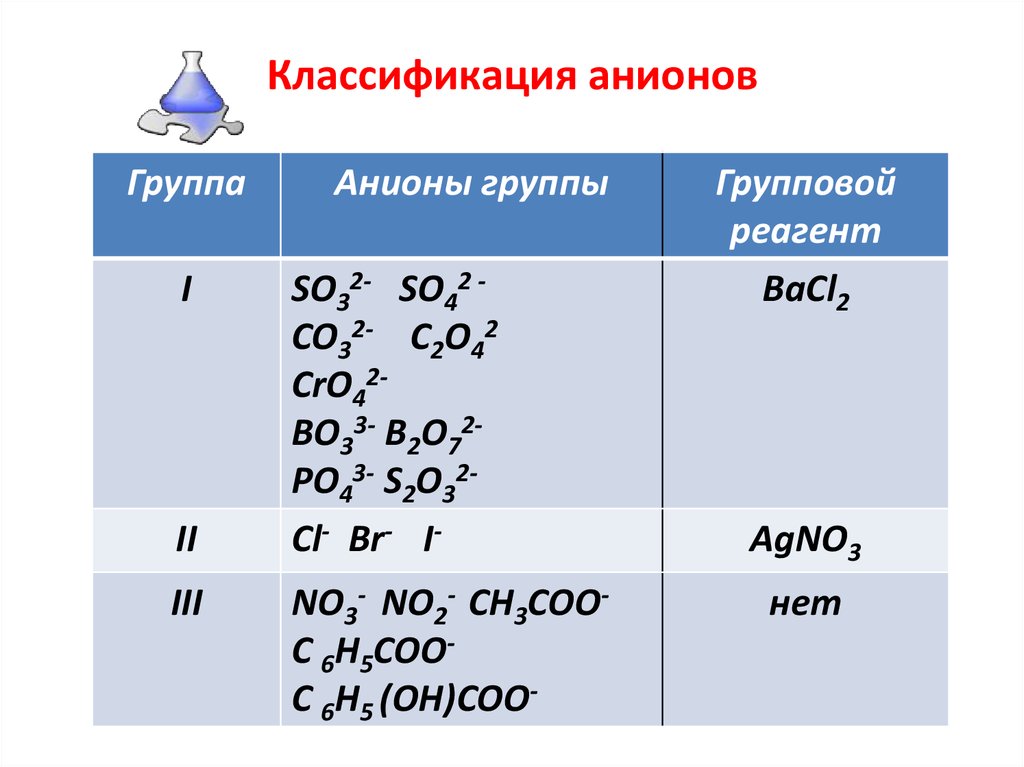
| № группы | Анионы, относящиеся к данной группе | Растворимость солей | Групповой реагент |
| I | SO42-, CO32-, SiO32-, PO43- | Соли бария, нерастворимые в воде | Хлорид бария в нейтральной среде |
| II | Cl-, Br-, I- | Соли серебра, нерастворимые ни в воде, ни в разбавленной азотной кислоте | Нитрат серебра в присутствии азотной кислоты |
| III | NO3- , NO2- | Соли бария и серебра, растворимые в воде | Нет |
Таблица аналитические сигналы на анионы первой группы
| № | Реагенты | Анионы | |||
| SO42- | CO32- | SiO32- | PO43- | ||
| 1 | BaCl2 в нейтральной среде |
ВаSO4 молочнобелый осадок, нерастворимый в кислотах |
ВaCO3 белый осадок |
|
ВaHPO4 белый осадок |
| 2 | AgNO3 в нейтральной среде |
— | Ag2CO3 белый осадок | Ag2SiO3 желтый осадок | Ag3PO4 желтый осадок |
| 3 | Кислоты HCl и HNO3 |
— | Выделение углекислого газа CO2 | белый студенистый Н2SiO3 | — |
| 4 | Хлорид аммония NH4Cl при нагревании | — | — | белый студенистый Н2SiO3 |
— |
| 5 | молибденовая жидкость при кипячении | — | — | желтое окрашивание | желтый крист.осадок фосфомолибдата аммония |
Таблица аналитические сигналы на анионы второй группы
| № | Реагенты | Анионы | ||
| Cl- | Br- | I- | ||
| 1. | AgNO3 в присутствии HNO3 | AgCl белый творожистый растворим в избытке NH4ОН | AgBr желто-белый, частично растворим в избытке NH4ОН, хорошо растворим в Na2S2O3 | AgI светложелтый, растворим в Na2S2O3 и в большом иодида калия |
| 2. | Хлорная вода в кислой среде | — | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
| 3. | диоксид марганца MnO2 в кислой среде | Свободный хлор, практически не окрашивает бензол-толуол | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
Таблица аналитические сигналы на анионы третьей группы
| № | Реагенты | Анионы | |
| NO3- | NO2- | ||
| 1. | металлический алюминий или цинк (Al,Zn) в щелочной среде | выделяется аммиак NH3 | — |
| 2. | металлическая медь (Cu) | выделяются буро-желтые пары диоксида азота (NO2) | — |
| 3. | дифениламин | раствор окрашивается в синий цвет | раствор окрашивается в синий цвет |
| 4. | сильные кислоты (HCl, H2SO4) | — | выделяются желто- бурые пары окислов азота |
| 5. | перманганат калия(KMnO4) | — | раствор перманганата калия обесцвечивается |
Роль ионизации в химии
 Можно с уверенностью сказать, что химия – это, по сути, прикладная физика. И хотя данные науки занимаются изучением совершенно разных вопросов, но законы взаимодействия вещества в химии никто не отменял.
Можно с уверенностью сказать, что химия – это, по сути, прикладная физика. И хотя данные науки занимаются изучением совершенно разных вопросов, но законы взаимодействия вещества в химии никто не отменял.
Как было описано выше, электроны имеют свои строго определенные места – орбитали. Когда атомы образуют какое-либо вещество, то они, сливаясь в группу, также «делятся» своими электронами с соседями. И хотя молекула остается электрически нейтральной, одна ее часть может представлять собой анион, а другая — катион.
За примером далеко ходить не требуется. Для наглядности можно взять всем известную соляную кислоту, она же хлороводород – HCL. Водород в данном случае будет обладать положительным зарядом. Хлор же в данном соединении является остатком и называется хлоридом – тут он имеет заряд отрицательный.
Таблица растворимости покажет, какое вещество хорошо растворяется, а какое сразу же вступает во взаимодействие с водой.
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
- элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1+;
- элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2+;
- элементы группы IIIA отдают три электрона и образуют катион с зарядом 3+;
- элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1-;
- элементы группы VIA принимают два электрона и образуют анион с зарядом 2-;
- элементы группы VA принимают три электрона и образуют анион с зарядом 3-;
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA |
Литий Натрий Калий |
Катион лития Катион натрия Катион калия |
Li+ Na+ K+ |
| IIA |
Бериллий Магний Кальций Стронций Барий |
Катион бериллия Катион магния Катион кальция Катион стронция Катион бария |
Be2+ Mg2+ Ca2+ Sr2+ Ba2+ |
| IB | Серебро | Катион серебра | Ag+ |
| IIB | Цинк | Катион цинка | Zn2+ |
| IIIB | Алюминий | Катион алюминия | Al3+ |
Распространенные одноатомные анионы
| Группа | Элемент | Ион | Обозначение |
| VIIA |
Фтор Хлор Бром Йод |
Анион фтора Анион хлора Анион брома Анион йода |
F- Cl- Br- I- |
| VIA |
Кислород Сера |
Анион кислорода Анион серы |
O2- S2- |
| VA |
Азот Фосфор |
Аниона азота Анион фосфора |
N3- P3- |
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
- Cr2+ — ион двухвалентного хрома; хром (II)
- Mn3+ — ион трехвалентного марганца; марганец (III)
- Hg22+ — ион двухатомной двухвалентной ртути; ртуть (I)
- Pb4+ — ион четырехвалентного свинца; свинец (IV)
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Ионы не всегда бывают одноатомными, они могут состоять из группы атомов — многоатомные ионы. Например, ион двухатомной двухвалентной ртути Hg22+: два атома ртути связаны в один ион и имеют общий заряд 2+ (каждый катион имеет заряд 1+).
Примеры многоатомных ионов:
- SO42- — сульфат
- SO32- — сульфит
- NO3— — нитрат
- NO2— — нитрит
- NH4+ — аммоний
- PO43+ — фосфат
Строение простых ионов
Простые ионы состоят из одного атомного ядра и электронов. Атомное ядро состоит из протонов и нейтронов, неся практически всю (более 99,9%) массу иона и создаёт электрическое поле, которое удерживает электроны. Заряд атомного ядра определяется числом протонов, и совпадает с порядковым номером элемента в
периодической таблице Д.И. Менделеева.
Электроны заполняют электронные слои вокруг атомного ядра. Электроны с одинаковым значением главного квантового числа n образуют квантовый слой близких по размерам электронных облаков. Слои с n = 1,2,3,4… обозначаются соответственно буквами K, L, M, N… По мере удаления от атомного ядра ёмкость слоёв увеличивается и в зависимости от значения n составляет 2 (слой K), 8 (слой L), 18 (слой M), 32 (слой N)… электронов.
Исключением из общего правила является положительный ион водорода, который не содержит электронов и является элементарной частицей — протоном. В то же время отрицательный ион водорода содержит два электрона. Фактически гидрид-ион является системой из одного протона и двух электронов и изоэлектронен положительному иону лития, имеющему в электронной оболочке также два электрона.
Вследствие волнового характера движения электрона ион не имеет строго определённых границ. Поэтому точно определить размеры ионов невозможно. Кажущийся радиус иона зависит от того, какое физическое свойство рассматривается, и будет различным для разных свойств. Обычно используют такие ионные радиусы, чтобы сумма двух радиусов равнялась равновесному расстоянию между соседними ионами в кристалле. Такая полуэмпирическая таблица ионных радиусов была составлена Л. Полингом.
Позднее была составлена новая система ионных радиусов на основе кристаллохимических исследований Г.Б. Бокия структур простейших бинарных соединений.
Таблица растворимости
Растворимостью называется способность одного или нескольких веществ вступать в реакцию с другими веществами таким образом, чтобы в результате получалась однородная система. При этом оба вещества распадаются на молекулы, атомы или ионы.
Наравне с таблицей периодической системы Д. И. Менделеева, таблица растворимости является основным теоретическим пособием при изучении химии. Не все вещества взаимодействуют между собой одинаково.
Начинающие химики, учащиеся школ, колледжей и вузов не всегда могут запомнить степень растворимости в воде тех или иных веществ. Именно поэтому таблицу периодической системы Менделеева и таблицу растворимости можно увидеть в каждом кабинете или классе химии, каждой лаборатории.
То или иное сочетание веществ из таблицы может вступать в семь различных реакций с водой:
- хорошо растворяется в воде;
- практически не растворяется в воде;
- растворяется в слабых и разбавленных кислотах и почти не растворяется в воде;
- растворяется только в сильных неорганических кислотах, не растворяясь при этом в воде;
- не растворяется ни в кислотах, ни в воде;
- не существует при контакте с водой, но полностью гидролизируется при растворении;
- вещество не существует.
Чаще всего таблица растворимости применяется при решении уравнений с участием ионных реакций. Реакция возможна только в том случае, если конечный продукт малорастворим или нерастворим вообще.
Условные обозначения в таблице растворимости:
| Р | Вещество хорошо растворимо в воде |
| М | Малорастворимо |
| Н | Практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | Нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| – | вещество вообще не существует |
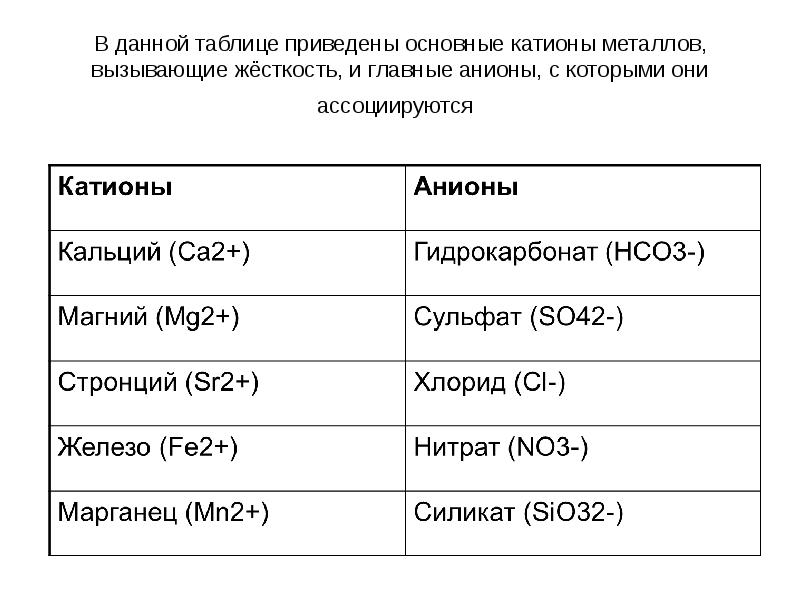
| Катионы | Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Агрегатные состояния вещества
Еще с малых лет, в начальной школе рассказывали о том, что существует три состояния вещества: твердое, жидкое, а также газообразное. Повседневный опыт показывает, что это действительно так. Мы можем взять немного льда, растопить его, а затем испарить – все довольно логично.
Однако, прежде чем ответить на вопрос: что же это такое, давайте вспомним школьный курс физики и рассмотрим строение атома.
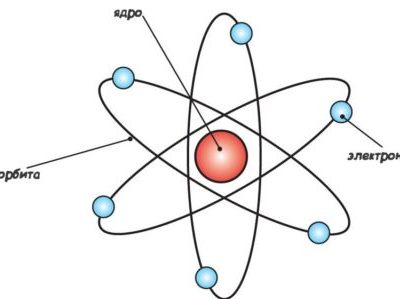
По результатам его опытов с альфа-частицами, стало известно, что атом является неким аналогом солнечной системы, где уже ранее известные электроны играли роль «планет», вращаясь вокруг атомного ядра.
Данная теория стала одним из наиболее значимых открытий в физике элементарных частиц. Но на сегодняшний день она признана устаревшей, а ей на замену принята другая, более совершенная, предложенная Нильсом Бором. Еще позднее, с появлением нового ответвления науки, так называемой квантовой физики, была принята теория корпускулярно-волнового дуализма.
В соответствие с ней, большинство частиц одновременно являются не только частицами, но и электромагнитной волной. Таким образом, невозможно на 100% точно указать, в каком месте находится электрон в определенный момент. Имеется возможность лишь предположить, где он может быть. Подобные «допустимые» границы впоследствии получили название орбиталей.
Как известно, электрон обладает отрицательным зарядом, в то время как протоны, находящиеся в ядре, – положительным. Так как число электронов и протонов равно, то атом обладает нулевым зарядом, или же, – электрически нейтрален.
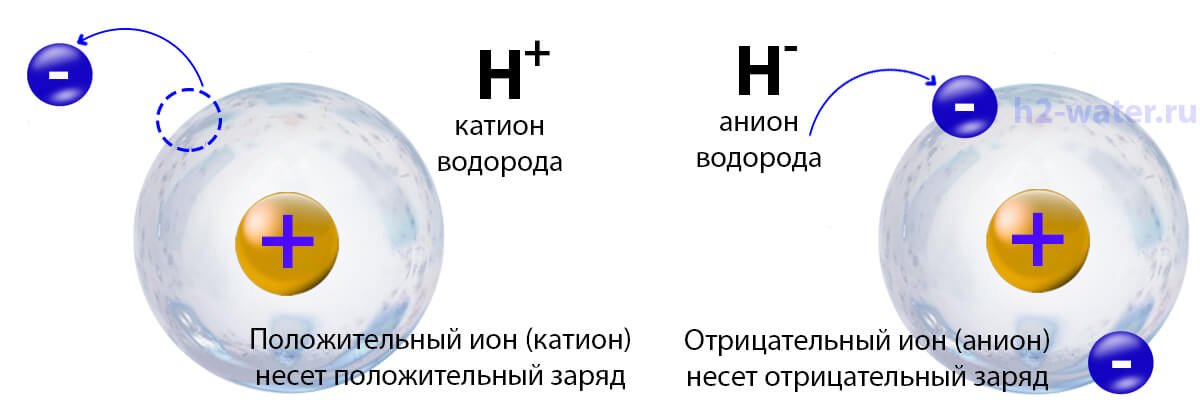
При различных внешних воздействиях атом получает возможность, как терять электроны, так и приобретать их, при этом меняя свой заряд на положительный или отрицательный, становясь при этом ионом. Таким образом, ионы представляют собой частицы с ненулевым зарядом – будь то ядра атомов, или оторванные электроны. В зависимости от заряда, положительного или отрицательного, ионы называются катионами и анионами соответственно.

Другой не менее интересный эффект можно наблюдать в космических туманностях. Подобные объекты чаще всего состоят из газа. Если поблизости имеется звезда, то ее излучение может ионизировать вещество туманности, в результате чего оно уже самостоятельно начинает излучать свет.
Глядя на эти примеры, можно ответить на вопрос о том, чем является плазма. Итак, ионизируя определенный объем вещества, мы заставляем атомы отдать свои электроны и приобрести положительный заряд. Свободные электроны, обладая отрицательным зарядом, могут либо остаться свободными, либо же присоединиться к другому атому, тем самым изменив его заряд на положительный. Так вещество никуда не уходит, а число протонов и электронов так и остается равным, оставляя плазму электрически нейтральной.
катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
- Катионы с зарядом +1 называются одновалентными.
- Катионы с зарядом +2 называются бивалентами.
- Катионы с зарядом +3 называются трехвалентными.
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.