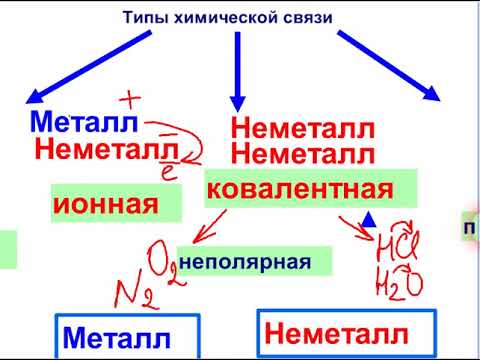
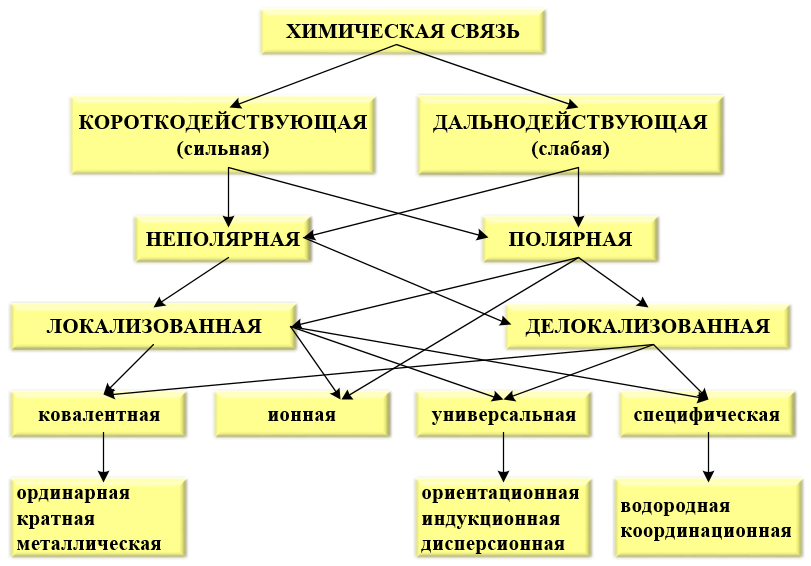
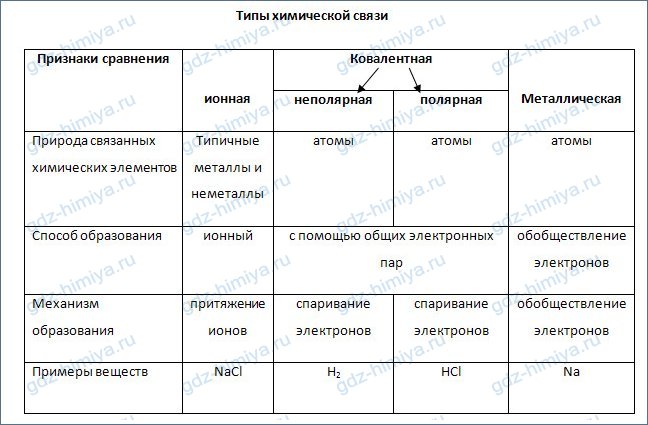
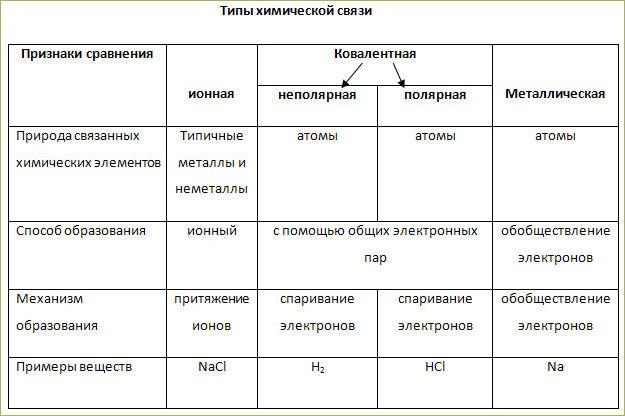
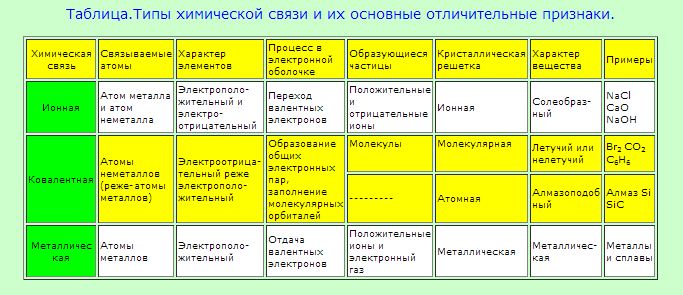
Ионы. Ионная связь
Для атома существует две основные возможности подчиниться правилу октета. Первая из них — образование ионной связи. (Вторая — образование ковалентной связи, о ней речь пойдет ниже). При образовании ионной связи атом металла теряет электроны, а атом неметалла приобретает.
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным. Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне. Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Ионная связь — это химическая связь, возникающая между ионами. Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
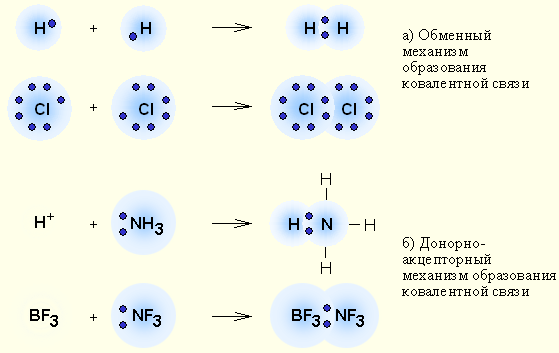
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
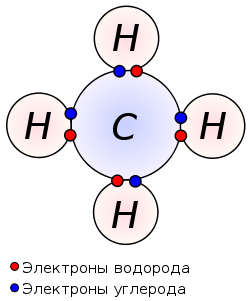
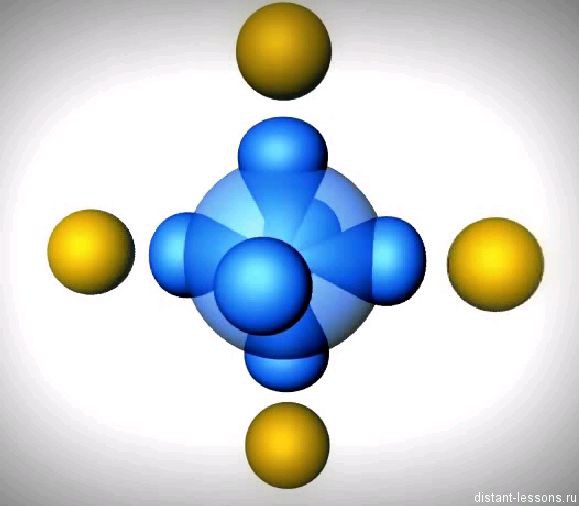
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
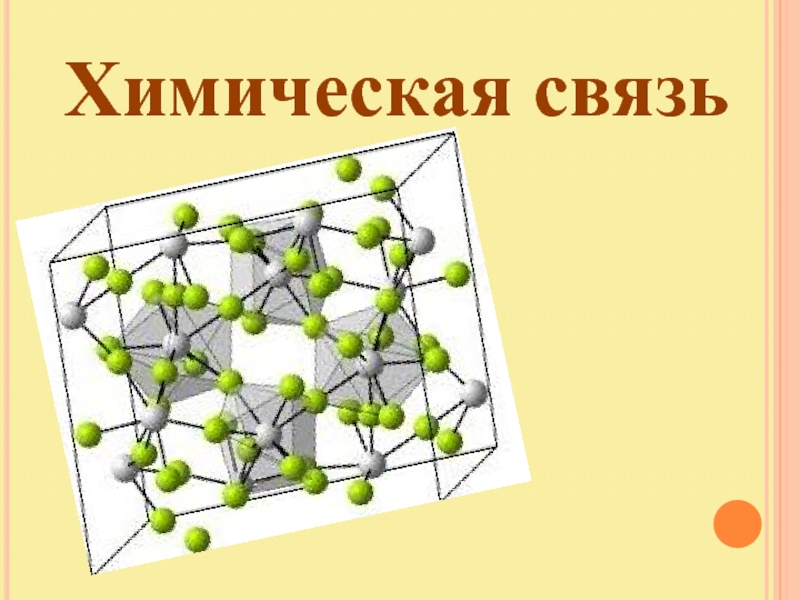
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.

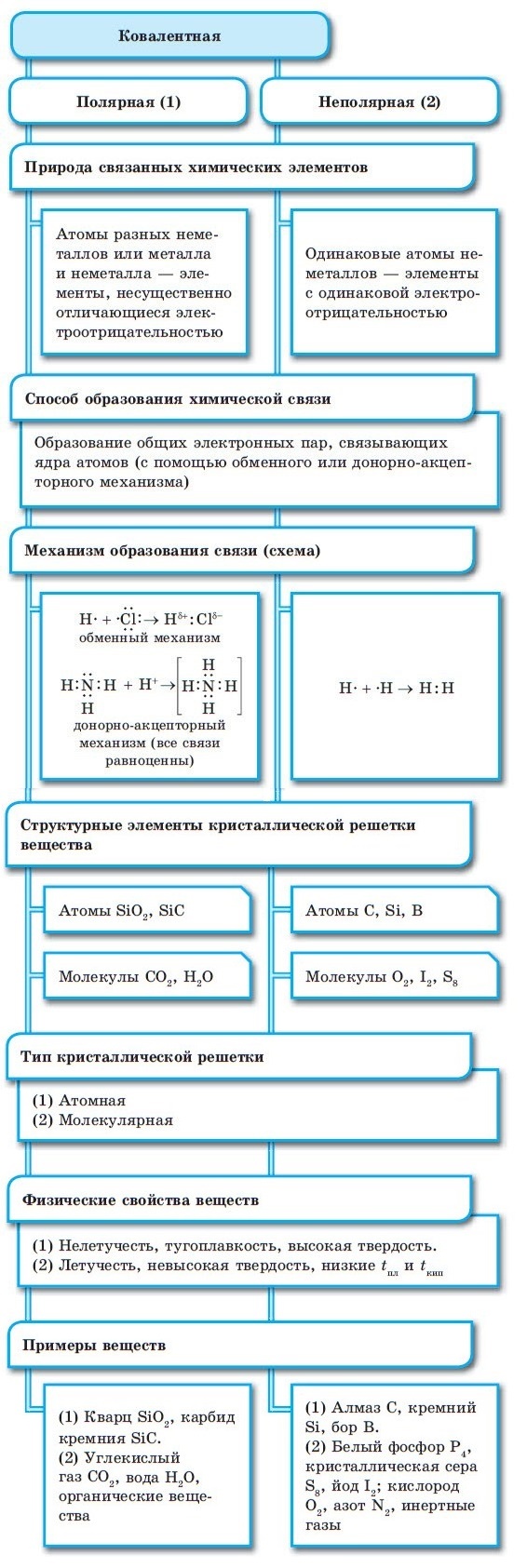
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие
Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).

В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.

Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.

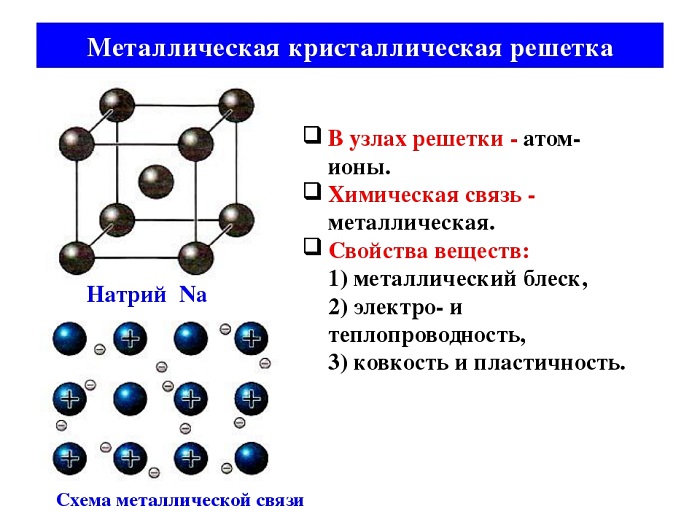
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.

Итак, из вышесказанного сделаем вывод.
Литература
- Пиментел Г., Спратли Р. Как квантовая механика объясняет химическую связь. Пер. с англ. М.: Мир, 1973. 332 с.
- Рюденберг К. Физическая природа химической связи. М.: Мир, 1964. 164 c.
- Бердетт Дж. Химическая связь. М.: Бином. Лаборатория знаний, 2008. 248 с. ISBN 978-5-94774-760-7, ISBN 978-5-03-003847-6, ISBN 0-471-97129-4
- Яцимирский К. Б., Яцимирский В. К. Химическая связь. Киев: Вища школа, 1975. 304 c.
- Краснов К. С. Молекулы и химическая связь. 2-ое изд. М: Высшая школа, 1984. 295 с.
- Татевский В. М. Строение молекул. М.: Химия, 1977. 512 с (Глава VIII. «Проблема химической связи в квантовой механике»)
- Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. 162 с. (§§ 30-31)
- Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. 532 c. ISBN 5-03-003363-7 Глава 7. Модели химической связи.
Характеристика ионной связи
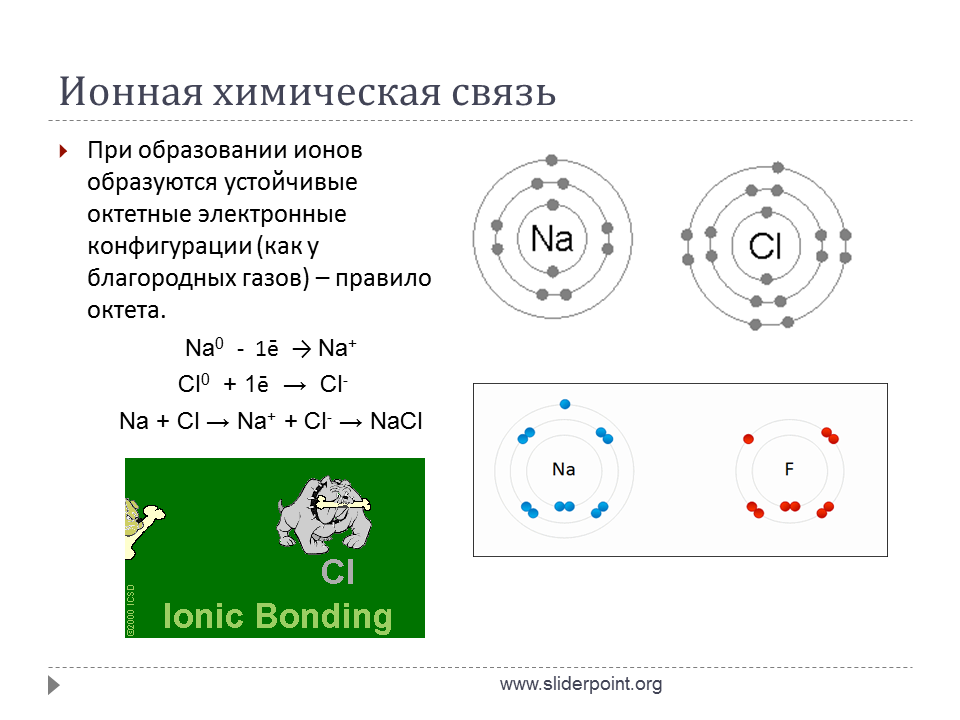
 Химическое взаимодействие, которое образуется из-за притяжения ионов, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц — ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц — ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы, а наибольшими — типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет.
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na — 1 е = Na + (катион)
Cl + 1 е = Cl— (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba — 2 е = Ba2+
S + 2 е = S2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S2- и катионы бария Ba2+ .
Электроотрицательность
Определить тип химической связи в веществах можно, основываясь на разнице в значениях электроотрицательностей составляющих ее атомов. Под электроотрицательностью понимают способность атомов оттягивать на себя общие электронные пары (электронное облако), что приводит к поляризации связи.
Существуют различные способы определения значений электроотрицательностей химических элементов. Однако наиболее применяемой является шкала, основанная на термодинамических данных, которая была предложена еще в 1932 году Л. Полингом.

Чем значительнее разница в электроотрицательностях атомов, тем в большей степени проявляется ее ионность. Напротив, равные или близкие значения электроотрицательности указывают на ковалентный характер связи. Иначе говоря, определить, какая химическая связь наблюдается в той или иной молекуле, можно математически. Для этого нужно вычислить ΔХ — разность электроотрицательностей атомов по формуле: ΔХ=|Х1-Х2|.
- Если ΔХ>1,7, то связь является ионной.
- Если 0,5≤ΔХ≤1,7, то ковалентная связь носит полярный характер.
- Если ΔХ=0 или близка к нему, то связь относится к ковалентной неполярной.
Водородная связь
Этот тип химической связи иногда называют промежуточной между ковалентной и межмолекулярным взаимодействием. Если атом водорода имеет связь с одним из сильно электроотрицательных элементов (таких как фосфор, кислород, хлор, азот), то он способен образовывать дополнительную связь, называемую водородной.
Она гораздо слабее всех рассмотренных выше типов связей (энергия не более 40 кДж/моль), но пренебрегать ею нельзя. Именно поэтому водородная химическая связь на схеме выглядит в виде пунктирной линии.

Возникновение водородной связи возможно благодаря донорно-акцепторному электростатическому взаимодействию одновременно. Большая разница в значениях электроотрицательности приводит к появлению избыточной электронной плотности на атомах О, N, F и других, а также к ее недостатку на атоме водорода. В том случае если между такими атомами нет существующей химической связи, при их достаточно близком расположении активизируются силы притяжения. При этом протон является акцептором электронной пары, а второй атом — донором.
Водородная связь может возникать как между соседними молекулами, например, воды, карбоновых кислот, спиртов, аммиака, так и внутри молекулы, например, салициловой кислоты.
Наличием водородной связи между молекулами воды объясняется ряд ее уникальных физических свойств:
- Значения ее теплоемкости, диэлектрической проницаемости, температур кипения и плавления в соответствии с расчетами должны быть значительно меньше реальных, что объясняется связанностью молекул и необходимостью затрачивать энергию на разрыв межмолекулярных водородных связей.
- В отличие от других веществ, при понижении температуры объем воды увеличивается. Это происходит благодаря тому, что молекулы занимают определенное положение в кристаллической структуре льда и отдаляются друг от друга на длину водородной связи.
Особую роль эта связь играет для живых организмов, поскольку ее наличием в молекулах белков обуславливается их особая структура, а значит, и свойства. Кроме того, нуклеиновые кислоты, составляя двойную спираль ДНК, также связаны именно водородными связями.
Теория Бутлерова
Более успешная попытка объяснить природу химической связи веществ была предпринята русским ученым А.М.Бутлеровым. В основу своей теории этот ученый положил такие предположения:
- Атомы в соединенном состоянии связаны друг с другом в определенном порядке. Изменение этого порядка служит причиной образования нового вещества.
- Атомы связываются между собой по законам валентности.
- Свойства вещества зависят от порядка соединения атомов в молекуле вещества. Иной порядок расположения становится причиной изменения химических свойств вещества.
- Атомы, связанные между собой, наиболее сильно влияют друг на друга.
Теория Бутлерова объясняла свойства химических веществ не только их составом, но и порядком расположения атомов. Такой внутренний порядок А.М. Бутлеров назвал «химическим строением».

Теория русского ученого позволила навести порядок в классификации веществ и предоставила возможность определять строение молекул по их химическим свойствам. Также теория дала ответ на вопрос: почему молекулы, содержащие одинаковое количество атомов, имеют разные химические свойства.
Как определить тип связи
Характеристики химических связей между частицами веществ зависят от электроотрицательности – возможности сохранять валентные электроны. Этот показатель зависит от заряженности ядра и радиуса атома. Для количественной оценки применяют шкалу Полинга (Табл. 1).
Таблица 1
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
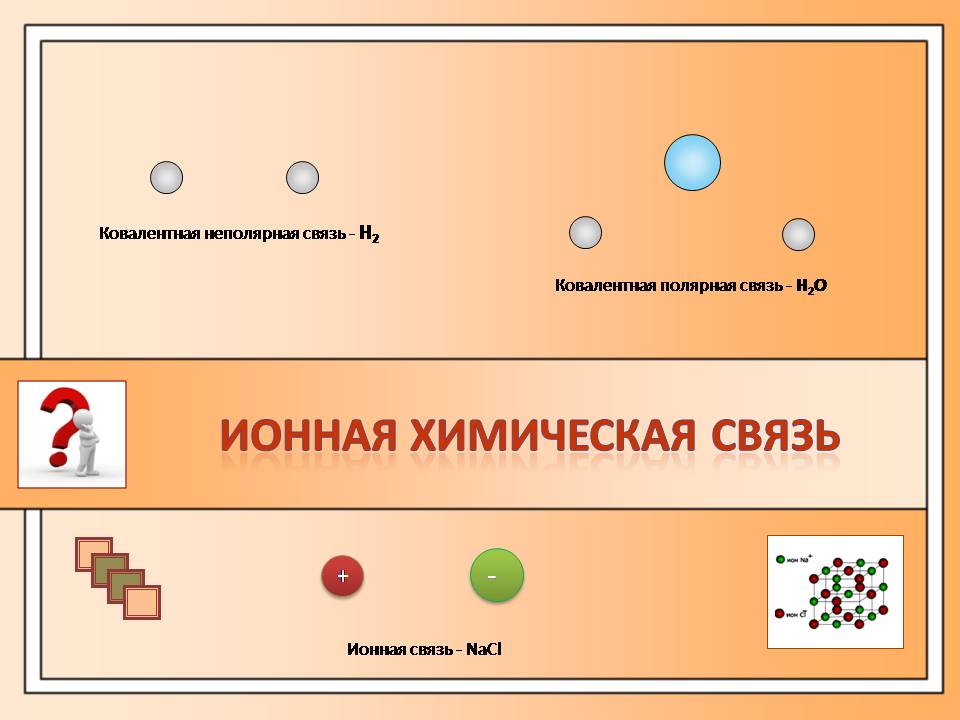
- Δ ЭО = 0 – неполярная ковалентная;
- Δ ЭО
- Δ ЭО ≥ 1,7 – ионная.
Химические связи различаются по связываемым атомам, образующимся частицам, кристаллической решётке, характере вещества. Выделяют 4 типа:
- Ковалентная (полярная и неполярная).
- Ионная.
- Механическая.
- Водородная.
Определяют тип по веществу, принимающему участие в связи. Если это 2 неметалла, то связь ковалентная. Если метал с неметаллом, то ионный тип, но если 2 металла, то металлический тип. Водородная связь – соединение молекул водорода с фтором, хлором, кислородом или азотом.
Примечания
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М.: «Химия», 1987. — С. 124. — 320 с.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М.: «Химия», 1987. — С. 132-136. — 320 с.
- Ганкин В.Ю., Ганкин Ю.В. Как образуется химическая связь и протекают химические реакции. — М.: издат.группа «Граница», 2007. — 320 с. — ISBN 978-5-94691296-9.
- Некрасов Б. В. Курс общей химии. — М.: Госхимиздат, 1962. — С. 88. — 976 с.
- Паулинг Л. Природа химической связи / под редакцией Я.К.Сыркина. — пер. с англ. М.Е.Дяткиной. — М.-Л.: Госхимиздат, 1947. — 440 с.
- ↑ Теоретическая органическая химия / под ред. Р.Х.Фрейдлиной. — пер. с англ. Ю.Г.Бунделя. — М.: Изд. иностранной литературы, 1963. — 365 с.
- ↑ Леменовский Д.А., Левицкий М.М. Российский химический журнал (журнал Российского химического общества им. Д.И.Менделеева). — 2000. — Т. XLIV, вып.6. — С. 63-86.
- Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М.: Сов. энциклопедия, 1983. — С. 607. — 792 с.
- Некрасов Б. В. Курс общей химии. — М.: Госхимиздат, 1962. — С. 679. — 976 с.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М.: «Химия», 1987. — С. 155-161. — 320 с.
- Гиллеспи Р. Геометрия молекул / пер. с англ. Е.З. Засорина и В.С. Мастрюкова, под ред. Ю.А Пентина. — М.: «Мир», 1975. — С. 49. — 278 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 402-513. — 1072 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ.. — М.: «Химия», 1987. — С. 132—136. — 320 с.
- Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми). Успехи физических наук.. — 1962. — Т. 78, вып.2. — 291 с.
Характеристики химических связей
Учение о химической связи составляет основу всей теоретической химии. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную. Различные типы связей могут содержаться в одних и тех же веществах.
1. В основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная.
2. В солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная.
3. В солях аммония, метиламмония и т. д. между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная.
4. В пероксидах металлов (например, Na2O2) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т. д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
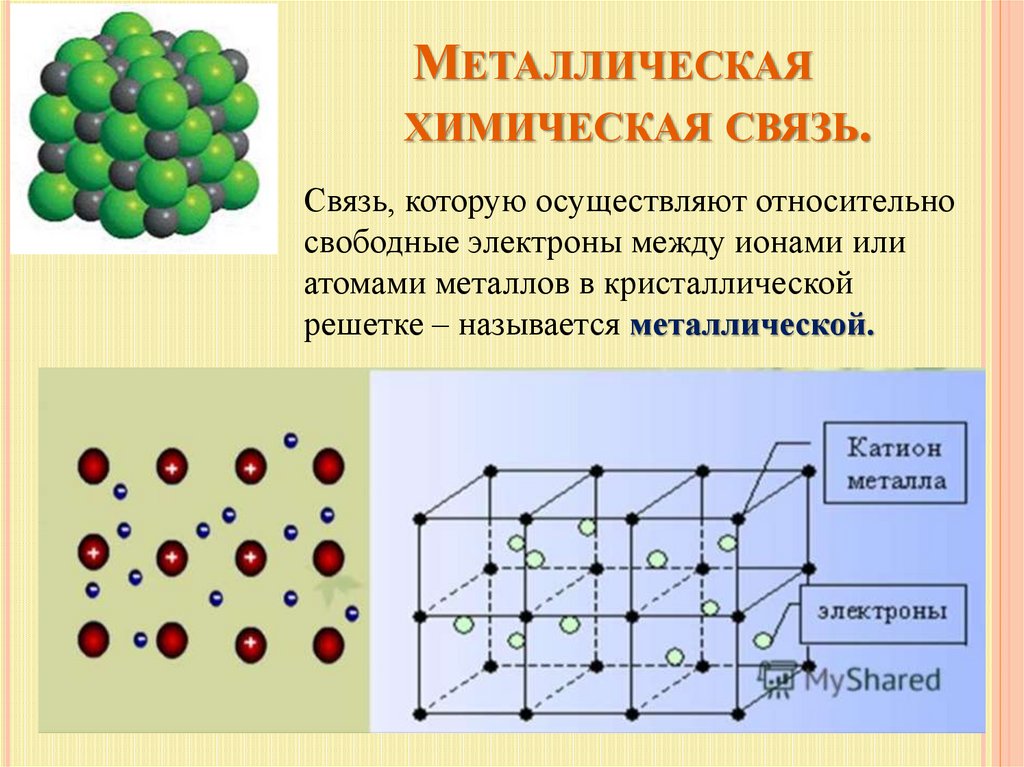
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.