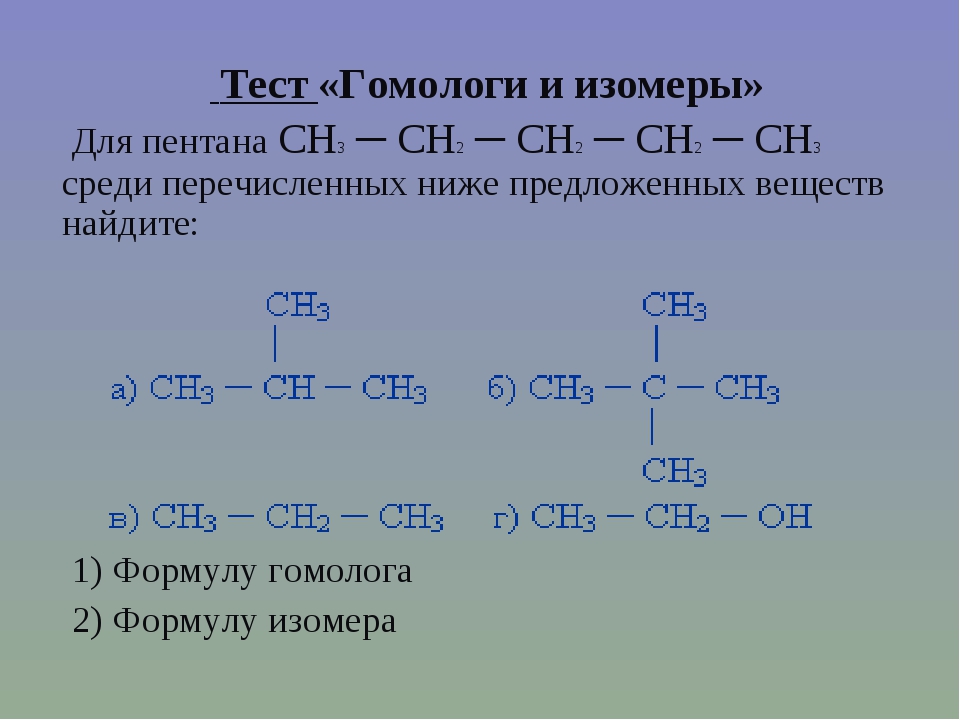
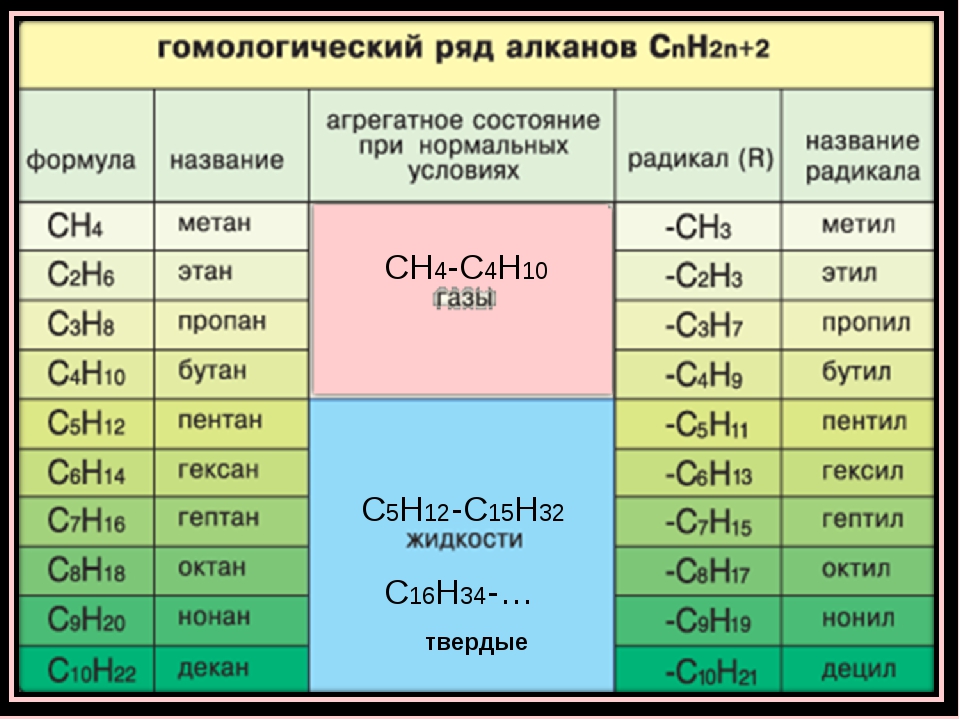
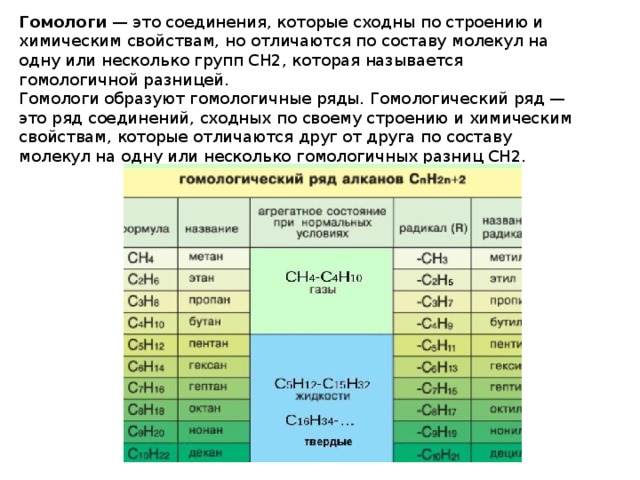
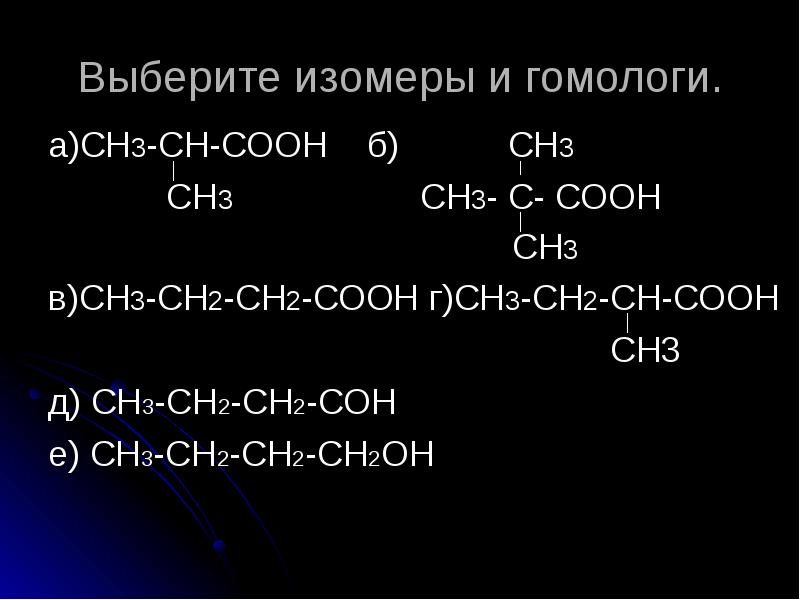
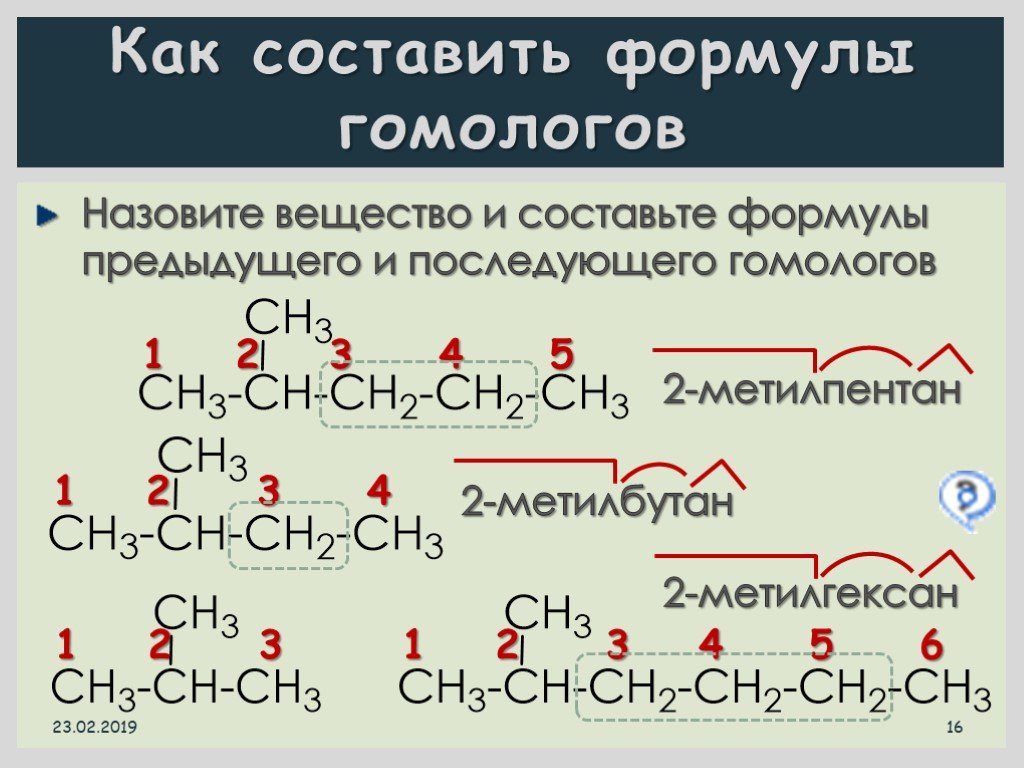
Гомология алкинов

Алкины – это углеводородные химические соединения, несущие в себе тройные связи между атомами C. Они образовывают ряд гомологов с характерной формулой CnH2n-2. Общая особенность положения углеродного атома при тройном количестве связей – состояние sp-гибридизации.
Гомологический ряд алкинов: этин (C2H2), пропин (C3H4), бутин (C4H6), пентин (C5H8), гексин (C6H10), гептин (C7H12), октин (C8H14), нонин (C9H16), децин (C10H18).

Физические свойства алкинов определяются аналогичным образом с алкенами. Например, температура кипения и плавления постепенно возрастает с увеличением длины главенствующей цепи углерода и молекулярной массой. К химическим свойствам можно отнести реакции галогенирования, гидрогалогенирования, гидратацию, полимеризацию. Для алкинов также характерны реакции замещения.
Гомология альдегидов
Альдегиды – ряд соединений органического типа, содержащих в себе альдегидную группу – COH. В веществах данного типа карбоксильная группа взаимосвязана с водородным атомом и одной радикальной группой.

Гомологический ряд альдегидов имеет общую формулу R–COH. Одним из элементарных представителей является формальдегид (H–COH), в нем альдегидная группа связана с H. В других, предельных представителях данного ряда соединений водородный атом заменяется на алкин. Общая формула: CnC2n+1–COH.
Альдегиды рассматриваются в качестве веществ, которые произошли в результате замены в парафиновом углеводородном атоме H на группу альдегидную группу. Для таких химических соединений изомерия и гомология является аналогичной другим производным предельных однозамещенных углеводородов.
Наименование альдегидов составляется в зависимости от названия кислоты с таким же количеством углеродных атомов в молекуле, например: CH3–CHO – уксусный альдегид, CH3CH2–CHO – пропионовый альдегид, (CH3)2CH–CHO – изомасляный альдегид и т. д.
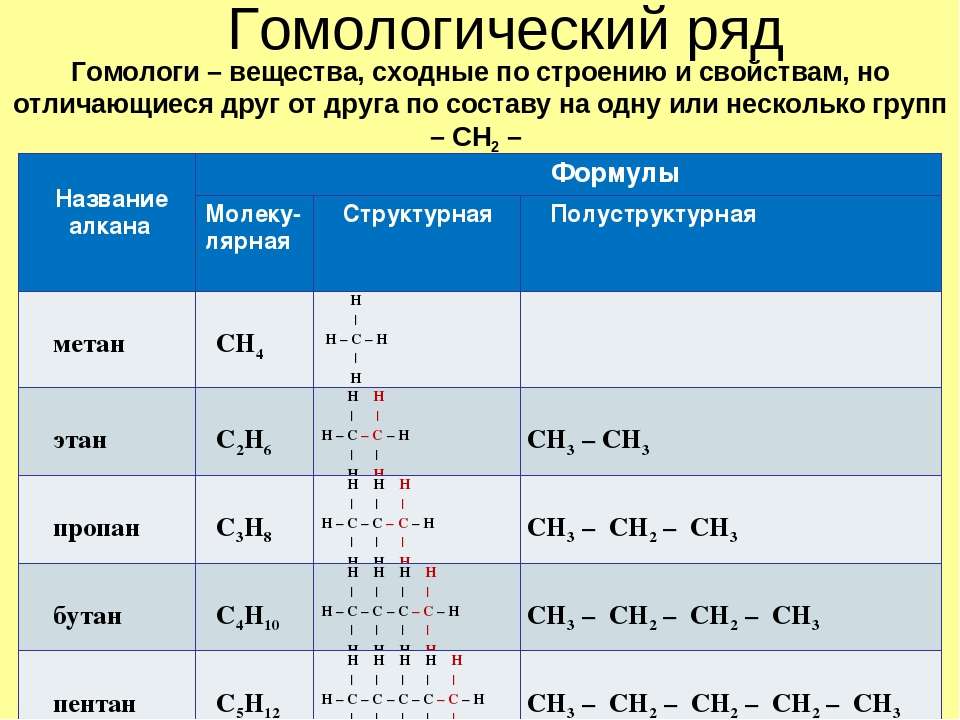
Общие представления о структуре и гомологии соединений
Представление о гомологии веществ в органической химии базируется на понимании того, что как физические, так и химические качественные характеристики веществ могут определяться молекулярной структурой. Свойства гомологических соединений могут зависеть от строения углеродного скелета и функциональной группы определенного соединения.
Определить химические свойства и, следовательно, принадлежность гомолога к конкретному классу возможно по его функциональной группе
В качестве примера можно обратить внимание на карбоксильную группу, которая отвечает за проявление кислых свойств и принадлежность вещества к карбоновым кислотам. Однако определить уровень проявления химических или физически качеств можно, изучая не только функциональную группу, но и углеродный молекулярный скелет
Существуют соединения, в которых углеродные скелеты схожи, иными словами, изомерия в них отсутствует. Такие гомологи записываются следующим образом: X – (CH2)n – Y. Количество метиленовых n-звеньевых единиц является гомологичным и относится к классу соединений одного вида. Подобные виды гомологов являются ближайшими.
Гомологический ряд веществ носит некоторые общие закономерности изменения свойств от младших представителей к старшим. Подобное явление способно нарушаться, что связано с образованием водородной связи при наличии группы, которая может их образовывать.
Гомология в биологии
Гомологический ряд используется в биологии, однако носит несколько иной характер. Н. И. Вавилов открыл закон, в соответствии с которым происхождение видов и даже родов растений, сходных между собой, влечет протекание изменчивости по параллельным путям. Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.

Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:

то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
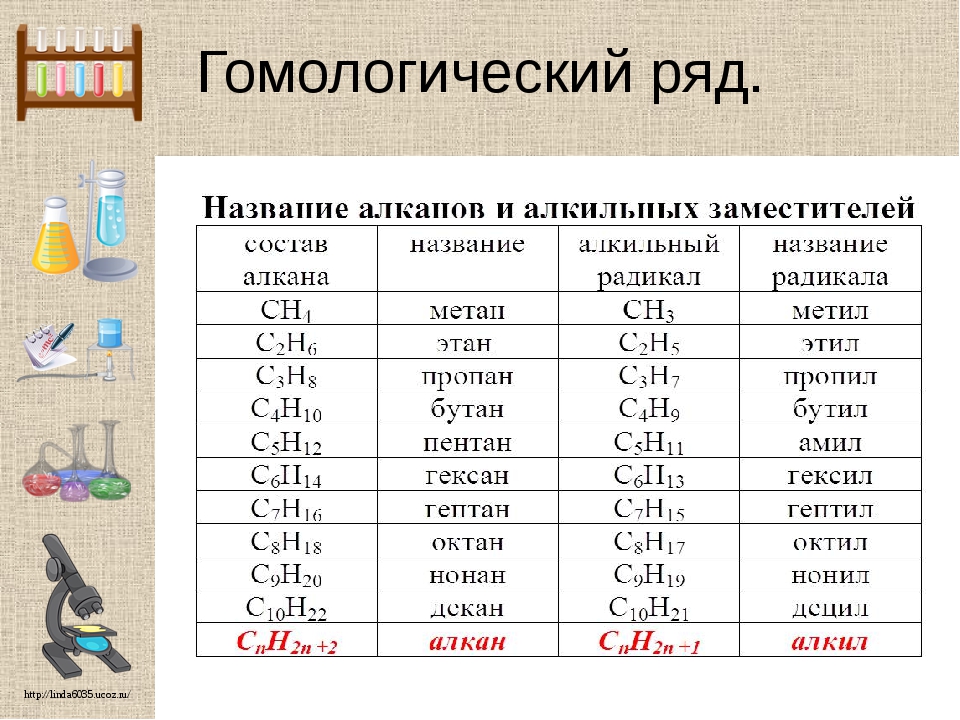
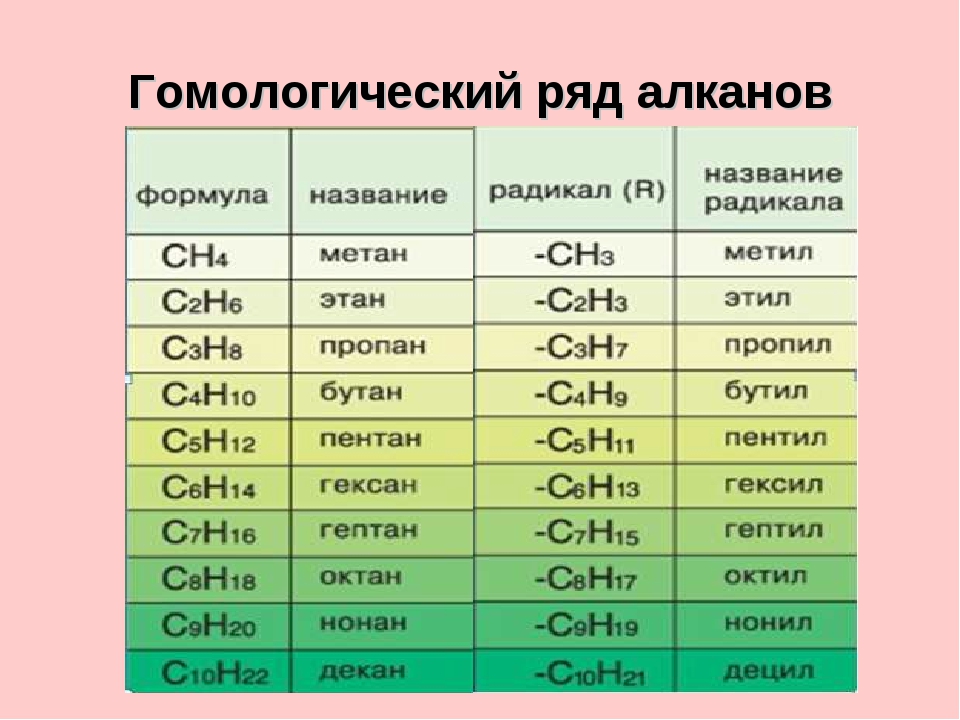
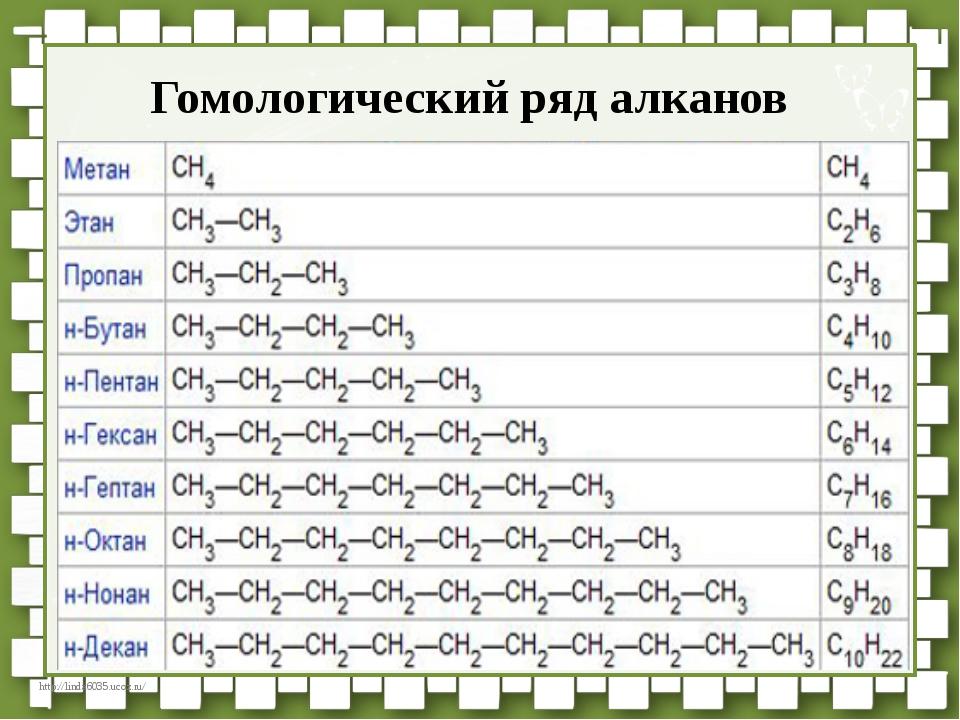
Номенклатура алканов
В названиях алканов используется суффикс -АН.
| Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:

2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.