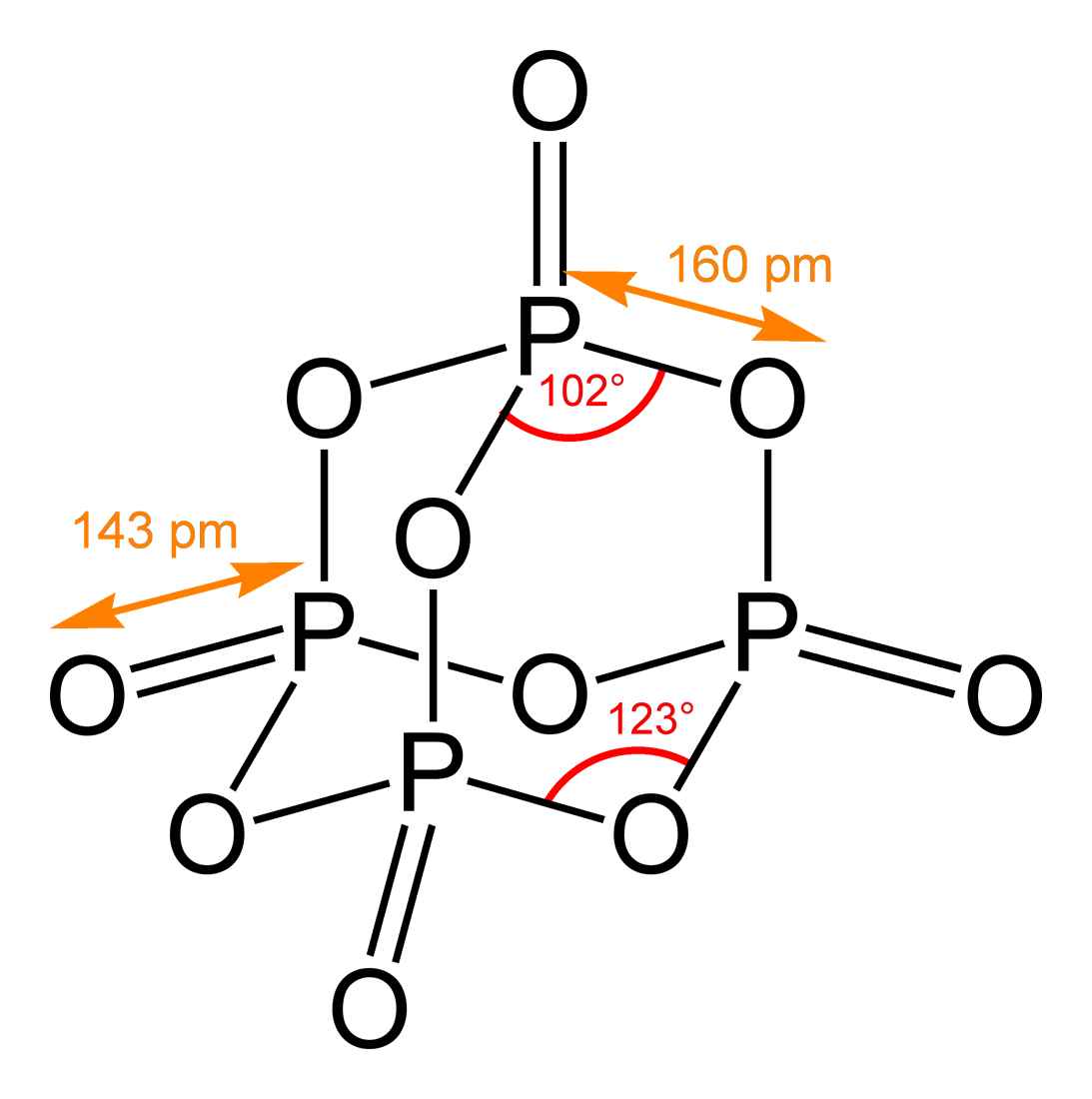
Избыток фосфора в организме человека
Фосфор и фосфаты являются нетоксичными. Летальной дозой для человека считается 60 мг фосфора. Высокой токсичностью обладает ряд соединений фосфора (фосфин). Отравления соединениями фосфора провоцируют нарушения работы почек и печени, сердечно-сосудистой системы, пищеварительного тракта, а также других систем и органов.
Причины избытка фосфора:
- чрезмерное количество поступления фосфора (избыток белков в продуктах)
- употребление большого количества консервированной продукции, лимонадов
- продолжительное взаимодействие с фосфорорганическими соединениями
- нарушения обмена фосфора
Симптомы избытка фосфора:
- отложение малорастворимых фосфатов в тканях
- поражения пищеварительного тракта и печени
- декальцинация костей (остеопороз)
- кровоизлияния и кровотечения
- лейкопения, анемия
Применение фосфора и его соединений. Удобрения.
Область применения соединений фосфора огромна и не представляется возможным дать всеохватывающий ее обзор. Определение А.Е.Ферсмана: «Фосфор – элемент жизни…» находит повсеместное подтверждение. Фосфор – элемент не только биологической жизни, но и повседневной, действительно, фосфорсодержащие соединения используются в сельском хозяйстве, медицине, фармакологии, научных исследованиях, пищевой и химической промышленности, строительстве, металлургии, технике и, наконец, в повседневном быту. Такая ситуация была не всегда, и на протяжении долгого времени после открытия Бранда фосфор оказывался замешанным во многих скверных историях, все началось со спекуляций самого Бранда и его последователей. Далее «таинственные» вспыхивающие надписи на стенах в храмах и «чудо самовоспламенения свечей». Долгое время бытовали предрассудки и суеверия, связанные с «блуждающими» огнями, возникающими иногда над болотами и являющимися следствием самовоспламенения фосфина.
Большинство (80–90%) добываемой фосфатной руды идет на получение удобрений. В 1799 было доказано, что фосфор необходим для нормальной жизнедеятельности растений. Накапливаясь в биомассе, фосфор исчезает из почвы. Ежегодно мировой урожай уносит с полей несколько миллионов тонн фосфора, наряду с азотом и калием, поэтому необходимо возобновление его ресурсов в плодородном слое. В древние времена люди удобряли почву навозом, костями и гуано. Первое искусственное фосфорное удобрение – суперфосфат – было получено в Англии в 1839 Лаузом, а в 1842 там же было организовано его первое промышленное производство. В России первое предприятие по производству суперфосфата появилось в 1868. Сейчас его получают, обрабатывая апатит серной кислотой:
Ca10(PO4)6F2 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF.
Побочно получающийся сульфат кальция не отделяют.
Более ценный продукт – двойной суперфосфат, так как в нем содержится в три раза больше фосфора по массе, его получают обработкой апатита фосфорной кислотой:
Ca10(PO4)6F2 + 14H3PO4 +10H2O = 10Ca(H2PO4)2·H2O +2HF.
Доля производства удобрений, содержащих в своем составе только один фосфор, падает, и все больше производится комплексных удобрений, содержащих два или три питательных элемента. Большая часть фосфорных удобрений, производимых в России, приходится на аммофос, диаммофос и азофоску. Ежегодное мировое производство фосфорных удобрений на начало 21 в. составило 41 млн. тонн, а суммарное количество всех удобрений – 190 млн. тонн. Основными производителями фосфорных удобрений являются Марокко, США и Россия, а основными потребителями – страны Азии, Латинской Америки и Западной Европы.
Необходимый состав вносимого удобрения и его эффективность зависят от характеристик почвы, например, рН, но растворимость фосфатных удобрений определяет время, за которое происходит его усвоение растениями, и долю усвоенного фосфора, которая обычно мала и составляет около 20%.
Юрий Крутяков
Фосфор в продуктах

В составе почти всех продуктов присутствует фосфор. Но наибольшее количество фосфора наблюдается в продуктах животного происхождения. К ним относится, как мясо, рыба и птица, так и яйца, молоко и приготовленные на их основе йогурты, сыры и др. Поступая в организм вместе с пищей, данный микроэлемент в большей части усваивается в виде неорганических соединений. Примечательно, что фосфор, полученный из продуктов животного происхождения, усваивается намного легче, чем микроэлемент, содержащийся в растительной пище.
По количеству больше всего фосфора содержится в сухих дрожжах. Здесь на 100 г продукта приходится 1290 мг фосфора. Примерно такое же количество микроэлемента отмечается в пшеничных отрубях, тыквенных семенах и ряде других растительных продуктов. Вторыми по объему содержащегося фосфора являются молочные продукты. Так, в 100 г сыра содержится приблизительно 600 мг микроэлемента. Такой показатель может варьироваться в зависимости от сорта сыра. Вместе со 100 г творога организм получает 500 мг фосфора, с кефиром – 140 мг, а с молоком 90 мг. Стоит отметить, что включение в ежедневный рацион молочных продуктов является наилучшим решением, поскольку кроме фосфора в них содержится большое количество кальция. Третье место по количественному содержанию фосфора занимают рыба и морепродукты. В рыбе имеется высокий процент фосфора, кальция, железа.
Как упоминалось ранее, фосфор содержится в составе почти всех продуктов питания, наполняющих ежедневный рацион человека. Максимально без вреда здоровью в сутки можно употреблять до 5000 мг данного микроэлемента
При этом важно учитывать, что попадая в организм, вещество усваивается не полностью:
- больше всего фосфора организм получает из молочных продуктов;
- примерно 60-70% микроэлемента поступает при употреблении в пищу мясных и морепродуктов;
- из общего содержания фосфора в растительной пище организмом усваивается всего около 20%.
При составлении своего рациона необходимо учитывать не только присутствие в нем достаточного количества фосфора. Нельзя также забывать о кальции
Важно, чтобы объем поступающего в организм кальция не превышал объем фосфора. Чтобы в оптимальном объеме в организм поступал кальций и фосфор, необходимо правильно подбирать продукты для своего рациона
Идеальным решения является включение в ежедневное меню жирного творога, фундука, свеклы, моркови, капусты. Говяжья печень, грецкие орехи, фасоль, овсянка, гречневая и пшеничная каша, а также черная икра – отличные источники фосфора для организма.
Пищевая промышленность сегодня также активно использует фосфор. Многие его соединения позволяют придать продуктам более привлекательный внешний вид. Фосфаты, к примеру, используются в колбасном производстве. С их помощью производители связывают лишнюю жидкость в продукции, обеспечивают однородную ее структуру, плотность и сочность. Использование фосфатов актуально в изготовлении мясной и рыбной консервации, заводском сливочном масле, маргарине, плавленых сырках и всего того, что непременно входит в рацион каждого современного человека. С помощью различных соединений фосфора производители могут:
- заменять фосфатами подкислители в составе сладких газировок, слабоалкогольных напитков и кондитерской продукции;
- избегать образования твердых кристаллов в сгущенном молоке;
- исключать вероятность образования комков в таких порошковых добавках, как сухое молоко, какао, сливки и др.;
- добиваться однородной мягкой консистенции при производстве плавленых сырков;
- ускорять растворение сухих смесей при изготовлении мороженого и других такого плана продуктов;
- увеличивать сохранность маргарина и сливочного масла;
- повышать плотность консервированных овощей-фруктов;
- осветлять сахар и т.д.
Фосфор в продуктах современной промышленности содержится в чрезмерном количестве. И это способно нанести существенный вред здоровью. В норме количество поступающего в организм фосфора и кальция должно быть примерно одинаковым. Максимально допустимым считается потребление 1,5 части Р и 1 части Са. Чтобы избежать употребления чрезмерного объема фосфора, состав продуктов необходимо изучать наиболее внимательно
При этом следует обращать особое внимание на присутствие в составе:
- ортофосфорной (фосфорной) кислоты, обозначаемой кодом Е338;
- фосфатов натрия – Е339;
- фосфатов калия, представляемых как добавка Е340;
- фосфатов кальция, указываемых на этикетках как Е341;
- фосфатов аммония – Е342;
- и, наконец, фосфатов магния под кодом Е343.
Суточная норма фосфора для взрослых и детей
В норме ежедневная потребность в фосфоре для здорового мужчины составляет примерно 1,5 тысячи мг. При занятиях спортом или тяжелой физической работой суточная норма может удваиваться. Женщине требуется на 200 мг фосфора меньше. В период вынашивания плода, лактации – норма возрастает почти до 4000 мг.
Проблемы с зубами – первый сигнал о недостатке фосфора в организме. Отдельного внимания заслуживает остеопороз, требующий индивидуального увеличения суточной нормы микроэлемента витаминно-минеральными комплексами и специальными медикаментами. Все действия строго согласовываются с врачом и требуют предварительной лабораторной оценки.
Суточная норма фосфора для детей составляет по возрастам:
- в первые дни после рождения – 125 мг;
- до 6 месяцев – 405 мг;
- до года – 510 мг;
- до 3 лет — 805 мг;
- до 8 лет — 1010 мг;
- до 18 — 1310 мг.
Лучший способ обеспечить норму – грудное вскармливание. В молоке матери присутствует идеально сбалансированный набор макро- и микроэлементов. В идеале кормление грудью должно быть не менее двух лет. При этом нормы оптимума выглядят следующим образом:
- у детей до месяца – не более 111 мг/сутки;
- до полугода – не менее 400;
- до года – 501;
- в 3 года – не менее 701;
- до 7 лет – не более 901;
- 14 лет – не менее 1101.
У женщин в 16 лет – 1201 мг/сутки; у мужчин – 1401единица. В остальном генедерных различий нет: до 18 – 1301 мг/сутки, старше – 1201. В период гестации и лактации – до 1500 единиц.
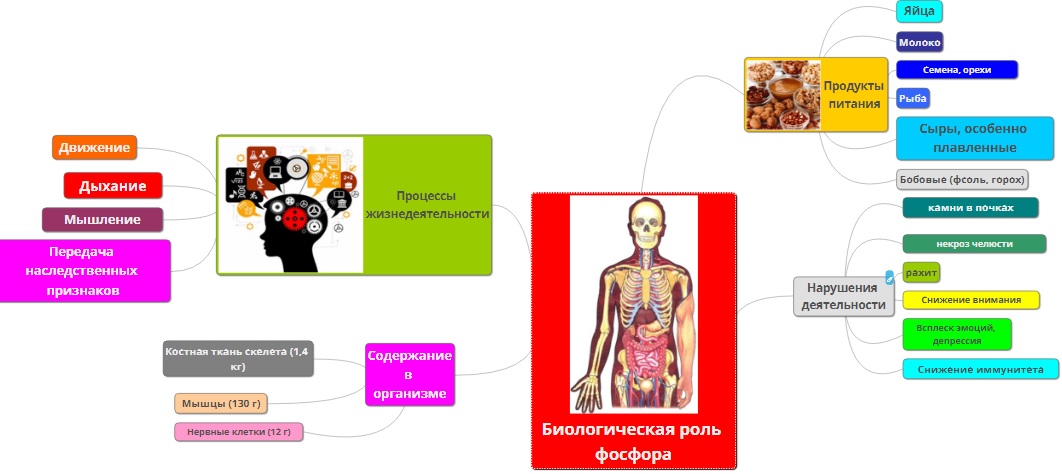
Биологическая роль соединений фосфора
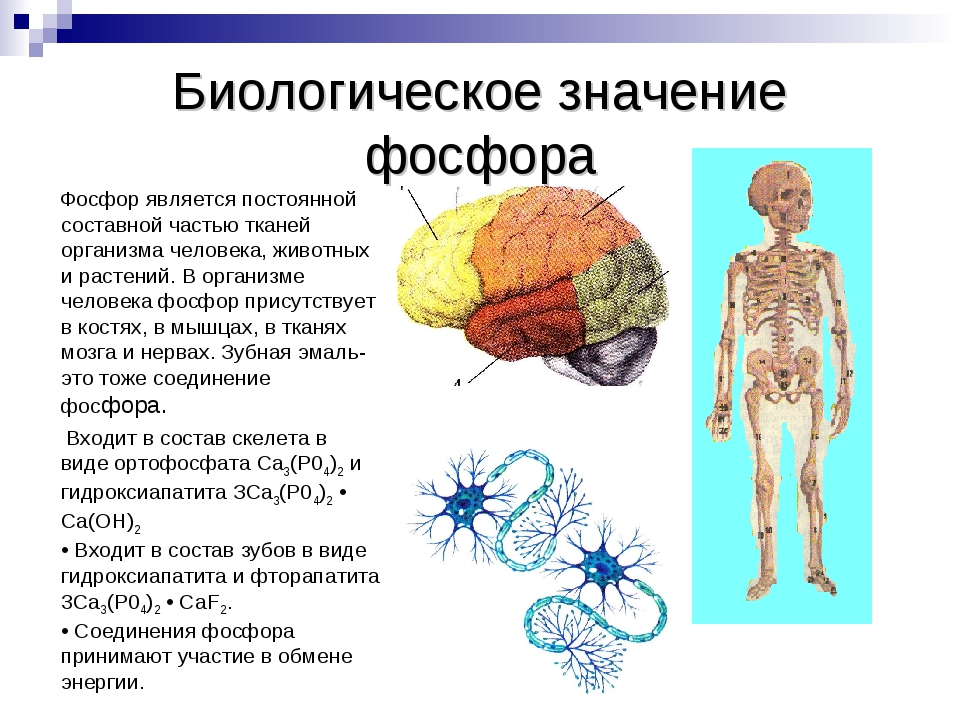
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
| Продукт | Содержание, мг/100 г |
|---|---|
| Очищенное конопляное семя | 1650 |
| Семена тыквы (ядра) | 1233 |
| Семена подсолнечника (ядра) поджаренные | 1158 |
| Семена мака | 870 |
| Горчичный порошок | 828 |
| Кунжут (очищенный) | 774 |
| Семена дыни (ядра) | 755 |
| Какао-порошок | 734 |
| Твёрдый пармезан | 694 |
| Семена подсолнечника (ядра) сушеные | 660 |
| Сафлора семена (ядра) | 644 |
| Семена льна | 642 |
| Семена лотоса | 626 |
| Сыр швейцарский нежирный | 605 |
| Кешью сырые | 593 |
| Орехи пили | 575 |
| Амарантовая крупа | 557 |
| Сыр гауда | 546 |
| Овёс | 523 |
| Грецкий орех чёрный | 513 |
| Печень говяжья тушеная | 497 |
| Фисташки сырые | 490 |
| Миндаль | 481 |
| Киноа | 457 |
| Люпин, семена | 440 |
| Карп | 415 |
| Фасоль | 407 |
| Арахис | 397 |
| Сыр рокфор | 392 |
| Мука из цельного зерна | 357 |
| Печень куриная | 297 |
| Вырезка свиная | 286 |
| Желтоперый тунец | 278 |
| Сгущенное молоко | 253 |
| Яйцо | 198 |
| Говядина | 188 |
| Курица | 178 |
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды.
ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³ .
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой (<15 мг/кг) токсичности большинство фосфорорганических соединений (ФОС) используются в качестве пестицидов (инсектициды, акарициды, зооциды и т. д.) или боевых отравляющих веществ. Примером боевых отравляющих веществ являются — зарин, зоман, табун, V-газы.
ФОС проявляют свойства веществ нервно-паралитического действия. Токсичность фосфорорганических соединений обусловлена ингибированием фермента ацетилхолинэстеразы, вследствие чего развивается головная боль, тошнота, головокружение, сужение зрачков (миоз), затруднение дыхания (отдышка), возникает слюнотечение, понижается артериальное давление, возникают конвульсии, проявляется паралитическое воздействие, кома, и как следствие может быстро возникнуть летальный исход. Эффективным антидотом при отравлении ФОС является атропин.
Биохимия фосфора и его значение в питании человека.
Жизнь не может существовать без фосфора, этот элемент необходим как субмикроскопическим частицам – вирусам, так и высокоорганизованным живым системам – животным и человеку.
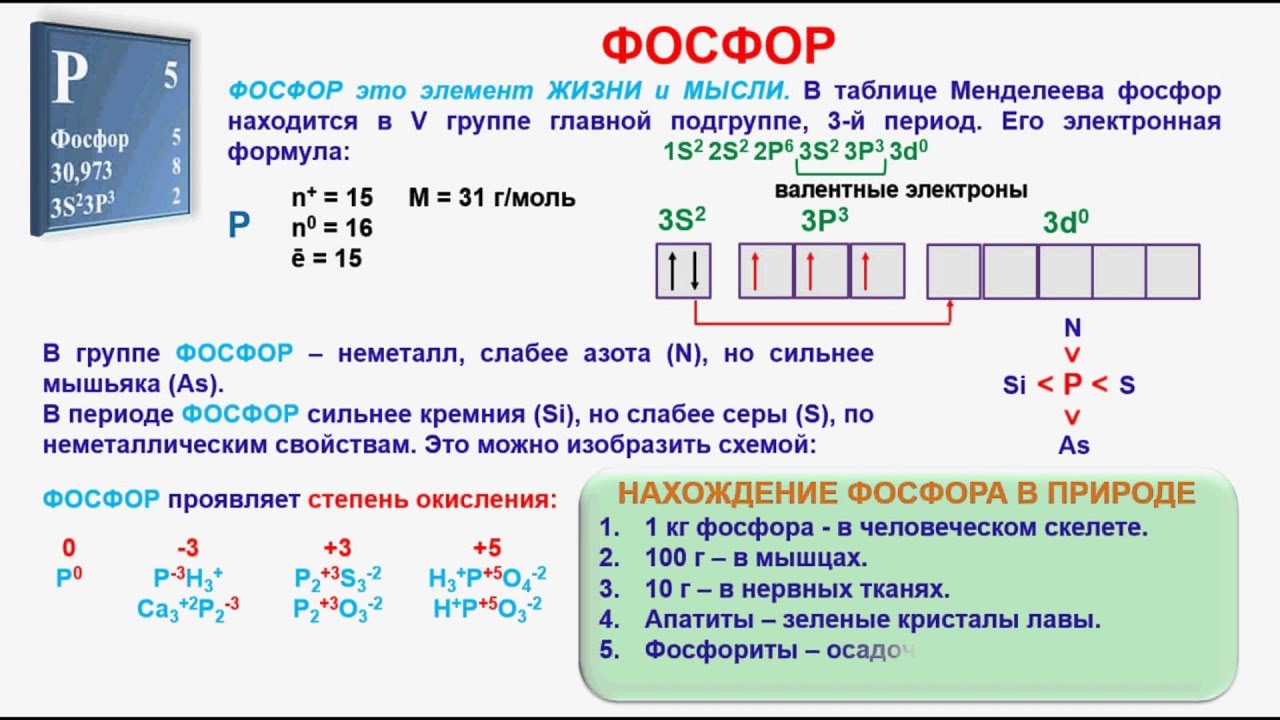
Фосфор – шестой по содержанию элемент в организме человека после кислорода, водорода, углерода, азота и кальция. Количество фосфора составляет 1–1,5% от массы тела.
Можно выделить несколько важнейших функций, выполняемых соединениями фосфора в организме человека:
Рост и поддержание целостности костной ткани и зубов. В костях содержится примерно 85% от общего количества фосфора (в виде гидроксиапатита) в организме.
Участие в катаболических и анаболических реакциях. Особенно важны содержащие фосфор коферменты – низкомолекулярные вещества небелковой природы, действующие в составе ферментов и необходимые при специфических каталитических превращениях. Некоторые коферменты многим хорошо известны – это аденозинтрифосфат (АТФ), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН), пиридоксальфосфат, тиаминпирофосфат, кофермент А и другие. Каждый кофермент выполняет определенную функцию в клетке. Напрмер, гидролиз АТФ до АДФ – реакция, при сопряжении с которой потенциально эндергонические реакции(с поглощением энергии) превращаются в экзергонические (с выделением энергии), что необходимо при осуществлении важнейших биохимических процессов.
Служит предшественником в синтезе фосфолипидов – эфиров фосфорной кислоты и липидов (содержат остатки глицерина или сфигнозина, жирных кислот и фосфорной кислоты). Фосфолипиды обладают интересной особенностью – растворяются как в воде (за счет фосфата), так и в масле (за счет углеводородного остатка жирной кислоты) и эта характерная черта делает их важным компонентом клеточных мембран, так как такая структура оболочки позволяет проникать внутрь клетки (или из нее) как водо-, так и жирорастворимым питательным веществам.
Служит предшественником в синтезе ДНК и РНК. Эти носители генетической информации были впервые выделены в 1869 Мишером и названы им нуклеином. Мишер установил содержание значительного количества фосфора в нуклеине. ДНК и РНК представляют собой двухцепочечные спирализованные полимерные молекулы. Остов их образован остатками пентоз (дезоксирибозы для ДНК и рибозы для РНК) и фосфата
Важность фосфора в сохранении целостности РНК и ДНК была подтверждена на опытах с фагами (вирусами, заражающими клетки бактерий), меченными радиофосфором. Их назвали фагами-самоубийцами, так как по мере распада радиоактивного фосфора, структура нуклеиновой кислоты повреждалась настолько, что это становилось летальным для вируса
Участвует (около 1% P в организме) в создании буферной емкости жидкостей и клеток тела. И этим все сказано.
Во всех живых организмах элемент № 15 находится исключительно в виде ортофосфат-аниона или органических эфиров фосфорной кислоты (фактически в виде неорганического фосфата), поэтому, наряду с термином «фосфор», при обсуждении биологической роли элемента, часто используют понятие «неорганический фосфат».
Значение фосфатов в питании человека огромно. Практически весь фосфор усваивается организмом человека в виде неорганических фосфатов, в среднем всасывается около 70% потребляемого с пищей фосфора. Суточная потребность в элементе для беременных и кормящих женщин составляет 1500 мг, для детей 2–6 лет 800 мг, детей 10–12 лет – 1200 мг, взрослого человека 800 мг.
В силу распространенности фосфатов в природе, обычный дневной рацион взрослого человека содержит фосфора в 7–10 раз больше суточной потребности в нем, поэтому встречаться со случаями недостаточного поступления этого элемента в организм приходится очень редко. Важнее правильное сочетание в рационе кальция и фосфора, ведь образование костной ткани связано с обоими этими элементами. Замечено, что если организм испытывает недостаток кальция, то, как правило, тут же обнаруживается переизбыток фосфора, и наоборот. Детальные исследования позволили установить, что оптимальная суточная норма фосфора, поступающего с продуктами питания, эквивалентна таковой для кальция, то есть пища должна содержать одинаковые количества по массе фосфора и кальция (исключение – норма для грудных детей). Ниже приводятся некоторые примеры содержания фосфора и кальция в обычной пище:
| Продукт | Ca, мг/100г | P, мг/100г | Ca/P |
| Жареная говядина | 12 | 250 | 0,05 |
| Цельное молоко | 118 | 93 | 1,26 |
| Вареная фасоль | 50 | 37 | 1,35 |
| Жареная треска | 31 | 274 | 0,11 |
| Пшеничный хлеб | 84 | 254 | 0,33 |
| Картофель | 7 | 53 | 0,13 |
| Яблоки | 7 | 10 | 0,70 |
| Яйцо куриное | 54 | 205 | 0,26 |
Известны и некоторые заболевания, связанные с избытком неорганического фосфата в пище.
Начнем с истории
В истории химических элементов фосфор занимает совершенно уникальное место. Как-никак, а это первый химический элемент, который имеет точную дату открытия. Удивительно, но эту дату мы знаем точнее, чем даты рождения и смерти его первооткрывателя, немецкого алхимика Хеннига Бранда, который родился где-то около 1630 года, а умер то ли около 1692, то ли около 1710… Зато мы точно знаем, что в 1669 году этот человек, сначала бывший солдатом во время Тридцатилетней войны, но благоразумно решивший, что быть врачом и алхимиком безопаснее, решился на попытку добыть философский камень из мочи. Ибо другие варианты, видимо, уже были исчерпаны до него. Ну и гомеопатический принцип подобия (впрочем, гомеопатии-то как раз тогда не было еще): в золото может превращать нечто золотистого цвета. А что плохо пахнет – ну так можно несколько дней отстоять, чтобы запах ушел. Потом эту мочу можно кипятить до состояния пасты. Тоже желтого цвета. Вот как раз нагревая эту пасту (фактически, кипятя ее несколько часов), у Бранда внезапно получилось некоторое белое вещество, похожее на воск, которое ярко светилось в темноте.
Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.
Так был открыт phosphorus mirabilis, «чудесный носитель света». Или белый фосфор. 14 октября 1680 года датируется получение фосфора тем же способом Робертом Бойлем. В российских источниках пишется, что это открытие было независимым, однако мы знаем, что сначала Бранд попытался сохранить свой рецепт в тайне, но затем продал его некоему Д. Краффту из Дрездена, который встречался с Робертом Бойлем… В общем, пошло-поехало, и секрет белого фосфора растекся по Европе. Кстати, именно Бойль использовал впервые белый фосфор, 13-й химический элемент, известный человечеству, для того, чтобы зажечь деревянные палочки с серными наконечниками – предтечи современных спичек.
Роберт Бойль
Нужно сказать, что именно фосфор часто становится первым элементом, на котором знакомятся с аллотропией – существованием разных форм простого вещества одного и того же химического элемента. Но сначала – немного об исторически первой аллотропной модификации.
Свечение белого фосфора
Роль фосфора в организме человека
Фосфор находится в организме человека в качестве органических и неорганических соединений. Наибольшее количество нутриента (примерно 90 % от всей массы) содержит костные ткани и зубная эмаль. Там он представлен фторапатитом и гидроксиапатитом. Около 10 % нутриента содержится в различных жидкостях, участвующих во внутренних процессах организма. А в теле человека находится всего 1 % фосфорсодержащих веществ.
На фосфор возложено несколько важных функций, выполнение которых влияет на состояние всего организма:
- Фосфор вместе с другими нуклеотидами переносит энергию и предает генетическую информацию, а также отвечает за процесс регуляции секреции. Кроме того, без нутриента не происходит становление нейронных связей.
- Нутриент участвует в процессах построения костных тканей и зубной эмали, входит в состав каждой клетки человеческого тела.
- Фосфор запускает процессы фосфорилирования, без которых не происходит синтез белка. Активация химических реакций позволяют перестроить молекулы белка, для получения иных питательных веществ. Таких, как коферменты, ферменты и витамины.
- Нутриент активизирует процессы роста и деления клеток, а также отвечает за передачу генов.
- Без фосфора не происходит усвоение глюкозы, а также белковый и углеводный обмен.
- Активизирует работу различных ферментов.
- Нутриент поддерживает оптимальное состояние буферной системы, на уровне pH. Кроме того, фосфор имеет непосредственное отношение к кальциевому обмену.
- Без фосфора не происходит мышечное сокращение, рост клеток мозговых и нервных.
- Нутриент обеспечивает правильную работу почек, защищает организм от развития остеопороза и болезней, связанных со стрессом.
Организм человека получает фосфор через пищу как растительного, так и животного происхождения. Элемент представленный в виде фосфатов, фосфолипидов и белка, проходит несколько этапов усвоения, попадая в организм человека с продуктами питания. За всасывание нутриента отвечает тонкий кишечник, до 90 % от общей массы потребляемого фосфора усваивается именно там.
На процесс усвоения влияет наличие витамина D и специальный гормон паратирин, выделяемый из паращитовидных желез. За аккумуляцию фосфорсодержащих веществ отвечает печень. Она же переносит необходимое количество нутриента в кровь, а также проводит все процессы фосфорилирования.
Выделительные процессы происходят в кишечнике и почках, из организма нутриент выводиться в виде неорганических солей. Гормон паратирин позволяет выводить фосфор с мочой, а кальцитонин усиливает выделительный процесс нутриента со стулом. За регуляцию концентрации нутриента отвечает инсулин. Этот гормон, при возникновении необходимости, может как увеличить, так и уменьшить уровень фосфора в крови. По сути он выполняет роль транзита доставляя нутриент к клеткам.
Наука обнаружила связь между обменными процессами фосфора и кальция. Их грамотное соотношение обеспечивает правильное развитие костной структуры. По мнению ученых, оптимальным является соотношение 2:3. Если доза одного из нутриентов возрастает, то другой элемент начинает активно выводиться из организма через почки. В случае недостатка фосфора, организм запускает процесс саморегуляции.
Однако он достаточно опасен, так как доза нутриента увеличивается за счет костных тканей. Организм начинает вымывать из костей и зубов фосфор и использовать для обеспечения функционирования различных процессов. Подобное состояние, продолжающееся на протяжении длительного времени, может спровоцировать различные заболевания костей и зубов.
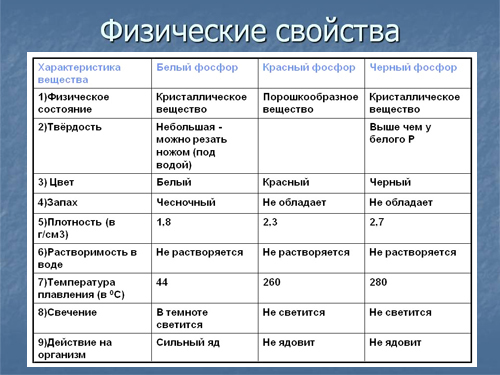
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
-
- 4P+5O2→2P2O5{\displaystyle {\mathsf {4P+5O_{2}\rightarrow 2P_{2}O_{5}}}} (с избытком кислорода)
- 4P+3O2→2P2O3{\displaystyle {\mathsf {4P+3O_{2}\rightarrow 2P_{2}O_{3}}}} (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
-
- 2P+3Ca→Ca3P2{\displaystyle {\mathsf {2P+3Ca\rightarrow Ca_{3}P_{2}}}}
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
-
- 2P+3S→P2S3{\displaystyle {\mathsf {2P+3S\rightarrow P_{2}S_{3}}}}
- 2P+5Cl2→2PCl5{\displaystyle {\mathsf {2P+5Cl_{2}\rightarrow 2PCl_{5}}}}
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
-
- Ca3P2+6H2O→2PH3+3Ca(OH)2{\displaystyle {\mathsf {Ca_{3}P_{2}+6H_{2}O\rightarrow 2PH_{3}+3Ca(OH)_{2}}}}
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
-
- 8P+12H2O→>500oC 5PH3+3H3PO4{\displaystyle {\mathsf {8P+12H_{2}O{\xrightarrow {>500^{o}C}}\ 5PH_{3}+3H_{3}PO_{4}}}}
-
- 2P+8H2O→700−900oC,kat 2H3PO4+5H2{\displaystyle {\mathsf {2P+8H_{2}O{\xrightarrow {700-900^{o}C,kat}}\ 2H_{3}PO_{4}+5H_{2}}}}
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
-
- 4P+3KOH+3H2O→ τ PH3+3KH2PO2{\displaystyle {\mathsf {4P+3KOH+3H_{2}O{\xrightarrow {\ \tau \ }}PH_{3}+3KH_{2}PO_{2}}}}
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
-
- 3P+5HNO3+2H2O→3H3PO4+5NO{\displaystyle {\mathsf {3P+5HNO_{3}+2H_{2}O\rightarrow 3H_{3}PO_{4}+5NO}}}
- 2P+5H2SO4→2H3PO4+5SO2+2H2O{\displaystyle {\mathsf {2P+5H_{2}SO_{4}\rightarrow 2H_{3}PO_{4}+5SO_{2}+2H_{2}O}}}
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
-
- 6P+5KClO3→5KCl+3P2O5{\displaystyle {\mathsf {6P+5KClO_{3}\rightarrow 5KCl+3P_{2}O_{5}}}}
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.