Основные сферы использования фосфатов
Ниже поговорим о том, где и зачем используют фосфаты.
Моющие средства

В состав стиральных порошков, средств для мытья посуды и других детергентов фосфаты вводятся в первую очередь как комплексообразователи, так как они растворяясь в воде способны связывать ионы кальция и магния в комплексные соединения, тем самым предупреждая образование накипи и улучшая действие более дорогих поверхностно-активных веществ.
Триполифосфат натрия пожалуй является самым распространенным компонентом детергентов или моющих средств. Он добавляется в бытовую химию в качестве комплексообразователя и буфера. Помимо этого пирофосфаты, в частности триполифосфаты натрия и калия способны хорошо эмульгировать жиры. В разных моющих средствах эта группа веществ, а преимущественно триполифосфат натрия может содержаться в количестве до 30%.
Также в моющих средствах иногда используются нерастворимые фосфаты в качестве абразивов. Это преимущественно нерастворимые фосфаты щелочных и щелочноземельных металлов.
Моющие средства действительно являются важной составляющей антропогенного влияния на окружающую среду. В рецептурах моющих средств может быть до 35% триполифосфата натрия, т.е до 20% в пересчете на P2O5 и 2,8% фосфора
В большинстве стран Европы применение моющих средств с фосфатами запрещено или сокращено до критически минимальных значений.
Удобрения

Широко используются три наименования фосфорных удобрений.
- Фосфоритная мука — это порошок серого или бурого цвета, который не совсем не растворяется в воде, и почти не реагирует на слабые кислоты. Удобрение состоит преимущественно из ортофосфата кальция Са3(РО4)2 и Са3(РО4)2•CaCO3. Это удобрение эффективно только на кислых грунтах или если в почву параллельно вносятся кислотные удобрения. Пожалуй с экологической точки зрения оно является самым безопасным для окружающей среды, поскольку высвобождается медленно и минимально поступает в воде. Но одновременно этот момент является негативным для сельскохозяйственной промышленности.
- Суперфосфат получается воздействием серной кислоты на фосфориты или фосфорную муку. В результате реакции получается дигидрофосфат кальция Са(Н2РО4)2. Это удобрение довольно медленно усваивается, при этом и более активно выделяется в почву. Стоит отметить, что удобрение содержит до 50% CaSO4 (гипса), который выполняет роль балластного вещества.
- Двойной суперфосфат получается при обработке фосфоритов фосфорной кислотой. В данном случае содержание активного вещества выше, вместе с ним выгоднее использование в качестве удобрения и больше вреда для окружающей среды.
- Преципитат натрия — это концентрированное удобрение CaHPO4•2H2O, которое содержит не менее 27% P2O5.
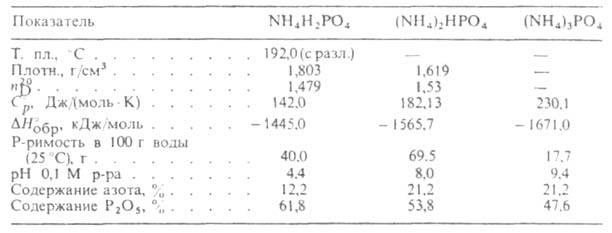
- Концентрированное азотно фосфорное удобрение, которое получается нейтрализацией фосфорной кислоты аммиаком.
2H3PO4 + 3NH3 = NH4H2PO4 + (NH4)2HPO4
Это удобрение хорошо растворимо в воде, вследствие чего имеет кардинальное влияние на окружающую среду.
Другие сферы использования
Фосфаты широко используются в пищевой промышленности. В частности в мясной продукции для обеспечения снижения массы продукта и консервирующих свойств.
Фосфаты в котловой воде присутсвуют для того чтобы минимизировть образование накипи
В зубных пастах применяется натрий монофторфосфат, он распадается с выделением фторидов для защиты эмали.
Чем вредны фосфаты для человека
Как мы уже разобрались, без фосфатов невозможна жизнь человека на нашей планете. Это, безусловно, так, но есть одно «но»! Современная промышленность применяет соли фосфорной кислоты буквально везде, что в конечном итоге приводит к избытку этих минеральных веществ в организме человека. Анализ рациона современного человека показал, что на сегодняшний день каждый из нас получает дозу фосфатов, превышающих допустимую норму в 7–10 раз!
Такое избыточное содержание фосфатов неминуемо приводит к смещению баланса фосфора и кальция в организме, который в идеале должен находиться в соотношении 1:1. Чтобы восстановить соотношение, организм начинает забирать недостающий кальций из ближайших источников, в частности, из костей и зубов. Все это вызывает ослабление костной ткани и развитие серьезных заболеваний (у детей – рахит, у взрослых – остеопороз). Именно по причине избыточного количества фосфатов кости человека становятся ломкими и он все чаще подвергается переломам. Это подтверждают и научные исследования, говорящие о том, что более 60% подростков в возрасте до 14 лет имеют низкую плотность костной ткани.
Со временем проблема затрагивает и нервную систему. Особенно это касается подростков, у которых на фоне избытка данных веществ развивается импульсивность, моторное беспокойство, гиперактивность, агрессивность и нарушение концентрации внимания. Еще одним симптомом дисбаланса кальция и фосфора становится нарушение сна, в частности проблемы с засыпанием у подростков. Родители склонны считать такие изменения в психике ребенка наступлением «переходного возраста», в то время как достаточно изменить рацион питания, чтобы подросток стал таким, как прежде!
В результате недавних исследований выяснилось, что чем больше фосфатов находится в крови, тем выше риск инфаркта и возрастает смертность от сердечных болезней. Под действием избытка фосфора развивается кальцификация – отложение на стенках сосудов плотных бляшек из кальция. Опыты на животных показали, что избыток этих веществ в пище негативно влияет на развитие плода и приводит к патологии легких и печени.
Излишки фосфора выводятся из организма почками, а при развитии болезней почек, этот процесс накопления избытка в организме фосфора ускоряется.
Фосфаты в спорте[править]
Влияние фосфатов кальция и натрия на энергетический метаболизм и спортивные показатели начало изучаться еще несколько десятилетий назад. Предполагается, что прием фосфатов способен повлиять на уровень энергозатрат организма, тем не менее, исследования в этой области весьма устарели. Одна из таких устаревших работ проделана Кацюбо-Училко (Kaciuba-Uscilko) и соавт., которые установили, что прием фосфатов во время четырехнедельной программы по снижению веса способствовал ускорению метаболизма в состоянии покоя (RMR), а также увеличил дыхательный коэффициент (увеличив утилизацию углеводов и расход энергии) во время велосипедных упражнений.
Кроме того, Назар (Nazar) и соавт. отмечают, что прием фосфатов на протяжении 8-недельной программы по снижению веса увеличил скорость метаболизма в состоянии покоя (RMR) на 12-19% и предотвратил снижение уровня гормонов щитовидной железы. Итак, результаты этого исследования показывают, что фосфаты способны изменять RMR, оказывая влияние на выработку гормонов щитовидной железы.
Тем не менее, дальнейшие исследований в этой области не проводились, а значит нельзя с уверенностью утверждать, что прием фосфатов способствует снижению веса.
Как бороться с избытком фосфатов в организме
Традиции питания людей, проживающих на постсоветском пространстве, таковы, что мы едим больше мяса, чем молочной продукции, а значит, фосфора в наш организм поступает больше, а вот кальция всегда не хватает. Но производители не решают, а лишь усугубляют проблему. К примеру, в 100 г куска говядины содержится примерно 200 мг фосфора, однако на деле, 100 г порция мяса, обработанного фосфатами, содержит сразу 100 мг фосфатов! И это лишь увеличивает баланс фосфора и кальция. А что будет, если запить такой мясной бифштекс бутылочкой «Кока-Кола», дающей организму 40–50% суточной нормы фосфора в день?
А ведь если разобраться, ГОСТа, который бы регламентировал количество фосфатов в продуктах питания, на сегодняшний день не существует. Это значит, что производители и дальше будут «пичкать» этими веществами продукты питания, руководствуясь исключительно увеличением прибыли!
Основной способ снизить количество солей фосфорной кислоты, поступающих в организм – отказаться или хотя бы снизить потребление продуктов, богатых этими веществами. В этом плане всегда смотрите состав продукта, и если окажется, что в нем фосфора более 0,25 мг, не сомневайтесь, фосфаты в него добавили извне.
Снизить количество избытка соединений фосфора помогут продукты, богатые магнием. Этим элементом богаты: черный шоколад, отруби, какао, гречневая крупа, овсянка, сухофрукты (чернослив, финики и изюм), соя и фасоль, и т.д.
Смогут помочь и продукты, богатые гемовым железом. К таким продуктам относится нежирное красное мясо – телятина, язык, телячья печень. Только употреблять их нельзя с ржаным хлебом, так как в нем содержатся вещества, препятствующие усвоению железа.
Для нейтрализации негативного влияния на баланс кальция в организме полезно употреблять больше молочных и кисломолочных продуктов.
Вред от переедания белковой пищей можно снизить употреблением достаточного количества овощей и соблюдением питьевого режима (не менее 2-х литров чистой воды в день).
К слову есть и еще одна зацепка. Все фосфаты имеют специальные коды, по которым можно вычислить, какое именно обозначение имеет тот или иной фосфат. С такими знаниями вам будет гораздо проще распознавать присутствие солей фосфорной кислоты в продуктах питания.
1. Добавка E339 (фосфат натрия) – используется в качестве стабилизатора, регулятора кислотности, антиоксиданта и разрыхлителя. Ее можно обнаружить в хлебе и всевозможных сладостях, мясе, сырах, сухом молоке и продуктах быстрого приготовления.
2. Добавка E340 (фосфат калия) – применяется в качестве влагоудерживающего агента, эмульгатора, регулятора кислотности и фиксатора окраски. Благодаря своим свойствам добавка нашла широкое применение в изготовлении сосисок, колбас и ветчины, а также в обработке куриных окорочков. Кроме того, ее применяют для изготовления чипсов, растворимого кофе и кондитерских изделий, а также для изготовления зубных паст.
3. Добавка E341 (ортофосфат кальция) – применяется в качестве разрыхлителя, стабилизатора, фиксатора краски и регулятора кислотности. Обнаружить добавку можно в спортивных напитках и энергетиках, овощных и фруктовых консервах, плавленом сыре, сухом молоке и сливках.
4. Добавка E342 (фосфат аммония) – является регулятором кислотности, благодаря чему используется в производстве дрожжей.
5. Добавка E343 (фосфат магния) – считается отличным загустителем, стабилизатором консистенции и связующим агентом. Чаще всего добавку применяют для производства сливок и сухого молока.
6. Добавка E450 (пирофосфаты) – зарекомендовала себя в качестве средства, увеличивающего мышечную массу. Благодаря такой особенности добавка широко применяется в изготовлении мясных продуктов и плавленых сыров.
7. Добавка E451 (трифосфаты) – чаще всего используется в качестве эмульгатора жира, благодаря чему ее можно встретить в составе макарон и сухих круп, пастеризованного молока, выпечки и тортов, а также в рыбном фарше и при обработке свежей рыбы.
8. Добавка E452 (полифосфаты кальция, калия и натрия) – вещества, используемые в качестве стабилизаторов и замедлителей химических реакций. Участвуют в производстве чипсов, пакетированного кофе, сосисок, колбас, окорочков и ветчины.
Как можно заметить, список продуктов, которые изобилуют солями фосфорной кислоты, просто огромен. Если регулярно употреблять эти продукты, вы неминуемо столкнетесь с нервными расстройствами и ослаблением костной ткани. Чтобы избежать этого, постарайтесь исключить вредные продукты из своего рациона, а в дополнение к этому, пейте больше молока и кисломолочных продуктов. Крепкого вам здоровья!
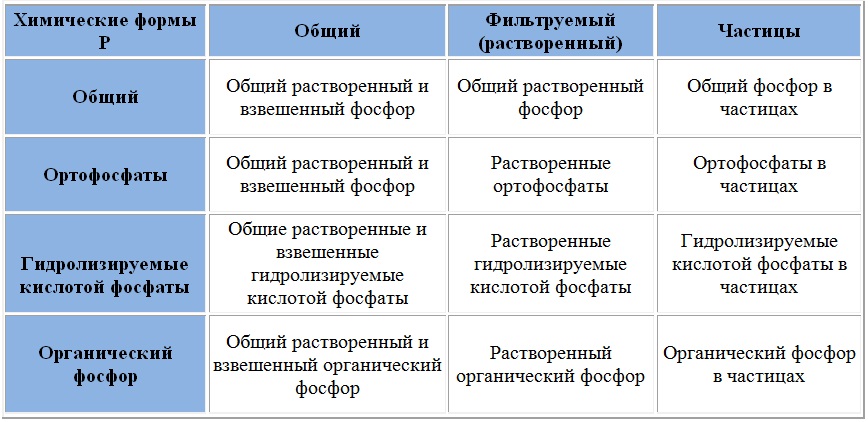
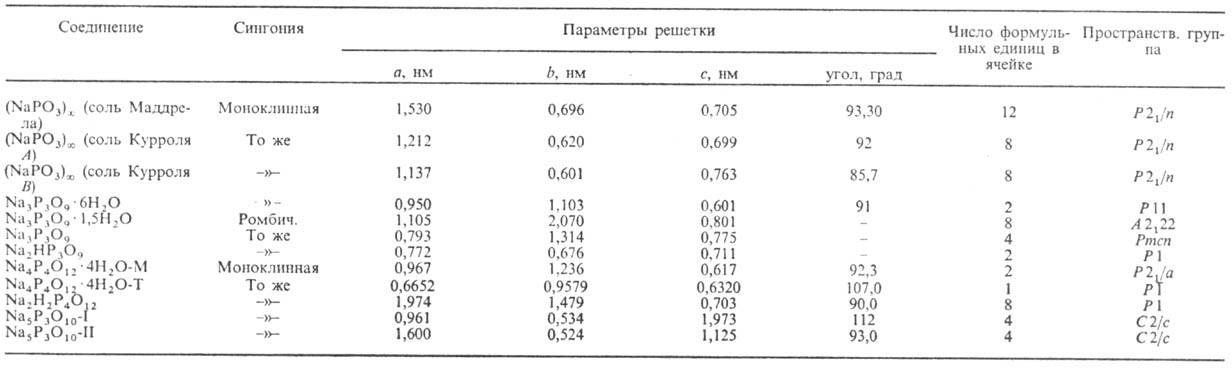
Ортофосфаты
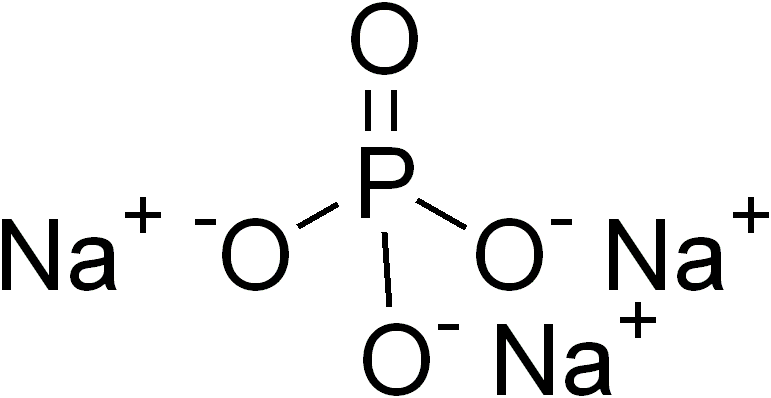
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
-
- H3PO4+NaOH→NaH2PO4+H2O{\displaystyle {\mathsf {H_{3}PO_{4}+NaOH\rightarrow NaH_{2}PO_{4}+H_{2}O}}} (дигидрофосфат натрия)
- H3PO4+2NaOH→Na2HPO4+2H2O{\displaystyle {\mathsf {H_{3}PO_{4}+2NaOH\rightarrow Na_{2}HPO_{4}+2H_{2}O}}} (гидрофосфат натрия)
- H3PO4+3NaOH→Na3PO4+3H2O{\displaystyle {\mathsf {H_{3}PO_{4}+3NaOH\rightarrow Na_{3}PO_{4}+3H_{2}O}}} (фосфат натрия)
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
-
- NaH2PO4→NaPO3+H2O{\displaystyle {\mathsf {NaH_{2}PO_{4}\rightarrow NaPO_{3}+H_{2}O}}}
- 2Na2HPO4→Na4P2O7+H2O{\displaystyle {\mathsf {2Na_{2}HPO_{4}\rightarrow Na_{4}P_{2}O_{7}+H_{2}O}}}
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Получение
Ортофосфаты можно получить действием ортофосфорной кислоты на щёлочь:
-
- 3LiOH+H3PO4→Li3PO4↓+3H2O{\displaystyle {\mathsf {3LiOH+H_{3}PO_{4}\rightarrow Li_{3}PO_{4}\downarrow +3H_{2}O}}}
Химические свойства
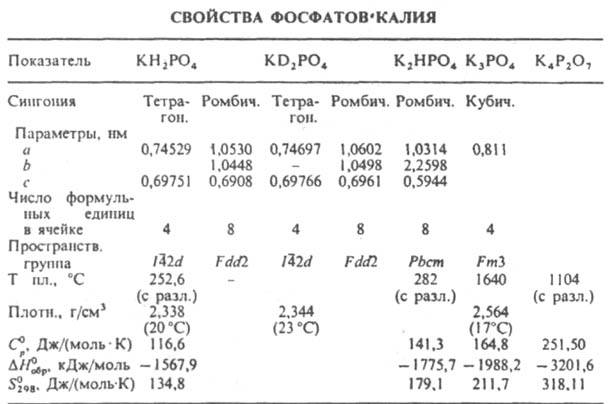
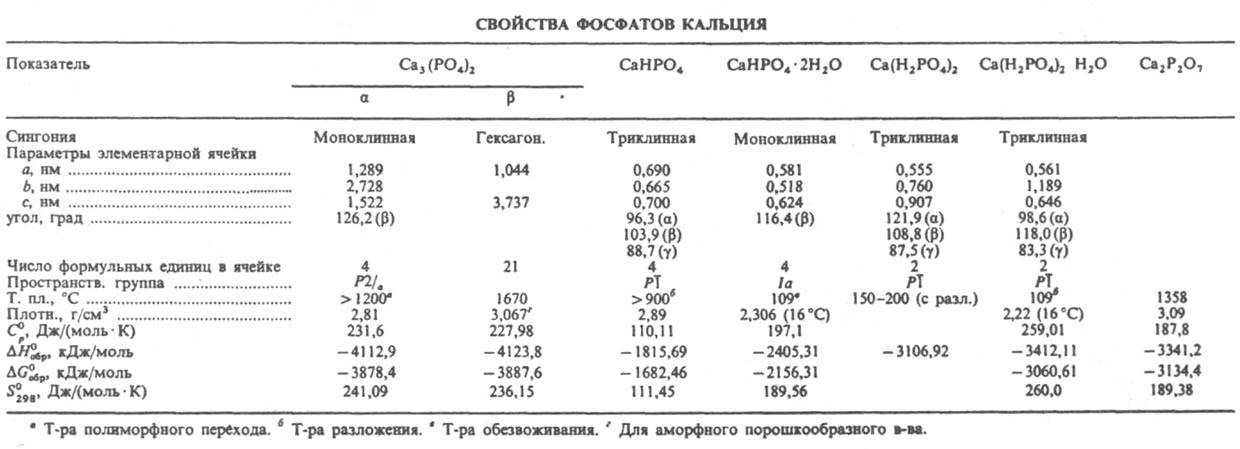
У всех ортофосфатов есть свойство: безводные соли стабильны при нагревании до температуры плавления, которая для разных солей колеблется в диапазоне от 830 °C (у фосфата свинца) до 1605 °C (у фосфата бария).
Фосфаты в основном плохо растворимы, в отличие от дигидрофосфатов. Растворимы только фосфаты щелочных металлов, начиная с натрия (фосфат лития — малорастворим) и аммония. Фосфаты обладают общими свойствами солей:
Взаимодействуют с сильными кислотами (они превращают нерастворимый фосфат в растворимый дигидрофосфат):
-
- Ca3(PO4)2+4HCl→Ca(H2PO4)2+2CaCl2{\displaystyle {\mathsf {Ca_{3}(PO_{4})_{2}+4HCl\rightarrow Ca(H_{2}PO_{4})_{2}+2CaCl_{2}}}}
Взаимодействуют с другими растворимыми солями:
-
- 2Na3PO4+3Li2SO4→2Li3PO4↓+3Na2SO4{\displaystyle {\mathsf {2Na_{3}PO_{4}+3Li_{2}SO_{4}\rightarrow 2Li_{3}PO_{4}\downarrow +3Na_{2}SO_{4}}}}
При нагревании выше 2000C° разлагаются на оксиды:
-
- Ca3(PO4)2→3CaO+P2O5{\displaystyle {\mathsf {Ca_{3}(PO_{4})_{2}\rightarrow 3CaO+P_{2}O_{5}}}}
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую среду, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Гидроортофосфаты — неорганические соединения, кислые соли ортофосфорной кислоты, например, гидроортофосфат бериллия. Дигидроортофосфаты — неорганические соединения, кислые соли ортофосфорной кислоты, например, дигидроортофосфат аммония. Существуют также метафосфаты, например, метафосфат калия.
Происхождение фосфатов в моче
Фосфор жизненно важен для организма. Он выполняет транспортную функцию, доставляя энергию во все клетки, участвует при обменных процессах, способствует продуцированию необходимых ферментов для пищеварения. Поступает к человеку элемент с пищей.
По целому ряду причин вещество перестаёт растворяться полностью в моче и выпадает в виде кристаллического осадка, ещё называемого песком, состоящим из фосфорнокислых солей, кальция, магнезии. Откладываясь со временем всё в большем количестве, они создают рыхлую аморфную массу. При появлении некоторых неблагоприятных факторов происходит склеивание частиц, образуются камни.
Причины и стадии формирования
Появление фосфатов в моче может быть связано с целым рядом причин. Одни из них носят временный характер и легко устраняются.
При некоторых случаях может понадобиться сложное, длительное лечение. Наиболее часто данный вид солей выпадает при следующих состояниях:
- нарушение питьевого режима;
- употребление большого количества фосфора;
- вегетарианство;
- резкая смена рациона;
- питание фастфудом;
- голодание;
- рвота;
- диарея;
- беременность;
- переохлаждение;
- включение в меню газированных напитков с красителями;
- инфекционные заболевания мочеполовой системы;
- нарушение обменных процессов организма;
- врожденные аномалии;
- наследственный фактор.
Важно знать! Если у малыша обнаруживают аморфные фосфаты в моче, это может означать начало развития такого серьёзного заболевания, как рахит. Немного повышенное количество солей у грудничка указывает на несовершенный метаболизм, который с возрастом нормализуется
Если такой вид кристаллов обнаружен однократно, паниковать не стоит. Скорее всего причиной стал сбой диеты. Врач обязательно назначит повторное обследование. Но если осадок присутствует постоянно, его количество увеличивается, следует немедленно начать комплексную терапию. Без медицинской помощи высок риск склеивания песчинок, появления конкрементов и развития мочекаменной болезни, ведущей к тяжёлым последствиям.
Состав и описание камней
Химический анализ таких образований показывает, что их основой являются кальциевые соли фосфорной кислоты. Они по своей структуре рыхлые, мягкие, пористые. Цвет белый или сероватым оттенком.
Поверхность камня чаще всего гладкая или незначительно шероховатая. Форму фосфаты могут иметь любую, чаще они выглядят, как удлинённые сферы. Более подробно можно изучить их по фото, большое количество их представлено в интернете.
Понятие нормы содержания фосфатов в моче
В питании современного человека фосфор присутствует в достаточном количестве. Дефицит этого элемента встречается крайне редко. При избытке повышается содержание его в моче, почки стараются избавиться от лишнего.
В норме по результатам анализ урина должна содержать у взрослого от 12.9 до 42 ммоль/литр этого вещества. Для детей показатель не превышает 30.
Признаки фосфатурии
На начальном этапе развития фосфатного уролитиаза проблему заметить сложно. Чаще всего внимательные мамы могут обнаружить помутнение, хлопья в моче у ребёнка раннего возраста, когда он пользуется ещё детским горшком. Взрослые мужчины и женщины при прогрессировании состояния отмечают такие неприятные симптомы:
- частое мочеиспускание;
- ложные позывы;
- тошнота;
- рвота;
- боли в пояснице;
- метеоризм;
- расстройства стула;
- кишечные колики.
Происходит обострение заболеваний пищеварительного тракта. Может присутствовать слабость, упадок сил.
Опасно ли это
Фосфатные камни в почках формируются медленно и не очень часто. Но это не значит, что выпадение осадка не вызывает других серьёзных нарушений работы организма. На начальных стадиях отмечается ломкость волос, расслаивание ногтевой пластины. Кожа делается сухой, шелушится, становится тонкой.
Далее происходит разрушение дентина. Вследствие этого зубы поражаются кариесом, крошатся. Страдает и костная система: очень часто причиной остеопороза является вымывание фосфоркальциевых соединений.
Фосфаты в пищевой промышленности
Уже многие десятилетия при производстве продуктов питания используются фосфаты. Благодаря большому количеству полезных свойств их добавляют во многие полуфабрикаты и готовые изделия:
- для маргарина и масла они увеличивают срок годности;
- сахару обеспечивают чистый белый цвет;
- в хлебобулочные изделия добавляют в качестве стабилизатора;
- в замороженных овощах помогают сохранить окраску;
- сохраняют мягкость в плавленых сырках;
- улучшают внешний вид консервированных овощей и фруктов;
- в газированных напитках служат подкислителем;
- препятствуют кристаллизации сгущенного молока.
Чаще всего в продуктах можно встретить несколько пищевых добавок на основе фосфора. Прежде всего, это Е339 или фосфат натрия. Его добавляют в хлеб, кондитерские изделия, сдобу, молочные продукты, мясо и полуфабрикаты. Химическая формула фосфата натрия — Na3PO4, это соединение служит регулятором кислотности, антиоксидантом и стабилизатором.
Добавка Е340, или фосфат калия, используется для удержания влаги, фиксации окраски, в качестве эмульгатора и регулятора кислотности. Чаще всего ее можно встретить в сосисках, колбасе, мясных полуфабрикатах. Но есть фосфат калия также в чипсах, растворимом кофе и кондитерских изделиях.
Пищевые добавки Е 342 (фосфат аммония) и Е343 (фосфат магния) применяются реже. Но наиболее распространены фосфаты Е450-452. Причем их используют не только в допустимых количествах. Некоторые производители применяют эти добавки на всякий случай, хотя с этими же целями можно было использовать, например, эмульгатор Е471, который более безопасен.
Пищевые фосфаты сейчас добавляют в молоко и молочные продукты, сыры, маргарин, мороженое, десерты, жевательную резинку. Их используют при заморозке овощей и фруктов, консервации, производстве макарон, сухих завтраков и концентратов, мясных и рыбных продуктов. Даже в детское питание добавляют фосфаты, так как они считаются безопасными.
Ноутбук
Процесс чистки клавиатуры ноутбука значительно более сложный, чем может показаться на первый взгляд. Если степень загрязнения низкая, вы можете воспользоваться нашей инструкцией по лёгкой очистке от пыли и загрязнений.

Если «клава» загрязнена серьёзно, советуем обратиться в специализированный сервис. Дело в том, что демонтировать кнопки с клавиатуры ноутбука довольно сложно, так как они фиксируются с использованием всякого рода технологических ухищрений или могут быть просто посажены на специальный клей.
Чтобы не сломать клавиатуру нужно знать её устройство и иметь технические навыки. Между тем чистка в специализированном сервисе обойдётся на порядок дешевле ремонта вышедшей из строя, в результате неудачной разборки, клавиатуры.
В первой части нашего большого лайфхака мы расскажем вам о том, как лучше, безопаснее и эффективнее всего почистить клавиатуру своего ноутбука (нетбука). В общих и частных случаях.

Не всякую клавиатуру можно мыть под водой!
Зачем чистить
Кто-то грешит тем, что не прочь перекусить, сидя за ноутбуком. Отсюда на лицо такие загрязнения как крошки, капельки сладкого чая, кофе, сока. Но если вы не имеете такой соблазнительной привычки, то, стало быть, чистка клавиатуры вам не нужна? Увы, она остается необходимой, поэтому и вам нужно знать, чем промыть клавиатуры ноутбука.

Клавиши на ноутбуке крепятся несколько по иному, чем на обычной механической компьютерной клавиатуре
Вся электроника – это, к сожалению, большой «пылесборник». Отсюда совет – не забывайте чистить от пыли кулер вашего устройства. Клавиатура также привлекает к себе пыль и грязь. И мыть ее нужно не только для образцового внешнего вида, но и для обеспечения работоспособности девайса, его долгих лет службы. Пока пыль на внешней поверхности клавиатуры – она ничем не страшна. Но если попадет в «начинку»… Вот что может вас ждать:
- Механический мусор может стать причиной «залипания» кнопок.
- Пролитая жидкость – это причина выхода из строя не только клавиш, но и всего ноутбука.
- Попадание пыли и грязи далеко вовнутрь техники чревато перегревом радиатора, что ведет к серьезной поломке.

Используйте холодные струи воздуха фена
Виды чистки
Чистка ноутбука разделяется на две разновидности, что влияет и на то, чем отмыть клавиатуру на ноутбуке:
- Поверхностная. Очищение как кнопок, так и пространств между ними. Производится дома, без разборки и применения сложных технологий.
- Глубокая. Удаление загрязнений с клавишных контактов, чтобы они не проникли далее в «начинку». Требуется снимать клавиатуру и, возможно, если загрязнение проникло глубже нее, прочищать, промывать и иные элементы. Для владельцев многих ноутбуков с несъемной клавиатурой проблема осложняется тем, что устройство приходится разбирать практически полностью. Если у вас нет навыков, уверенности в своих силах и какого-никакого опыта в этом деле, то процедуру лучше доверить специалистам.

При чистке таких шлейфов будьте максимально осторожны!
Поверхностно
Будьте готовы к поверхностной чистки минимум раз в месяц.
Перед тем, как начинать чистку любой из клавиатур, необходимо запастись специальными щеточками и салфетками. Их можно приобрести как в специализированном компьютерном магазине, так и на обычном рынке, в отделе комплектующих и расходных компьютерных материалов. Используя щеточки, эффективно удаляется грязь и пыль между клавишами. Если при чистке использовать только салфетки и щетки, то это и называется поверхностная чистка.
Предлагаем ознакомиться Как выбрать хорошую сковороду-гриль?
Ни в коем случае не используйте для чистки клавиатуры такие агрессивные жидкости как бензин или ацетон. Чаще всего все те, кто используют такие элементы при чистке клавиатуры, убивают ее полностью.
Если у вас нет возможности купить специальные жидкости для чистки клавиатуры, то можно использовать раствор изопропилового спирта и мягкой тканью.
Но для тех, у кого все совсем запущено, и чистка клавиатуры требует дополнительных усилий и приспособлений, рекомендуем использовать USB или обычный пылесос, а еще более эффективный баллончик с сжатым воздухом.
Для того, чтобы провести полную глубокую очистку клавиатуры ноутбука, ее необходимо демонтировать.
Бывают моменты, что после отсоединения клавиатуры и ее чистка, устанавливая ее на место, клавиатура не работает. Большинство, естественно, паникуют и думают, что повредили клавиатуру при чистке. На самом то деле просто необходимо проверить, качественно ли вы закрепили шлейф.
Перечень детских порошков для стирки
Средства, предназначенные для детей, являются гипоаллергенными, лучше отстирывают био-загрязнения (пятна от молока, соков, пюре). Они безопасны для нежной кожи малышей.
Наша мама
Средство напоминает мыльную стружку. Не сушит кожу рук. Гипоаллергенное и безопасное для малыша. Сложные пятна требуют предварительного застирывания хозяйственным мылом. Отлично выполаскивается из тканей и оставляет белье мягким.
Аистенок
Семьи, в которых есть дети, давно знакомы с этим стиральным порошком, поскольку это известный российский бренд. Производство этого продукта осуществляется в Санкт-Петербурге. Средство не содержит отдушек, не вызывает аллергии.
Ушастый нянь
Забавное запоминающееся название имеет детский стиральный порошок, выпускаемый на предприятии Невская косметика. Почти не имеет запаха, привлекает демократичной ценой, имеется много противоречивых отзывов по качеству стирки, но так бывает со всяким популярным товаром.

Карапуз
Линейка средств для стирки детских вещей с первых дней жизни. Не содержит фосфатов и цеолитов. Гипоаллергенный и безопасный для малышей. Пользователи жалуются, что он не слишком хорошо отстирывает пятна.
Помните: биологически активные компоненты, которые содержатся в детских порошках, для борьбы с пятнами, которые мог оставить ваш малыш, не работают в слишком горячей воде. Оптимальная температура застирывания: +30…+32 °С.
Burti Hugiene
Не позиционируется, как детский порошок, но отлично подходит для стирки детского белья. Качественно отстирывает, оставляет вещи яркими, без серого налета. Экономичен, не вызывает аллергии, защищает от грибков и бактерий. Единственный минус — высокая цена.
Amway baby
Детский стиральный порошок с легким ненавязчивым ароматом, не содержит фосфатов и цеолитов. Во многих средствах имеется немного кислородного отбеливателя. Отзывы о продукте сильно различаются, многим порошок нравится, пишут и о недостаточном качестве стирки. Продукт безвреден для малышей, не задерживается в тканях.
Влияние стиральных порошков с фосфатами на здоровье людей
Разберем в этой статье, зачем в порошке фосфаты и почему лучше выбирать бесфосфатные стиральные порошки.
Общим свойством фосфатов является способность смягчать воду путем связывания ионов кальция и магния. Чем больше в воде кальция и магния, тем более жесткой будет вода.
Фосфаты добавляют в стиральные порошки, чтобы:
- снизить жесткость воды;
- улучшить проникание поверхностно-активных веществ в волокна ткани;
- усилить эффективность стрики.
Как результат — белье отстирывается быстрей. К сожалению, за удобство и качество стирки часто приходится расплачиваться своим здоровьем.
Фосфаты сами по себе не являются очень опасными для большинства взрослых здоровых людей. Они разрешены в определенных количествах в производстве продуктов питания в качестве стабилизаторов и регуляторов кислотности. Однако в пищевой промышленности используются специально очищенные пищевые фосфаты.
Производители стиральных порошков и других моющих средств добавляют в свою продукцию неочищенные фосфаты с примесями вредных веществ, которые могут вызвать аллергию и раздражение кожи у некоторых людей, имеющих повышенную чувствительность к данным веществам.
Другая опасность состоит в том, что поверхностно-активные вещества (ПАВ) благодаря фосфатам лучше проникают в волокна ткани и частично остаются в них после стирки.
А ПАВы однозначно являются ядовитыми веществами. Следует избегать контакта этих веществ с кожей детей и аллергиков.
ПАВ остаются на одежде после стирки, на посуде после мытья, на коже и волосах после купания. Длительно воздействуя на организм, эти вещества приводят к заболеваниям.
Фосфаты в составе бытовой химии усиливают вредное действие поверхностно-активных веществ и оказывают негативное влияние на окружающую среду.

Единственный способ избавиться от отрицательного влияния вредных компонентов моющих и чистящих средств — полностью или частично перейти на использование бесфосфатной бытовой химии и стиральных порошков в домашнем хозяйстве.