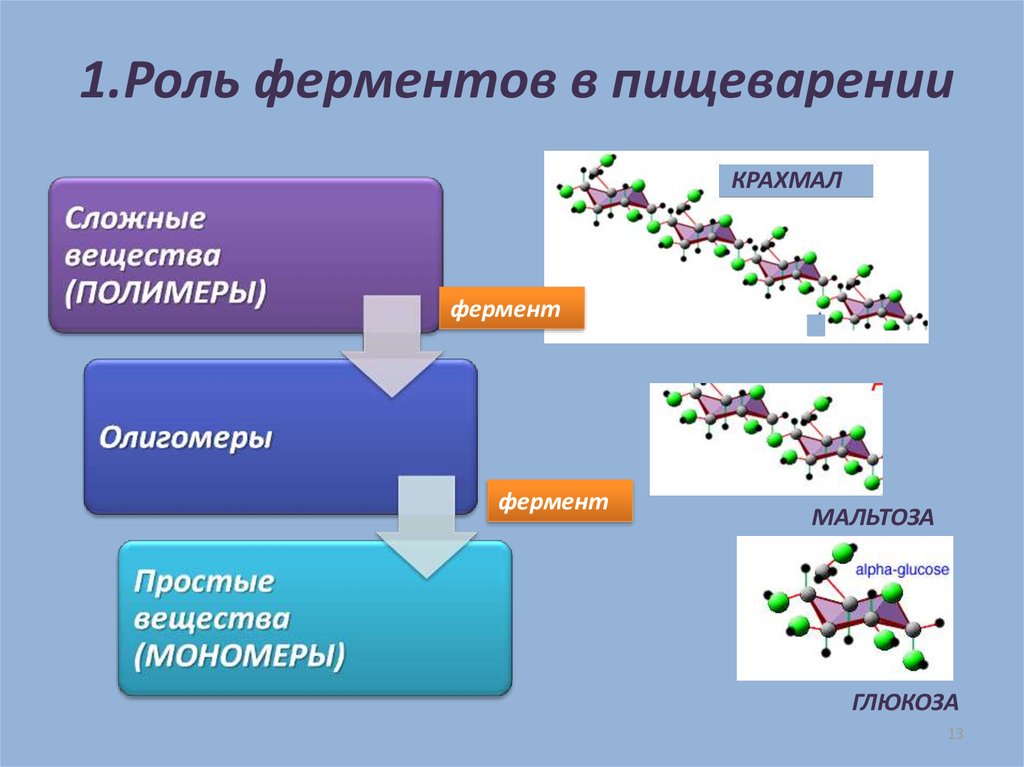
Ферменты-что это такое?
В большинстве случаев ферменты в организме человека представляют собой гигантские молекулы, состоящие из белка, и они необходимы для жизни. В организме практически ничего не работает без ферментов. Функцией этих так называемых биокатализаторов является включение или ускорение биохимических реакций в клетках.
В таких реакциях, например, некоторые вещества (субстраты) разрушаются или преобразуются. Некоторые ферменты работают очень специфическим образом: они могут только связывать определенный субстрат и обеспечивать его химическое превращение. Другие реагируют с различными субстратами, но тесно связаны с одним типом реакции (см. Ниже: классы ферментов).
Ферменты часто могут развить свои эффекты, только если они активируются так называемым кофактором или несколькими кофакторами. Это могут быть ионы металлов (например, ионы железа или меди) или органические молекулы (например, витамины). Кофакторы временно или постоянно и постоянно связаны с ферментом. Во втором случае их также называют протезной группой.
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Изоферменты креатинкиназы |
Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
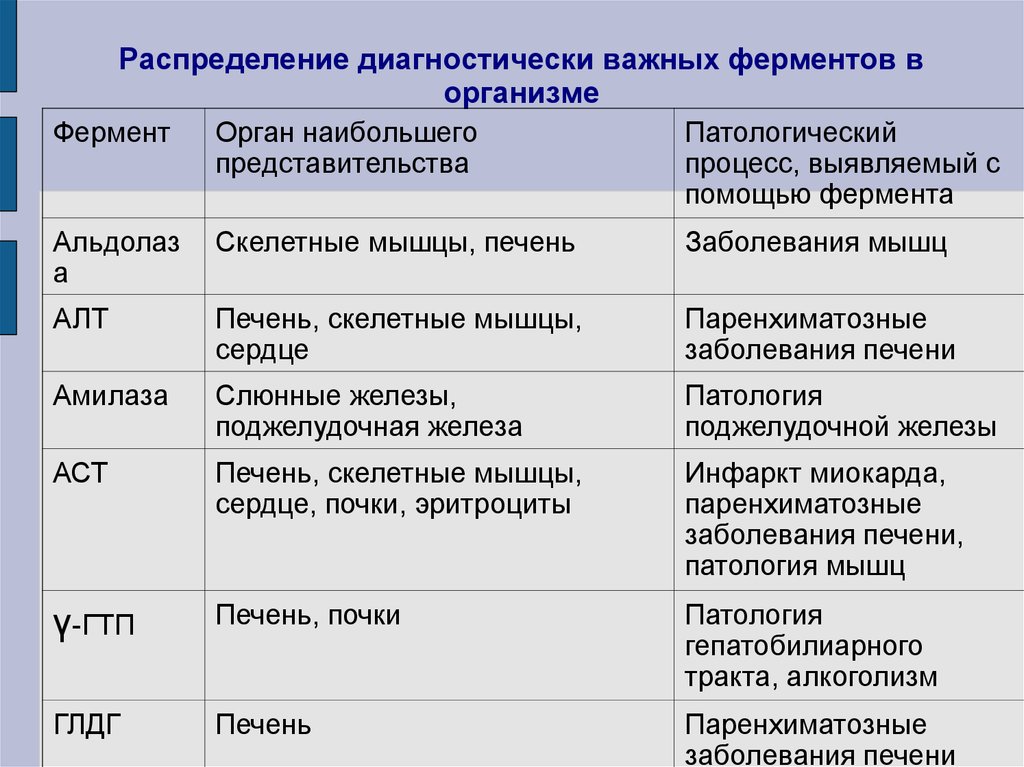
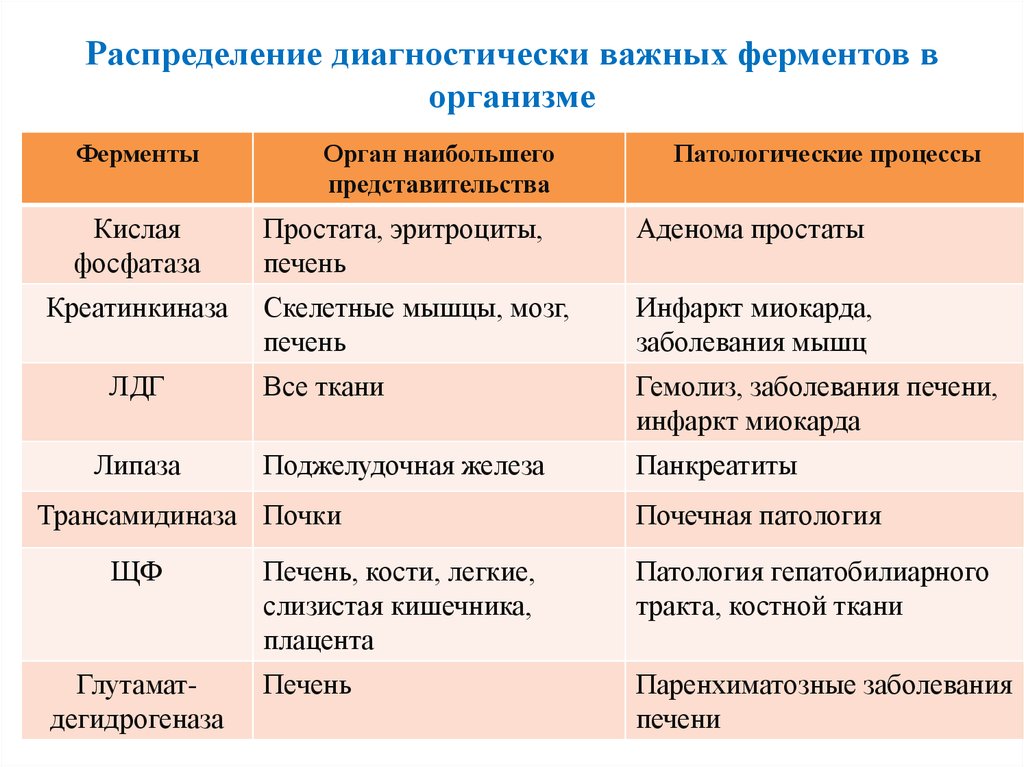
Распределение ферментов в организме
Ферменты, участвующие в синтезе белков, нуклеиновых
кислот и ферменты энергетического обмена присутствуют во всех клетках
организма. Но клетки, которые выполняют специальные функции содержат и
специальные ферменты. Так клетки островков Лангерганса в поджелудочной железе
содержат ферменты, катализирующие синтез гормонов инсулина и глюкагона.
Ферменты, свойственные только клеткам определенных органов называют
органоспецифическими: аргиназа и урокиназа —
печень, кислая фосфатаза
— простата. По изменению концентрации таких ферментов в крови судят о наличии
патологий в данных органах.
В клетке отдельные ферменты распределены по всей
цитоплазме, другие встроены в мембраны митохондрий и эндоплазматического
ретикулума, такие ферменты образуют компартменты, в которых происходят
определенные, тесно связанные между собой этапы метаболизма.
Многие ферменты образуются в клетках и секретируются
в анатомические полости в неактивном состоянии — это проферменты. Часто в виде
проферментов образуются протеолитические ферменты (расщепляющие белки). Затем
под воздействием рН или других ферментов и субстратов происходит их химическая
модификация и активный центр становится доступным для субстратов.
Существуют также изоферменты — ферменты,
отличающиеся по молекулярной структуре, но выполняющие одинаковую функцию.
Механизм действия ферментов
Акт катализа складывается из трех последовательных
этапов.
1.Образование
фермент-субстратного комплекса при взаимодействии через активный центр.
2.Связывание
субстрата происходит в нескольких точках активного центра, что приводит к
изменению структуры субстрата, его деформации за счет изменения энергии связей
в молекуле. Это вторая стадия и называется она активацией субстрата. При этом
происходит определенная химическая модификация субстрата и превращение его в
новый продукт или продукты.
3.В
результате такого превращения новое вещество (продукт) утрачивает способность
удерживаться в активном центре фермента и фермент-субстратный, вернее уже
фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е,где Е — энзим, А и Б — субстраты, либо
продукты реакции.
Ферментативные эффекторы — вещества, изменяющие
скорость ферментативного катализа и регулирующие за счет этого метаболизм.
Среди них различают ингибиторы — замедляющие скорость реакции и активаторы
— ускоряющие ферментативную реакцию.
В зависимости от механизма торможения реакции
различают конкурентные и неконкурентные ингибиторы. Строение молекулы
конкурентного ингибитора сходно со структурой субстрата и совпадает с
поверхностью активного центра как ключ с замком (или почти совпадает). Степень
этого сходства может даже быть выше чем с субстратом.
Если А+Е = АЕ = БЕ = Е + Б ,
тоИ+Е = ИЕ ¹
Концентрация способного к катализу фермента при этом
снижается и скорость образование продуктов реакции резко падает (рис. 4.3.2.).
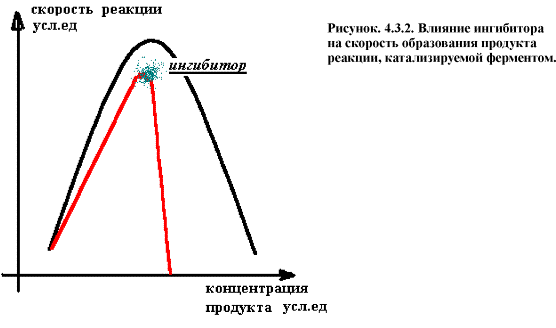
В качестве конкурентных ингибиторов выступает большое
число химических веществ эндогенного и экзогенного происхождения (т.е.
образующихся в организме и поступающих извне – ксенобиотики, соответственно).
Эндогенные вещества являются регуляторами метаболизма и называются
антиметаболитами. Многие из них используют при лечении онкологических и
микробных заболеваний, тк. они ингибируют ключевые метаболичекие реакции
микроорганизмов (сульфаниламиды) и опухолевых клеток. Но при избытке субстрата
и малой концентрации конкурентного ингибитора его действие отменяется.
Второй вид ингибиторов — неконкурентные. Они
взаимодействую с ферментом вне активного центра и избыток субстрата не влияет
на их ингибирующую способность, как в случае с конкурентными ингибиторами. Эти
ингибиторы взаимодействуют или с определенными группами фермента (тяжелые
металлы связываются с тиоловыми группами Цис) или чаще всего регуляторным
центром, что снижает связывающую способность активного центра. Собственно
процесс ингибирования — это полное или частичное подавление активности фермента
при сохранении его первичной и пространственной структуры.
Различают также обратимое и необратимое
ингибирование. Необратимые ингибиторы инактивируют фермент, образуя с его АК
или другими компонентами структуры химическую связь. Обычно это ковалентная связь
с одним из участков активного центра. Такой комплекс практически недиссоциирует
в физиологических условиях. В другом случае ингибитор нарушает конформационную
структуру молекулы фермента — вызывает его денатурацию.
Действие обратимых ингибиторов может быть снято при
переизбытке субстрата или под действием веществ, изменяющих химическую
структуру ингибитора. Конкурентные и неконкурентные ингибиторы относятся в
большинстве случаев к обратимым.
Помимо ингибиторов известны еще активаторы
ферментативного катализа. Они:
1)защищают
молекулу фермента от инактивирующих воздействий,
2)образуют
с субстратом комплекс, который более активно связывается с активным центром Ф,
3)взаимодействуя
с ферментом, имеющим четвертичную структуру, разъединяют его субъединицы и тем
самым открывают доступ субстрату к активному центру.
Для чего нужны ферменты
Роль ферментов заключается в ускорении биохимических реакций до 1 000 000 раз. Ферменты снижают энергетический барьер реакции, не влияя на термодинамическое равновесие. Они характеризуются специфичностью как в реакции, которую они катализируют, так и в субстрате. Это определяется соответствием каталитической и гидрофобной областей, взаимодействием поверхностных электрических зарядов и т.д.
Благодаря ферментам осуществляются, ускоряются и контролируются процессы, поддерживающие жизнь организма. Они не меняются, поэтому их называют биокатализаторами.
Ферменты — это потрясающее творение природы. Только с их помощью возможно:
- обновление клеток;
- преобразование питательных веществ в энергию и строительные компоненты;
- удаление отходов после обмена веществ и посторонних элементов из организма;
- защита организма от патогенных микроорганизмов;
Без ферментов жизнь была бы абсолютно невозможна, каждый из них в буквальном смысле слова «узкий специалист» и выполняет одну единственную задачу, которая реализуется самым совершенным и безупречным образом
Для жизни и здоровья организма крайне важно, чтобы все ферменты в нем присутствовали в достаточном количестве, в оптимальном соотношении и нормальном функциональном состоянии
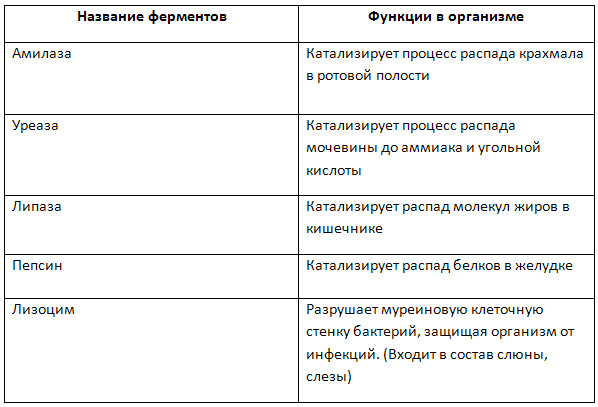
Специфичность – отличительное свойство ферментов. В отношении ферментов она бывает абсолютная или относительная. Это возможность влиять только на определённые реакции. Фермент с абсолютной специфичностью может связываться только с одним единственным субстратом (Например, аргиназа только с аргинином, лактаза только с лактозой).
Ферменты с относительной (широкой субстратной) специфичностью могут связываться с уже несколькими сходными по структуре субстратами. Например, такой фермент, как панкреатическая липаза может гидролизовать любые пищевые жиры. Что позволяет использовать ее в качестве лекарственных препаратов, по такому принципу и работает мезим
С возрастом ферменты теряют свою первоначальную эффективность и начинают совершать ошибки, поэтому их необходимо постоянно обновлять. Они очень чувствительны к температуре. Оказалось, что при 38 — 40 градусах они теряют свои первоначальные свойства и становятся «ленивыми», «бессильными», а при 43 градусах умирают.
«Эффективность одного и того же количества фермента может быть разной. Фермент может находиться как в активной, так и неактивной форме, бывает, что меньшее количество фермента вызывает более высокую скорость реакции.
Под действием ферментов происходят все жизненно важные функции организма — переваривание пищи, очищение крови и тканей, заживление ран, выделение патогенов и раковых клеток, даже обеспечение проникновения сперматозоидов в яйцеклетку — тоже происходит под действием ферментов. Человек может быть здоров, только если его ферменты находятся в нужном количестве и функционируют как можно лучше.
Энзимопатология
В медицине есть целый раздел, который занимается поиском связи между заболеванием и отсутствием синтеза определенного фермента. Это область энзимологии – энзимопатология. Недостаточный синтез ферментов также подлежит рассмотрению. Например, наследственное заболевание фенилкетонурия развивается на фоне потери способности клеток печени осуществлять синтез этого вещества, что катализирует превращение в тирозин фенилаланина. Симптомами данного заболевания являются расстройства психической деятельности. Из-за постепенного накопления токсических веществ в организме больного тревожат такие признаки, как рвота, беспокойство, повышенная раздражительность, отсутствие интереса к чему-либо, выраженная усталость.
При рождении ребенка патология не проявляется. Первичную симптоматику можно заметить в возрасте от двух до шести месяцев. Второе полугодие жизни малыша характеризируется выраженным отставанием в психическом развитии. У 60% больных развивается идиотия, менее чем 10% ограничиваются слабой степенью олигофрении. Ферменты клетки не справляются со своими функциями, но это можно поправить. Своевременная диагностика патологических изменений способна приостановить развитие заболевание до периода полового созревания. Лечение заключается в ограничении поступления с пищей фенилаланина.
Катализатор и не только
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
«Высокоактивные» панкреатические энзимы[править | править код]
Состав «высокоактивных» панкреатических энзимов
|
Название препарата, Е |
Липаза, Е |
Амилаза, Е |
Протеаза, Е |
|
Панцитрат(10000) |
10000 |
9000 |
500 |
|
Панцитрат(25000) |
25000 |
22500 |
1250 |
|
Креон (10000) |
10000 |
8000 |
600 |
|
Креон (25000) |
25000 |
18000 |
1000 |
|
Ликреаза |
12000 |
14000 |
660 |
Представителями панкреатических ферментов относительно нового поколения являются препараты креон 10000, креон 25000 (Solvay Pharma) и панцитрат 10000, панцитрат 25000 (Knoll). Препараты содержат стандартизированный панкреатин, получаемый из поджелудочной железы свиней.
Препараты, содержащие панкреатические ферменты в виде микрогранул или микротаблеток, могут применяться как постоянно в качестве заместительной терапии, так и однократно при пищевой нагрузке.
Дозу подбирают индивидуально, это зависит от степени выраженности клинико-лабораторных показателей экзокринной функции поджелудочной железы. О достаточности дозы судят по клиническим (нормализация частоты и характера стула) и лабораторным показателям (исчезновение стеатореи и креатореи в ко-программе, нормализация триглицеридов в липидограмме стула).
Наличие микросферических препаратов позволяет значительно повысить эффективность лечения ферментами.
Капсулы следует проглатывать целиком с достаточным количеством воды (100 мл). При затруднении проглатывания капсулы целиком ее вскрывают и минимикросферы смешивают с пищей, проглатывают не разжевывая!
Креон необходимо назначать с любой жиросодержащей пищей. Дозу подбирают индивидуально, при необходимости ее увеличивают постепенно. Нельзя растирать микротаблетки/микросферы до консистенции порошка.
Терапию ферментативными препаратами лучше проводить дифференцированно.
При подборе ферментативного препарата следует руководствоваться следующими критериями:
высокие дозы ферментов для заместительной терапии;
низкие дозы для лечения функциональных изменений активности поджелудочной железы.
Для лечения панкреатопатий необходимо назначение небольших доз панкреатина, который в данном случае снимает нагрузку с поджелудочной железы и в то же время стимулирует выработку ею большего количества ферментов.
Отсутствие эффекта заместительной терапии может быть следствием:
неправильного диагноза (стеаторея, следствие нарушения кишечной абсорбции, лямблиоз, неконтролируемый бактериальный рост);
нарушения режима приема препарата;
недостаточного количества принимаемого фермента;
потери активности фермента в препарате;
инактивации фермента в содержимом желудка.
Последний фактор вызывает повышенный интерес, хотя инактивация панкреатических ферментов желудочным соком известна уже многие годы.
Панкреатическая липаза необратимо инактивируется желудочным соком при значении pH 4,0 и ниже. Кислотная среда приводит к секреции больших объемов желчи и панкреатического сока. Последними исследованиями показано, что у пациентов с хроническим панкреатитом желудочная гиперсекреция встречается чаще, чем это предполагалось.
Приемы, которыми врачи пытаются преодолеть инактивацию ферментов желудочным соком, общеизвестны: увеличение дозировки, прием антацидов, антагонистов Н2-рецепторов, ингибиторов протонового насоса.
Отдельно хотелось бы остановиться на возможных побочных эффектах ферментной терапии. Среди них выделяют болезненные ощущения в ротовой полости, раздражение кожи в пери-анальной области, дискомфорт в животе, гиперурикемию. Описаны аллергические реакции у больных с гиперчувствительностью к свиному белку, а также нарушение всасывания фолиевой кислоты и железа при приеме больших доз.
С 1994 г. появились сообщения о развитии на фоне приема ряда ферментных препаратов (панцитрат и нутризим) стриктуры толстой кишки
Это заставило врачей всего мира с осторожностью относиться ко вновь созданным высокоактивным препаратам и большим дозам этих препаратов.