Описание
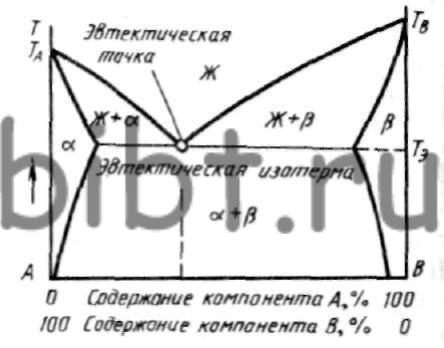
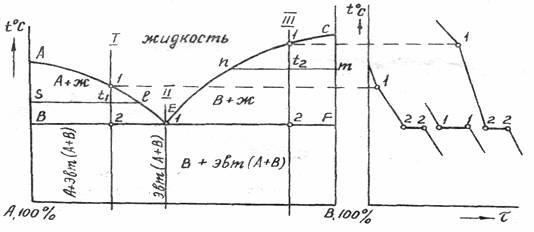
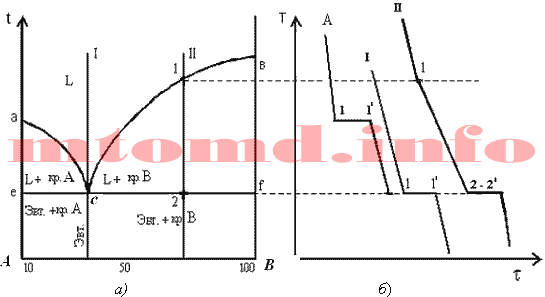
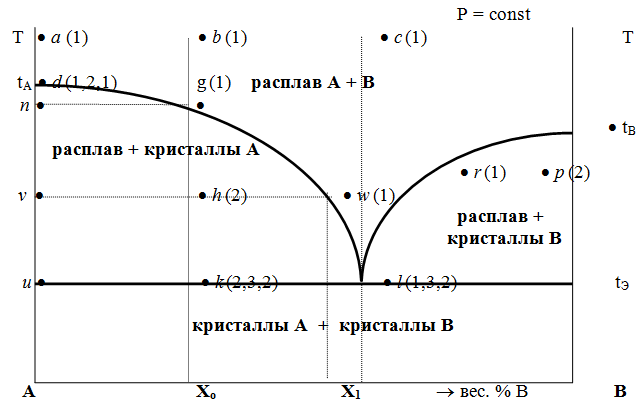
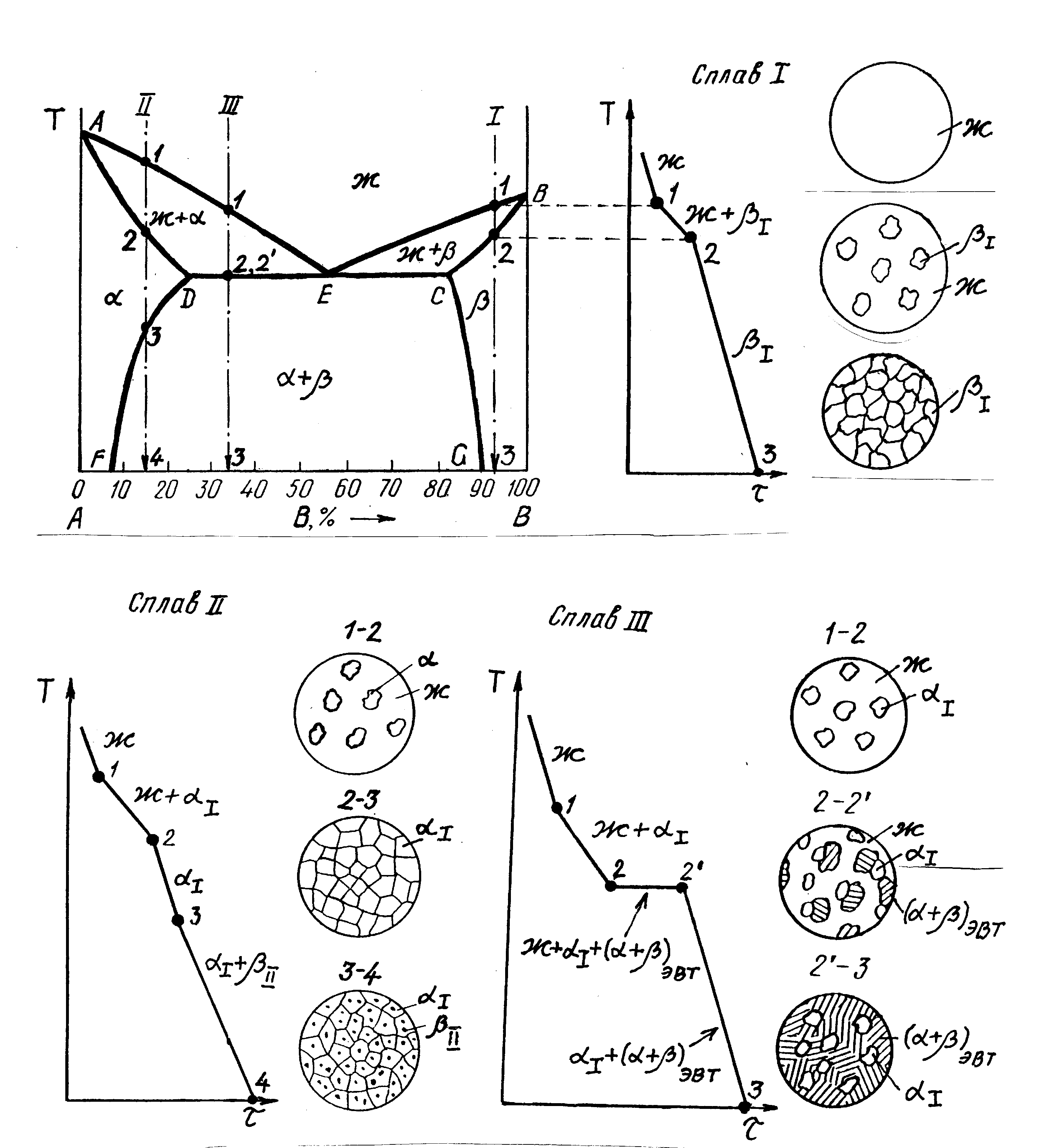
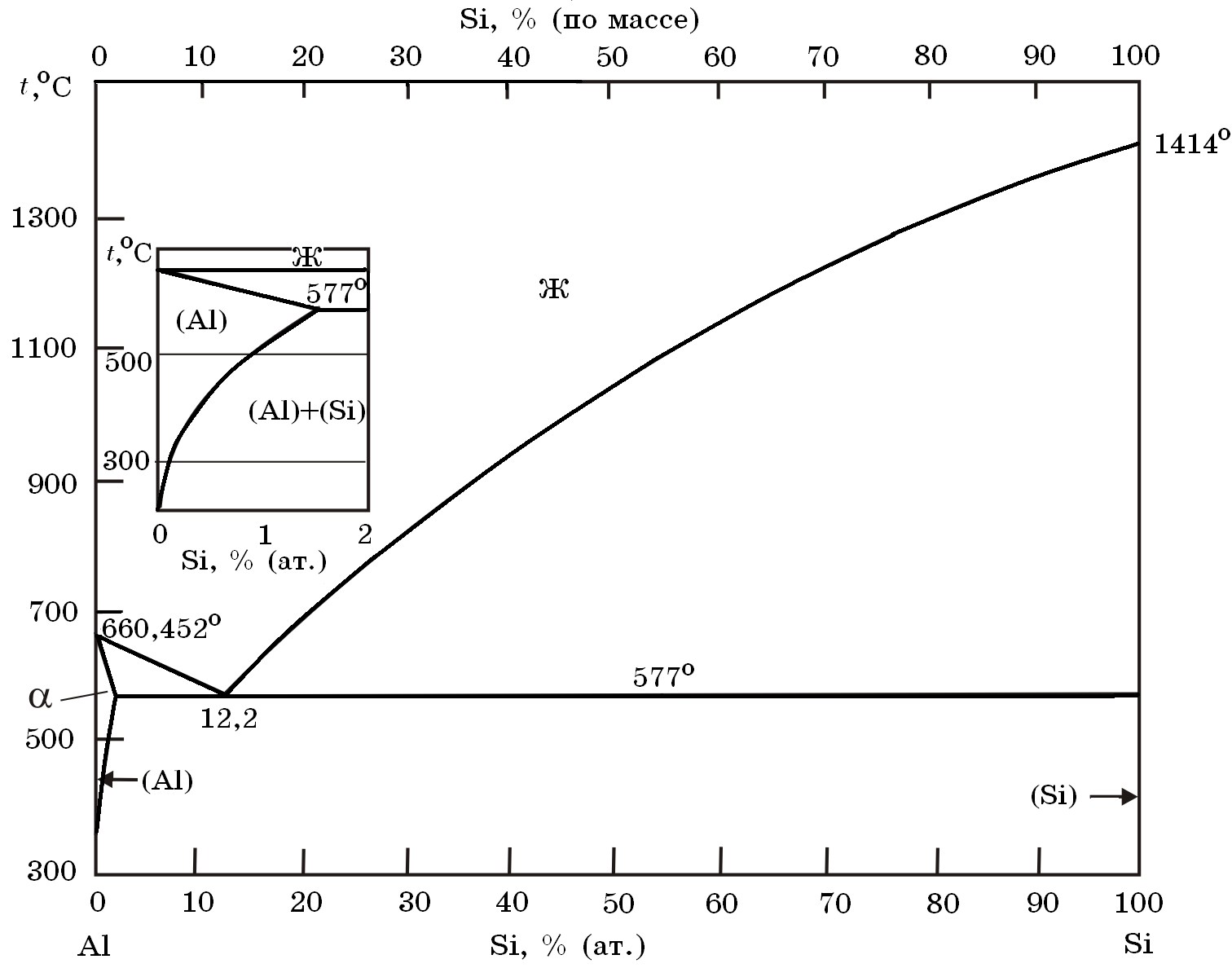
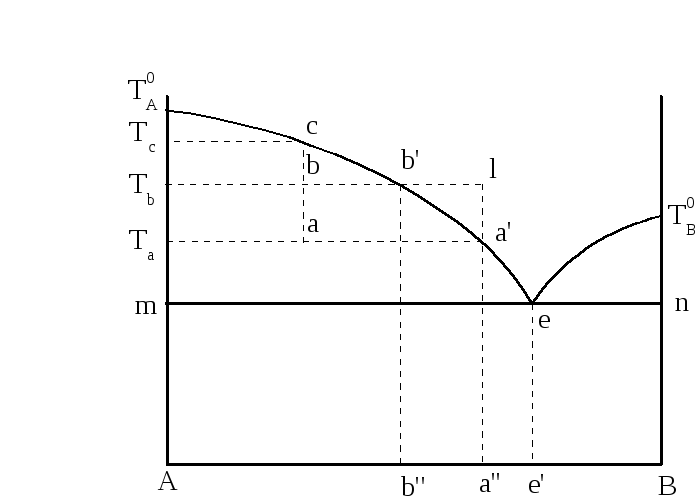
В двухкомпонентной (или бинарной) системе эвтектическое равновесие можно выразить:
- α+β⇔L,{\displaystyle \alpha +\,\!\beta \Leftrightarrow L,}
- где L{\displaystyle L} — жидкая фаза (расплав, или раствор, например, «водный раствор»);
- α{\displaystyle \alpha } — твёрдый раствор компонента B{\displaystyle B} в кристаллической решётке, образованной компонентом A{\displaystyle A};
- β{\displaystyle \beta } — твёрдый раствор компонента A{\displaystyle A} в кристаллической решётке, образованной компонентом B{\displaystyle B}.
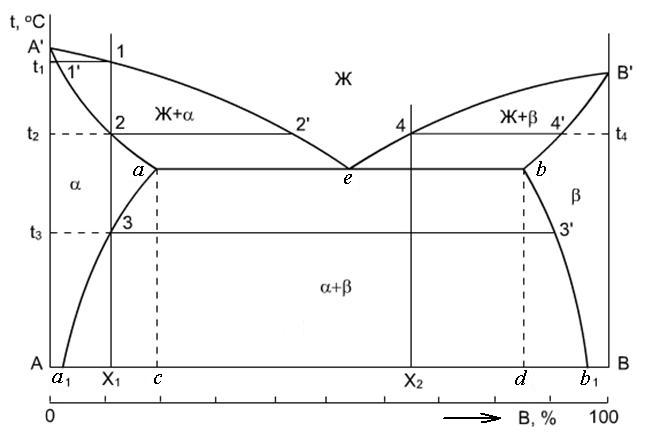
Добавляя или отводя тепло, можно изменить пропорцию между суммарным объёмом кристаллических фаз и расплавом в эвтектической точке при около эвтектической температуре.
Температура системы при этих процессах будет отличаться от равновесной (в подавляющем большинстве практических случаев очень незначительно — на десятые или сотые доли градуса Цельсия), так как для фазовых превращений (кристаллизации или плавления) необходим термодинамический стимул — переохлаждение или перегрев.
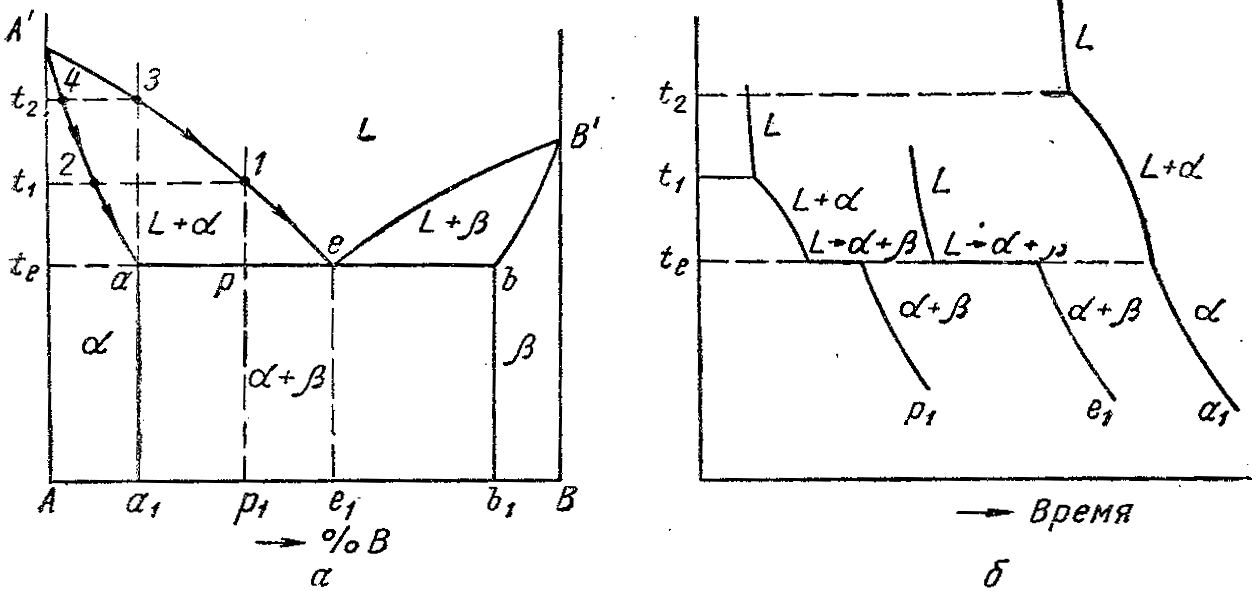
Процесс кристаллизации:
- L→α+β.{\displaystyle L\rightarrow \,\!\alpha +\,\!\beta .}
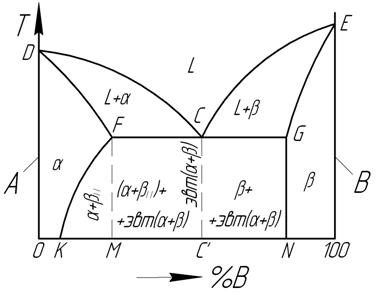
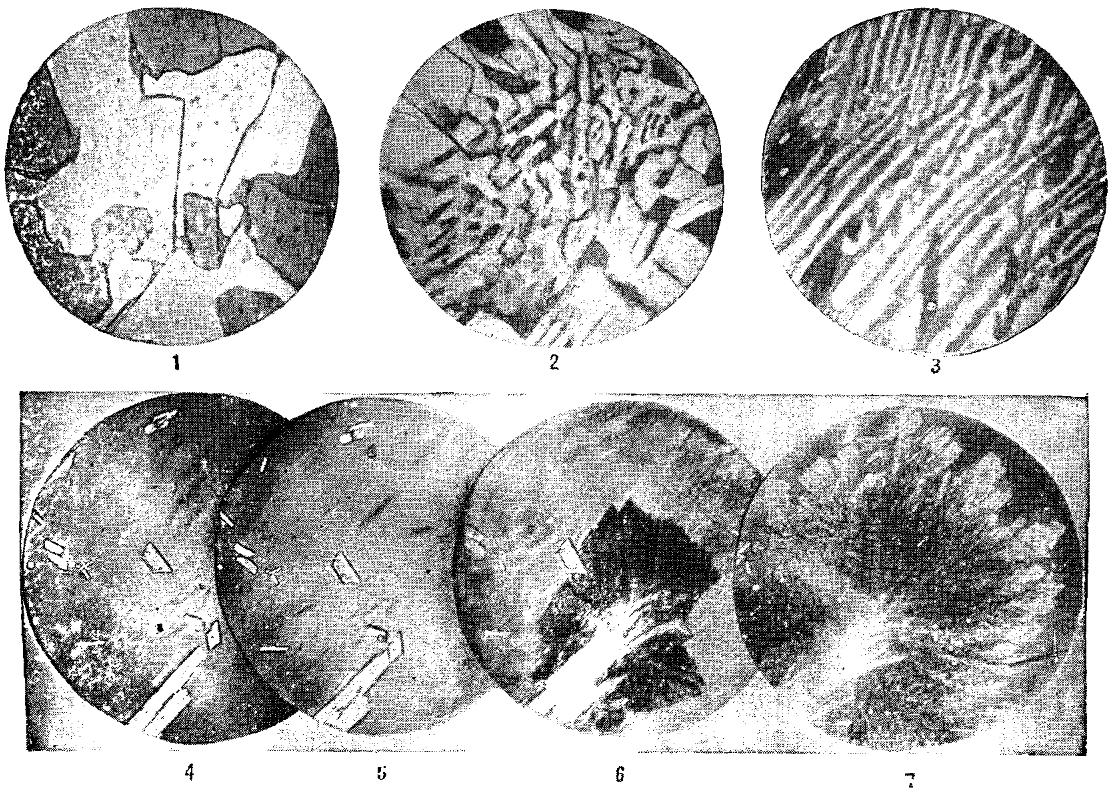
После кристаллизации эвтектика становится смесью кристаллитов фаз, очень часто сильно разветвлённых, взаимно проросших в процессе эвтектической кристаллизации. Одновременное образование нескольких кристаллических фаз в ходе эвтектической кристаллизации обусловливает возможность их кооперативного роста, при выполнении дополнительных условий, прежде всего, частичной кристаллографической согласованности решёток эвтектических фаз. В результате последнего образуются эвтектические бикристаллы (в случае двухкомпонентных, а также квазибинарных систем) — разветвлённые взаимновложенные дендриты эвтектических фаз, лишь выглядящие в сечении как мелкодисперсная смесь.
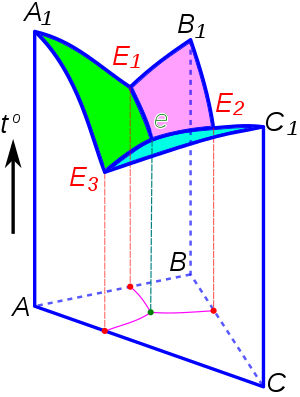
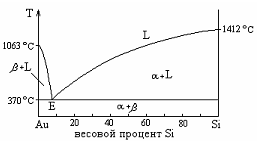
Эвтектика является пересечением поверхностей равновесия расплава с соответствующими (эвтектическими) фазами. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в условиях близких к равновесным даст все кристаллические фазы, участвующие в равновесии. Если же подводится тепло в достаточном количестве, то смесь фаз, отвечающая эвтектическому составу, в условиях близких к равновесным будет плавиться с одновременным уменьшением доли каждой из кристаллических фаз вплоть до их полного исчезновения.
Твердые растворы
Твёрдые растворы
— фазы переменного состава, в которых
атомы различных элементов расположены
в общей кристаллической решётке.
Могут быть
неупорядоченными (с хаотическим
расположением атомов), частично или
полностью упорядоченными. Экспериментально
упорядоченность определяют, главным
образом, рентгеновским структурным
анализом.
Способность
образовывать твёрдые растворы свойственна
всем кристаллическим твёрдым телам. В
большинстве случаев она ограничена
узкими пределами концентраций, но
известны системы с непрерывным рядом
твёрдых растворов (например, Cu—Au, Ti—Zr,
GaAs—GaP). По существу, все кристаллические
вещества, считающиеся чистыми, представляют
собой твёрдые растворы с очень малым
содержанием примесей.
Различают три вида
твёрдых растворов:
твёрдые растворы
замещения;
твёрдые растворы
внедрения;
твёрдые растворы
вычитания.
Согласно
полуэмпирическим правилам Юм-Розери,
непрерывный ряд твёрдых растворов
замещения в металлических системах
образуются лишь теми элементами, которые,
во-первых, имеют близкие по размерам
атомные радиусы (отличающиеся не более
чем на 15 %) и, во-вторых, находятся не
слишком далеко друг от друга в
электрохимическом ряду напряжений. При
этом элементы должны иметь один и тот
же тип кристаллической решётки. В твёрдых
растворах на основе полупроводников и
диэлектриков, благодаря более «рыхлым»
кристаллическим решёткам образование
твёрдых растворов замещения возможно
и при большем различии атомных радиусов.
Если атомы
компонентов существенно различаются
по размерам или электронной структуре,
возможно внедрение атомов одного
элемента в междоузлия решётки, образованной
другим элементом. Подобные твёрдые
растворы часто образуются при растворении
неметаллов (B, H2, O2, N2, C) в металлах.
Твёрдые растворы
вычитания, возникающие за счёт появления
в кристаллической решётке вакантных
узлов, образуются при растворении одного
из компонентов в химическом соединении
и характерны для нестехиометрических
соединений.
Природные минералы
часто представляют собой твёрдые
растворы (см. Изоморфизм в кристаллах).
Образование твёрдых растворов при
легировании элементов и соединений
имеет большое значение в производстве
сплавов, полупроводников, керамики,
ферритов.
Твёрдые растворы
— основа всех важнейших конструкционных
и нержавеющих сталей, бронз, латуней,
алюминиевых и магниевых сплавов высокой
прочности. Свойства твёрдых растворов
регулируют их составом, термической
или термомеханической обработкой.
Легированные полупроводники и многие
сегнетоэлектрики, являющиеся основой
современной твердотельной электроники,
также являются твёрдыми растворами.
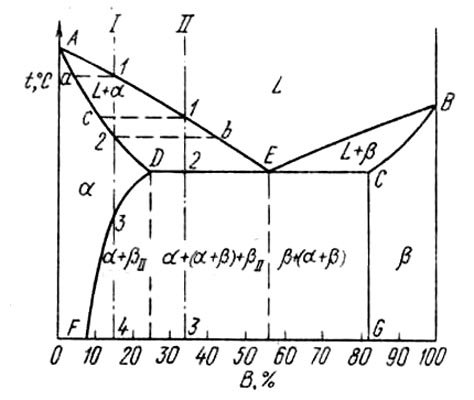
При распаде твёрдых
растворов сплавы приобретают новые
свойства. Наиболее ценными качествами
обладают сплавы с очень тонкой
неоднородностью — так называемые
дисперсионно-твердеющие, или стареющие
твёрдые растворы. Дисперсионное твердение
может наблюдаться и при распаде твёрдых
растворов на основе соединений, например,
нестехиометрических шпинелей.