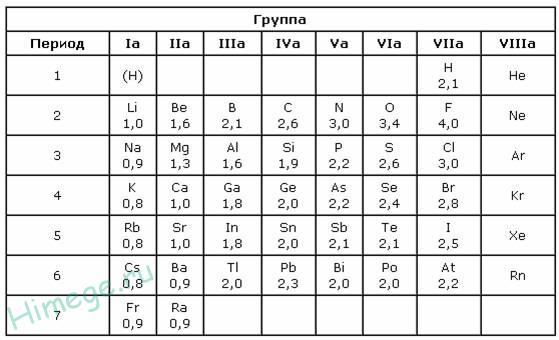
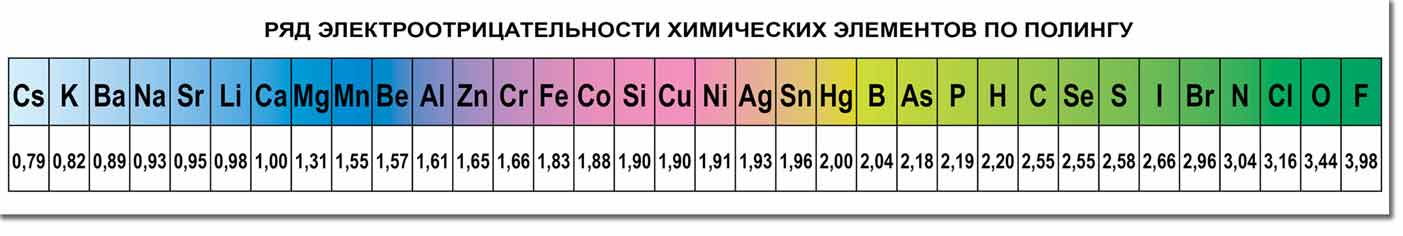
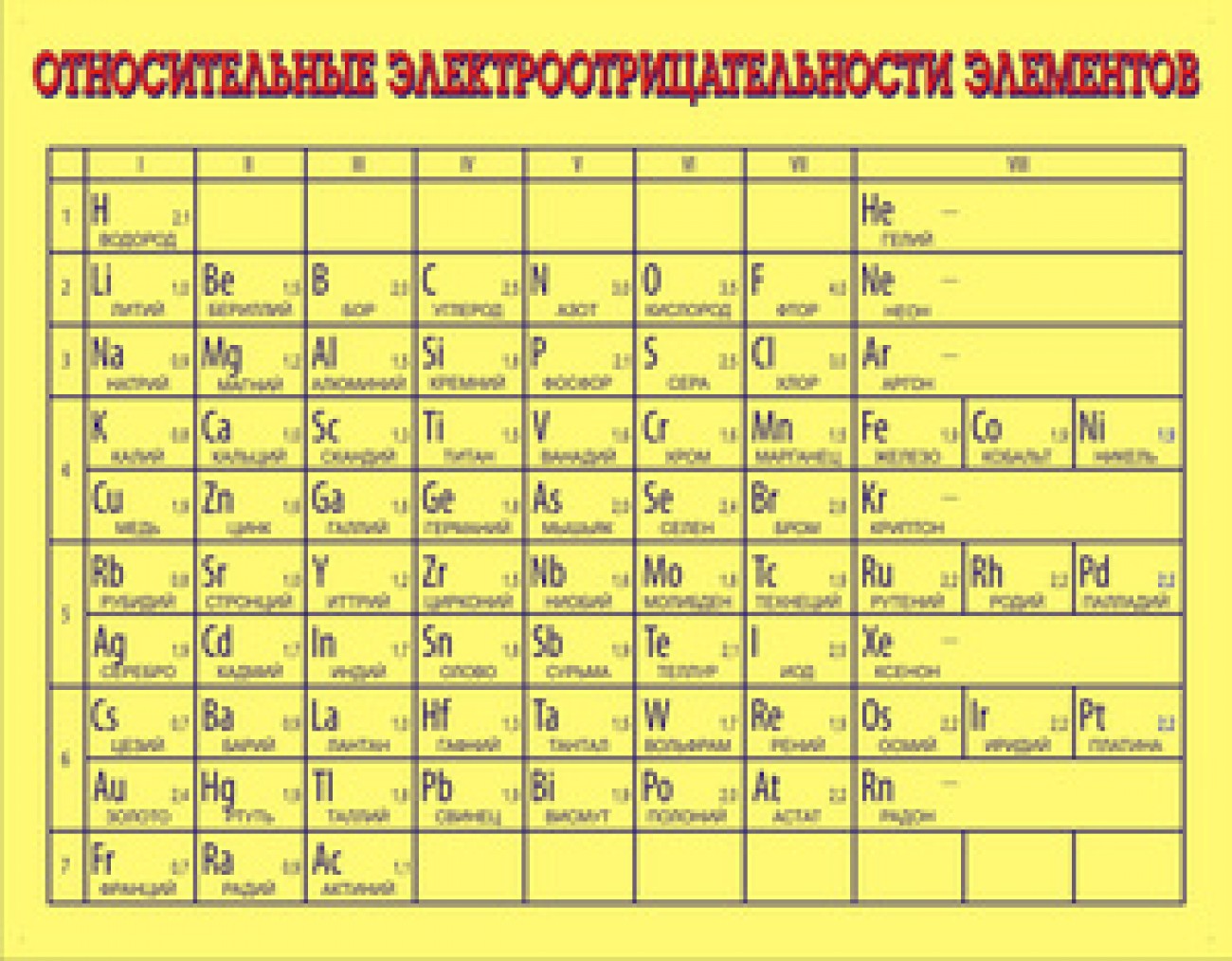
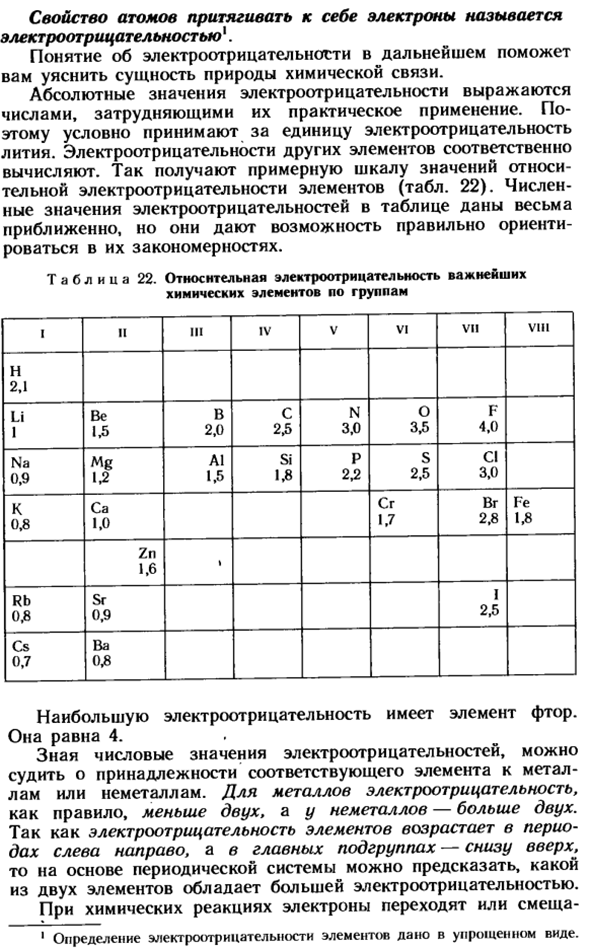
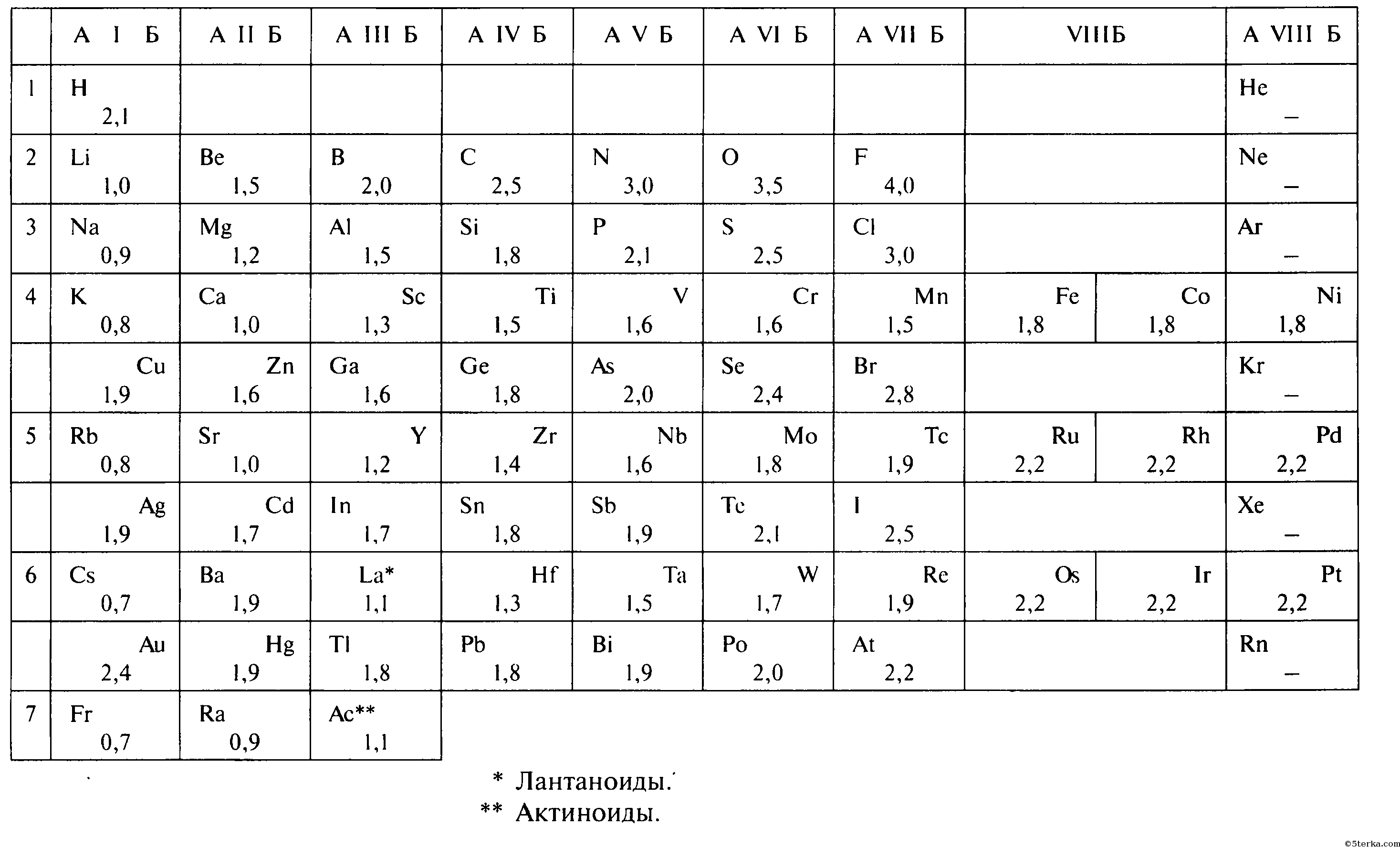
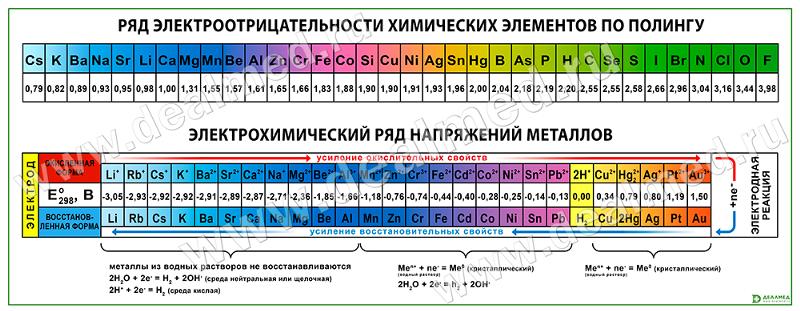
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости)
Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Групповая электроотрицательность
В органической химии электроотрицательность больше связана с различными функциональными группами, чем с отдельными атомами. Термины групповая электроотрицательность и электроотрицательность заместителей используются как синонимы. Однако принято различать индукционный эффект и резонансный эффект , которые можно описать как σ- и π-электроотрицательности соответственно. Существует ряд линейных соотношений свободной энергии , которые использовались для количественной оценки этих эффектов, из которых уравнение Хаммета является наиболее известным. Параметры Кабачника — это групповые значения электроотрицательности для использования в химии фосфорорганических соединений .
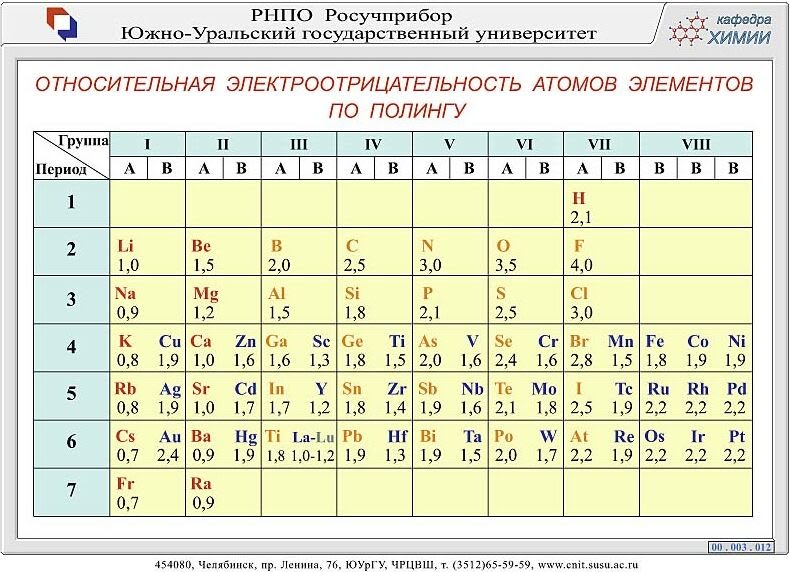
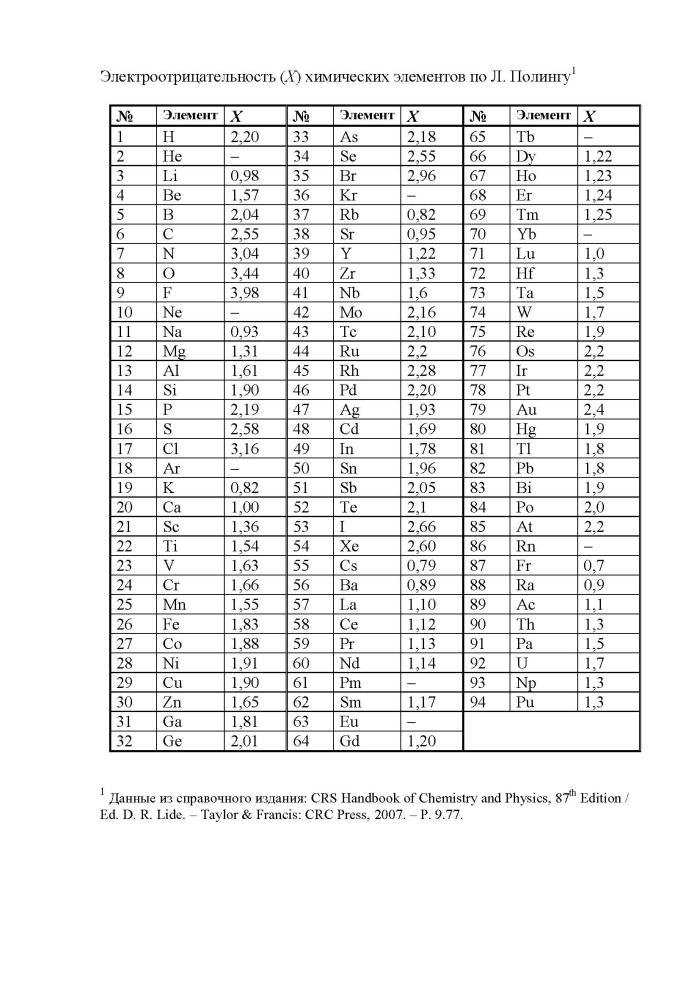
Таблица электроотрицательности химических элементов. Химические элементы в порядке возрастания относительной электроотрицательности (X) по Полингу (Pauling)
| Электроотрицательность (X)/ Electronegativity / по Полингу (Pauling) |
Наименование русский/английский |
Символ | Атомный номер |
| 0,79 (раньше — 0,7) | Франций / Francium | Fr | 87 |
| 0,79 | Цезий / Caesium = Cesium |
Cs | 55 |
| 0,82 | Калий / Potassium | K | 19 |
| 0,82 | Рубидий / Rubidium | Rb | 37 |
| 0,89 | Барий / Barium | Ba | 56 |
| 0,9 | Радий / Radium | Ra | 88 |
| 0,93 | Натрий / Sodium | Na | 11 |
| 0,95 | Стронций / Strontium | Sr | 38 |
| 0,98 | Литий / Lithium | Li | 3 |
| 1,0 | Кальций / Calcium | Ca | 20 |
| 1,1 | Лантан / Lanthanum | La | 57 |
| 1,1 | Актиний / Actinium | Ac | 89 |
| 1,1 | Иттербий / Ytterbium | Yb | 70 |
| 1,12 | Церий / Cerium | Ce | 58 |
| 1,13 | Празеодим / Praseodymium | Pr | 59 |
| 1,13 | Прометей / Promethium | Pm | 61 |
| 1,13 | Америций / Americium | Am | 95 |
| 1,14 | Неодим / Neodymium | Nd | 60 |
| 1,17 | Самарий / Samarium | Sm | 62 |
| 1,2 | Гадолиний / Gadolinium | Gd | 64 |
| 1,22 | Диспрозий / Dysprosium | Dy | 66 |
| 1,22 | Иттрий / Yttrium | Y | 39 |
| 1,24 | Эрбий / Erbium | Er | 68 |
| 1,25 | Тулий / Thulium | Tm | 69 |
| 1,27 | Лютеций / Lutetium | Lu | 71 |
| 1,28 | Кюрий / Curium | Cm | 96 |
| 1,28 | Плутоний / Plutonium | Pu | 94 |
| 1,3 | Торий / Thorium | Th | 90 |
| 1,3 | Берклий / Berkelium | Bk | 97 |
| 1,3 | Калифорний / Californium | Cf | 98 |
| 1,3 | Эйнштейний / Einsteinium | Es | 99 |
| 1,3 | Фермий / Fermium | Fm | 100 |
| 1,3 | Менделевий / Mendelevium | Md | 101 |
| 1,3 | Нобелий / Nobelium | No | 102 |
| Электроотрицательность (X)/ Electronegativity / по Полингу (Pauling) |
Наименование русский/английский |
Символ | Атомный номер |
| 1,31 | Магний / Magnesium | Mg | 12 |
| 1,33 | Цирконий / Zirconium | Zr | 40 |
| 1,36 | Нептуний / Neptunium | Np | 93 |
| 1,36 | Скандий / Scandium | Sc | 21 |
| 1,38 | Уран / Uranium | U | 92 |
| 1,5 | Тантал / Tantalum | Ta | 73 |
| 1,5 | Протактиний / Protactinium | Pa | 91 |
| 1,54 | Титан / Titanium | Ti | 22 |
| 1,55 | Марганец / Manganese | Mn | 25 |
| 1,57 | Бериллий / Beryllium | Be | 4 |
| 1,6 | Ниобий / Niobium | Nb | 41 |
| 1,61 | Алюминий / Aluminum | Al | 13 |
| 1,62 | Талий / Thallium | Tl | 81 |
| 1,65 | Цинк / Zinc | Zn | 30 |
| 1,63 | Ванадий / Vanadium | V | 23 |
| 1,66 | Хром / Chromium | Cr | 24 |
| 1,69 | Кадмий / Cadmium | Cd | 48 |
| 1,78 | Индий / Indium | In | 49 |
| 1,81 | Галлий / Gallium | Ga | 31 |
| 1,83 | Железо / Iron | Fe | 26 |
| 1,87 | Свинец / Lead | Pb | 82 |
| 1,88 | Кобальт / Cobalt | Co | 27 |
| 1,9 | Медь / Copper | Cu | 29 |
| 1,9 | Рений / Rhenium | Re | 75 |
| 1,9 | Кремний / Silicon | Si | 14 |
| 1,9 | Технеций / Technetium | Tc | 43 |
| 1,91 | Никель / Nickel | Ni | 28 |
| 1,93 | Серебро / Silver | Ag | 47 |
| 1,96 | Олово / Tin | Sn | 50 |
| Электроотрицательность (X)/ Electronegativity / по Полингу (Pauling) |
Наименование русский/английский |
Символ | Атомный номер |
| 2 | Ртуть / Mercury | Hg | 80 |
| 2 | Полоний / Polonium | Po | 84 |
| 2,02 | Висмут / Bismuth | Bi | 83 |
| 2,04 | Бор / Boron | B | 5 |
| 2,05 | Сурьма / Antimony | Sb | 51 |
| 2,16 | Молибден / Molybdenum | Mo | 42 |
| 2,18 | Мышьяк / Arsenic | As | 33 |
| 2,19 | Фосфор / Phosphorus | P | 15 |
| 2,2 | Водород / Hydrogen | H | 1 |
| 2,2 | Иридий / Iridium | Ir | 77 |
| 2,2 | Радон / Radon | Rn | 86 |
| 2,2 | Астат / Astatine | At | 85 |
| 2,2 | Рутений / Ruthenium | Ru | 44 |
| 2,2 | Палладий / Palladium | Pd | 46 |
| 2,2 | Осмий / Osmium | Os | 76 |
| 2,28 | Платина / Platinum | Pt | 78 |
| 2,28 | Родий / Rhodium | Rh | 45 |
| 2,36 | Вольфрам / Tungsten | W | 74 |
| 2,54 | Золото / Gold | Au | 79 |
| 2,55 | Углерод / Carbon | C | 6 |
| 2,55 | Селен / Selenium | Se | 34 |
| 2,58 | Сера / Sulfur | S | 16 |
| 2,6 | Ксенон / Xenon | Xe | 54 |
| 2,66 | Йод / Iodine | I | 53 |
| 2,96 | Криптон / Krypton | Kr | 36 |
| 3,04 | Азот / Nitrogen | N | 7 |
| 3,16 | Хлор / Chlorine | Cl | 17 |
| 3,44 | Кислород / Oxygen | O | 8 |
| 3,98 | Фтор / Fluorine | F | 9 |
Электроотрицательность
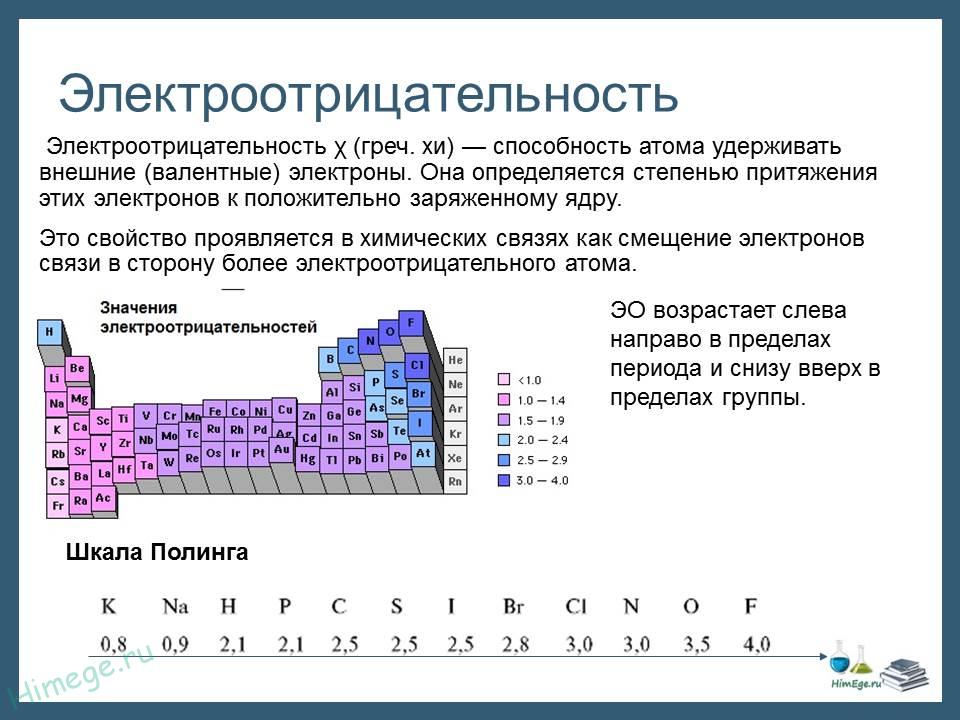
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.

Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Об этой статье
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 9 человек(а). Количество просмотров этой статьи: 52 990.
Категории: Химия
English:Calculate Electronegativity
Español:calcular la electronegatividad
Português:Calcular Eletronegatividade
Français:calculer l’electronégativité
Deutsch:Elektronegativität berechnen
Italiano:Calcolare l’Elettronegatività
Bahasa Indonesia:Menghitung Elektronegativitas
Nederlands:Elektronegativiteit berekenen
Tiếng Việt:Tính độ âm điện
العربية:حساب السالبية الكهربية
日本語:電気陰性度を算出する
हिन्दी:इलेक्ट्रोनेगेटिविटी कैलकुलेट करें
Печать
Электроотрицательность. Степень окисления и валентность химических элементов

Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды.
При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl).
Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО.
Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
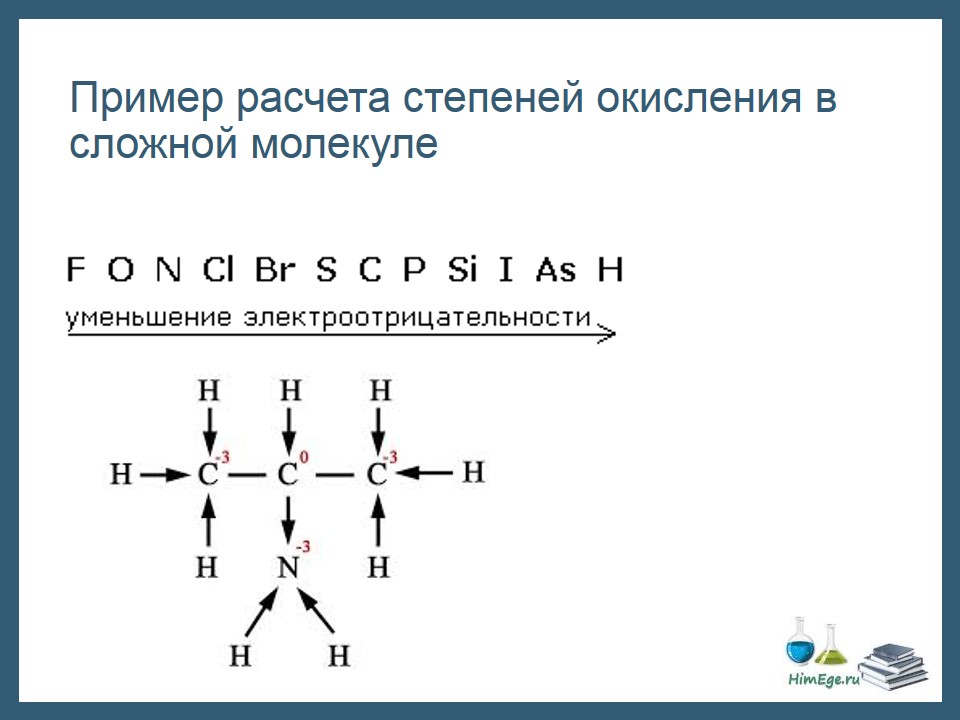
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е.
его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния.
Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Электроположительность
Электроположительность — это мера способности элемента отдавать электроны и, следовательно, образовывать положительные ионы ; таким образом, это антипод электроотрицательности.
В основном это свойство металлов , что означает, что, как правило, чем сильнее металлический характер элемента, тем выше электроположительность. Следовательно, наиболее электроположительными являются щелочные металлы . Это потому, что у них есть единственный электрон во внешней оболочке, и, поскольку он находится относительно далеко от ядра атома, он легко теряется; Другими словами, эти металлы имеют низкую энергию ионизации .
В то время как электроотрицательность увеличивается по периодам в периодической таблице и уменьшается по группам вниз , электроположительность уменьшается по периодам (слева направо) и увеличивается по группам вниз. Это означает, что элементы в правом верхнем углу периодической таблицы элементов (кислород, сера, хлор и т. Д.) Будут иметь наибольшую электроотрицательность, а элементы в левом нижнем углу (рубидий, цезий и франций) — наибольшую электроположительность.
Смысл понятия
Электроотрицательность химических элементов представляет собой способность атома вещества притягивать к себе электроны других атомов в сложных соединениях. Впервые это понятие ввел в начале XX столетия американский химик Лайнус Полинг. Простые элементы можно разделить на две большие группы в соответствии с их химическими и физическими свойствами:
- неметаллы;
- металлы.

Вещества из первой группы могут выступать в роли восстановителя либо окислителя в зависимости от показателя электроотрицательности элемента. Чем он выше, тем активнее вещество проявляет свойства окислителя.
Таким образом, необходимо разобраться с двумя новыми понятиями:
- Окислитель. Это реагент, который во время окислительно-восстановительной реакции принимает электроны.
- Восстановитель. Так называется вещество, которое может отдавать негативно заряженные частицы во время окислительно-восстановительной реакции.
Полингом была составлена специальная шкала электроотрицательности. Максимальной электронегативностию обладает фтор — 4. Минимальный электроотрицательный показатель у франция, и он равен 0,7.
Валентность
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
• числом неспаренных электронов (одноэлектронных орбиталей);
• наличием свободных орбиталей;
• наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4.
Постоянные валентности:
- H, Na, Li, К, Rb, Cs — Степень окисления I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd — Степень окисления II
- B, Al, Ga, In — Степень окисления III
Переменные валентности:
- Сu — I и II
- Fe, Со, Ni —II и III
- С, Sn, Pb — II и IV
- P— III и V
- Cr — II, III и VI
- S — II, IV и VI
- Mn—II, III, IV, VI и VII
- N—II, III, IV и V
- Cl—I, IV, VI и VII
Используя валентности можно составить формулу соединения.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Например: Н2O-формула воды, где Н и О-химические знаки элементов, 2 — индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р205— оксид фосфора (V)
I. Степень окисления свободных атомови атомов в молекулах простых веществравна нулю — Na, Р4, О2
II. В сложном веществеалгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0. а в сложном ионеего заряду.
Например:
Разберем для примера несколько соединений и узнаем валентность хлора:
Справочный материал для прохождения тестирования:
Корреляция электроотрицательности с другими свойствами

Изменение изомерного сдвига ( ось y , в мм / с) анионов [SnX 6 ] 2- , измеренная с помощью мессбауэровской спектроскопии 119 Sn, в зависимости от суммы электроотрицательностей по Полингу галогенидных заместителей ( ось x ).
Широкое разнообразие методов расчета электроотрицательностей, которые все дают результаты, которые хорошо коррелируют друг с другом, является одним из показателей количества химических свойств, на которые может влиять электроотрицательность. Наиболее очевидное применение электроотрицательностей — это обсуждение полярности связи , концепция которого была введена Полингом. В общем, чем больше разница в электроотрицательности между двумя атомами, тем более полярная связь будет образовываться между ними, причем атом, имеющий более высокую электроотрицательность, находится на отрицательном конце диполя. Полинг предложил уравнение, связывающее «ионный характер» связи с разницей в электроотрицательности двух атомов, хотя оно в некоторой степени вышло из употребления.
Было показано несколько корреляций между инфракрасными частотами растяжения определенных связей и электроотрицательностями задействованных атомов: однако это не удивительно, поскольку такие частоты растяжения частично зависят от прочности связи, которая учитывается при вычислении электроотрицательностей Полинга. Более убедительными являются корреляции между электроотрицательностью и химическими сдвигами в ЯМР-спектроскопии или изомерные сдвиги в мессбауэровской спектроскопии (см. Рисунок). Оба этих измерения зависят от плотности s-электронов в ядре и, таким образом, являются хорошим показателем того, что различные меры электроотрицательности действительно описывают «способность атома в молекуле притягивать электроны к себе».
Практическая шкала электроотрицательности атомов
Детальный поиск взаимосвязи между шкалами электроотрицательностей позволил сформировать новый подход к выбору практической шкалы электроотрицательностей атомов. В основу практической шкалы электроотрицательностей атомов взята концепция Луо-Бенсона, использующая понятие ковалентного радиуса r. По физическому смыслу электроотрицательность атома χЛБ — это величина, пропорциональная энергии притяжения валентного электрона, находящегося на расстоянии r от атомного ядра:
χ ЛБ=(m+n)/r,
Где m и n — число p- и s- электронов в валентной оболочке атома.
Сами Луо и Бенсон рекомендовали для величины χ ЛБ (электроотрицательности атомов) более точное название «ковалентный потенциал». В процессе разработки практической шкалы электроотрицательностей шкала Луо и Бенсона была дополнена электроотрицательностями d- и f-элементов, для которых в расчётное управление введено число внешних электронов, равное двум. Значения электроотрицательностей атомов в практической шкале χ * и их ковалентных радиусов r (Å) приведены в таблице:
Значения электроотрицательностей атомов в практической шкале χ* и их ковалентных радиусов r, (Å).
|
Приведённая в таблице совокупность значение χ* демонстрирует важную особенность практической шкалы электроотрицательностей: значение электроотрицательности для водорода в этой шкале χ*(H)=2,7 определяет чёткую границу между металлами (М) и неметаллами : χ*(М) < χ*. Исключение составляют лишь постпереходные металлы (Sn, Bi, Po), в то время как в других шкалах значения электроотрицательностей, меньшие электроотрицательности водорода, помимо металлов, имеют большинство неметаллов (B, Si, Ge, As, Sb, Te), а в шкале Парра-Пирсона даже углерод, фосфор, сера, селен, иод.
Особое положение водорода в практической шкале даёт основание рассматривать электроотрицательность водорода как «меру» электроотрицательности элементов, которая позволяет осуществить переход к безразмерной практической шкале χ*, определяемой как отношение χ*(X)/ χ*(Н).
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
|
Номер элемента |
Элемент |
Символ |
Электроотрицательность |
|
87 |
Франций |
Fr |
0,79 |
|
55 |
Цезий |
Cs |
0,79 |
|
19 |
Калий |
K |
0,82 |
|
37 |
Рубидий |
Rb |
0,82 |
|
56 |
Барий |
Ba |
0,89 |
|
88 |
Радий |
Ra |
0,9 |
|
11 |
Натрий |
Na |
0,93 |
|
38 |
Стронций |
Sr |
0,95 |
|
3 |
Литий |
Li |
0,98 |
|
20 |
Кальций |
Ca |
1,0 |
|
57 |
Лантан |
La |
1,1 |
|
89 |
Актиний |
Ac |
1,1 |
|
70 |
Иттербий |
Yb |
1,1 |
|
58 |
Церий |
Ce |
1,12 |
|
59 |
Празеодим |
Pr |
1,13 |
|
61 |
Прометей |
Pm |
1,13 |
|
95 |
Америций |
Am |
1,13 |
|
60 |
Неодим |
Nd |
1,14 |
|
62 |
Самарий |
Sm |
1,17 |
|
64 |
Гадолиний |
Gd |
1,2 |
|
66 |
Диспрозий |
Dy |
1,22 |
|
39 |
Иттрий |
Y |
1,22 |
|
68 |
Эрбий |
Er |
1,24 |
|
69 |
Тулий |
Tm |
1,25 |
|
71 |
Лютеций |
Lu |
1,27 |
|
96 |
Кюрий |
Cm |
1,28 |
|
94 |
Плутоний |
Pu |
1,28 |
|
90 |
Торий |
Th |
1,3 |
|
97 |
Берклий |
Bk |
1,3 |
|
98 |
Калифорний |
Cf |
1,3 |
|
99 |
Эйнштейний |
Es |
1,3 |
|
100 |
Фермий |
Fm |
1,3 |
|
101 |
Менделевий |
Md |
1,3 |
|
102 |
Нобелий |
No |
1,3 |
|
12 |
Магний |
Mg |
1,31 |
|
40 |
Цирконий |
Zr |
1,33 |
|
93 |
Нептуний |
Np |
1,36 |
|
21 |
Скандий |
Sc |
1,36 |
|
92 |
Уран |
U |
1,38 |
|
73 |
Тантал |
Ta |
1,5 |
|
91 |
Протактиний |
Pa |
1,5 |
|
22 |
Титан |
Ti |
1,54 |
|
25 |
Марганец |
Mn |
1,55 |
|
4 |
Бериллий |
Be |
1,57 |
|
41 |
Ниобий |
Nb |
1,6 |
|
13 |
Алюминий |
Al |
1,61 |
|
81 |
Талий |
Tl |
1,62 |
|
30 |
Цинк |
Zn |
1,65 |
|
23 |
Ванадий |
V |
1,63 |
|
24 |
Хром |
Cr |
1,66 |
|
48 |
Кадмий |
Cd |
1,69 |
|
49 |
Индий |
In |
1,78 |
|
31 |
Галлий |
Ga |
1,81 |
|
26 |
Железо |
Fe |
1,83 |
|
82 |
Свинец |
Pb |
1,87 |
|
27 |
Кобальт |
Co |
1,88 |
|
29 |
Медь |
Cu |
1,9 |
|
75 |
Рений |
Re |
1,9 |
|
14 |
Кремний |
Si |
1,9 |
|
43 |
Технеций |
Tc |
1,9 |
|
28 |
Никель |
Ni |
1,91 |
|
47 |
Серебро |
Ag |
1,93 |
|
50 |
Олово |
Sn |
1,96 |
|
80 |
Ртуть |
Hg |
2 |
|
84 |
Полоний |
Po |
2 |
|
83 |
Висмут |
Bi |
2,02 |
|
5 |
Бор |
B |
2,04 |
|
51 |
Сурьма |
Sb |
2,05 |
|
42 |
Молибден |
Mo |
2,16 |
|
33 |
Мышьяк |
As |
2,18 |
|
15 |
Фосфор |
P |
2,19 |
|
1 |
Водород |
H |
2,2 |
|
77 |
Иридий |
Ir |
2,2 |
|
86 |
Радон |
Rn |
2,2 |
|
85 |
Астат |
At |
2,2 |
|
44 |
Рутений |
Ru |
2,2 |
|
46 |
Палладий |
Pd |
2,2 |
|
76 |
Осмий |
Os |
2,2 |
|
78 |
Платина |
Pt |
2,28 |
|
45 |
Родий |
Rh |
2,28 |
|
74 |
Вольфрам |
W |
2,36 |
|
79 |
Золото |
Au |
2,54 |
|
6 |
Углерод |
C |
2,55 |
|
34 |
Селен |
Se |
2,55 |
|
16 |
Сера |
S |
2,58 |
|
54 |
Ксенон |
Xe |
2,6 |
|
53 |
Йод |
I |
2,66 |
|
36 |
Криптон |
Kr |
2,96 |
|
7 |
Азот |
N |
3,04 |
|
17 |
Хлор |
Cl |
3,16 |
|
8 |
Кислород |
O |
3,44 |
|
9 |
Фтор |
F |
3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Рис. 2. Ряд электроотрицательности.
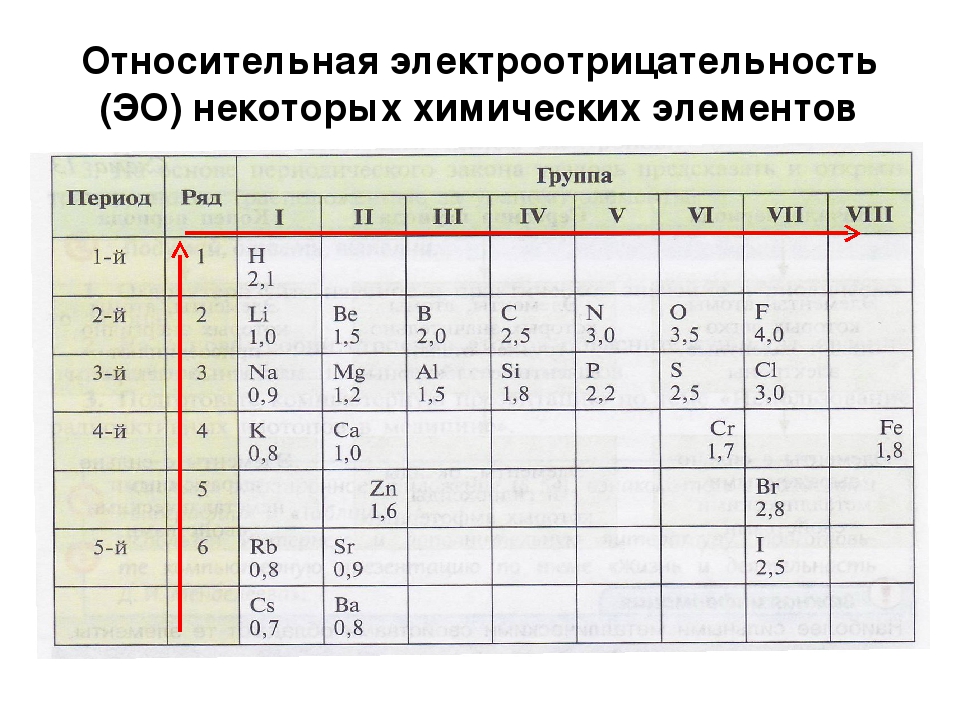
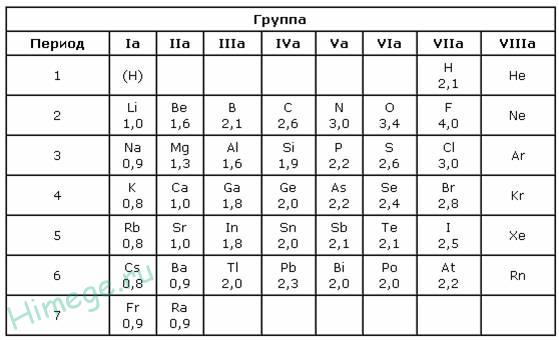
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.

Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
-
Вопрос 1 из 5
Какие свойства проявляют металлы?
- Окислительные – отдают электроны
- Окислительные – принимают электроны
- Восстановительные – отдают электроны
- Восстановительные – принимают электроны
Начать тест(новая вкладка)
Значения относительной электроотрицательности
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A |
| Период | ||||||||||||||||||
| 1 | H2,20 | He4,5 | ||||||||||||||||
| 2 | Li0,99 | Be1,57 | B2,04 | C2,55 | N3,04 | O3,44 | F3,98 | Ne4,4 | ||||||||||
| 3 | Na0,98 | Mg1,31 | Al1,61 | Si1,90 | P2,19 | S2,58 | Cl3,16 | Ar4,3 | ||||||||||
| 4 | K0,82 | Ca1,00 | Sc1,36 | Ti1,54 | V1,63 | Cr1,66 | Mn1,55 | Fe1,83 | Co1,88 | Ni1,91 | Cu1,90 | Zn1,65 | Ga1,81 | Ge2,01 | As2,18 | Se2,55 | Br2,96 | Kr3,00 |
| 5 | Rb0,82 | Sr0,95 | Y1,22 | Zr1,33 | Nb1,6 | Mo2,16 | Tc1,9 | Ru2,2 | Rh2,28 | Pd2,20 | Ag1,93 | Cd1,69 | In1,78 | Sn1,96 | Sb2,05 | Te2,1 | I2,66 | Xe2,60 |
| 6 | Cs0,79 | Ba0,89 | * | Hf1,3 | Ta1,5 | W2,36 | Re1,9 | Os2,2 | Ir2,20 | Pt2,28 | Au2,54 | Hg2,00 | Tl1,62 | Pb2,33 | Bi2,02 | Po2,0 | At2,2 | Rn2,2 |
| 7 |
Fr
0,7 |
Ra0,9 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Лантаноиды | * | La1,1 | Ce1,12 | Pr1,13 | Nd1,14 | Pm1,13 | Sm1,17 | Eu1,2 | Gd1,2 | Tb1,1 | Dy1,22 | Ho1,23 | Er1,24 | Tm1,25 | Yb1,1 | Lu1,27 | ||
| Актиноиды | ** | Ac1,1 | Th1,3 | Pa1,5 | U1,38 | Np1,36 | Pu1,28 | Am1,13 | Cm1,28 | Bk1,3 | Cf1,3 | Es1,3 | Fm1,3 | Md1,3 | No1,3 | Lr1,291 | ||

Примеры определения степени окисления
Определим степени окисления хлора в соединениях:

Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.