Типы ОВР
Рассуждая над тем, что такое ОВР, необходимо отметить о тех разновидностях данных процессов, которые чаще всего рассматриваются в неорганическом и органическом синтезе.
Межмолекулярные взаимодействия предполагают такие процессы, при которых атомы и восстановителя, и окислителя располагаются в разных исходных веществах, вступающих во взаимодействие. В качестве примера подобного типа превращения можно привести взаимодействие между оксидом марганца (4) и раствором соляной кислоты, в результате которого образуется газообразный хлор, хлорид двухвалентного марганца, а также вода.
В рассматриваемом химическом процессе в качестве восстановителя предстают анионы хлора, окисляющиеся по мере взаимодействия. Катион марганца (со степенью окисления +4) проявляет в реакции окислительные способности, принимая два электрона, восстанавливается.
Внутримолекулярное взаимодействие представляет собой такие химические превращения, по мере которых и атомы восстановителя, и атомы окислителя первоначально являются одним исходным веществом, а после завершения превращения они оказываются в различных продуктах реакции.В качестве примера такого типа реакции можно представить разложение хлората калия. При нагревании данное вещество будет превращаться в хлорид калия и кислород. Окислительные свойства будут характерны для аниона хлората, который, принимая пять электронов в реакции, будет восстанавливаться, превращаясь в хлорид.
При этом анион кислорода будет проявлять восстановительные свойства, окисляясь до молекулярного кислорода. Так что такое ОВР в данном случае? Это процесс передачи электронов между ионами, приводящий к образованию двух продуктов реакции.
Также к данному виду химических превращений, происходящих с изменением степеней окисления у элементов, первоначально находящихся в одной формуле, относится процесс разложения нитрита аммония. Азот, стоящий в катионе аммония, имея степень окисления -3, в ходе процесса отдает шесть электронов и окисляется до молекулярного азота. А тот азот, который входит в состав нитрита, принимает шесть электронов, при этом является восстановителем, а в ходе реакции он окисляется.
Что такое ОВР в химии? Определение, рассмотренное нами выше, свидетельствует о том, что это превращения, связанные с изменениями у нескольких элементов степеней окисления.
Самоокисление и восстановление (диспропорция) предполагает такие процессы, при протекании которых в качестве восстановителя и окислителя выступает один исходный атом, который будет увеличивать, и одновременно уменьшать свою степень окисления после завершения взаимодействия. Рассуждая над тем, что такое ОВР в химии, примеры подобных превращений можно найти даже в курсе химии средней школы. Разложение сульфита калия при нагревании приводит к образованию двух солей этого металла: сульфида и сульфата. Сера со степенью окисления +4 проявляет и восстановительные, и окислительные свойства, повышая и понижая показатели степени окисления.
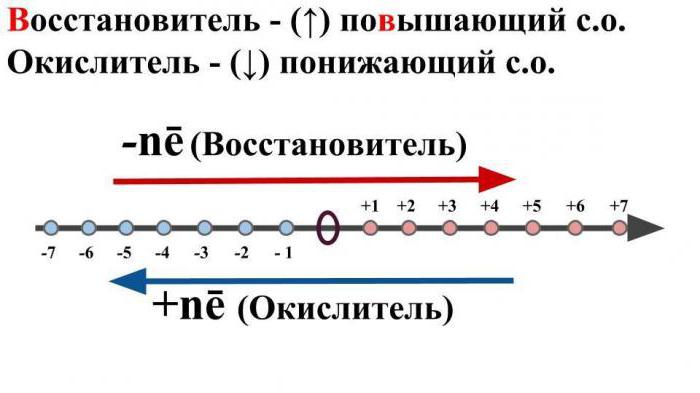
Чтобы понять, что означает ОВР в химии, назовем еще один вид таких химических превращений. Контрпропорционирование предполагает такие процессы, в результате которых атомы восстановителя и окислителя находятся в составе разных исходных компонентов, но в правой части они образуют один продукт реакции. Например, при взаимодействии оксида серы (4) с сероводородом будет образовываться сера и вода. Ион серы со степенью окисления +4 будет принимать четыре электрона, а ион серы с показателем -2 лишается двух электронов. В итоге оба они превращаются в простое вещество, у которого степень окисления равна нулю.

Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
-
- H2S+Cl2→S+2HCl{\displaystyle {\mathsf {H_{2}S+Cl_{2}\rightarrow S+2HCl}}}
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
-
- 2H2O→2H2+O2{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}+O_{2}}}}
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
-
- H2O+Cl2→HCl+HOCl{\displaystyle {\mathsf {H_{2}O+Cl_{2}\rightarrow HCl+HOCl}}}
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
-
- SO2+2H2S→3S+2H2O{\displaystyle {\mathsf {SO_{2}+2H_{2}S\rightarrow 3S+2H_{2}O}}}
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
4Fe + 6H2O + 3O2 = 4Fe(OH)3