Особенности влияния

Особенностью является комплексность влияния:
- Иммунная система. Влияние радионуклидов ведет к снижению функциональной активности компетентных клеток. Из-за этого растет масштаб инфекционных и паразитарных заболеваний.
- Кроветворная система. При накоплении существенных доз снижается уровень эритроцитов в крови, а также начинаются масштабные нарушения в процессе образования кровяных телец.
- Щитовидная железа. Нарушается процесс выработки гормонов. Основной удар радионуклиды по этому органу наносят в первые дни, хотя и последующий эффект сбрасывать со счетов не следует.
- Патологии репродуктивной системы. В первую очередь это относится к женщинам. Их возникновение связано с воздействием радионуклидов на щитовидную железу. Возникает дисбаланс между эстрогеном и прогестероном, растет количество кортизола и еще ряд осложнений.
Виды радиоактивного излучения
Радиоактивное излучение бывает нескольких типов, о которых сейчас и пойдет речь. Уже упоминалось альфа- и бета-излучение, но это не весь список.
Альфа-излучение — это самое слабое излучение, которое представляет опасность в том случае, если частицы попадают непосредственно в тело человека. Такое излучение реализуется тяжелыми частицами, и именно поэтому легко останавливается даже листом бумаги. По этой же причини альфа-лучи не пролетают больше 5 см.

Бета-излучение более сильное, чем предыдущее. Это излучение электронами, которые намного легче альфа-частиц, поэтому могут проникать на несколько сантиметров в кожу человека.
Гамма-излучение реализуется фотонами, которые достаточно легко проникают еще дальше к внутренним органам человека.
Самое мощное по проникновению излучение — это нейтронное. От него спрятаться достаточно сложно, но в природе его, по сути, и не существует, разве что в непосредственной близости к ядерным реакторам.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Открытие изотопов, историческая справка.
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Одинаковые снаружи, разные внутри
Пожалуй, точкой отсчета в истории изучения радиоактивных изотопов следует считать 1900 год, когда английский химик Фредерик Содди стал ассистент-профессором химии в университете Мак-Гилла в Монреале (Канада). В 1901–1902 гг. будущие Нобелевские лауреаты Эрнест Резерфорд и Фредерик Содди создали теорию распада радиоактивных элементов, согласно которой несколько самых тяжелых элементов становятся устойчивыми, выбрасывая из своих ядер небольшие, но в достаточной степени разрозненные единицы массы, заряда и энергии в виде альфа-, бета- и гамма-частиц. Оказалось, что в процессе радиоактивного распада образуются другие элементы. В частности, Содди доказал, что в результате радиоактивного распада радия образуется гелий. Это был первый документально подтвержденный случай образования одного элемента из другого.
Далее, проведя ряд экспериментов, Содди пришел к выводу, что радий образуется в результате постепенного распада атомов урана, и высказал предположение, что в ходе этого превращения должен образоваться промежуточный элемент.

В 1913 г. была выдвинута концепция изотопов — атомов одного и того же элемента, идентичных по химическим свойствам, но отличающихся друг от друга физическими характеристиками. Все изотопы одного элемента занимают в периодической таблице Менделеева одно и то же место (греч. «изо» — одинаковый, «топ» — место), но имеют разную атомную массу. Содди говорил, что изотопы одинаковы «снаружи», но отличаются «внутри».
В 1920 г. ученый предположил, что изотопы можно использовать для определения геологического возраста горных пород и окаменелостей, поскольку известна скорость их радиоактивного распада. Это предположение стало основой развития современной технологии радиоактивного датирования.
В 1921 г. Фредерик Содди получил Нобелевскую премию «За вклад в химию радиоактивных веществ и за проведенное исследование происхождения и природы изотопов».
В конце ХХ в. было рекомендовано термин «изотоп» заменить на «нуклид» и соответственно «радиоактивный изотоп» на «радионуклид». Однако широкого распространения это нововведение не получило, и оба термина используются в научной литературе как синонимы.
Где в таблице Д. И. Менделеева находятся радиоактивные вещества?
Довольно простой и легкий способ узнать, относиться ли вещество к радиоактивным, это посмотреть в таблицу Д. И. Менделеева. Все, что находится после элемента свинец — это радиоактивные элементы, а также еще прометий и технеций
Важно помнить, какие вещества радиоактивные, ведь это может спасти вам жизнь

Существует также ряд элементов, которые имеют хотя бы один радиоактивный изотоп в своих природных смесях. Вот их неполный список, где указаны одни из самых распространенных элементов:
- Калий.
- Кальций.
- Ванадий.
- Германий.
- Селен.
- Рубидий.
- Цирконий.
- Молибден.
- Кадмий.
- Индий.
К радиоактивным веществам относятся те, которые содержат любые радиоактивные изотопы.
Подробнее про влияние на организм

Экспериментально доказано, что под воздействием радионуклидов происходят патологические изменения в сердце, почках, печени, эндокринной, репродуктивной, нервной, кроветворной и иммунной системах. Давайте пройдемся по этим моментам более подробно:
- Сердечно-сосудистая система. Функциональные изменения главным образом связаны с блокадами различных отделов и повреждением миокарда. Следует отметить, что влияние естественных радионуклидов может проявляться даже в дошкольном возрасте. По мере увеличения накопленного количества соединений в организме человека ситуация будет ухудшаться. Не следует забывать о вредоносном влиянии на сердечную мышцу опосредственно и напрямую (как результат повреждения вегетативной нервной и эндокринной систем).
- Почки. Воздействие радионуклидов неминуемо ведет к гибели канальцев и клубочков. А это оборачивается снижением почечной фильтрации. В таком случае, в крови растет содержание продуктов белкового обмена (это мочевина и креатинин). Основные радионуклиды, под влиянием которых это происходит – это изотопы цезия.
- Печень. Накопление цезия в ней способствует возникновению цирроза и гепатоза.
В целом нарушение работы эндокринной системы, почек и печени меняет метаболические процессы. Это влияет на биохимическую картину крови. И все из-за радионуклидов.
Понятие радиоактивности
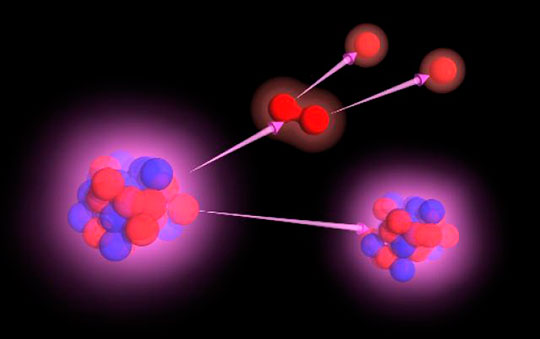
Радиоактивностью называю «умение» атомов некоторых изотопов расщепляться и создавать этим излучения. Термин «радиоактивность» появился не сразу. Изначально такое излучение называли лучами Беккереля, в честь ученого, открывшего его в работе с изотопом урана. Уже теперь мы называем этот процесс термином «радиоактивное излучение».

В этом достаточно сложном процессе изначальный атом превращается в атом совсем другого химического элемента. За счет выбрасывания альфа- или бета-частиц, массовое число атома изменяется и, соответственно, это перемещает его по таблице Д. И. Менделеева. Стоит заметить, что массовое число изменяется, но сама масса остается практически такой же.
Опираясь на данную информацию, можем немного перефразировать определение понятия. Итак, радиоактивность — это также способность неустойчивых ядер атомов самостоятельно превращаться в другие, более стабильные и устойчивые ядра.
Изотопы в природе
Считается, что изотопный состав большинства элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии. Особое значение имеют процессы образования изотопов углерода в верхних слоях атмосферы под воздействием космического излучения. Эти изотопы распределяются в атмосфере и гидросфере планеты, вовлекаются в оборот углерода живыми существами (животными и растениями). Изучение распределения изотопов углерода лежит в основе радиоуглеродного анализа.
Архив
Выберите месяц Июль 2020 (1) Декабрь 2017 (3) Октябрь 2017 (2) Сентябрь 2017 (3) Август 2017 (1) Июль 2017 (1) Апрель 2016 (1) Март 2016 (1) Февраль 2016 (1) Январь 2016 (3) Декабрь 2015 (2) Ноябрь 2015 (8) Октябрь 2015 (8) Сентябрь 2015 (8) Август 2015 (12) Июль 2015 (10) Июнь 2015 (9) Май 2015 (22) Апрель 2015 (18) Март 2015 (20) Февраль 2015 (16) Январь 2015 (7) Декабрь 2014 (8) Ноябрь 2014 (6) Октябрь 2014 (10) Сентябрь 2014 (21) Август 2014 (17) Июль 2014 (12) Июнь 2014 (24) Май 2014 (14) Апрель 2014 (22) Март 2014 (25) Февраль 2014 (34) Январь 2014 (16) Декабрь 2013 (29) Ноябрь 2013 (42) Октябрь 2013 (42) Сентябрь 2013 (42) Август 2013 (29) Июль 2013 (58) Июнь 2013 (38) Май 2013 (25) Апрель 2013 (29) Март 2013 (1) Февраль 2013 (2) Январь 2013 (5) Декабрь 2012 (10) Ноябрь 2012 (26) Сентябрь 2012 (13) Июнь 2012 (1) Май 2012 (1) Апрель 2012 (3) Март 2012 (11) Февраль 2012 (33) Январь 2012 (22) Декабрь 2011 (11) Ноябрь 2011 (40) Октябрь 2011 (7) Сентябрь 2011 (21) Август 2011 (2) Февраль 2011 (3) Ноябрь 2010 (7) Сентябрь 2010 (3) Август 2010 (4) Июнь 2010 (2) Май 2010 (28) Апрель 2010 (9) Март 2010 (35) Февраль 2010 (47) Январь 2010 (67) Декабрь 2009 (75) Ноябрь 2009 (257) Октябрь 2009 (4)
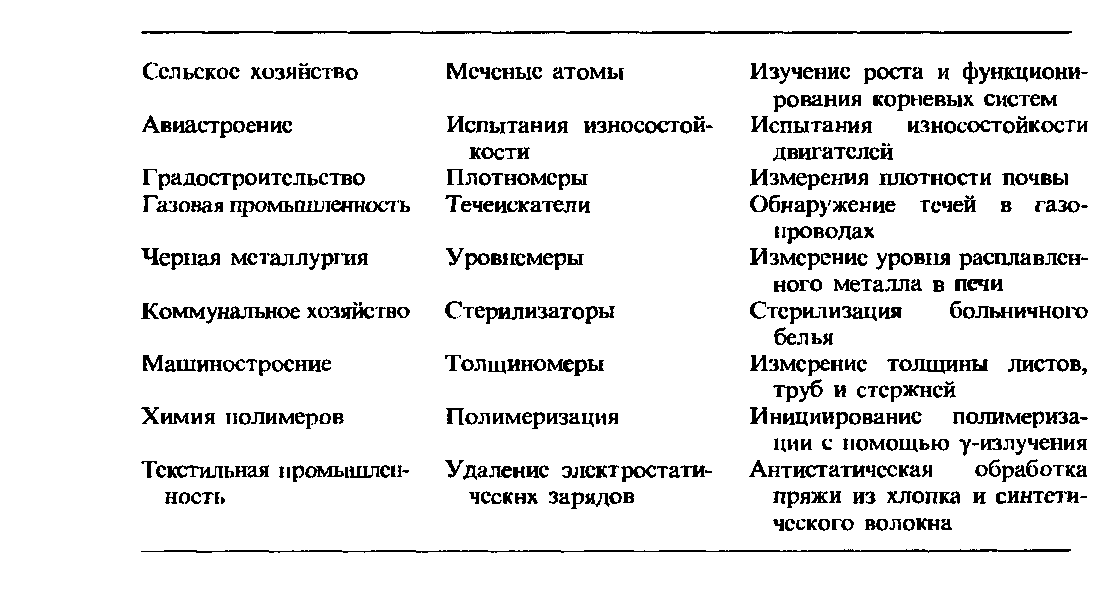
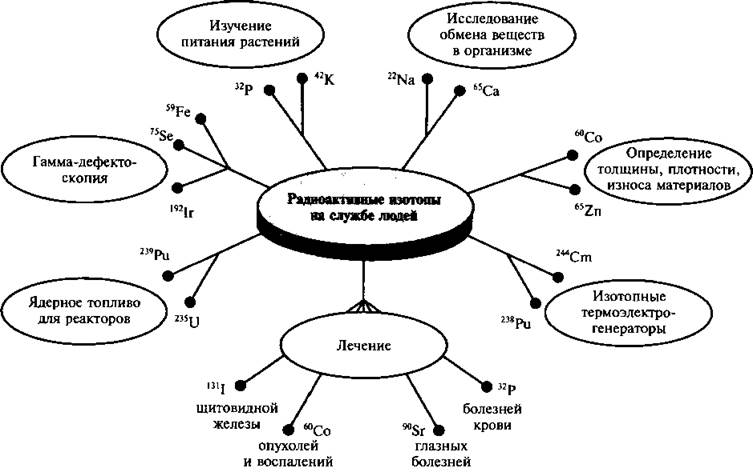
О возможностях применения

Человек применяет радионуклиды в хозяйстве, науке, технике и медицине. Благодаря им можно изучать биохимические и физиологические процессы в нормальном состоянии и при возникновении патологий. Также они помогают в изучении закономерностей обмена и миграции химических элементов в организме и окружающей среде.
В медицинской практике радионуклиды неоценимы при диагностике и последующем лечении различных заболеваний. Они же используются для стерилизации различных изделий, материалов и медикаментов
Что такое радионуклиды в общим чертах рассмотрели, теперь давайте уделим внимание частным случаям
Изотоп против нуклида
Нуклид относится к ядру, а не к атому. Идентичные ядра принадлежат одному нуклиду, например каждому ядру углерода, 13 нуклидов составлены из 6 протонов и 7 нейтронов. Понятие нуклида (относящийся к отдельным ядерным разновидностям) подчеркивает ядерные свойства по химическим свойствам, в то время как понятие изотопа (группирующий все атомы каждого элемента) подчеркивает химический по атомной энергии. Нейтронное число имеет большие эффекты на ядерные свойства, но его эффект на химические свойства незначителен для большинства элементов. Даже в случае очень самых легких элементов, где отношение нейтронного числа к атомному числу варьируется больше всего между изотопами, это обычно имеет только небольшой эффект, хотя это действительно имеет значение при некоторых обстоятельствах (для водорода, самого легкого элемента, изотопный эффект достаточно большой, чтобы сильно затронуть биологию). Так как изотоп — более старый термин, это более известно, чем нуклид и все еще иногда используется в контекстах, где нуклид мог бы быть более соответствующим, таким как ядерная технология и медицинская радиология.
Вредные радиоактивные вещества, примеры и предостережения
Самое опасное радиоактивное вещество — это Полоний-210. Из-за излучения вокруг него даже видно своеобразную светящуюся «ауру» голубого цвета. Стоит сказать о том, что существует стереотип, будто все радиоактивные вещества светятся. Это совсем не так, хотя и встречаются такие варианты, как Полоний-210. Большинство радиоактивных веществ внешне совсем не подозрительные.
Самым радиоактивным металлом на данный момент считают ливерморий. Его изотопу Ливерморию-293 достаточно 61 миллисекунды, чтобы распасться. Это выяснили еще в 2000 году. Немного уступает ему унунпентий. Время распада Унунпентия-289 составляет 87 миллисекунды.

Также интересный факт состоит в том, что одно и то же вещество может быть как безвредным (если его изотоп стабильный), так и радиоактивным (если ядра его изотопа вот-вот разрушатся).
Цезий и стронций

Это изотопы, которые вредят здоровью на протяжении всей человеческой жизни. Именно они представляют наибольшую опасность для тех, кто живет на загрязненной территории. Кроме цезия и стронция следует упомянуть еще и трансурановые изотопы. В основном они попадают в организм через продукты питания. Их влияние зависит от ряда факторов.
Радионуклиды в организме человека наносят вред, причем степень поражения зависит от:
- Возраста. Больше всего негативным эффектам подвержены дети.
- Пола. Мужчины проявляют большую склонность к накоплению радионуклидов, нежели женщины.
- Физиологического состояния организма.
- Концентрации изотопов в употребляемых продуктах питания. Больше всего их находится в ягодах и грибах.
- Структурно-функциональных особенностей тканей и органов.
- Воздействия факторов усвоения (присоединения) и выведения радионуклидов из человека.
Хотя здесь следует сделать небольшое уточнение относительно пола. Во время беременности женщины отличаются повышенной способностью к накоплению радионуклидов. При этом они обычно занимают плаценту. А это часто оборачивается гормональными нарушениями, которые наблюдаются как у плода, так и матери. Это сказывается на последующем развитии, в первую очередь, ребенка. Плацента – это главный барьер для радионуклидов на пути к зародышу.
Но в случае ее повреждения (если изотопов очень много) плод гибнет. Если говорить о различных органах, то необходимо отметить, что в них могут идти изменения двух типов: метаболические и структурные. Опасность от них неравнозначна и сильно зависит от того, как именно копятся радиоактивные элементы в конкретных случаях.
Примечание
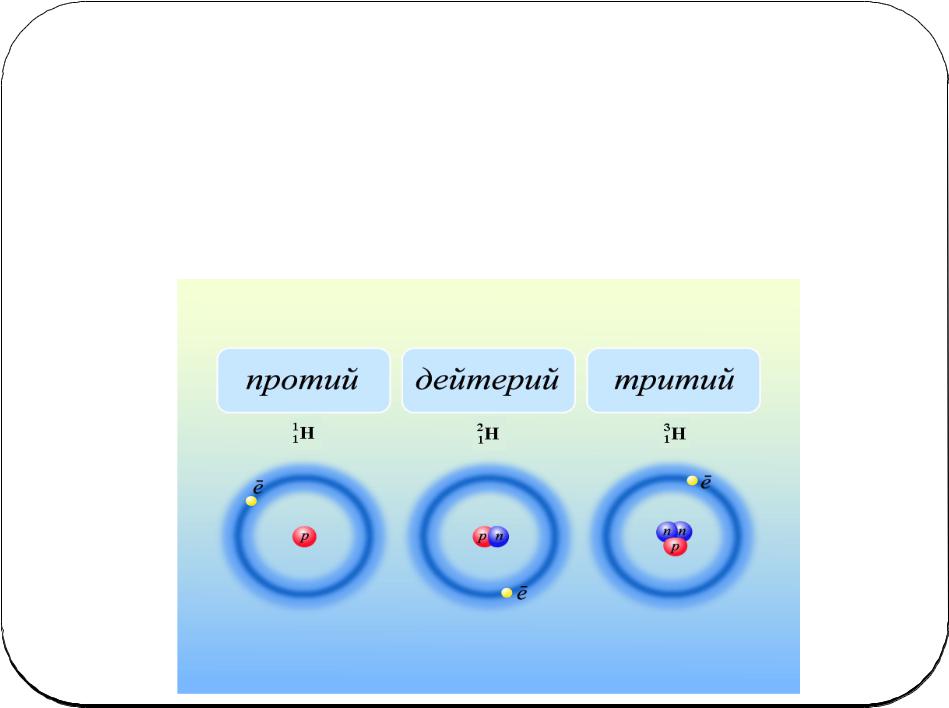
Изотоп и/или нуклид определены названием особого элемента (это указывает на атомное число), сопровождаемый дефисом и массовым числом (например, гелий 3, гелий 4, углерод 12, углерод 14, уран 235 и уран 239). Когда химический символ используется, например, «C» для углерода, стандартное примечание (теперь известный как «примечание AZE», потому что A — массовое число, Z атомное число и E для элемента) должен указать на массовое число (число нуклеонов) с суперподлинником в верхнем, оставленном химического символа и указать на атомное число с припиской в оставленном более низком (например, и). Так как атомное число дано символом элемента, распространено заявить только массовое число в суперподлиннике и не учесть приписку атомного числа (например, и). Письмо m иногда прилагается после массового числа, чтобы указать на ядерный изомер, метастабильное или энергично взволнованное ядерное государство (в противоположность стандартному состоянию самой низкой энергии), например (тантал-180m).
Возникновение в природе
Элементы составлены из одного или более естественных изотопов. Нестабильные (радиоактивные) изотопы или исконные или постисконные. Исконные изотопы были продуктом звездного nucleosynthesis или другим типом nucleosynthesis, такого как космическое расщепление ядра луча, и сохранились вниз к подарку, потому что их уровень распада настолько медленный (например, уран 238 и калий 40). Постисконные изотопы были созданы космической бомбардировкой луча как cosmogenic нуклиды (например, тритий, углерод 14), или распадом радиоактивного исконного изотопа радиоактивной радиогенной дочери нуклида (например, уран к радию). Несколько изотопов естественно синтезируются как nucleogenic нуклиды некоторой другой естественной ядерной реакцией, такой как тогда, когда нейтроны от естественного ядерного деления поглощены другим атомом.
Как обсуждено выше, только у 80 элементов есть любые стабильные изотопы, и у 26 из них есть только один стабильный изотоп. Таким образом приблизительно две трети стабильных элементов происходят естественно на Земле в многократных стабильных изотопах, с наибольшим числом стабильных изотопов для элемента, являющегося десять, для олова . Есть приблизительно 94 элемента, найденные естественно на Земле (до плутония включительно), хотя некоторые обнаружены только в очень крошечных суммах, таких как плутоний 244. Ученые оценивают, что элементы, которые происходят естественно на Земле (некоторые только как радиоизотопы) происходят как 339 изотопов (нуклиды) всего. Только 254 из этих естественных изотопов стабильны в смысле того, чтобы никогда быть наблюдаемым распасться с настоящего времени. Еще 35 исконных нуклидов (к в общей сложности 289 исконным нуклидам), радиоактивны с известными полужизнями, но имеют полужизни дольше, чем 80 миллионов лет, позволяя им существовать с начала солнечной системы. См. список нуклидов для деталей.
Все известные стабильные изотопы происходят естественно на Земле; другие естественные изотопы радиоактивны, но происходят на Земле из-за их относительно долгих полужизней, или иначе из-за других средств продолжающегося естественного производства. Они включают вышеупомянутые cosmogenic нуклиды, nucleogenic нуклиды и любые радиогенные радиоизотопы, сформированные продолжающимся распадом исконного радиоактивного изотопа, такие как радон и радий от урана.
Еще ~3000 радиоактивных изотопов, не найденных в природе, были созданы в ядерных реакторах и в ускорителях частиц. Много недолгих изотопов, не найденных естественно на Земле, также наблюдались спектроскопическим анализом, естественно создаваемым в звездах или суперновинках. Пример — алюминий 26, который естественно не найден на Земле, но найден в изобилии в астрономическом масштабе.
Сведенные в таблицу атомные массы элементов — средние числа, которые составляют присутствие многократных изотопов с различными массами. Перед открытием изотопов опытным путем определенные ценности нецелого числа атомной массы путали ученых. Например, образец хлора содержит хлор на 75,8% 35 и хлор на 24,2% 37, давая среднюю атомную массу 35,5 единиц атомной массы.
Согласно общепринятой теории космологии, только изотопы водорода и гелия, следов некоторых изотопов лития и бериллия, и возможно небольшого количества бора, были созданы в Большом взрыве, в то время как все другие изотопы были синтезированы позже в звездах и суперновинках, и во взаимодействиях между энергичными частицами, такими как космические лучи и ранее произведенные изотопы. (См., что nucleosynthesis для деталей различных процессов думал ответственный за производство изотопа.) Соответствующее изобилие изотопов на Земле следует из количеств, сформированных этими процессами, их распространением через галактику и ставками распада для изотопов, которые нестабильны. После начального соединения солнечной системы изотопы были перераспределены согласно массе, и изотопический состав элементов варьируется немного от планеты до планеты. Это иногда позволяет проследить происхождение метеоритов.
Ученные, которые изучали радиоактивность
Вещества радиоактивные долгое время не считались опасными, и потому из свободно изучали
К сожалению, печальные смерти научили нас тому, что с такими веществами нужна осторожность и повышенный уровень безопасности
Одним их первых, как уже упоминалось, был Антуан Беккерель. Это великий французский физик, которому и принадлежит слава первооткрывателя радиоактивности. За свои заслуги он удостоился членства в Лондонском королевском обществе. Из-за своего вклада и эту сферу он скончался достаточно молодым, в возрасте 55 лет. Но его труд помнят по сей день. В его честь были названа сама единица радиоактивности, а также кратеры на Луне и Марсе.

Не менее великим человеком была Мария Склодовская-Кюри, которая работала с радиоактивными веществами вместе со своим мужем Пьером Кюри. Мария также была француженкой, хоть и с польскими корнями. Кроме физики она занималась преподаванием и даже активной общественной деятельностью. Мария Кюри — первая женщина лауреат Нобелевской премии сразу в двух дисциплинах: физика и химия. Открытие таких радиоактивных элементов, как Радий и Полоний, — это заслуга Марии и Пьера Кюри.
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—1907 годах выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Содди с 1910 г. стали называть изотопами.
К началу 2016 года открыто 3211 изотопов всех элементов (без учёта изомеров), из них 431 (13 %) стабильных или околостабильных, 294 (9 %) изотопы трансурановых элементов, 1209 (38 %) нейтронно-избыточных и 1277 (40 %) протонно-избыточных (то есть отклоняющихся от линии бета-стабильности в сторону избытка нейтронов или протонов, соответственно). По количеству открытых изотопов первое место занимают США (1237), затем идут Германия (558), Великобритания (299), СССР/Россия (247) и Франция (217). Среди лабораторий мира первые пять мест по числу открытых изотопов занимают Национальная лаборатория им. Лоуренса в Беркли (638), Институт тяжёлых ионов в Дармштадте (438), Объединённый институт ядерных исследований в Дубне (221), Кавендишская лаборатория в Кембридже (218) и ЦЕРН (115). За 10 лет (2006—2015 годы включительно) в среднем физики открывали в год 23 нейтронно-избыточных и 3 протонно-избыточных изотопа, а также 4 изотопа трансурановых элементов. Общее количество учёных, являвшихся авторами или соавторами открытия какого-либо изотопа, составляет 3598 человек.
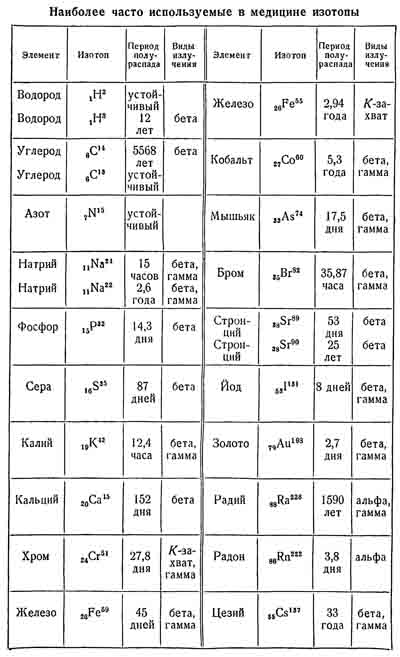
Что такое радионуклиды: определение

Начать следует с терминологии. Радионуклиды – это радиоактивные атомы, которые характеризуются определенным (обычно указываемым) массовым числом и номером. Для изомерных представителей еще следует упомянуть про энергетическое состояние ядра. Атом – это сложная система, она состоит из частиц-волн трех категорий: в ядре протоны и нейтроны, а также окружающие его электроны, которые формируют оболочку. В плане массы существует значительный перевес. Практически вся она находится в ядре.
Кстати, протоны и нейтроны составляют массу нуклида. Которые из них могут пребывать в разных ядерно-энергетических состояниях. Одно из них представлено изотопами – это нуклиды, у которых одинаковое число протонов. Другое состояние – это изобары. В таком случае атомы имеют различное число протонов и нейтронов, хотя наблюдается одинаковое массовое значение. Вот, что такое нуклиды и радионуклиды.
Йод
Один из самых известных представителей. Его специфика действия зависит от периода полураспада. По данном критерию выделяют короткоживущие (Й-131) и долгоживущие (Й-137) изотопы. Но вероятность встречи первых на порядок больше, чем вторых. Радиоактивный йод Й-131 может попасть в организм человека с пищей, через ожоги и раны, во время процесса дыхания. Но в основном это происходит через первый и последний варианты накопления. Отличительной особенностью данного элемента является то, что он чрезвычайно быстро всасывается в лимфу и кровь.
Он обладает способностью к накоплению в щитовидной железе, костях, мышцах и печени. Некоторые заболевания щитовидной железы приводят к увеличению масштаба этого процесса. Считается, что смертельная концентрация этого радионуклида в организме составляет 55 миллибеккерель на килограмм. При меньших дозах просто происходят негативные патологические изменения в иммунной и кроветворной системах, щитовидной железе, и нарушается обмен веществ.
Касательно воздействия этого радионуклида необходимо всегда помнить о коротком периоде полураспада. Иными словами, негативный эффект ощущается в первые дни после радиационного заражения.
Заключение
Как мы видим, радиоактивность — достаточно сложный процесс, который не всегда остается подконтрольным человеку. Это один из тех случаев, когда люди могут оказаться абсолютно бессильными перед лицом опасности
Именно поэтому важно помнить, что действительно опасные вещи могут быть внешне очень обманчивыми
Узнать вещество радиоактивное или нет, чаще всего можно уже попав под его воздействие. Поэтому будьте осторожны и внимательны. Радиоактивные реакции во многом нам помогают, но также не стоит забывать, что это практически не подконтрольная нам сила.
К тому же стоит помнить вклад великих ученных в изучение радиоактивности. Они передали нам невероятно много полезных знаний, которые теперь спасают жизни, обеспечивают целые страны энергией и помогаю лечить страшные заболевания. Радиоактивные химические вещества — это опасность и благословение для человечества.