Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
-
- 2H2+O2→2H2O{\textstyle {\mathsf {2H_{2}+O_{2}\rightarrow 2H_{2}O}}}
- 2Cu+O2→2CuO{\displaystyle {\mathsf {2Cu+O_{2}\rightarrow 2CuO}}}
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:
-
- 2Na+O2→Na2O2{\displaystyle {\mathsf {2Na+O_{2}\rightarrow Na_{2}O_{2}}}}
- K+O2→KO2{\displaystyle {\mathsf {K+O_{2}\rightarrow KO_{2}}}}
2. Обжиг или горение бинарных соединений в кислороде:
-
- 4FeS2+11O2→2Fe2O3+8SO2{\displaystyle {\mathsf {4FeS_{2}+11O_{2}\rightarrow 2Fe_{2}O_{3}+8SO_{2}}}}
- CS2+3O2→CO2+2SO2{\displaystyle {\mathsf {CS_{2}+3O_{2}\rightarrow CO_{2}+2SO_{2}}}}
- 2PH3+4O2→P2O5+3H2O{\displaystyle {\mathsf {2PH_{3}+4O_{2}\rightarrow P_{2}O_{5}+3H_{2}O}}}
3. Термическое разложение солей:
-
- CaCO3→CaO+CO2{\displaystyle {\mathsf {CaCO_{3}\rightarrow CaO+CO_{2}}}}
- 2FeSO4→Fe2O3+SO2+SO3{\displaystyle {\mathsf {2FeSO_{4}\rightarrow Fe_{2}O_{3}+SO_{2}+SO_{3}}}}
4. Термическое разложение оснований или кислот:
-
- 2Al(OH)3→Al2O3+3H2O{\displaystyle {\mathsf {2Al(OH)_{3}\rightarrow Al_{2}O_{3}+3H_{2}O}}}
- 4HNO3→4NO2+O2+2H2O{\displaystyle {\mathsf {4HNO_{3}\rightarrow 4NO_{2}+O_{2}+2H_{2}O}}}
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
-
- 4FeO+O2→2Fe2O3{\displaystyle {\mathsf {4FeO+O_{2}\rightarrow 2Fe_{2}O_{3}}}}
6. Взаимодействие некоторых металлов с водой при высокой температуре:
-
- Zn+H2O→ZnO+H2{\displaystyle {\mathsf {Zn+H_{2}O\rightarrow ZnO+H_{2}}}}
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
-
- Ca3(PO4)2+3SiO2+5C→3CaSiO3+2P+5CO{\displaystyle {\mathsf {Ca_{3}(PO_{4})_{2}+3SiO_{2}+5C\rightarrow 3CaSiO_{3}+2P+5CO}}}
8. Взаимодействие металлов с кислотами-окислителями:
-
- Zn+4HNO3→Zn(NO3)2+2NO2↑+2H2O{\displaystyle {\mathsf {Zn+4HNO_{3}\rightarrow Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
9. При действии водоотнимающих веществ на кислоты и соли:
-
- 2KClO4+H2SO4→K2SO4+Cl2O7+H2O{\displaystyle {\mathsf {2KClO_{4}+H_{2}SO_{4}\rightarrow K_{2}SO_{4}+Cl_{2}O_{7}+H_{2}O}}}
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
-
- NaHCO3+HCl→NaCl+H2O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}O+CO_{2}\uparrow }}}
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или одноокисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
В начале XIX века и ранее тугоплавкие, практически не растворимые в воде оксиды химики называли «землями».
Традиционная номенклатура
Оксиды с низшими степенями окисления (субоксиды) иногда называют закись и недокись (например, оксид углерода(II), CO — закись углерода; диоксид триуглерода, C3O2 — недокись углерода; оксид азота(I), N2O — закись азота; оксид меди(I), Cu2O — закись меди).
Оксиды с высшими степенями окисления (например, оксид железа(III), Fe2O3) называют в соответствии с этой номенклатурой окись, а двойные (то есть с разными степенями окисления) оксиды — закись-окись (Fe3O4 = FeO·Fe2O3 — закись-окись железа, оксид урана(VI)-диурана(V), U3O8 — закись-окись урана).
Эта номенклатура, однако, не отличается последовательностью, поэтому такие названия следует рассматривать скорее как традиционные.
Свойства
- При взаимодействии кислотного оксида с основным образуется соль.
- Оксиды взаимодействуют с водой, если образуется растворимая кислота или растворимое основание.
- Основные оксиды взаимодействуют с кислотами, а кислотные с основаниями.
Основные оксиды
1. Основный оксид + сильная кислота → соль + вода
-
- CuO+H2SO4→CuSO4+H2O{\displaystyle {\mathsf {CuO+H_{2}SO_{4}\rightarrow CuSO_{4}+H_{2}O}}}
2. Сильноосновный оксид + вода → гидроксид
-
- CaO+H2O→Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\rightarrow Ca(OH)_{2}}}}
3. Сильноосновный оксид + кислотный оксид → соль
-
- CaO+Mn2O7→Ca(MnO4)2{\displaystyle {\mathsf {CaO+Mn_{2}O_{7}\rightarrow Ca(MnO_{4})_{2}}}}
4. Основный оксид + водород → металл + вода
-
- CuO+H2→Cu+H2O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
-
- SO3+H2O→H2SO4{\displaystyle {\mathsf {SO_{3}+H_{2}O\rightarrow H_{2}SO_{4}}}}
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
-
- CO2+CaO→CaCO3{\displaystyle {\mathsf {CO_{2}+CaO\rightarrow CaCO_{3}}}}
3. Кислотный оксид + основание → соль + вода
-
- SO2+2NaOH→Na2SO3+H2O{\displaystyle {\mathsf {SO_{2}+2NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
-
- Ca(OH)2+CO2→CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}}
- CaCO3+H2O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
-
- SiO2+Na2CO3→Na2SiO3+CO2{\displaystyle {\mathsf {SiO_{2}+Na_{2}CO_{3}\rightarrow Na_{2}SiO_{3}+CO_{2}}}}
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
-
- P2O5+2HClO4→2HPO3+Cl2O7{\displaystyle {\mathsf {P_{2}O_{5}+2HClO_{4}\rightarrow 2HPO_{3}+Cl_{2}O_{7}}}}
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
-
- ZnO+2HCl→ZnCl2+H2O{\displaystyle {\mathsf {ZnO+2HCl\rightarrow ZnCl_{2}+H_{2}O}}}
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
-
- ZnO+2KOH+H2O→K2Zn(OH)4{\displaystyle {\mathsf {ZnO+2KOH+H_{2}O\rightarrow K_{2}}}} (в водном растворе)
- ZnO+2KOH→K2ZnO2+H2O↑{\displaystyle {\mathsf {ZnO+2KOH\rightarrow K_{2}ZnO_{2}+H_{2}O\uparrow }}} (при сплавлении)
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → 2Na2O2
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
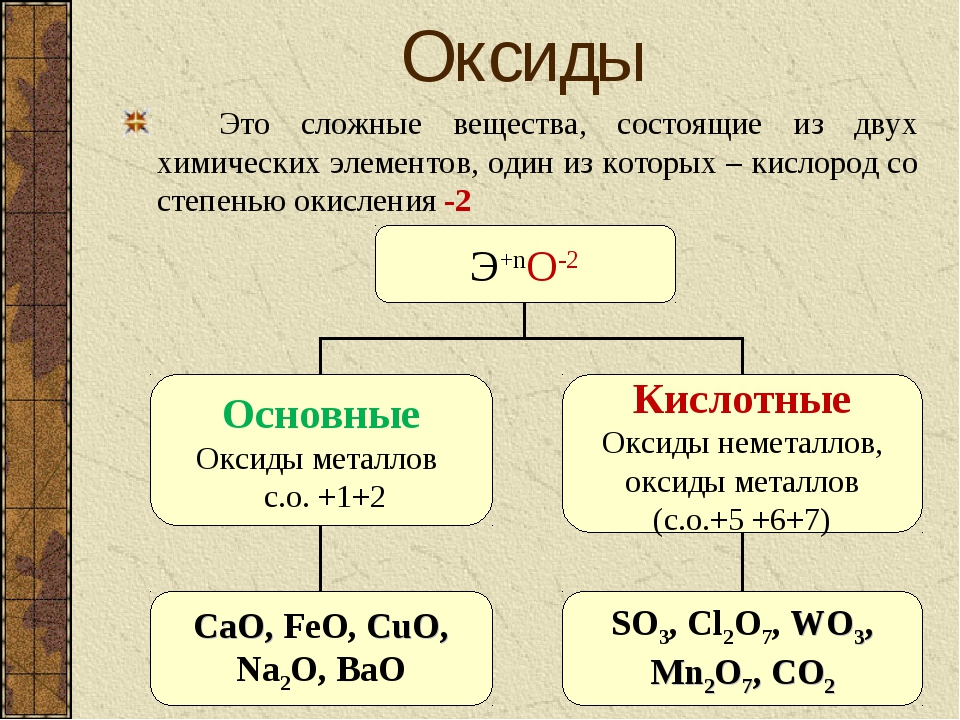
Классификация
В зависимости от химических свойств различают:
-
Солеобразующие оксиды:
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
- Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Существуют сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода — например, оксид лития-кобальта(III) Li2O·Co2O3, и двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления — например, оксид марганца(II,IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот. Так, оксид лития-кобальта(III) можно рассматривать как кобальтит лития Li2Co2O4, а оксид марганца(II,IV) — как ортоманганит марганца Mn3(MnO4)2.
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.