Содержание
Получение[править | править код]
Общие запасы никеля в рудах на начало 1998 г. оцениваются в количестве 135 млн. т., в том числе достоверные — 49 млн.т.
Из достоверных запасов, по разным данным, от 40 до 66% никеля находится в окисленных рудах (ОНР), 33% — в сульфидных, 0,7% — в прочих. По состоянию на 1997 г. доля никеля, произведенного переработкой ОНР, составила порядка 40% от общемирового объема производства.
В промышленных условиях ОНР делят на два типа: магнезиальные и железистые.
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5-50% Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90% Ni), синтер (89% Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей.
подробнее см. на сайте «Никель»
Карбонил никеля
В 80-х годах прошлого века в лаборатории Людвига Монда — крупного инженера-химика и промышленника, одного из основателей химической индустрии Англии — шла работа по очистке газов от примеси окиси углерода.
Окись углерода пропускали над накаленным никелем. Случайно заметили, что по окончании опыта, когда никель почти остыл, пламя отходящей окиси углерода из бесцветного сделалось белым. Непонятный факт стал интригующим, когда выяснилось, что это белое пламя на холодном фарфоре оставляет металлический налет. Казалось совершенно невероятным, чтобы такой металл, как никель, давал летучее соединение с окисью углерода.
Опыты были повторены еще и еще раз. Когда избыток окиси углерода был поглощен аммиачным раствором хлористой меди и исследователям — Монду, Лангеру и Квинке — удалось сконденсировать в смеси снега с солью первые капли тяжелой бесцветной жидкости, они окончательно уверовали, что никель дает соединение с окисью углерода.
Новое вещество — одно из самых интересных соединений элемента № 28 — назвали карбонилом никеля. Карбонил никеля потряс воображение химиков мира. Соединение тяжелого металла с газом — жидкое, текучее, летучее, как эфир! Формула NiC4О4, не укладывающаяся ни в какие представления о валентности. Но многим химикам она казалась недостоверной. Менделеев писал: «Мне кажется, что ныне еще рано временно судить о строении столь необыкновенного вещества, как Ni(CO)4».
Лишь когда развились физические методы исследования молекул (рентгеновский, электронографический, спектроскопический), удалось установить, что на самом деле молекула карбонила никеля — тетраэдр с атомом никеля в центре. Природа химических связей в карбониле никеля и сейчас остается интереснейшим объектом и для теоретиков, и для экспериментаторов.
Применение
В 2015 году 67 % потребления никеля пришлось на производство нержавеющей стали, 17 % на сплавы без железа, 7 % на никелирование и 9 % на прочие применения, такие как аккумуляторы, порошковая металлургия и химические реактивы.
Сплавы
Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок.
- монель-металл (65—67 % Ni + 30—32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
- белое золото (например, 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));
- нихром, сплав никеля и хрома (60 % Ni + 40 % Cr);
- пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
- инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании;
- Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.
- Никель присутствует в качестве компонента ряда нержавеющих сталей.
Никелирование
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12—36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома — 0,3 мкм).
Бестоковое никелирование проводится в растворе смеси хлорида никеля(II) и гипофосфита натрия в присутствии цитрата натрия:
-
- NiCl2+NaH2PO2+H2O→Ni+NaH2PO3+2HCl{\displaystyle {\mathsf {NiCl_{2}+NaH_{2}PO_{2}+H_{2}O\rightarrow Ni+NaH_{2}PO_{3}+2HCl}}}
Процесс проводят при рН 4—6 и 95 °C.
Радиационные технологии
Нуклид 63Ni, излучающий β—частицы, имеет период полураспада 100,1 года и применяется в крайтронах, а также детекторах электронного захвата (ЭЗД) в газовой хроматографии.
Монетное дело
Никель широко применяется при производстве монет во многих странах.
В США монета достоинством в 5 центов носит разговорное название «никель».
Использование никеля
Благодаря присутствию оксидной пленки на поверхности, металл наделен способностью отлично противостоять коррозии. К тому же покрытие из данного металла надежно защищает от окисления детали и предметы, изготовленные из других материалов. Именно поэтому никель широко используется в современной промышленности.
К тому же, элемент имеет не только антикоррозийные свойства. Он отлично противостоит воздействию различных щелочей. Благодаря этому, его применяют для защиты всевозможных алюминиевых, железных и чугунных деталей, предназначенных для эксплуатации в агрессивных средах. В том числе для изготовления самолетных лопастей, цистерн для перевозки опасных веществ и другого оборудования для химической промышленности.
Если говорить о других сферах нашей жизни, где использование никеля сегодня поставлено на широкую ногу, то стоит упомянуть производство:
- протезов и брекетов для нужд медицины;
- аккумуляторов;
- химических реактивов;
- «белого золота» в ювелирной промышленности;
- обмотки для струн музыкальных инструментов.

Никелевый дерматит
Часто встречается первичная разновидность контактного дерматита. В месте длительного соприкосновения этого металла с кожей человека вначале возникает эритема, или очаги покраснения. Затем появляется огрубение кожного рисунка, возникает уплотнение кожи. Такой симптом в дерматологии называется лихенизацией, или лихенификацией. Затем появляются бугорки, или папулы
Эти симптомы аллергии на никель похожи на любой контактный дерматит, и очень важно выявить связь жалоб с металлическими деталями, натирающими кожу
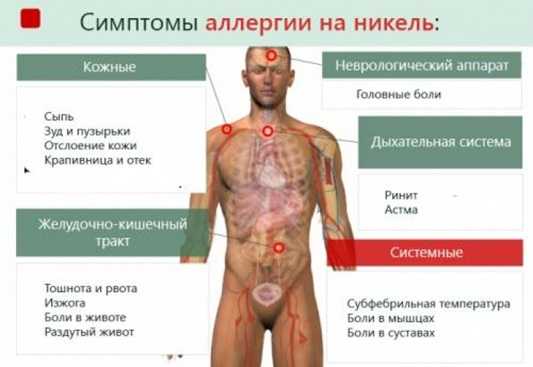
Симптомы аллергии на никель
Можно легко выяснить причину дерматита, если окажется, что это ограниченное поражение в точности соответствует местам натирания кожи металлическими предметами. Это могут быть пряжки ремней, ювелирные украшения.
Гораздо более тяжелой является общая аллергическая реакция человеческого организма на поступление в него никеля, причём металл попадает внутрь через органы дыхания, при введении различных никельсодержащих металлических имплантатов, и такой общий генерализованный дерматит можно расценивать как системную реакцию организма. Поэтому вред использования спирали из никеля в качестве внутриматочного контрацептива может значительно превысить ее пользу.
При вторичном дерматите сыпь располагается симметрично, может захватывать всё тело, или локализоваться на отдельных участках, на локтевых сгибах, на лице, под коленками. Как и любой другой аллергический дерматит, вначале возникает сенсибилизация организма при первичном контакте с аллергеном, а затем, при повторной встрече, развиваются симптомы диффузного токсического дерматита. Общая схема симптомов никелевой аллергии показана ниже.
При длительном наблюдении рабочих – никелировщиков, отмечена экзема. На коже располагаются различные папулы с элементами отёков, пятна, пузырьки, хроническое мокнутие. По данным статистики, более 10% всех профессиональных поражений кожных покровов составляют никелевые дерматиты, а у сотрудников электролизных цехов частота никелевых поражений кожи доходит до 15%. Однако, встречаются и более редкие случаи никелевого дерматита. Например, у кассиров банков, которые по долгу службы часто считали монеты, изготовленные из сплавов этого металла, возникали симптомы контактного дерматита на пальцах.

Дерматит на никель
История
Поскольку руды никеля легко спутать с рудами серебра, понимание этого металла и его использования датируется относительно недавним временем. Тем не менее, непреднамеренное использование никеля является древним, и его можно проследить еще до 3500 года до нашей эры. Было обнаружено, что бронзы из современной Сирии содержат до 2% никеля. Некоторые древние китайские рукописи предполагают, что «белая медь» ( мельхиор , известный как байтонг ) использовалась там между 1700 и 1400 годами до нашей эры. Эта белая медь из Пактонга экспортировалась в Великобританию еще в 17 веке, но содержание никеля в этом сплаве не было обнаружено до 1822 года. Монеты из медно-никелевого сплава чеканили бактрийские короли Агафокл , Евтидем II и Панталеон во 2- м веке. до н.э., возможно, из китайского мельхиора.
Никелин / никколит
В средневековой Германии, красный минерал был найден в Рудных (Рудные горы), напоминающей медную руду. Однако, когда горняки не смогли извлечь из него медь, они обвинили озорной спрайт немецкой мифологии Никель (похожий на Старый Ник ) в том, что он окружил медь. Они назвали эту руду Купферникель от немецкого Kupfer для меди. Эта руда, как теперь известно, представляет собой никелин , арсенид никеля . В 1751 году барон Аксель Фредрик Кронштедт попытался извлечь медь из купферникеля на кобальтовой шахте в шведской деревне Лос , и вместо этого получил белый металл, названный им в честь духа, давшего название минералу, никель. На современном немецком языке купферникель или купфер-никель обозначают сплав мельхиора .
Первоначально единственным источником никеля был редкий купферникель. Начиная с 1824 года никель был получен как побочный продукт производства синего кобальта . Первая крупномасштабная выплавка никеля началась в Норвегии в 1848 году из богатого никелем пирротина . Введение никеля в производство стали в 1889 году увеличило спрос на никель, а месторождения никеля в Новой Каледонии , открытые в 1865 году, обеспечивали большую часть мировых запасов в период с 1875 по 1915 год. Открытие крупных месторождений в бассейне Садбери , Канада в 1883 году, в Норильске-Талнахе , Россия в 1920 году, и на рифе Меренского , Южная Африка, в 1924 году, стало возможным крупномасштабное производство никеля.
Области применения
Малогабаритные никель-кадмиевые аккумуляторы используются в различной аппаратуре как замена стандартного гальванического элемента, особенно если аппаратура потребляет большой ток. Так как внутреннее сопротивление никель-кадмиевого аккумулятора на один-два порядка ниже, чем у обычных марганцево-цинковых и марганцево-воздушных батарей, мощность выдаётся стабильнее и без перегрева.
Никель-кадмиевые аккумуляторы применяются на электрокарах (как тяговые), трамваях и троллейбусах (для питания цепей управления), речных и морских судах. Широко применяются в авиации в качестве бортовых аккумуляторных батарей самолётов и вертолётов. Используются как источники питания для автономных шуруповёртов/винтовёртов и дрелей, однако здесь намечается тенденция к вытеснению их высокотоковыми батареями различных литиевых систем.
Несмотря на развитие других электрохимических систем и ужесточение экологических требований, никель-кадмиевые аккумуляторы остаются основным выбором для высоконадёжных устройств, потребляющих большую мощность, например фонарей для дайвинга.
Длительный срок хранения, относительная нетребовательность к постоянному уходу и контролю, способность стабильно работать на морозе до -40 °C и отсутствие возможности возгорания при разгерметизации в сравнении с литиевыми, малый удельный вес в сравнении со свинцовыми и дешевизна в сравнении с серебряно-цинковыми, меньшее внутренне сопротивление, большая надёжность и морозостойкость в сравнении с NiMH обуславливают по-прежнему широкое применение никель-кадмиевых аккумуляторов в военной технике, авиации и портативной радиосвязи.
Дисковые никель-кадмиевые аккумуляторы
Никель-кадмиевые аккумуляторы выпускаются также в герметичном «таблеточном» конструктиве, наподобие батареек для часов. Электроды в таком аккумуляторе — две прессованные тонкие таблетки из активной массы, сложенные в пакет с сепаратором и плоской пружиной и завальцованные в никелированный стальной корпус диаметром с монету. Используются для питания различных, в основном маломощных, нагрузок (током C/10-C/5). Допускают только небольшие зарядные токи, не более С/10, так как внутри корпуса должна успевать происходить рекомбинация выделяющихся газов. Благодаря замкнутой конструкции допускают длительный перезаряд с непрерывной рекомбинацией и выделением избыточной энергии в виде тепла. Напряжение такого аккумулятора ниже, чем у негерметичного, и мало изменяется в процессе разряда вследствие избытка активной массы катода, создаваемого с целью ускорения рекомбинации кислорода.
Дисковые аккумуляторы (как правило, в батареях по 3 шт. в общей оболочке, типоразмера аналогичного советскому Д-0,06) широко применялись в персональных компьютерах выпуска 1980–90 годов, в частности PC-286/386 и ранних 486, для питания энергонезависимой памяти настроек (CMOS NVRAM) и часов реального времени при отключенном сетевом питании. Срок службы аккумуляторов в таком режиме составлял несколько лет, после чего батарея, в большинстве случаев — впаянная в материнскую плату, подлежала замене. С развитием CMOS-технологии и уменьшением потребляемой мощности NVRAM и RTC аккумуляторы были вытеснены одноразовыми литиевыми элементами ёмкостью порядка 200 мА·ч (), устанавливаемыми в гнёзда-защёлки и легко заменяемыми пользователем, с аналогичным сроком непрерывной работы.
В СССР дисковые аккумуляторы были практически единственными доступными в широкой продаже аккумуляторами (кроме автомобильных и, позднее, NiCd размера AA на 450 мА·ч). Помимо отдельных элементов, предлагалась 9-вольтовая батарея из семи аккумуляторов Д-0,1 с разъёмом, аналогичным «Кроне», которая, однако, входила в отсек питания не у всех радиоприёмников, для которых предназначалась. Поставлялись только простейшие зарядные устройства с током С/10, заряжавшие аккумулятор или батарею примерно за 14 часов (время контролировалось пользователем).
| Названиеаккумулятора | Диаметр,мм | Высота,мм | Напряжение,В | Ёмкость,А*ч | Рекомендуемыйток разряда, мА | Применение |
|---|---|---|---|---|---|---|
| Д-0,03 | 11,6 | 5,5 | 1,2 | 0,03 | 3 | фотоаппараты, слуховые аппараты |
| Д-0,06 | 15,6 | 6,4 | 1,2 | 0,06 | 12 | фотоаппараты, фотоэкспонометры, слуховые аппараты, дозиметры |
| Д-0,125 | 20 | 6,6 | 1,2 | 0,125 | 12,5 | аккумуляторные электрические фонарики[уточнить], миниатюрные радиоприёмники |
| Д-0,26 | 25,2 | 9,3 | 1,2 | 0,26 | 26 | аккумуляторные электрические фонарики, фотовспышки, калькуляторы (Б3-36) |
| Д-0,55 | 34,6 | 9,8 | 1,2 | 0,55 | 55 | |
| 7Д-0,125 | 8,4 | 0,125 | 12,5 | замена батарее Крона |
Химические свойства карбонила никеля
Своеобразны химические свойства карбонила никеля: он не вступает в реакции соединения. (Это и привело к выводу, что его молекула химически насыщена.) Атом никеля в карбониле нульвалентен, он имеет 18-электронную оболочку, как у благородного газа. По химическая насыщенность карбонила никеля не означает химической инертности — это весьма реакционноспособное вещество.
Группы СО в карбониле никеля легко замещаются другими молекулами и радикалами, например РН3, PF3, CN-; таких производных карбонила никеля, хотя бы с одной карбонильной группой, замененной на что-то иное, сейчас синтезировано уже несколько сот.
На подобных реакциях замещения основано каталитическое действие карбонила никеля во многих реакциях органической химии.
Карбонил никеля легко взаимодействует с кислородом, давая окислы никеля и свободную окись углерода; аналогичная реакция протекает с элементной серой. Смесь паров карбонила никеля с воздухом самопроизвольно вспыхивает, а иногда и взрывается. Если к тому же вспомнить о сильной токсичности карбонила никеля, то можно посочувствовать исследователям, впервые столкнувшимся с этим веществом.
В свое время оно было одним из наиболее ядовитых веществ, известных человеку, и состояло в списках боевых отравляющих веществ ряда держав. Теперь карбонил никеля переведен в список просто вредных веществ. Предельно допустимая концентрация его в воздухе производственных помещений 0,0005 мг/м3.
Задолго до того, как прояснилась природа удивительной молекулы и были изучены ее химические реакции, Монд разгадал практическую ценность открытого в его лаборатории вещества; раз реакция синтеза карбонила никеля обратима, можно, действуя окисью углерода на никельсодержащий материал, «испарять» никель в виде карбонила, а затем, нагревая карбонил, получать чистый металл.
Через несколько лет Монд и Лангер построили металлургический завод нового типа, где пышущие жаром металлургические печи впервые были заменены химическими реакторами.
На заводе Монда в Южном Уэльсе (он действует и ныне, являясь одним из крупнейших никелевых заводов мира) синтез карбонила никеля ведут при атмосферном давлении, а пары карбонила разлагают на движущихся — чтобы не срастались — горячих никелевых шариках. На них оседает никель из карбонила. Шарики «растут».
Позже был найден другой вариант карбонил-процесса, более интенсивный: синтез карбонила никеля происходит при высоком давлении окиси углерода (до 250 атм), а разложение — в горячих полых Срубах, установленных вертикально. Сверху в них подают пары или брызги карбонила, а внизу собирают выпавший никелевый «снег» — порошок из сросшихся между собой мельчайших кристаллов никеля, которые возникли при распаде молекул Ni(CO)4.
Железо никелевого сплава — 90,85% Fe, 8,5% Ni и 0,6% Со. Оно заключает в себе чудовищную массу никеля — около 17 • 10¹⁹ т ,почти весь никель вашей планеты (общее его количество оценивается в 17 • 10¹⁹ т).
В тонкую поверхностную кору Земли проникли лишь немногие из его атомов — в среднем один из ста тысяч. Часть этих атомов образовала вместе с медью и серой скопления сернистых минералов. (Несколько миллиардов лет спустя человек обнаружил эти скопления и назвал их сульфидными медно-никелевыми рудами.).
Другие атомы никеля до самой поверхности Земли двигались в окружении железа, магния и хрома. Но здесь спутники никеля окислились, и часть их ушла прочь в виде гидроокисей.
Обогащенные никелем невзрачные землистые остатки ныне называются окисленными никелевыми рудами.
Статья на тему Никель в химии
Методы заряда

Кривая заряда NiMH-аккумулятора
Зарядка производится электрическим током при напряжении на элементе до 1,4—1,6 В. Напряжение на полностью заряженном элементе без нагрузки составляет 1,4 В. Напряжение при нагрузке меняется от 1,4 до 0,9 В. Напряжение без нагрузки на полностью разряженном аккумуляторе составляет 1,0—1,1 В (дальнейшая разрядка может испортить элемент). Для зарядки аккумулятора используется постоянный или импульсный ток с кратковременными отрицательными импульсами (для предотвращения эффекта «памяти», метод заряда аккумуляторов переменным асимметричным током).[источник?]
Контроль окончания заряда по изменению напряжения
Одним из методов определения окончания заряда является метод -ΔV. На изображении показан график напряжения на элементе при заряде. Зарядное устройство заряжает аккумулятор постоянным током. После того, как аккумулятор полностью заряжен, напряжение на нём начинает падать. Эффект наблюдается только при достаточно больших токах зарядки (0,5C — 1C). Зарядное устройство должно определить это падение и выключить зарядку.
Существует ещё так называемый «inflexion» — метод определения окончания быстрой зарядки. Суть метода заключается в том, что анализируется не максимум напряжения на аккумуляторе, а изменение производной напряжения по времени. То есть быстрая зарядка прекратится в тот момент, когда скорость роста напряжения будет минимальной. Это позволяет завершить фазу быстрой зарядки раньше, когда температура аккумулятора ещё не успела значительно подняться. Однако метод требует измерения напряжения с большей точностью и некоторых математических вычислений (вычисления производной и цифровой фильтрации полученного значения).
Контроль окончания заряда по изменению температуры
При зарядке элемента постоянным током бóльшая часть электрической энергии преобразуется в химическую энергию. Когда аккумулятор полностью заряжен, то подводимая электрическая энергия будет преобразовываться в тепло. При достаточно большом зарядном токе можно определить окончание заряда по резкому увеличению температуры элемента, установив датчик температуры аккумулятора. Максимальная допустимая температура аккумулятора — +60 °C.
Расчет времени заряда
Для расчета времени заряда аккумулятора используется следующая формула: t = 1.3*(ёмкость аккумулятора / ток заряда)
Биологическая роль
Хотя никель не был признан до 1970-х годов, известно, что он играет важную роль в биологии некоторых растений, эубактерий , архебактерий и грибов . Никелевые ферменты, такие как уреаза , считаются факторами вирулентности у некоторых организмов. Уреаза катализирует гидролиз мочевины с образованием аммиака и карбамата . В NiFe Гидрогеназы может катализировать окисление H2с образованием протонов и электронов, а также может катализировать обратную реакцию, восстановление протонов с образованием газообразного водорода. Кофермент никель-тетрапиррол, кофактор F430 , присутствует в метилкофермент М- редуктазе, который может катализировать образование метана или обратную реакцию у метаногенных архей (в степени окисления +1 ). Один из ферментов дегидрогеназы монооксида углерода состоит из кластера Fe-Ni-S. Другие никельсодержащие ферменты включают редкий бактериальный класс ферментов супероксиддисмутазы и глиоксалазы I в бактериях и несколько паразитических эукариотических трипаносомных паразитов (у высших организмов, включая дрожжи и млекопитающих, этот фермент содержит двухвалентный Zn 2+ ).
Пищевой никель может повлиять на здоровье человека из-за заражения никель-зависимыми бактериями, но также возможно, что никель является важным питательным веществом для бактерий, обитающих в толстом кишечнике, фактически действуя как пребиотик . Институт медицины США не подтвердил, что никель является важным питательным веществом для человека, поэтому ни Рекомендуемая диета (RDA), ни Адекватное потребление не установлены. Впускной Уровень Терпимый Верхний диетического никеля составляет 1000 мкг / день , в виде растворимых солей никеля. Потребление с пищей оценивается от 70 до 100 мкг / день, при этом всасывается менее 10%. То, что всасывается, выводится с мочой. Относительно большие количества никеля — сравнимые с приведенным выше расчетным средним уровнем потребления никеля — попадают в пищу, приготовленную из нержавеющей стали. Например, количество никеля, выщелоченного после 10 циклов варки в одной порции томатного соуса, составляет в среднем 88 мкг.
Предполагается, что никель, выделяющийся в результате извержений вулканов Сибирских ловушек, способствует росту Methanosarcina , рода архей-эвриархеот, производивших метан во время пермско-триасового вымирания , крупнейшего в истории вымирания.
Мобильное приложение
В мобильном приложении есть список важных друзей, он так и называется — «Важные». Порядок появления пользователей в нем тот же самый, что и в первом случае, о котором рассказано выше.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А.. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
- Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- F. Albert Cotton, Carlos A. Murillo, and Manfred Bochmann, (1999), Advanced inorganic chemistry. (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- Housecroft, C. E. Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall, ISBN 978-0-13-175553-6
Биография
Иоганн Никель родился 28 октября 1863 года в городе Жоры (Силезское воеводство, Польша). Изучал теологию и восточные языки сначала во Вроцлавском университете (1881-1884), затем продолжил обучение в университете Вюрцбурга (1884-1890). В Вюрцбурге он также написал свою докторскую диссертацию «Ветхий Завет» о Херувиме и Серафиме, который был опубликован во Вроцлаве в 1890 году.
26 июня 1886 года во Вроцлаве И. Никель был рукоположен в священники . В 1886-1890 годах работал куратором в Оленице, а затем в Хожуве. В 1890-1897 годах он работал учителем в гимназиях Глубчице, Нысе и Вроцлава.
В 1897 году он начал работать доцентом экзегетики (кафедра библейских наук) в Вроцлавском университете и некоторое время спустя стал ординарным профессором католического теологического факультета в Бреславльском университете.
В 1907 году Иоганн Никель был назначен консультантом Папской библейской комиссии. В 1913 году он стал каноником, а в 1921 году — начальником кафедрального собора.
С 1914 по 1921 год он был председателем Силезской ассоциации святого Бонифация.
Помимо этого Никель стоял во главе периодических печатных изданий «Altestamentliche Abhandlungen» и «Biblische Zeitfragen», а также занимался социальными вопросами в меру сил и возможностей помогая людям в трудных ситуациях.
Иоганн Никель умер 28 июня 1924 года в городе Бреслау.
Никель был признанным экспертом в областях, которые он выбрал — Ветхий Завет и социальные проблемы. Об этом свидетельствуют многочисленные публикации, которые до сегодняшнего дня не утратили своей ценности. На протяжении всей своей жизни он работал над адаптацией научных результатов современной экзегетики к преподаванию в католической церкви.























































